O diabetes mellitus está entre as principais causas de morte em mulheres na pós‐menopausa. A ooforectomia bilateral, muitas vezes oferecida concomitantemente à histerectomia, promove, além da interrupção abrupta da produção dos estrogênios, a redução dos androgênios que continuariam a ser produzidos pelo ovário na menopausa natural. Tais alterações hormonais podem ter repercussões próprias e tornar a paciente ooforectomizada mais suscetível a numerosas doenças crônicas, dentre elas o diabete. O objetivo desse estudo é revisar a literatura disponível sobre risco de diabete atribuível à ooforectomia.
MétodosFoi feita uma revisão da literatura com pesquisa em banco de dados do PubMed sobre o risco de diabetes mellitus em relação à ooforectomia, à menopausa natural e à orquiectomia.
ResultadoO diabete é fortemente associado à ooforectomia na maioria dos estudos. Em relação à menopausa natural, a maioria também mostrou aumento de risco condicional ou independente. Os androgênios parecem oferecer um papel protetor na resistência à insulina.
ConclusãoApesar de mais estudos serem necessários para conclusões definitivas relativas à associação entre ooforectomia e o risco de diabete, as evidências atuais apontam para um aumento de risco de diabete em mulheres ooforectomizadas.
Diabetes mellitus is among the main causes of death in postmenopausal women. Bilateral oophorectomy, commonly offered together with hysterectomy, promotes, in addition to the abrupt interruption of estrogen production, the reduction of the androgens that would continue to be produced by the ovary in natural menopause. Such hormonal changes can have their own repercussions, making the oophorectomized patient more susceptible to numerous chronic diseases, among them diabetes. The objective of this study is to review the available literature about the risk of diabetes attributable to oophorectomy.
MethodsA literature review was performed, searching in the Pubmed data bank about the risk of diabetes mellitus related to oophorectomy, natural menopause and orchiectomy.
ResultDiabetes is strongly associated with oophorectomy in most studies. Related to natural menopause, the majority showed an increase in conditional or independent risk. Androgens appear to offer a protective role in insulin resistance.
ConclusionIn spite of the need for more studies to reach definitive conclusions related to the association between oophorectomy and risk of diabetes, current evidence points to an increased risk of diabetes in oophorectomized women.
Atualmente o diabetes mellitus (DM) é a doença mais comum e a principal causa de morte em mulheres na pós‐menopausa.1
A proteção contra eventos coronarianos em mulheres jovens é drasticamente reduzida com a menopausa e a resistência à insulina um importante fator de risco.2
Os estrogênios desempenham papel‐chave na proteção contra o desenvolvimento da obesidade e de doenças metabólicas e são importantes reguladores de vários processos metabólicos, incluindo glicose e metabolismo lipídico, peso corporal, distribuição do tecido adiposo e gasto energético em ambos os sexos, masculino e feminino.3
A ooforectomia bilateral é frequentemente oferecida com a histerectomia como um procedimento profilático usado para prevenir câncer de ovário, câncer de mama, tumores ovarianos benignos, além de ser indicada muitas vezes como tratamento para dor pélvica, síndrome pré‐menstrual e endometriose. No entanto, a ausência de esteroides sexuais ovarianos consequentes à ooforectomia tem associação com função sexual diminuída, alteração de saúde mental, risco aumentado de fraturas e de mortalidade por outras causas, como doença coronariana.4,5
A ooforectomia bilateral profilática no momento da histerectomia é uma decisão complexa que requer que os pacientes e os médicos considerem múltiplos fatores. A preservação dos ovários pode influenciar na saúde das mulheres em longo prazo.6
MétodosApesar de o trabalho de revisão se propor a avaliar o papel da ooforectomia no risco de diabete, pareceu‐nos pertinente avaliar se a menopausa natural teria esse mesmo papel e, para isso, nossa busca incluiu menopausa e diabetes.
A opção por acrescentar a associação entre androgênios e diabete na busca teve como objetivo avaliar o efeito da testosterona no risco de diabete e, assim, estabelecer se a ação da ooforectomia seria pela queda abrupta dos estrogênios e/ou pela ausência da ação da testosterona.
Setenta e um artigos foram identificados em pesquisa no PubMed (National Library of Medicine) com os termos MeSH para o preditor (ovariectomy, oophorectomy, castration e menopause) combinados com termos MeSH para o resultado (diabete e insulin resistance). A busca foi filtrada por idioma (inglês), sem restrição de datas, e foram incluídos estudos em humanos e em animais. Foi removido um artigo duplicado e, em seguida, 37 artigos foram excluídos por meio de rastreio do título, texto do resumo ou texto completo. As razões mais comuns para exclusão foram a ausência de correlação entre ooforectomia/menopausa/androgênio e diabete ou por serem artigos sobre efeito do diabetes na menopausa, que não era objeto do nosso estudo. No total, 31 artigos foram analisados.
Após o exame do texto completo, os artigos foram divididos em três grupos (ooforectomia e diabete, menopausa e diabete, orquiectomia e diabete) e classificados por níveis de evidência. Desde a introdução de níveis de evidência, várias organizações adotaram variações no sistema de classificação. Como as questões relativas ao prognóstico não envolvem comparação de tratamentos, a maior evidência será de estudos de coorte ou de revisão sistemática de estudos de coorte. Por isso, níveis de evidência desenvolvidos pela American Society of Plastic Surgeons (ASPS) for Prognosis foram atribuídos aos estudos7 (tabela 1).
Níveis de evidência para estudos prognósticos – Adaptado da American Society of Plastic Surgeons
| I | Estudo prospectivo de coorte de alta qualidade com adequado poder estatístico ou revisão sistemática desses estudos |
| II | Coorte prospectivo de menor qualidade, coorte retrospectivo, ensaios clínicos randomizados com controles não tratados ou revisão sistemática desses estudos |
| III | Estudo de caso‐controle ou revisão sistemática desses estudos |
| IV | Série de casos |
| V | Opinião de especialista, relato de caso, evidência baseada em fisiologia, pesquisa financiada ou “primeiros princípios” |
Foram selecionados, pelos critérios de busca, dez estudos prospectivos que relacionaram a ooforectomia com o metabolismo glicêmico (tabela 2).
Estudos que relacionaram efeitos da ooforectomia no diabetes mellitus
| Autor | Tipo de estudo | Descrição | Nível de evidência | Resultados |
|---|---|---|---|---|
| Makino, 19818 | Ensaio clínico randomizado | Grupos de171 ratos divididos em quatro grupos:machos e fêmeas castrados e machos e fêmeas intactos. | II | DM aumentou em ratos machos castrados.DM diminuiu em fêmeas castradas em idade mais jovem, mas não alterou em ratas fêmeas castradas em idade mais avançada. |
| Mizuno, 199310 | Ensaio clínico randomizado | 356 ratos Long‐Evans Tokushima Lean (LETL) tratados com CY 857 e ratos não tratados LETL – verificação da incidência de diabete. | II | A ooforectomia aumentou a incidência de diabetes em ratas. |
| Rincon, 199611 | Ensaio clínico randomizado | Ratas fêmeas Sprague‐Dawley(6‐8/grupo): Ooforectomias ou procedimento SHAM. Ratas fêmeas ooforectomizadas tratadas com 2mg de testosterona. | II | A ooforectomia aumentou o risco de desenvolvimento de DM. |
| Fitzpatrick, 19999 | Ensaio clínico randomizado | Ratos machos diabéticos não obesos submetidos à castração e ratas fêmeas (20‐25/grupo): castrados, castrados+timectomizados e procedimento SHAM. | II | Castração diminuiu a prevalência de DM em fêmeas e aumentou em machos. |
| Swislocki20022 | Ensaio clínico randomizado | Ratas SHR e Wistar‐Kyoto (WKY) (12/grupo): submetidas a ooforectomia (SHR/OVX) e (WKY/OVX) ou procedimento SHAM e (SHR/SHAM) e (WKY/SHAM) – medição de teste de tolerância oral à glicose (TOTG). | II | Ooforectomia não alterou a tolerância a glicose. |
| Siri, 20036 | Ensaio clínico randomizado | Ratas fêmeas apoB/BATless divididas em grupos (4‐9/grupo): ooforectomia (OVX), OVX e reposição de estrogênio ou procedimento SHAM. | II | Reposição de estrogênio após ooforectomia diminuiu os níveis plasmáticos de insulina e normalizou a sensibilidade à insulina e tolerância a glicose. |
| Kim, 201113 | Ensaio clínico randomizado | Mulheres na pré‐menopausa (n=708), mulheres na pós‐menopausa natural (n=328) e mulheres ooforectomizadas bilateralmente (n=201) no Programa de Prevenção de Diabetes. Ensaio randomizado placebo controlado de intervenção no estilo de vida e uso de metformina entre os adultos com intolerância à glicose. | II | Menopausa natural não foi associada com o risco de diabetes e as intervenções de prevenção do diabetes não afetaram a resposta.Nas intervenções de estilo de vida, a ooforectomia bilateral foi associada à diminuição do risco de diabetes. |
| Zhu, 201312 | Ensaio clínico randomizado | Ratas fêmeas C57BL/6J (n=6‐10 por grupo) divididas em grupos: procedimento SHAM, ooforectomia (OVX) ou OVX associada a tratamento com estradiol, sendo alimentados com uma dieta rica em gordura. | II | A administração de dieta rica em gordura após a ooforectomia induziu a resistência à insulina.O tratamento com estrogênio no da menopausa cirúrgica foi associado a melhorias na resistência à insulina. |
| Appiah, 20141 | Coorte | Dados obtidos da Avaliação Nacional de Saúde e Nutrição, de 9.599 mulheres na pós‐menopausa. | I | Mulheres com ooforectomia bilateral têm risco elevado de diabetes. |
| Tawfik, 20153 | Ensaio clínico randomizado | Ratas fêmeas Wistar divididas em grupos, (10/grupo): procedimento SHAM, ratas ooforectomizadas (OVX), ratas diabéticas que haviam sido submetidos a procedimento cirúrgico SHAM, ratas diabéticas OVX | II | A ooforectomia altera o metabolismo do tecido adiposo. Fêmeas OVX diabéticas sofrem de exacerbação da resistência à insulina. |
Dentre esses estudos, oito foram feitos em ratos – Makino et al. (1981), Fitzpatrick et al. (1991), Mizuno et al. (1993), Rincon et al. (1996), Swislocki et al. (2002), Siri et al. (2003), Zhu et al. (2013) e Tawfik et al. (2015) – e dois em humanos, os de Kim et al. (2011) e Appiah et al. (2015). Os estudos de Mizuno et al. (1993) e de Kim et al. (2011) e Appiah et al. (2015) foram feitos em uma grande população.1‐3,6,8‐13 De acordo com os dez estudos analisados, nove tinham nível de evidência II e um tinha nível de evidência I. Seis estudos mostraram que a ooforectomia aumenta a resistência à insulina e o risco de diabete, incluindo o estudo de Appiah et al. (2015), de nível de evidência I. Dois estudos evidenciaram diminuição do risco de DM após ooforectomia e um estudo não mostrou alteração.
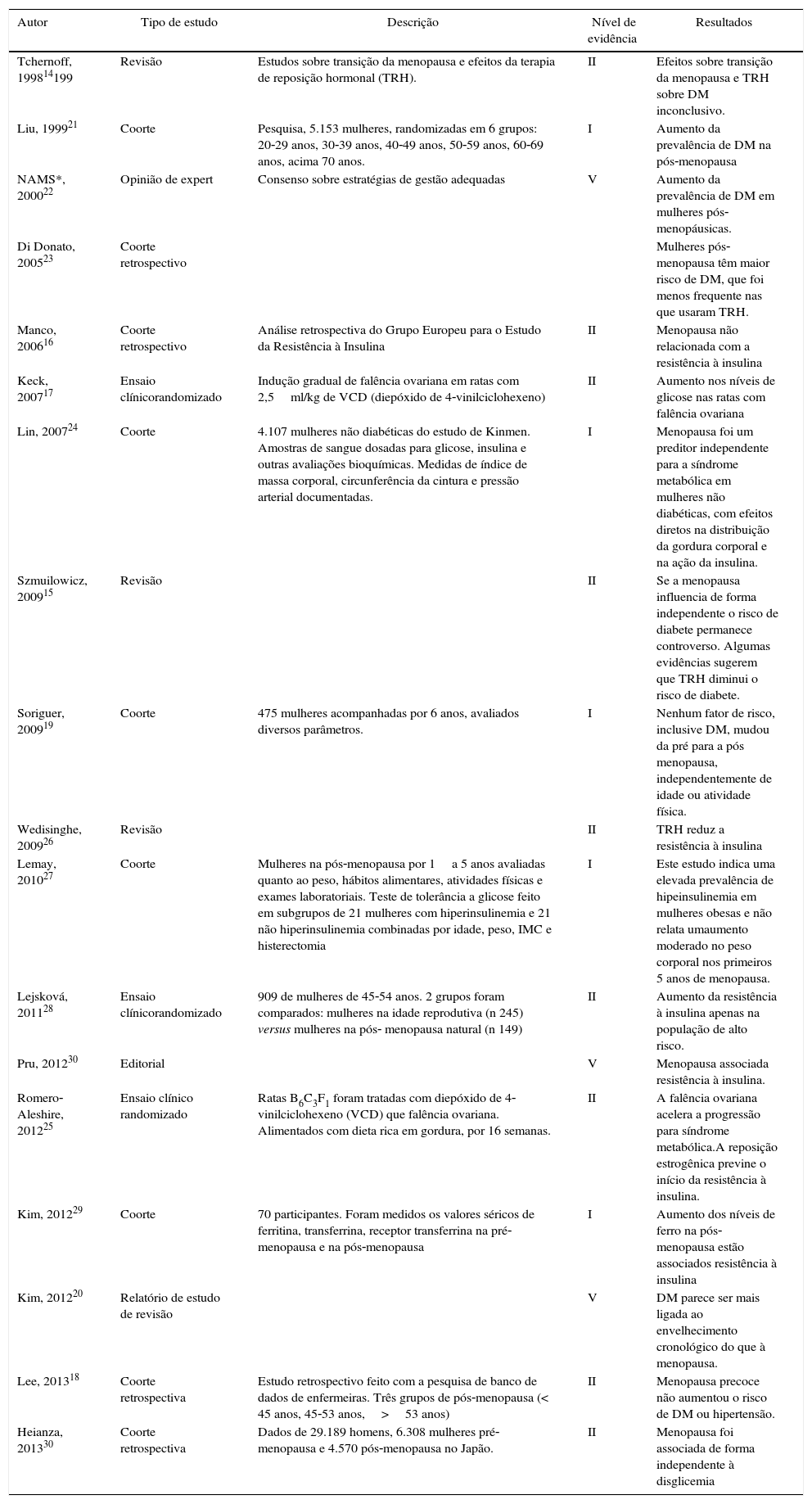
Menopausa natural e risco de diabetes mellitusForam selecionados, pelos critérios de busca, 18 artigos (tabela 3). Apenas dois foram feitos em ratos.
Estudos que relacionam efeitos da menopausa no diabetes mellitus
| Autor | Tipo de estudo | Descrição | Nível de evidência | Resultados |
|---|---|---|---|---|
| Tchernoff, 199814199 | Revisão | Estudos sobre transição da menopausa e efeitos da terapia de reposição hormonal (TRH). | II | Efeitos sobre transição da menopausa e TRH sobre DM inconclusivo. |
| Liu, 199921 | Coorte | Pesquisa, 5.153 mulheres, randomizadas em 6 grupos: 20‐29 anos, 30‐39 anos, 40‐49 anos, 50‐59 anos, 60‐69 anos, acima 70 anos. | I | Aumento da prevalência de DM na pós‐menopausa |
| NAMS*, 200022 | Opinião de expert | Consenso sobre estratégias de gestão adequadas | V | Aumento da prevalência de DM em mulheres pós‐menopáusicas. |
| Di Donato, 200523 | Coorte retrospectivo | Mulheres pós‐menopausa têm maior risco de DM, que foi menos frequente nas que usaram TRH. | ||
| Manco, 200616 | Coorte retrospectivo | Análise retrospectiva do Grupo Europeu para o Estudo da Resistência à Insulina | II | Menopausa não relacionada com a resistência à insulina |
| Keck, 200717 | Ensaio clínicorandomizado | Indução gradual de falência ovariana em ratas com 2,5ml/kg de VCD (diepóxido de 4‐vinilciclohexeno) | II | Aumento nos níveis de glicose nas ratas com falência ovariana |
| Lin, 200724 | Coorte | 4.107 mulheres não diabéticas do estudo de Kinmen. Amostras de sangue dosadas para glicose, insulina e outras avaliações bioquímicas. Medidas de índice de massa corporal, circunferência da cintura e pressão arterial documentadas. | I | Menopausa foi um preditor independente para a síndrome metabólica em mulheres não diabéticas, com efeitos diretos na distribuição da gordura corporal e na ação da insulina. |
| Szmuilowicz, 200915 | Revisão | II | Se a menopausa influencia de forma independente o risco de diabete permanece controverso. Algumas evidências sugerem que TRH diminui o risco de diabete. | |
| Soriguer, 200919 | Coorte | 475 mulheres acompanhadas por 6 anos, avaliados diversos parâmetros. | I | Nenhum fator de risco, inclusive DM, mudou da pré para a pós menopausa, independentemente de idade ou atividade física. |
| Wedisinghe, 200926 | Revisão | II | TRH reduz a resistência à insulina | |
| Lemay, 201027 | Coorte | Mulheres na pós‐menopausa por 1a 5 anos avaliadas quanto ao peso, hábitos alimentares, atividades físicas e exames laboratoriais. Teste de tolerância a glicose feito em subgrupos de 21 mulheres com hiperinsulinemia e 21 não hiperinsulinemia combinadas por idade, peso, IMC e histerectomia | I | Este estudo indica uma elevada prevalência de hipeinsulinemia em mulheres obesas e não relata umaumento moderado no peso corporal nos primeiros 5 anos de menopausa. |
| Lejsková, 201128 | Ensaio clínicorandomizado | 909 de mulheres de 45‐54 anos. 2 grupos foram comparados: mulheres na idade reprodutiva (n 245) versus mulheres na pós‐ menopausa natural (n 149) | II | Aumento da resistência à insulina apenas na população de alto risco. |
| Pru, 201230 | Editorial | V | Menopausa associada resistência à insulina. | |
| Romero‐Aleshire, 201225 | Ensaio clínico randomizado | Ratas B6C3F1 foram tratadas com diepóxido de 4‐vinilciclohexeno (VCD) que falência ovariana. Alimentados com dieta rica em gordura, por 16 semanas. | II | A falência ovariana acelera a progressão para síndrome metabólica.A reposição estrogênica previne o início da resistência à insulina. |
| Kim, 201229 | Coorte | 70 participantes. Foram medidos os valores séricos de ferritina, transferrina, receptor transferrina na pré‐ menopausa e na pós‐menopausa | I | Aumento dos níveis de ferro na pós‐menopausa estão associados resistência à insulina |
| Kim, 201220 | Relatório de estudo de revisão | V | DM parece ser mais ligada ao envelhecimento cronológico do que à menopausa. | |
| Lee, 201318 | Coorte retrospectiva | Estudo retrospectivo feito com a pesquisa de banco de dados de enfermeiras. Três grupos de pós‐menopausa (< 45 anos, 45‐53 anos,>53 anos) | II | Menopausa precoce não aumentou o risco de DM ou hipertensão. |
| Heianza, 201330 | Coorte retrospectiva | Dados de 29.189 homens, 6.308 mulheres pré‐menopausa e 4.570 pós‐menopausa no Japão. | II | Menopausa foi associada de forma independente à disglicemia |
Dos 18 artigos analisados sobre a correlação de diabete e menopausa, sete tinham nível de evidência I e oito de nível de evidência II. Três artigos foram classificados com nível de evidência V. Quatro estudos foram de revisão, dois de opinião de especialista (um editorial), nove coortes, quatro deles retrospectivos, e três ensaios clínicos randomizados.
Dois estudos, os de Tchernof et al. (1998) e Szmuilowicz et al. (2009), foram inconclusivos, cinco, os de Manco et al. (2006), Keck et al. (2007), Lee et al. (2009), Soriguer et al. (2009) e Kim et al. (2012a), não mostraram influência da menopausa no DM e 11, de Liu et al. (1999), o Consenso da Sociedade Norte‐Americana de Menopausa (2000), Di Donato et al. (2005), Lin et al. (2007), Romero‐Aleshire et al. (2009), Wedisinghe et al. (2009), Lemay et al. (2010), Lejskova et al. (2011), Kim et al. (2012b), Pru (2012) e Heianza et al. (2013), evidenciaram aumento de risco.14‐31
Androgênios e risco de diabetes mellitusForam selecionados três estudos, Shi et al. (1994), Fukui et al. (2000) e Xia et al. (2013), que avaliaram os efeitos do androgênio no metabolismo glicêmico32‐34 (tabela 4).
Estudos que relacionam efeitos dos androgênios no diabetes mellitus
| Autor | Tipo de estudo | Descrição | Nível de evidência | Resultados |
|---|---|---|---|---|
| Shi, 199932 | Ensaio clínico randomizado | Ratos divididos em 6 grupos (10 ratos/grupo): 3 grupos de machos e 3 de fêmeas, castrados, procedimento SHAM. Um grupo de machos castrados com enantato de testosterona e um grupo de fêmeas castradas com valerato de estradiol. | II | A orquiectomia reduziu a ocorrência de diabetes em 20%.A ooforectomia aumentou a ocorrência de DM em 30%. |
| Fukui, 200033 | Série de casos | Observação de 6 pacientes avaliadas sobre o controle de diabete após castração cirúrgica (orquiectomia) ou medicamentosa (administração de análogos de GNRH), | III | Todos os pacientes necessitaram de terapêutica antidiabética mais intensa após a castração e terapia antiandrogênica. |
| Xia, 201334 | Ensaio clínico randomizado | 30 ratos machos Sprague‐Dawley, divididos em três grupos: procedimento SHAM, orquiectomia bilateral e castrado recebendo propionato de testosterona através de injeção intraperitoneal | II | Deficiência de testosterona induzida pela castração aumenta glicemia de jejum e resistência à insulina. |
O estudo de Fukui et al. (2000) foi o único feito em humanos, porém com poucos pacientes (nível de evidência III).33
Dois estudos evidenciaram aumento do risco de DM e um, redução no risco de DM.
DiscussãoOoforectomia e risco de diabetes mellitusNa pós‐menopausa os ovários continuam a produzir quantidades significativas de testosterona e androstenodiona, que são convertidas perifericamente em estrogênio. Mulheres que se submetem à histerectomia concomitante à ooforectomia representam uma população única devido à interrupção abrupta da produção dos hormônios ovarianos. A ooforectomia leva a um menor tempo de exposição ao estrogênio endógeno e torna as mulheres suscetíveis a numerosas doenças crônicas, como doença cardiovascular e diabete.35,36
Apesar de não existir um modelo ideal de menopausa em ratas, pois ratas velhas se mantêm ciclando, a maior parte dos estudos tem usado ratas fêmeas entre 6‐12 semanas, consideradas adultas jovens, e as submetido à retirada bilateral dos ovários (ooforectomia), o que leva à restrição dos hormônios ovarianos semelhante à observada em mulheres após a menopausa.37
Os trabalhos mais recentes, como os de Appiah et al. (2015), Tawfik et al. (2015) e Zhu et al. (2013), mostram que a ooforectomia resulta em um aumento de risco de desenvolvimento de diabetes mellitus.1,3,12 Além disso, trabalhos não tão recentes, como os de Mizuno et al. (1993), Rincon et al. (1996) e Siri et al. (2003), também evidenciam esse aumento de risco.6,10,11 Os trabalhos de Tawfik et al. (2015), Mizuno et al. (1993) e Zhu et al. (2013) não levaram em conta se a falta de hormônios sexuais na menopausa natural teria os mesmos efeitos que a ooforectomia.3,10,12
O estudo de Siri et al. (2003) evidenciou que a reposição de estrogênio conseguiu reverter a obesidade, diminuir os níveis de insulina e normalizar a sensibilidade à insulina e tolerância a glicose e apontou para uma possível reversão dos efeitos negativos da ooforectomia por meio da reposição hormonal.6
Três estudos, contrariamente, mostraram redução do DM após a ooforectomia: Makino et al. (1981), Fitzpatrick et al. (1991) e Kim et al. (2011).8,9,13
O estudo de Makino et al. (1981) evidenciou redução de DM apenas em ratas jovens ooforectomizadas e não observou o mesmo efeito em ratas mais velhas.8
O estudo de Kim et al. (2011) não encontrou associação entre menopausa e o risco de diabete, mas observou que a ooforectomia bilateral foi associada à redução no risco de diabetes em pacientes que adotaram medidas comportamentais com mudança de estilo de vida, o que pode sugerir que mulheres ooforectomizadas possam reverter os efeitos negativos da ooforectomia em relação ao metabolismo da glicose com adoção de medidas dietéticas mais saudáveis e prática de exercício físico.13
Apenas no estudo de Swislocki et al. (2002), no qual ratas foram submetidas à ooforectomia cirúrgica ou medicamentosa, não foi observada alteração da tolerância oral a glucose.2
A histerectomia com ooforectomia bilateral está associada com aumentos no índice de massa corporal nos anos que se seguem após a cirurgia. Isso sugere que o ganho de peso acelerado ocasionado pela ooforectomia bilateral entre as mulheres na meia‐idade pode aumentar o risco de doenças crônicas relacionadas à obesidade.37
O DM pode agravar as complicações da ooforectomia e vice‐versa. Diabéticas ooforectomizadas sofrem de graves distúrbios metabólicos, devido à exacerbação da resistência à insulina.1
Menopausa natural e risco de diabetes mellitusOs hormônios ovarianos regulam a absorção de glicose e atuam na resistência à insulina. Durante a menopausa há queda desses hormônios, o que leva a redução da secreção de insulina pelo pâncreas e predispõe o desenvolvimento de DM.26
Os anos após a menopausa estão associados ao aumento da adiposidade visceral e da glicemia, além da diminuição da massa magra do corpo. A hiperglicemia pode ser consequência direta da insuficiência ovariana ou indireta pelo aumento da gordura central devido à diminuição de estrogênio.31
Alguns dados de estudos em seres humanos sugerem que o estrogênio exerce efeito protetor nas células pancreáticas em seres humanos. No estudo Women's Health Initiative (WHI), a incidência de novos casos diagnosticados de diabete foi menor em mulheres em terapia de reposição hormonal do que nas mulheres tratadas com placebo.17
Estudos para avaliar se a menopausa, como fator independente, influencia no diabete encontram dificuldade em separá‐la de outros fatores.1
Dois trabalhos, os de Tchernof et al. (1998) e Szmuilowicz et al. (2009), ambos de revisão, se mostraram inconclusivos quanto à ação da menopausa no desenvolvimento do diabete.14,15
Apenas cinco estudos, os de Manco et al. (2006), Keck et al. (2007), Lee et al. (2009), Soriguer et al. (2009) e Kim et al. (2012a), não mostraram influência da menopausa no risco de diabete. O estudo de Soriguer et al. (2009), por se tratar de coorte longitudinal, foi classificado como nível de evidência I. Os estudos de Manco et al. (2006) e Lee et al. (2009) foram análises retrospectivas que têm viés de seleção e foram classificados como nível de evidência II.13,16‐19
Dos 18 estudos, 11 evidenciaram aumento do risco de diabete na menopausa. No trabalho de revisão de Wedisinghe et al. (2009), essa conclusão foi indiretamente deduzida pela demonstração de redução de incidência do DM com a TRH, na qual o principal efeito em longo prazo da reposição de estrogênio seria a preservação da resposta pancreática de insulina à glicose.26
Seis trabalhos, os de Liu et al. (1999), o Consenso da Sociedade Norte‐Americana de Menopausa (2000), Di Donato et al. (2005), Lin et al. (2007), Pru (2012) e Heianza et al. (2013), mostraram que as alterações nos níveis hormonais que ocorrem na menopausa levam ao aumento da prevalência de diabete em mulheres na pós‐menopausa como fator independente.21‐24,30,31
Quatro estudos evidenciaram risco condicional para desenvolvimento do diabete. Kim et al. (2012b) verificaram aumento de risco associado a mudanças de níveis de ferro na pré e pós‐menopausa, com aumento da resistência à insulina nas mulheres que apresentavam menores níveis de ferro na pré‐menopausa e maior ganho de ferro na pós‐menopausa.29 Romero‐Aleshire et al. (2009) observaram aumento do risco de diabete apenas quando associado a dietas ricas em gorduras.25 Lejskova et al. (2011) relacionaram o aumento do risco de síndrome metabólica apenas em pacientes de alto risco.28 O estudo de Lemay et al. (2010) associou o aumento do risco às pacientes que tiveram ganho de peso na pós‐menopausa.27
Embora o aumento de peso que normalmente ocorre durante a transição da menopausa seja mais atribuído ao envelhecimento do que à própria transição, as alterações na composição corporal foram independentemente associadas ao estado de menopausa. Essas mudanças na composição corporal foram, por sua vez, associadas às alterações na sensibilidade à insulina e no metabolismo de glicose em mulheres na pós‐menopausa.15
A associação entre menopausa e diabete diminui quando se compensa a hipertensão e a dislipidemia, o que sugere que devemos considerar a influência de outros fatores metabólicos. A taxa de risco para diabete é aproximadamente 32% maior em mulheres que entraram na menopausa antes dos 40 anos em comparação com aquelas entre 50‐54 anos. No entanto, independentemente da idade, mulheres na menopausa têm 1,5 vez maior chance de diabete do que mulheres na pré‐ menopausa.38
Androgênios e risco de diabetes mellitusOs androgênios declinam lenta e progressivamente nas mulheres ao longo do período reprodutivo, com maior decréscimo após a menopausa. Apesar disso, os ovários representam a principal fonte androgênica após a menopausa natural.39
Poucos estudos relacionaram os efeitos do androgênio com o metabolismo glicêmico.
Os estudos de Fukui et al. (2000) e Xia et al. (2013) concluíram que a orquiectomia levou ao aumento da resistência insulínica, o que sugere um papel protetor dos androgênios.33,34 Um único estudo, de Shi et al. (1994), concluiu que a orquiectomia diminuiu a incidência de diabete.32
No estudo de Fukui et al. (2000), o controle do diabete mostrou‐se prejudicado após a orquiectomia cirúrgica ou medicamentosa e caracterizou, também, um aumento da resistência insulínica.33
O estudo de Xia et al. (2013) (nível de evidência II) foi feito com 30 ratos, divididos aleatoriamente em grupos e submetidos a orquiectomia. A deficiência de testosterona induzida pela castração aumentou os níveis de glicemia em jejum, o que demonstra o aumento da resistência à insulina.34
Além disso, os trabalhos de Makino et al. (1981) e Fitzpatrick et al. (1991), (tabela 1) também evidenciaram aumento da resistência à insulina em ratos orquiectomizados.8,9
O estudo de Shi et al. (1994), com nível de evidência II, avaliou os efeitos do androgênio no metabolismo glicêmico após ooforectomia e orquiectomia e concluiu que a ooforectomia levou ao aumento de 30% na incidência de diabete e a orquiectomia reduziu a incidência de diabete em 20%, o que poderia ser atribuído a diferentes respostas da resistência à insulina aos androgênios nos diferentes sexos.32
ConclusõesAlém de redução da qualidade de vida, do aumento do risco de doença cardiovascular e da perda óssea acelerada, a ooforectomia pode representar importante fator de risco para DM.
As evidências da literatura apontam para o aumento de risco de diabete em mulheres ooforectomizadas. A ooforectomia efetuada na peri e na pós‐menopausa, além de promover a queda abrupta do estrogênio, reduz a produção de androgênio, que também parece exercer um papel protetor no diabete.
De forma semelhante, a menopausa natural parece estar associada ao aumento do risco do diabete, porém muitos estudos associam esse aumento de risco a outras condições pré‐existentes, como aumento de peso corporal, dietas riscas em gorduras e níveis crescentes de ferro sérico na pós‐menopausa.
A ooforectomia não é um procedimento inócuo, porém, para determinado grupo de mulheres, no qual os riscos de morbimortalidade são menores do que os ganhos obtidos pela ooforectomia, alguns dados da literatura sugerem que a terapia hormonal e a mudança no estilo de vida possam reverter os efeitos em relação à resistência à insulina.
Esta revisão teve como objetivo selecionar dados sobre risco de desenvolvimento de diabete com o intuito de informar e auxiliar na decisão da ooforectomia, que deve ser compartilhada entre médico e paciente, considerando os riscos e os possíveis benefícios.
Mais estudos são necessários para conclusões definitivas e para verificar o possível papel da terapia de reposição hormonal e da mudança no estilo de vida na reversão desses efeitos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.