Menores taxas de gestação em portadoras de endometriose submetidas a técnicas de reprodução assistida podem estar relacionadas à piora da qualidade oocitária. A análise da expressão gênica em células do cumulus (CC) pode fornecer biomarcadores passíveis de predizer a qualidade gamética. O objetivo deste estudo foi comparar os níveis da expressão do gene CYP19A1 em CC de mulheres inférteis com endometriose mínima/leve (I/II) e controles inférteis.
MétodoForam selecionadas pacientes com infertilidade por endometriose pélvica inicial e por fator masculino e/ou tubário (grupo controle), submetidas à estimulação ovariana controlada para injeção intracitoplasmática de espermatozoide (ICSI). Imediatamente após a captação oocitária, CC foram isoladas e armazenadas. Foi realizada a quantificação da expressão do gene CYP19A1 nas CC por meio de PCR-Real Time.
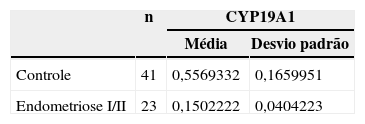
ResultadosForam isoladas CC de 23 mulheres inférteis com endometriose I/II e de 41 controles. Observou-se expressão significativamente menor do gene CYP19A1 em CC de mulheres inférteis com endometriose I/II (0,56±0,17) quando comparadas às controles (0,15±0,04) (p=0,043).
ConclusõesA menor expressão do gene CYP19A1 em CC de mulheres inférteis com endometriose pélvica em estágios iniciais pode mediar a piora da qualidade oocitária, abrindo novas perspectivas no entendimento da etiopatogênese da infertilidade relacionada à doença.
Lower pregnancy rate in women with endometriosis submitted to assisted reproductive techniques might be related to poor oocyte quality. The analysis of the expression of the genes in cumulus cells (CC) might provide biomarkers that can predict gamete quality. The main objective of the present study was to compare the levels of the expression of the gene CYP19A1 in CC of infertile women with minimal and mild (I/II) endometriosis and infertile controls.
MethodThere were selected patients with infertility caused by initial pelvic endometriosis and by male/tubal factor (control group), submitted to controlled ovarian stimulation to ICSI. Immediately after the oocyte retrieval, CC were isolated and stored. Quantification of the expression of the gene CYP19A1 in CC was performed using PCR-real time.
ResultsCC were isolated from 23 infertile women with endometriosis I/II and 41 from control. Significant lower expression of the gene CYP19A1 in CC was observed in infertile women with endometriosis I/II (0.56±0.17) when compared to control (0.15±0.04) (p=0,043).
ConclusionsThe lower expression of the gene CYP19A1 in CC of infertile women with pelvic endometriosis in initial stages might mediate the poor oocyte quality, opening new perspectives on the understanding of the etiopathogenesis of infertility related to the disease.
A endometriose afeta aproximadamente 10 a 15% das mulheres em idade reprodutiva1 e é associada à subfertilidade. Sua prevalência atinge 40% em mulheres com subfertilidade e aproximadamente 30 a 50% das portadoras de endometriose são inférteis.2 Entretanto, os mecanismos envolvidos na etiopatogênese da infertilidade em pacientes com endometriose ainda não foram completamente elucidados, sobretudo nos estágios iniciais (doença mínima e leve), em que não se observam alterações na anatomia pélvica.3,4
Alguns estudos têm evidenciado redução da fecundidade natural em mulheres inférteis com endometriose pélvica em estágios iniciais quando comparadas a mulheres férteis, com melhora significativa da fecundidade natural após a exérese e ablação cirúrgica das lesões,5–7 evidenciando o papel da endometriose, mesmo em estágios iniciais, na fertilidade destas pacientes.
Novas abordagens para o tratamento da infertilidade relacionada à endometriose se tornaram disponíveis, com ênfase na utilização cada vez mais frequente das técnicas de reprodução assistida (TRA). Alguns estudos têm sugerido a ocorrência de menores taxas de implantação e gestação em portadoras de endometriose pélvica em estágios iniciais submetidas à estimulação ovariana para a realização de procedimentos de reprodução assistida de alta complexidade,8,9 o que poderia ser secundário, pelo menos parcialmente, à piora da qualidade oocitária.10,11
Todavia, a doação de oócitos humanos maduros para pesquisas utilizando metodologias invasivas que impossibilitam a utilização subsequente dos mesmos nos procedimentos de reprodução assistida é incomum, de modo que há escassez de estudos avaliando a qualidade oocitária humana. Desta forma, persiste a dúvida sobre a ocorrência ou não de comprometimento da qualidade oocitária relacionada à endometriose. Neste contexto, a identificação de biomarcadores não invasivos, passíveis de predição da competência oocitária, é bastante desejável. Estudos demonstram que células da granulosa e células do cumulus podem ser marcadores de viabilidade de oócitos e embriões.12,13
A aromatase (codificada pelo gene CYP19A1), enzima envolvida na conversão da androstenediona e testosterona em estrona e estradiol, respectivamente, está presente nas células da granulosa e exerce papel fundamental na maturação folicular e no estabelecimento da qualidade oocitária.13–16 Alguns autores evidenciaram, em modelo de cultivo celular, uma redução da atividade da aromatase em células da granulosa de mulheres inférteis com endometriose.17 Outros observaram redução de transcritos do gene CYP19A1 em células da granulosa luteinizadas murais cultivadas in vitro.18,19
Todavia, até o presente, nenhum estudo avaliou a expressão do gene CYP19A1 em células do cumulus (CC) de mulheres inférteis com endometriose pélvica em estágios iniciais, cuja desregulação poderia estar relacionada à piora da qualidade oocitária, consequentemente, na etiopatogênese da infertilidade associada à doença, estimulando a realização do presente estudo.
O objetivo deste estudo foi comparar os níveis de transcritos do gene CYP19A1 em CC de mulheres inférteis com endometriose I/II e controles inférteis submetidos à estimulação ovariana para a realização de injeção intracitoplasmática de espermatozoide (ICSI).
MétodoRealizou-se um estudo transversal prospectivo, submetido e aprovado pelo Comitê de Ética em Pesquisa do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto (FMRP), Universidade de São Paulo (USP).
PacientesForam incluídos no presente estudo, consecutivamente, todos os casais submetidos à estimulação ovariana para a realização de injeção intracitoplasmática de espermatozoide (ICSI) junto ao Setor de Reprodução Humana do Departamento de Ginecologia e Obstetrícia da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP) no período de fevereiro de 2009 a outubro de 2010. Deste grupo, foram selecionados os que preencheram os critérios de elegibilidade abaixo descritos e manifestaram o desejo de participar do projeto, mediante a assinatura do termo de consentimento livre e esclarecido.
O Grupo Endometriose I/II foi constituído por 23 pacientes inférteis cujo procedimento de reprodução assistida foi indicado pela presença exclusivamente de endometriose inicial, diagnosticada por meio de videolaparoscopia e confirmação histológica das lesões, segundo os critérios definidos pela American Society for Reproductive Medicine.20 O Grupo Controle foi constituído por 41 pacientes inférteis cujo procedimento foi indicado devido à presença exclusiva de fator masculino e/ou fator tubário.
Foram excluídas pacientes com idade ≥ 38 anos, índice de massa corpórea ≥ 30kg/m2, FSH basal ≥ 10 mUI/mL, tabagistas, etilistas, portadoras de doenças como diabetes mellitus ou quaisquer outras endocrinopatias, doença cardiovascular, dislipidemia, lupus eritematoso sistêmico e outras doenças reumatológicas, qualquer infecção ativa, hidrossalpinge e uso de medicamentos que pudessem interferir na foliculogênese ovariana nos três meses que antecederam o início da estimulação ovariana, como anti-inflamatórios não esteroidais e corticosteroides.
Estimulação ovariana e suporte de fase lúteaA estimulação ovariana seguiu o protocolo do setor, que consiste em bloqueio hipofisário com análogo do hormônio liberador de gonadotrofinas (GnRHa) iniciado 10 dias antes do dia de realização da ultrassonografia transvaginal (USTV) basal (protocolo longo), no período vespertino, por meio da administração de acetato de leuprolide (Lupron®, Abott, Brasil) na dose de 0,5mg/dia (10 UI), por via subcutânea, mantida durante todo o período de estimulação ovariana controlada até o dia da administração da gonadotrofina coriônica humana (hCG) (Ovidrel®, Serono, Brasil).
A hiperestimulação ovariana controlada foi iniciada, preferencialmente, entre o segundo e o quarto dia do ciclo menstrual. As pacientes receberam 200 a 300 UI por dia de FSH recombinante (FSHr) (Gonal-F®, Serono, Brasil; Puregon®, Organon, Brasil) nos primeiros 6 dias da indução. A partir do sétimo dia da indução da ovulação, a dose foi ajustada de acordo com o crescimento folicular e a espessura endometrial, monitorados com USTV diariamente ou em dias alternados. Quando pelo menos dois folículos atingiram 18mm de diâmetro médio, foram administrados 250μg de hCG recombinante (Ovidrel®, Serono, Brasil) às 22 horas. A captação dos oócitos foi realizada 34 a 36 horas após a administração do hCG recombinante.
A suplementação da fase lútea foi realizada com progesterona natural micronizada (Utrogestan®, Enila, Brasil) por via oral na dose de 200mg, três vezes ao dia, a partir do dia da captação oocitária, e mantida até a décima segunda semana da gestação nas pacientes que engravidaram.
Captação oocitáriaA aspiração dos folículos foi realizada por via endovaginal guiada por transdutor ultrassonográfico transvaginal acoplado à agulha de punção. No presente estudo foi coletado o fluido folicular e foram obtidas CC apenas do primeiro folículo aspirado, individualmente, em tudo sem meio de cultura, do primeiro ovário puncionado. Os demais folículos foram aspirados continuamente formando um pool de fluido, seguindo o protocolo assistencial do serviço.
Após uma lavagem cuidadosa, os complexos cummulus oophorus (COCs) identificados foram colocados em placas NUNC (Multidish 4 well Nuclon, Delta SI) preenchidas com meio de cultura com fluido de tuba humano-HEPES (HTF, Irvine Scientific) suplementado com 10% de soro sintético substituto (SSS, Irvine Scientific), coberto com óleo mineral (Sigma-Aldrich), e incubado na estufa na presença de CO2 à 5% a 37°C e 95% de umidade por um período de 2 a 3 horas. Após esse período, os oócitos foram desnudados através da exposição dos COCs a hialuronidase (H4272 type IV-S, Sigma; 80 IU/mL) por 30 segundos e as células do cumulus foram mecanicamente removidas em HTF-SSS através de uma pipeta (130μm - Denuding Pipette, Cook).
Amostras obtidasCélulas do cumulusImediatamente após a identificação do complexo cummulus oophorus do primeiro folículo aspirado do primeiro ovário puncionado (com diâmetro maior ou igual a 15mm), as células do cumulus foram separadas do oócito através de microdissecção com a utilização de duas agulhas de insulina, colocadas no criotubo e imediatamente em seguida, congeladas em nitrogênio líquido até a utilização para a extração do RNA.
Extração de RNA total e síntese de cDNAO RNA total foi extraído das células do cummulus oophorus com o reagente TRIzol (Invitrogen Life Technologies, Paisley, Reino Unido) de acordo com as instruções do fabricante. Após o tratamento das amostras com DNase I (Sigma), a integridade do RNA foi confirmada pela presença das bandas ribossomais 28S e 18S quando analisadas por eletroforese em gel de agarose 1%. As concentrações de RNA total foram determinadas no espectrofotômetro NanoDrop (2000c, Thermo Scientific, EUA) à densidade óptica de 260nm. O RNA permaneceu armazenado à -80°C até os procedimentos posteriores.
Um micrograma de RNA total de cada amostra foi transcrito reversamente usando primers randômicos do kit High Capacity cDNA Archive (Applied Biosystems, Warrington, Reino Unido) segundo as instruções do fabricante. A reação foi realizada no termociclador PIKO Thermal Cycler, (Finnzymes) na ciclagem de 10minutos a 25°C, 37°C por 2 horas, 85°C por 5minutos, 4°C por 5minutos.
Quantificação por PCR em tempo realA quantificação relativa da expressão dos genes analisados foi realizada no aparelho ABI PRISMTM7500 FAST (Applied Biosystems, Warrington, Reino Unido). As reações foram executadas utilizando o sistema TaqMan®Gene Expression Assays (TaqMan® MGB probes, FAM™ dye-labeled) da Applied Biosystems. Os assay IDs das sondas usadas foram: GAPDH Hs 99999905_m1, ACTB Hs 99999903_m1 (genes de referência) e CYP19A1 Hs 00240671_m1. A PCR em tempo real foi realizada para cada amostra em triplicata seguindo as seguintes condições: 10μL do TaqMan® Universal PCR Master Mix (2x) (Applied Biosystems, Warrington, Reino Unido), 1μL do TaqMan® Gene Expression Assay Mix (20X) (Applied Biosystems, Warrington, Reino Unido), e 9μL de cDNA diluído (1:25) em volume final de 20μL reação. As condições da reação foram 50°C por 2 minutos, então 95°C por 10 minutos, seguidos de 40 ciclos a 95°C por 15 segundos e 60°C por 1 minuto.
A quantificação relativa (RQ) para os genes analisados foi calculada para cada amostra de acordo com o método de 2-ΔΔCT (ou 2-Ct).21 Um pool de cDNA contendo iguais quantidades das amostras do grupo controle foi usado como amostra calibradora. Os genes GAPDH e ACTB (genes de referência) foram usados para normalizar as reações.
Análise estatísticaOs dados foram analisados considerando cada paciente como unidade experimental do estudo. Os grupos endometriose I/II e controle foram analisados de forma comparativa. As análises estatísticas foram realizadas no software SAS 2003 (2002-2003, SAS Institute Inc., Cary, NC, EUA). A variável expressão gênica foi transformada pelo log10. A transformação logarítmica foi necessária, pois não foi atendida uma das suposições (linearidade) feitas em análises empregando-se os modelos lineares. Estas análises especificam que a média condicional E (y½x=x0) da variável resposta y dado o valor x0 do vetor preditor x é linear em x0. A aplicação dos modelos lineares pode ser estendida supondo-se que uma transformação apropriada da variável resposta dada por t(y), em que E{t(y)½x}, seja linear em x na função t(y)=b0+bTx+e para b0 e bT desconhecidos. O termo e (erro aleatório) é independente de x e tem média zero.22 Utilizou-se o teste Tukey pelo PROC GLM para comparar as médias de expressão do gene CYP19A1 entre os grupos controle e endometriose.
ResultadosForam isoladas CC de 23 mulheres inférteis com endometriose I/II e de 41 controles. Observou-se expressão significativamente menor do gene CYP19A1 em CC de mulheres inférteis com endometriose I/II (0,56±0,17) quando comparadas às controles (0,15±0,04) (p=0,043) (tabela 1).
DiscussãoOs mecanismos envolvidos na etiopatogênese da infertilidade em pacientes com endometriose ainda não foram completamente identificados.3,4 Resultados conflitantes de alguns estudos têm sugerido piora dos resultados de procedimentos de reprodução assistida em mulheres inférteis com endometriose pélvica,8,9,23 que poderia ser decorrente do comprometimento da qualidade oocitária.10,11
Sabe-se da comunicação bidirecional entre oócitos e células do cummulus oophorus, que ocorre durante todo o processo de desenvolvimento folicular,24–29 e que isso é essencial para a aquisição de competência para desenvolvimento adequado dos oócitos de mamíferos.30–32 Além disso, sabemos do importante papel das células da granulosa no processo de diferenciação folicular que leva a condições ótimas para o desenvolvimento oocitário, ovulação, fertilização e subsequente implantação.33
Alguns dados sugerem que as CC podem ser utilizadas como biomarcadores da qualidade oocitária.34–39 Desta forma, a análise da expressão de genes envolvidos na aquisição da competência oocitária nas CC de oócitos humanos maduros pode ser utilizada com a finalidade de avaliação não invasiva da qualidade oocitária e preditor de resultados de procedimentos de reprodução assistida.13,34–36,40–42
Pela primeira vez na literatura, evidenciamos redução significativa da expressão do gene CYP19A1 em CC de pacientes inférteis com endometriose I/II quando comparadas às inférteis controles. Dados acerca da expressão do gene CYP19A1 em células da granulosa humanas são escassos e controversos.18,19 Abreu et al. (2011)18 não demonstraram diferença entre a expressão do RNAm da aromatase em células da granulosa de mulheres inférteis com e sem endometriose submetidas a estimulação ovariana para TRA. Todavia, os referidos autores não analisaram separadamente os estágios iniciais da doença e as células analisadas foram obtidas a partir da centrifugação do fluido folicular obtido durante a captação oocitária. Embora a maioria das células analisadas sejam células granulosas murais, o fluido folicular pode conter algumas células do cumulus, células sanguíneas e eventualmente algumas células estromais ou da teca, de modo que os dados obtidos por Abreu et al. (2011)18 não podem ser comparados diretamente aos obtidos no presente estudo.
Por outro lado, outro estudo evidenciou produção reduzida de estradiol e menor expressão de RNAm da aromatase P450 em células da granulosa de mulheres inférteis com endometriose,19 sem individualização dos estágios da doença, cultivadas in vitro. Entretanto, como não dispomos de dados comparando expressão de RNAm da aromatase P450 entre células da granulosa murais e CC em humanos, não é possível comparar os dados obtidos dos dois estudos previamente citados com os do presente estudo.
Sabe-se que a qualidade oocitária resulta de um complexo e sincronizado processo que tem duração de vários meses, desde a fase de folículo primordial até a fase de folículo pré-ovulatório.43 Está bem estabelecido que as células da granulosa têm um papel fundamental no processo de diferenciação folicular criando condições ideais para o desenvolvimento oocitário, a ovulação e a fertilização.33 Dessa forma, a qualidade embrionária parece depender fundamentalmente da maturação folicular final, produzindo um oócito com capacidade de levar a uma gravidez viável.
Nossa compreensão sobre mudanças específicas na expressão gênica das células foliculares durante o crescimento folicular de animais e humanos está longe de se concluir. Entretanto, há evidência de que a aromatase P450 (codificada pelo gene CYP19A1) é estimulada pelo FSH e expressa em concentrações elevadas em folículos dominantes.44 Portanto, níveis de expressão mais elevados dessa enzima parecem estar relacionados à indução hormonal (FSH e LH), produção de hormônios esteroides (estrogênio e progesterona) e a mecanismos de dominância folicular.13
Nesse contexto, Hamel et al. (2008),13 por meio da análise de células foliculares, tanto granulosas murais quanto cumulus, obtidas de folículos aspirados individualmente de pacientes submetidas a FIV, demonstrou maior expressão do gene CYP19A1 em células foliculares provenientes de folículos cujo oócito fertilizado resultou em gravidez. Esses autores sugeriram que a maior expressão desse gene em células foliculares poderia ser usada como biomarcador de qualidade e competência embrionária.
Desta forma, sugerimos que a redução da expressão do gene CYP19A1 em CC de pacientes inférteis com endometriose pélvica em estágios iniciais pode favorecer o comprometimento da qualidade oocitária, participando da patogênese da infertilidade relacionada à doença.
FinanciamentoFAPESP (Processo 2008/58197-6) e CNPq (Processo 474858/2009-0).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Trabalho realizado no Departamento de Ginecologia e Obstetrícia da Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, SP, Brasil.