Nos últimos anos, têm sido observados retardos na maternidade. A maior incidência de câncer durante toda a vida e os percentuais de sobrevida mais expressivos para doenças oncológicas contribuíram para o surgimento de um número crescente de cânceres detectados durante a gravidez, o que implica a necessidade de um conhecimento mais aprofundado da concepção nessas pacientes. O câncer de mama é o tipo de neoplasia mais frequentemente detectado durante a gestação. Cerca de 40‐50% das sobreviventes do câncer de mama desejam engravidar subsequentemente ao tratamento. Apresentamos o caso de uma primigrávida diagnosticada com câncer de mama, que foi bem‐sucedida em sua primeira gestação a termo dois anos após o diagnóstico.
During last years a delay of motherhood has been noticed. The increased incidence of cancer during lifetime and the increased survival rates of oncological diseases have contributed to a growing number of cancers detected during pregnancy which leads to the need for better knowledge about conception in these patients. Breast cancer is the most frequent type of cancer detected during pregnancy. About 40‐50% of breast cancer survivors want a subsequent pregnancy after treatment. We present a case of a primigravida diagnosed with breast cancer that conducted her first full term healthy pregnancy 2 years after diagnosis.
Ao longo dos últimos anos, por variados motivos, tem‐se assistido a um adiamento da maternidade.1 Atendendo ao aumento da incidência de patologia oncológica ao longo da vida de um indivíduo e ao aumento das taxas de cura e sobrevivência, o diagnóstico de neoplasias durante a gravidez e a sua programação após tratamento por doença oncológica começam a ser uma realidade.2 Nesse contexto são colocados na prática clínica vários desafios relacionados sobretudo com a redução das taxas de fertilidade após tratamento oncológico, com as opções e as técnicas de preservação de fertilidade nesses doentes, com o impacto da gravidez na recorrência da doença e o intervalo seguro para a mãe e o feto entre o diagnóstico/tratamento e concepção.3 Apresentamos o caso de uma doente com primeira gravidez detectada quando do diagnóstico de carcinoma da mama e com gravidez posterior dois anos após o diagnóstico.
Descrição de casoMulher de 32 anos, previamente saudável, nuligesta, sem antecedentes familiares relevantes, referenciada à consulta de doenças da mama em contexto de detecção de nódulo da mama esquerda (ME) em autoexame. Era portadora de ecografia mamária que descrevia nódulo suspeito no quadrante superoexterno da ME com 25×12×34mm que se traduzia em mamografia por uma zona de microcalcificações em área de condensação (Birads‐4). Foi submetida a biópsia que por ter sido inconclusiva motivou a proposta de exérese da lesão para caracterização histológica. Em estudo extemporâneo de peça operatória foi conhecido o diagnóstico de carcinoma ductal invasivo (CDI) com biópsia de gânglio sentinela positiva para doença metastática ganglionar; foi então feita mastectomia radical modificada, o estudo histológico da peça operatória confirmou CDI, G3, triplo negativo (receptores de estrogênios e progesterona negativos, HER2 negativo), Ki 67‐100% com 19 gânglios metastatizados em 20 excisados. O estadiamento foi negativo para metastatização a distância – pT3N3aM0.
Entretanto, cerca de três meses após a detecção do referido nódulo, a doente referia amenorreia de 11 semanas e é feito o diagnóstico de gravidez evolutiva compatível com o tempo de amenorreia. Após discussão multidisciplinar, foi sugerida ao casal a interrupção de gravidez com vista à programação de quimio (QT) e radioterapia (RT) adjuvante imediatas. O casal optou pela interrupção de gravidez e seguidamente a doente cumpriu seis ciclos de QT com protocolo TAC (docetaxel, doxorrubicina e ciclofosfamida) seguida de RT adjuvante. Iniciou protocolo de acompanhamento multidisciplinar em consulta.
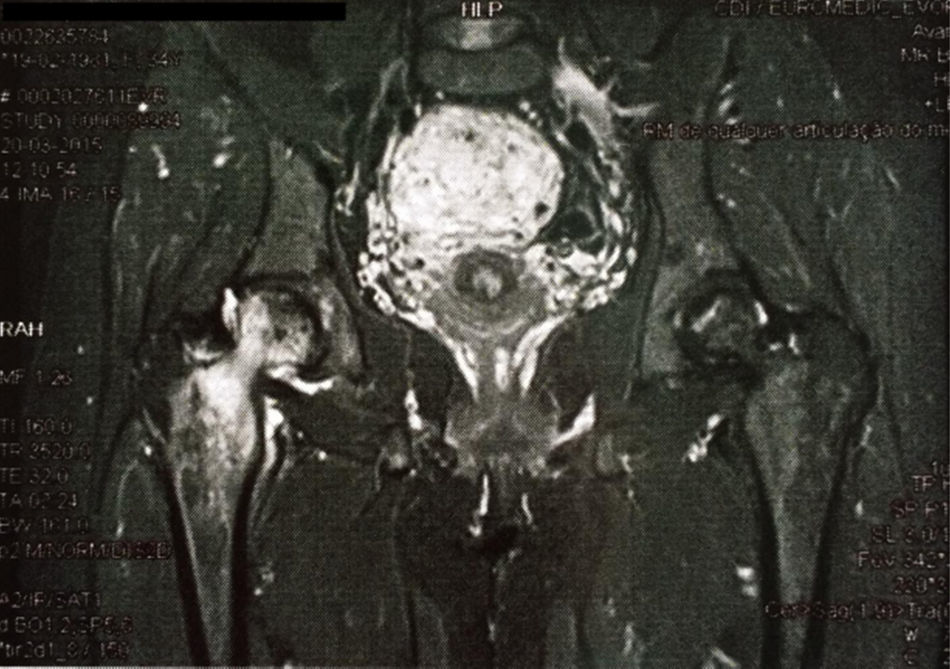
A doente ficou amenorreica desde o início da quimioterapia e após consulta de ginecologia para orientação contraceptiva optou por manter contracepção com método barreira. Em consulta de seguimento de oncologia referiu queixa de novo de cefaleia com tontura, vômitos e fotofobia associados. Fez RMN cranioencefálica que revelou duas lesões de provável natureza metastática. Foi submetida a corticoterapia com dexametasona, QT com temozolamida e RT holocraneana com ótima resposta e sem lesões metastáticas em RMN de controle, embora com evidência de sequelas pós‐rádicas. Durante todo esse período de seguimento, o valor do marcador tumoral CA 15,3 manteve‐se sempre estável dentro dos valores de referência e foram excluídas outras localizações de metastatização. Manteve o seguimento protocolado e ficou assintomática ao longo dos sete meses seguintes, altura em que iniciou quadro de dor coxofemural direita agravada pelo movimento. Fez cintilografia osteoarticular que excluiu lesões secundárias ósseas, mas sugeria RMN para melhor caracterização de lesão em nível coxofemural direito. A RMN da anca revelou lesões de necrose asséptica da cabeça do fêmur direito e confirmou ausência de lesões de metastatização óssea. Constatou‐se, ainda, presença de útero gravídico nesse exame (fig. 1). Perante esse achado, foi imediatamente referenciada a consulta de obstetrícia e confirmou‐se gravidez evolutiva de 19 semanas.
Após discussão multidisciplinar, o casal foi informado e esclarecido sobre os potenciais riscos associados à manutenção da gravidez. O fato de se tratar de um carcinoma com receptores hormonais negativo foi um fator importante tido em conta na sua orientação, embora a opinião de todos os clínicos envolvidos não tenha sido consensual. Apesar de tudo, e após ter sido devidamente informado, o casal optou pela manutenção da gravidez e foi iniciado seguimento imediato em consulta de medicina materno‐fetal.
Com base na decisão de prosseguir com a gravidez, optou‐se em consulta de ortopedia por tratamento conservador da necrose asséptica da anca, com analgesia e marcha com apoio e com contraindicação do parto por via vaginal. Decorreu uma gravidez de evolução normal até as 38 semanas. Nasceu de cesariana eletiva um recém‐nascido feminino, com 3.090 gramas de peso e índice de Apgar de 10/10 (1° e 5° minuto). O puerpério imediato decorreu sem complicações e ao 3° dia pós‐cesariana mãe e recém‐nascido tiveram alta. Embora sem evidências que apoiassem a decisão, optou‐se pela ablactação em atenção aos antecedentes maternos.
DiscussãoA neoplasia da mama é a mais frequentemente detectada durante a gravidez, corresponde a 0,2‐3,8% do total de casos diagnosticados nessa altura ou no 1° ano após o parto.4 Já para mulheres em seguimento por neoplasia mamária, são referidas na literatura taxas de desejo de concepção de 40‐50%, embora na prática essa taxa se reduza a 4‐7% de mulheres que efetivamente voltam a engravidar.5 Essa baixa taxa pode ser explicada por vários fatores, tais como a redução da fertilidade associada aos tratamentos instituídos com efeito gonadotóxico2 e o receio e dúvidas ainda muito evidentes de uma importante parte da comunidade médica sobre o impacto de uma gravidez no curso da doença, notadamente em termos de risco de recidiva,6 o que se traduz por taxas de interrupção de gravidez após neoplasia de mama de 30%.4
É importante ter em consideração que, apesar das limitações dos estudos publicados, eles não só não demonstraram um impacto negativo da gravidez no prognóstico da doença como encontraram uma associação positiva entre gravidez e o prognóstico em longo prazo em termos de sobrevivência,2,6,7 embora tal associação deva ser analisada cuidadosamente devido ao efeito healthy mother, o qual traduz provavelmente um viés de seleção, já que uma importante parte das mulheres que engravidam após doença oncológica é aquela à partida com melhor prognóstico e que se manteve em remissão sem sinais de recidiva de doença.4,7,8 Relativamente ao intervalo de tempo mais seguro para a concepção, embora dependa da duração do tratamento completo, do risco de recidiva, da idade e reserva ovárica da doente,2 a maioria dos estudos publicados aconselha os dois anos após o diagnóstico2,4,8,9 independentemente dos receptores hormonais. Esse período é o recomendado com base no risco de recidiva ser maior nos dois primeiros anos após diagnóstico e por habitualmente ser suficiente para completar o tratamento e poder permitir a recuperação da função ovárica após exposição a fármacos gonadotóxicos.4,6 No caso dos tumores com receptores hormonais positivos a discussão é mais controversa, já que recomendar os dois anos de espera até a concepção implicaria uma suspensão da hormonoterapia mais precoce do que o atualmente recomendado.10,11 Contudo, a sugestão de aguardar 5‐10 anos para programação de uma gravidez pode resultar em dificuldades acrescidas para nova gravidez; mas essas doentes devem ser sempre informadas dos riscos que podem advir da suspensão precoce da hormonoterapia. Nas mulheres que optem por assumir esse risco, parece ser prudente recomendar pelo menos 2‐3 anos de hormonoterapia, a qual deverá ser retomada após o parto.2,9 Relativamente aos riscos perinatais em gravidezes após neoplasia da mama, embora o número de trabalhos publicados seja limitado,12,13 alguns autores referem taxas ligeiramente superiores de partos pré‐termo e baixo peso ao nascer,13 o que constitui um fator adicional para que o seguimento em consulta de alto risco dessas gravidezes seja equacionado. É ainda essencial referir que a interrupção da gravidez após carcinoma de mama não demonstrou benefícios em termos de prognóstico e de sobrevivência1, deve essa decisão ser da responsabilidade da mulher/casal devidamente esclarecidos e informados de acordo com a sua situação.
Para concluir, a gravidez após doença oncológica é cada vez mais um tema da atualidade. Num momento em que se assiste a uma preocupação crescente com questões relacionadas com a oncofertilidade, é essencial desfazer alguns mitos e saber aconselhar adequadamente essas doentes com base em evidências.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.