Comparar oito marcadores de estresse oxidativo (EO) no soro e no fluido folicular (FF) de mulheres inférteis com e sem endometriose (E) submetidas à estimulação ovariana controlada (EOC) para injeção intracitoplasmática de espermatozoide (ICSI).
Material e métodosForam coletadas 87 amostras de soro (43 com E e 44 sem E – com fator tubário e/ou masculino) e 61 amostras de FF (29 com E e 32 sem E) no dia da captação oocitária. Hidroperóxidos totais (FOX1), malondialdeído (MDA), produtos avançados de oxidação proteica (AOPP), glutationa (GSH), superóxido dismutase (SOD) e capacidade antioxidante total (CAT) foram determinados por espectrofotometria; vitamina E (Vit E) por cromatografia líquida de alta eficiência; e 8‐hidroxi‐2’‐deoxiguanosina (8OHdG) por ELISA.
ResultadosForam observadas maiores concentrações séricas de GSH (220,32±43,2 nmol/g pt) e SOD (677,9±282,21 U/mL), menores concentrações séricas da CAT (0,34±0,17 mEq Trolox/L) e maiores concentrações foliculares de 8OHdG (23,19±6,8ng/mL) e Vit E (13,0±5,33μmol/L) em mulheres inférteis com E comparadas às sem E (193,92±43,25 nmol/g pt, 563,04±169,82 U/mL, 0,46±0,15 mEq Trolox/L, 17,22±5,6ng/mL e 8,71±2,51μmol/L, respectivamente).
ConclusõesFoi evidenciado EO sistêmico e folicular em pacientes inférteis com E submetidas à EOC para ICSI. Sugerimos que o EO possa estar envolvido na etiopatogênese da infertilidade relacionada à doença
The aim of the study was to compare eight oxidative stress (OS) markers in serum and follicular fluid (FF) of infertile women with and without endometriosis (E) undergoing controlled ovarian stimulation (COS) for intracytoplasmic sperm injection (ICSI).
Material and methodsEight‐seven serum samples (43 with E and 44 without E ‐ with male or tubal factor) and 61 FF samples (29 with E and 32 without E) were collected in the day of oocyte retrieval. Total hydroperoxides (FOX1), malondialdehyde (MDA), advanced oxidation protein products (AOPP), glutathione (GSH), superoxide dismutase (SOD) and the total antioxidant capacity (TAC) were determined by spectrophotometry, vitamin E (Vit E) by high performance liquid chromatography, and 8‐hydroxy‐2’–deoxyguanosine (8OHdG) by ELISA.
ResultsWe observed higher serum concentrations of GSH (220.32±43.2 nmol/g pt) and SOD (677.9±282.21 U/mL), lower serum concentrations of TAC (0.34±0.17 mEq Trolox/L), and higher follicular concentrations of 8OHdG (23.19±6.8ng/mL) and Vit E (13.0±5.33μmol/L) in infertile women with E compared to those without E (193.92±43.25 nmol/g pt, 563.04±169.82 U/mL, 0.46±0.15 mEq Trolox/L, 17.22±5.6ng/mL and 8.71±2.51μmol/L, respectively).
ConclusionsWe evidenced the occurrence of systemic and follicular OS in infertile patients with E undergoing COS for ICSI. We suggest that the OS may be involved in the etiopathogenesis of infertility‐related disease
A endometriose é uma doença ginecológica altamente prevalente entre mulheres em idade reprodutiva,1 caracterizada pela presença de implantes endometriais (glândulas e/ou estroma) ectópicos.2 Frequentemente associada à infertilidade, acomete de 25 a 40% das mulheres inférteis e estima‐se que 30 a 50% das mulheres com endometriose apresentam infertilidade.3 Entretanto, os mecanismos envolvidos na etiopatogênese da infertilidade relacionada à endometriose são pouco conhecidos, de modo que seu melhor entendimento permitiria o delineamento de estudos de intervenção específicos para promover a melhoria da fertilidade natural dessas mulheres.
O estresse oxidativo (EO) tem sido associado a diversas doenças reprodutivas e tem se questionado seu papel na etiopatogênese da endometriose.4‐6 Sua ocorrência está, possivelmente, associada a uma resposta inflamatória aos implantes endometriais ectópicos.7 Em mulheres com a doença, uma tendência a maior produção de agentes pró‐oxidantes, associada a uma potencial alteração da sua capacidade antioxidante, poderia promover a perda do equilíbrio redox do trato reprodutivo e induzir a ocorrência do EO,2,4,5,8 que, por sua vez, poderia estar envolvido também no comprometimento da fertilidade.6,9 Estudos evidenciam que o EO, por meio de diferentes mecanismos, pode causar anomalias meióticas e instabilidade cromossômica, além de aumentar apoptose e causar prejuízos no desenvolvimento embrionário pré‐implantação.10‐12 O microambiente folicular tem um papel crítico na qualidade oocitária, fertilização e no desenvolvimento embrionário.13 A ocorrência de EO nesse microambiente pode ter impacto na foliculogênese ovariana14 e promover comprometimento da qualidade oocitária.6,15 Até o presente, poucos estudos investigaram a presença de EO no FF de mulheres inférteis com endometriose.14‐16 O estudo com maior casuística não avaliou concomitantemente a presença de EO sistêmico.6,15 Em recente estudo de nosso grupo, foi evidenciado um efeito deletério do fluido folicular (FF) de mulheres inférteis com endometriose leve sobre o fuso e distribuição cromossômica de oócitos bovinos maturados in vitro, o que indica a presença de fatores nocivos à qualidade oocitária no FF de mulheres com a doença e questiona o papel do EO na pioria da qualidade gamética.17 Dessa forma, questionamos a ocorrência de EO no microambiente folicular de pacientes inférteis com a doença, que poderia afetar a qualidade oocitária e, consequentemente, comprometer a fertilidade natural dessas pacientes, de modo que sua identificação poderia ajudar na elucidação de mecanismos da infertilidade relacionada à endometriose. Também questionamos a ocorrência de EO sistêmico no dia da captação oocitária de pacientes submetidas à estimulação ovariana controlada (EOC) para a feitura de ICSI, uma vez que sua presença em mulheres com endometriose poderia não estar restrita à cavidade pélvica e atingir também a circulação sistêmica.18,19
Apesar de existirem evidências que sugerem presença de EO nos sítios dos implantes pélvicos endometriais,6 dispomos de dados inconclusivos acerca do balanço oxidante‐antioxidante em portadoras de endometriose e não encontramos estudos que avaliassem conjuntamente diferentes marcadores pró e antioxidantes no soro e FF de mulheres com infertilidade relacionada à endometriose, cuja análise conjunta permitiria um melhor entendimento desse complexo processo. Dessa forma, o objetivo deste estudo foi comparar oito marcadores de estresse oxidativo no soro e no fluido folicular (FF) de mulheres inférteis com e sem endometriose (E) submetidas à estimulação ovariana controlada (EOC) para injeção intracitoplasmática de espermatozoide (ICSI).
Material e métodosDesenho do estudoFez‐se um estudo observacional prospectivo junto ao Setor de Reprodução Humana do Departamento de Ginecologia e Obstetrícia da FMRP‐USP e Laboratório de Nutrição e Metabolismo, Departamento de Clínica Médica da FMRP‐USP. Este estudo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto (FMRP), Universidade de São Paulo (USP), processo HCRP 10187/2007. As pacientes que preencheram os critérios de inclusão e manifestaram o desejo de participar do projeto e concordaram em ceder amostras de fluido folicular assinaram o termo de consentimento livre e esclarecido previamente à inclusão no estudo.
Critérios de elegibilidadeNo grupo endometriose, foram incluídas pacientes com infertilidade associada exclusivamente à endometriose diagnosticada e classificada por videolaparoscopia segundo os critérios da American Society for Reproductive Medicine,20 com exclusão de fator masculino ou canalicular de infertilidade. No grupo controle, foram incluídas pacientes apenas com infertilidade por fator masculino e/ou tubário. Todas as pacientes do grupo controle foram submetidas à videolaparoscopia diagnóstica como procedimento de rotina para investigação da infertilidade conjugal e foi descartada a presença de endometriose e outras doenças pélvicas, como DIP em atividade.
Foram critérios de não elegibilidade para os dois grupos idade maior que 38 anos: índice de massa corporal (IMC) ≥ 30 Kg/m2, nível sérico de hormônio folículo estimulante (FSH) no terceiro dia do ciclo menstrual natural >10mUI/ml, presença de síndrome dos ovários policísticos e outras etiologias de anovulação crônica, hidrossalpinge e doenças crônicas como diabetes mellitus ou outras endocrinopatias, doença cardiovascular, dislipidemia, lúpus eritematoso sistêmico e outras doenças reumatológicas, infecção pelo vírus HIV, qualquer infecção ativa, tabagismo, uso de medicações hormonais e de anti‐inflamatórios hormonais e não hormonais e suplementos vitamínicos nos seis meses anteriores à inclusão no estudo (os quais poderiam ser vieses do estudo, já que estão relacionados a produção de espécies reativas e estresse oxidativo).
Protocolo de estimulaçãoCom o objetivo de sincronizar e programar o início do ciclo de estimulação ovariana controlada usou‐se a programação da menstruação, que consiste em se administrar diariamente anticoncepcionais orais combinados, iniciados no período menstrual do ciclo precedente até cinco dias antes do previsto para o início da estimulação ovariana, e suspender sua administração de tal forma que o início do sangramento menstrual coincida com a ultrassonografia transvaginal (USTV) basal para se observar o padrão endometrial e afastar a presença de cistos ovarianos que pudessem interferir na resposta à administração das gonadotrofinas exógenas e na monitoração ultrassonográfica do crescimento folicular.
O bloqueio hipofisário com análogo do hormônio liberador de gonadotrofinas (GnRHa) foi iniciado 10 dias antes do dia da USTV basal (protocolo longo), no período vespertino, por meio da administração de acetato de leuprolide (Lupron®, Abott, Brasil; Reliser®, Serono, Brasil) na dose de 0,5mg/dia (10 UI), por via subcutânea, mantida durante todo o período de estimulação ovariana controlada até o dia da administração da gonadotrofina coriônica humana (hCG) (Ovidrel®, Serono, Brasil).
A hiperestimulação ovariana controlada foi iniciada entre o segundo e o quarto dia do ciclo menstrual. As pacientes receberam 150 a 300 UI por dia de FSH recombinante (FSHr) (Gonal‐F®, Serono, Brasil; Puregon®, Organon, Brasil), via intramuscular, nos primeiros seis dias da indução. A partir do sétimo dia da indução da ovulação, a dose foi ajustada de acordo com o crescimento folicular e a espessura endometrial, monitorados com USTV diariamente ou em dias alternados.
Na presença de, pelo menos, dois folículos com 18mm de diâmetro médio, foram administrados 250μg de hCG recombinante (Ovidrel®, Serono, Brasil) às 22:00. A captação dos oócitos foi feita 34 a 36h após a administração do hCG recombinante.
Captação oocitária e desnudamento oocitárioA captação dos oócitos foi feita mediante prévia anestesia geral endovenosa com propofol (Diprivan®, Astra‐Zeneca, Brasil), associado ao citrato de fentanil (Fentanil®, Janssen‐Cilag, Brasil). A aspiração dos folículos por via endovaginal guiada por transdutor ultrassonográfico transvaginal foi feita com uma agulha de lúmen simples padrão, (Laboratório CCD, França), com pressão aspirativa artificial constante de 100mmHg, por meio de bomba de sucção com controle eletrônico (Craft® Suction Pump, Rocket Medical, Inglaterra). Cada folículo, cujo FF foi usado neste estudo (critérios descritos a seguir), foi aspirado individualmente em tubos previamente aquecidos a 37° C. Não continham meio de cultivo. O respectivo COC foi identificado e transferido para a placa com os demais complexos aspirados. Os demais folículos foram aspirados em pool, em tubos de ensaio, previamente aquecidos a 37°C, com 1ml de meio de cultivo HTF‐HEPES.
Para a identificação e o isolamento dos COC, o material aspirado foi transferido para placas de Petri com 10cm de diâmetro, previamente aquecidas em platina térmica a 37°C. Não continham meio de cultivo. Depois de identificados, os COC foram lavados cuidadosamente em meio de cultura HTF‐HEPES (HTF, Irvine Scientific), para a remoção de sangue e debris. A seguir foram colocados em pool em placas NUNC (Multidish 4 wells Nuclon, Delta SI), preenchidas com o meio de cultura HTF e cobertas com óleo mineral, e levados à incubadora em mistura gasosa de CO2 a 5%, sob condições ideais de temperatura (37°C) e umidade (95%) por três a quatro horas. Após esse período, os COC foram colocados em microgotas de 25μL de hialuronidase (H4272 tipo IV‐S, Sigma), na diluição de 80 UI/mL de HTF/HEPES (Irvine Scientific), por no máximo 30 segundos, e, então, lavados duas ou três vezes com o meio HTF modificado (HTF/HEPES, Irvine Scientific), suplementado com soro sintético substituto (SSS) a 10%. A remoção mecânica dos restos celulares foi feita com o auxílio de uma pipeta de desnudação (stripper pipette 130μm denuding pipette, Cook, Melbourne, Australia).
Após o desnudamento oocitário (remoção do cumulus oophorus), identificamos o grau de maturidade dos oócitos, sob visualização ao estereomicroscópio invertido. Os oócitos imaturos (em estágio de vesícula germinativa ou metáfase I) foram descartados e os oócitos maduros (caracterizados morfologicamente pela presença de um corpúsculo polar extruso) foram injetados como descrito a seguir.
Injeção intracitoplasmática de espermatozoide,, taxas de fertilização, implantação, gestação clínica e nascido vivoOs oócitos maduros, caracterizados pela extrusão do CP, foram submetidos à ICSI três a quatro horas após a captação oocitária e, após injetados, foram cultivados em gotas separadas. Cerca de 16 a 18 horas após a ICSI foi avaliada a fertilização, caracterizada pela presença de dois pró‐nucleos e dois corpúsculos polares (a taxa de fertilização corresponde ao número de oócitos fertilizados, divididos pelo número de oócitos injetados X 100). Cerca de 43 a 45 horas após a ICSI (segundo dia de desenvolvimento embrionário – D2) foi avaliada a qualidade embrionária (quanto ao número e à simetria de blastômeros, percentagem de fragmentação e presença ou não de multinucleação). Para os casos em que a transferência embrionária não ocorreu no D2, cerca de 67 a 69 horas após a ICSI (D3) foi feita novamente a análise da qualidade embrionária.
Foram considerados como embriões de boa qualidade em D2 os que apresentaram quatro blastômeros, simétricos, sem fragmentação e sem multinucleação (21). Foram considerados de boa qualidade no D3 os embriões com oito blastômeros simétricos, sem fragmentação e sem multinucleação.21
Fez‐se a transferência embrionária em D2 ou D3, de acordo com a individualização de cada caso. Avaliou‐se a taxa de taxa de gravidez clínica por ciclo com transferência, caracterizada pelo número de pacientes com embrião com batimento cardíaco visualizado ao USTV feito quatro a cinco semanas após a transferência embrionária dividido pelo número de ciclos com transferência embrionária X 100. Calcularam‐se também as taxas de nascidos vivos por ciclos com transferência embrionária (número de ciclos com nascidos vivos dividido pelo número de ciclos com transferência embrionária X 100) nos dois grupos.
Foram avaliados também idade, peso, estatura, IMC, valor do FSH basal no 3° dia do ciclo natural, quantidade total de FSH usado para estimulação ovariana, número de dias de estimulação ovariana, espessura endometrial no dia da transferência embrionária, número total de oócitos captados e maduros (com extrusão do primeiro CP), total de embriões de boa qualidade, de embriões formados e de embriões transferidos.
Coleta e processamento das amostrasSanguePara a coleta sanguínea foram usados tubos estéreis, a vácuo, com ácido etilenodiamino tetra‐acético (EDTA), para coleta de 5mL de sangue venoso das pacientes no dia da captação oocitária.
As amostras foram centrifugadas a 3.000rpm por 10 minutos e o soro foi armazenado a–80°C, dividido em quatro alíquotas, para posterior análise.
Fluido folicularAspirou‐se apenas todo o conteúdo do primeiro folículo do primeiro ovário puncionado, com diâmetro médio ≥ 15mm (pela chance elevada de conter um oócito maduro), em um tubo previamente aquecido a 37°C. Apenas os FF livres de contaminação sanguínea à inspeção visual22 e que apresentaram células da granulosa (CG) ou células da granulosa e um oócito maduro captado foram considerados adequados para análise. Cada amostra de FF adequado foi centrifugada a 300g por sete minutos, para remover os componentes celulares e estocada a–80°C, aliquotada em dois ou três criotubos, para posterior análise.
As amostras de sangue e FF armazenadas foram, posteriormente, enviadas para o Laboratório de Nutrição da Faculdade de Medicina de Ribeirão Preto, onde foram dosados os marcadores de estresse oxidativo descritos a seguir. Todas as dosagens foram feitas em duplicata, no mesmo momento, pelo mesmo técnico, com experiência comprovada nas metodologias empregadas. O responsável técnico pelas dosagens não teve acesso aos dados clínicos das pacientes e não conhecia o grupo ao qual pertenciam.
Mensuração dos marcadores de estresse oxidativoHidroperóxidos totais Injeção intracitoplasmática de espermatozoideA concentração total de peróxidos foi determinada pelo método hidroperóxidos totais (FOX1).23 O sistema de teste FOX1 é baseado na oxidação do Fe+2 (íon ferroso) a Fe+3 (íon férrico) por vários tipos de peróxidos contidos nas amostras analisadas. Na presença de xylenol orange forma‐se um complexo colorido (xylenol orange‐férrico) de cor azul púrpura, cuja absorbância pode ser medida.24 Nesse método usa‐se uma substância preparada no dia da leitura (o reagente FOX1). A solução 1 é preparada com 7,6mg de xylenol orange e 88mg de BHT (butil‐hidroxitolueno) em 90mL de metanol. A solução 2 é preparada com 9,8mg de sulfato ferroso em 10mL de ácido sulfúrico 250mM (0,13mL de ácido sulfúrico em 10mL de água). As duas soluções devem ser misturadas em concentração 9:1 somente no dia da leitura. Para a análise são necessários 100μL de soro ou fluido, 100μL de água (para o branco) e 1mLda solução, que reagem por 30 minutos ao abrigo da luz à temperatura ambiente. Após esse período, centrifuga‐se por cinco minutos a 3.500rpm e a absorbância do sobrenadante é medida em 560nm. A curva foi feita com H2O2 em concentrações de 10 a 200μM. O resultado foi expresso em μmol/g proteína.
Glutationa – concentração total de grupos tióis ou sulfidrilasA glutationa (GSH) do soro e FF foi medida por um método descrito originalmente por ELLMAN25 e modificado por HU,26 no qual os grupos tióis interagem com o ácido ditionitrobenzoico (DTNB) e formam um ânion altamente colorido com um pico máximo a 412nm (e412=13,600M−1cm−1). Nesse ensaio, uma alíquota de 25μL de soro ou fluido é misturada a 1mL de tris‐EDTA buffer (25 nmol/L Tris‐base, 20mmol/L EDTA, pH 8,2) e a leitura da absorbância é feita em um comprimento de onda de 412nm. Após essa leitura, uma alíquota de 25μL de solução estoque de DTNB (10 nmol/L em etanol absoluto) é adicionada à solução, que é mantida a temperatura ambiente durante 15 minutos. Após esse período, nova leitura é feita com o uso como branco do DTNB.24 A concentração de grupos sulfidril foi calculada com a glutationa reduzida e o resultado foi expresso em nmol/g proteína.
Vitamina EA determinação da concentração de vitamina E (Vit E) (α‐tocoferol) no soro e no FF foi feita segundo o método descrito por Arnaud et al.,27 como detalhado a seguir. Uma amostra de 0,5mL de soro ou FF foi homogeneizada em 2mL de etanol. Em seguida foi colocada em 1mL de n‐hexano e agitada por doisminutos. Uma alíquota de 0,5mL do sobrenadante (n‐hexano) foi pipetada, cuidadosamente, em tubo de ensaio seco em nitrogênio, ressuspensa em 0,5mL de fase móvel, composta por acetonitrila/diclorometanol/metanol (70:10:20, v/v/v) e filtrada. Uma quantidade de 100μL foi injetada na HPLC (Cromatografia Líquida de Alta Eficiência) e a leitura efetuada como descrito a seguir. Para a determinação das concentrações da Vit E foi usado um HPLC modelo Shimadzu LC‐9A, com uma coluna tipo C‐18 (Simpack CLC‐ODS 4,6×25cm), uma pré‐coluna de 4mm × 1cm, com fluxo de 2mL/min. A leitura foi feita por espectrofotometria com um detector UV/Vis a 292nm. O equipamento foi calibrado com soluções padrões de α‐tocoferol (SIGMA), nas concentrações de 10, 20 e 200μmol/L. Antes de cada leitura foi injetada uma solução padrão de α‐tocoferol na concentração de 20μmol/L. O equipamento foi programado para que os resultados fossem expressos em μmol/L para o soro e FF.
Superóxido dismutaseA superóxido dismutase (SOD) foi avaliada de acordo com o protocolo do Kit Frutosamina da Labtest Diagnóstica S.A. modificado. Para a dosagem com inibição foram preparados dois tubos eppendorfs. No primeiro tubo foram colocados 50μl de fluido ou soro, 50μl de HCL a 2N e incubado por dois minutos à temperatura de 37°C. Em seguida adicionaram‐se 100μl de NaOH 1M. No segundo tubo, foram colocados 500μl de reagente do kit e incubado por dois minutos à temperatura de 37°C. Depois foram adicionados 100μlda solução do primeiro tubo e incubada por 10 minutos à temperatura de 37°. Os dois tubos foram lidos separadamente em 530nm, o segundo cinco minutos depois do primeiro. Para a dosagem sem inibição foi feito um tubo eppendorf onde foram colocados 500μl de reagente do kit e incubado por dois minutos à temperatura de 37C. Logo em seguida foram adicionados 25μlda amostra, mais 25μlde HCL a 2N e 50μl de NaOH a 1M. Essa mistura foi homogeneizada e incubada à temperatura de 37°C por dez minutos e foi feita a leitura.
Os cálculos foram: sem inibição=A2‐A1 (S); com inibição=A2‐A1 (C); %inibição=(CX100)/S; U/mL=(%inibiçãoX500)/(%inibição do padrão).
Capacidade antioxidante totalA capacidade antioxidante total (CAT) do soro e fluido folicular foi medida por um método baseado na 2, 2‐azinobis‐3‐etilbenzotiazolina‐6‐sulfonato (ABTS).24,28 Nesse ensaio, ATBS é incubada com potássio persulfato para produzir a oxidação do ATBS. Em resumo, uma amostra de 10mg de ATBS é dissolvida em 10mL de uma solução aquosa com 2,5mmol/L de persulfato de potássio. Essa solução é deixada no escuro em temperatura ambiente, de uma a quatro horas, antes de ser usada. Para o estudo das amostras, a solução de estoque ATBS oxidada é diluída em água deionizada em absorvância de 0,70 a 734m. Cerca de 10 minutos após a adição de 1mL de ABTS oxidado diluído em 10μL de soro ou fluido folicular é feita a leitura da absorvância. A CAT foi calculada com Trolox® (OXIS International Inc., USA) como padrão e o resultado foi expresso em mEq Trolox®/L.
MalondialdeídoCerca de 1mL de cada amostra foi misturado com 2ml de TCA‐TBA‐HCL (15% de ácido tricloracético, 0,375% de ácido tiobarbitúrico e 0,25N de ácido clorídrico) e aquecido em banho‐maria por 15 minutos. Após resfriamento, o precipitado foi centrifugado em 1.000g por 10minutos. A absorbância do produto foi medida em espectrofotômetro (Spectronic 601‐Milto Roy) com comprimento de onda de 535nm. O cálculo da concentração das substâncias reativas ao ácido tiobarbitúrico (TBARS) foi feito considerando‐se o coeficiente de absortividade molar do produto (E535=1,56×10−5M−1cm−1). Os resultados foram expressos em nmol de malondialdeído (MDA)/litro. Uma curva padrão foi feita, com o uso de uma solução estoque de malondialdeído a 10mM, preparada a partir do tetrametoxipropano (SIGMA). As concentrações encontradas nas amostras apresentaram‐se dentro dessa curva e mostraram uma boa linearidade com o padrão. O resultado foi expresso em nmol MDA/g proteína.
Produtos avançados de oxidação proteicaOs produtos de oxidação proteica presentes no soro (AOPPs) e FF foram determinados pelo método descrito por Witko‐Sarsat et al.,29 conforme sumarizado a seguir. Uma amostra de 40μL de soro ou FF foi misturada a 160μL de PBS (tampão fosfato salino) e 20μL de ácido acético glacial (ultrapuro). A leitura da absorbância foi feita com comprimento de onda de 340nm. A curva para essa leitura foi feita com o uso de cloramina T (curva de 10 a 100mM) e iodeto de potássio (1,16M). Misturaram‐se 200μL dos padrões a 10μL de iodeto de potássio e 20μL de ácido acético e a placa foi agitada por seis minutos antes da leitura. O resultado final foi expresso em μmol/L.
Oito‐hydroxy‐2’‐deoxyguanosinaA determinação e a quantificação da oito‐hydroxy‐2’‐deoxyguanosina (8OHdG) foi feita pelo método de ELISA (Stressgen® DNA Damage ELISA Kit, Ann Arbor, MI), de acordo com as recomendações do fabricante, sumarizadas a seguir. Previamente à detecção, as amostras de soro ou fluido são diluídas em um diluente específico do Kit em concentração 1:20 (v/v). Durante a preparação dos reagentes, a amostra diluída permanece em temperatura ambiente. A curva de calibração é feita com padrão conhecido de 8OHdG nas concentrações de 0,94ng/mL a 10ng/mL. Para o procedimento, em uma placa previamente sensibilizada com anticorpos anti‐8OHdG, adicionam‐se 50μL das amostras e dos padrões em cada poço, faz‐se uma primeira lavagem da placa e a seguir adicionam‐se 50μL de anticorpo anti‐8OHdG previamente diluído em cada poço, exceto no branco. Após incubação à temperatura ambiente por uma hora, fazem‐se seis lavagens da placa com solução tampão. Adicionam‐se 100μL do conjugado HRP ‐ anti‐IgG de camundongo a cada poço, exceto no branco, e incuba‐se por mais uma hora à temperatura ambiente. Após mais uma lavagem, adicionam‐se 100μL do substrato TMB em cada poço, incuba‐se por 10 minutos no escuro e adicionam‐se 100μLda solução de parada. A cor obtida é estável por 30 minutos e a absorbância é medida em 450nm. A intensidade da cor amarela é inversamente proporcional à concentração de 8OHdG expressa em ng/mL.
Determinação de proteínas totais (hidroperóxidos totais, malondialdeído e glutationa são expressos por g proteína)As determinações de proteínas nas amostras de soro e FF foram feitas pelo kit Proteínas Totais Labtest®. O princípio dessa metodologia está na reação entre o íon cobre do reagente biureto, que reage em contato com as ligações peptídicas da proteína e produz uma cor púrpura, que deve ser lida a 540nm no espectrofotômetro.
Análise estatísticaPara as comparações dos marcadores de EO entre os grupos, foi aplicado o modelo de regressão linear com efeitos mistos (efeitos aleatórios e fixos) e o pós‐teste por contrastes ortogonais.
Para comparação das variáveis idade, peso, estatura, IMC, FSH basal, total de FSH usado, número de dias de indução, endométrio e número de oócitos captados entre os grupos foi aplicado o teste t. As variáveis número de oócitos maduros, taxa de fertilização, número de embriões de boa qualidade, total de embriões formados, número de embriões transferidos e taxa de implantação foram comparadas entre os grupos com o teste de Mann‐Whitney. O teste exato de Fisher foi usado para associar a gestação clínica e os nascidos vivos entre os grupos.
Para essas análises foi usado o programa estatístico SAS® 9.0.
Foi considerado o nível de significância de 5% (p<0,05).
ResultadosFluxogramaDe outubro de 2009 a outubro de 2010, 275 pacientes participaram do Programa de Reprodução Assistida do Hospital Universitário da Faculdade de Medicina de Ribeirão Preto e foram submetidas à estimulação ovariana para ICSI. Dessas, 124 não foram elegíveis para o estudo. As 151 pacientes elegíveis (76 do grupo sem endometriose e 75 do grupo com endometriose) foram entrevistadas e, dessas, 19 não aceitaram participar do estudo. Assim, 132 pacientes assinaram o termo de consentimento livre e esclarecido (65 do grupo sem endometriose e 67 do grupo com endometriose) e iniciaram o ciclo de EOC para ICSI. Trinta e três pacientes não tiveram captação oocitária, 25 em virtude de ciclo suspenso por má resposta (11 do grupo sem endometriose e 15 do grupo com endometriose), quatro em virtude de falta de condições econômicas para continuar o tratamento (duas em cada grupo) e quatro pelo uso incorreto de medicação (duas em cada grupo). Noventa e nove pacientes (50 do grupo sem endometriose e 49 do grupo com endometriose) foram submetidas à captação de oócitos. Foram obtidas amostras de sangue das 50 pacientes sem endometriose e das 49 com endometriose. Foram obtidas amostras de FF de todas as pacientes. Todavia, apenas 32 amostras de FF de pacientes sem endometriose e 35 de pacientes com endometriose foram elegíveis para o estudo. Oitenta e sete amostras de soro (43 com E e 44 sem E) e 61 amostras de FF (29 com E e 32 sem E) tiveram dados analisados no presente estudo (fig. 1). As demais estavam inadequadas para dosagens.
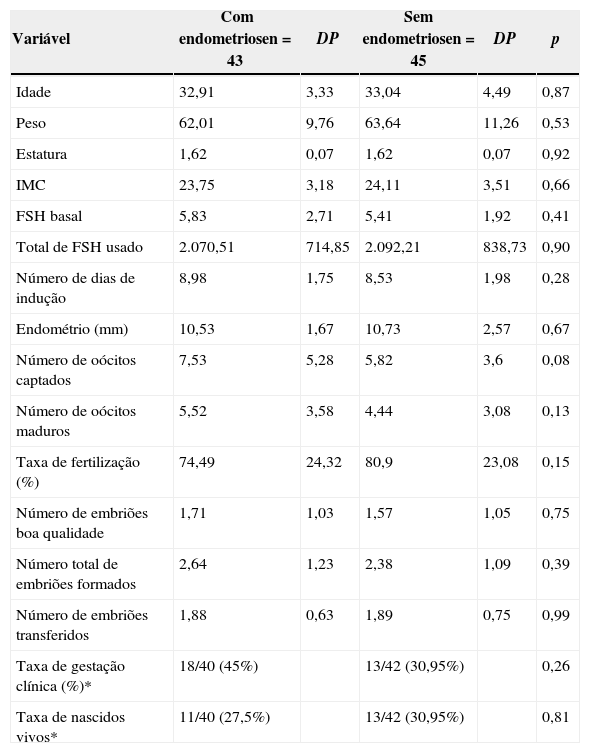
Variáveis clínicas, resposta à estimulação ovariana e resultados de injeção intracitoplasmática de espermatozoide, em pacientes inférteis com e sem endometrioseNão observamos diferença significativa entre os grupos avaliados com relação a idade, peso, estatura, IMC, FSH basal, dose total de FSH usada, dias de estimulação ovariana, espessura endometrial no dia da transferência embrionária, número de oócitos captados e maduros, número de embriões de boa qualidade, total de embriões formados e número de embriões transferidos (tabela 1). Também não se evidenciou diferença entre as taxas de fertilização, gestação clínica e nascidos vivos entre os grupos (tabela 1).
Variáveis clínicas, resposta à estimulação ovariana e resultados de ICSI em pacientes inférteis com e sem endometriose submetidas à estimulação ovariana controlada
| Variável | Com endometriosen=43 | DP | Sem endometriosen=45 | DP | p |
|---|---|---|---|---|---|
| Idade | 32,91 | 3,33 | 33,04 | 4,49 | 0,87 |
| Peso | 62,01 | 9,76 | 63,64 | 11,26 | 0,53 |
| Estatura | 1,62 | 0,07 | 1,62 | 0,07 | 0,92 |
| IMC | 23,75 | 3,18 | 24,11 | 3,51 | 0,66 |
| FSH basal | 5,83 | 2,71 | 5,41 | 1,92 | 0,41 |
| Total de FSH usado | 2.070,51 | 714,85 | 2.092,21 | 838,73 | 0,90 |
| Número de dias de indução | 8,98 | 1,75 | 8,53 | 1,98 | 0,28 |
| Endométrio (mm) | 10,53 | 1,67 | 10,73 | 2,57 | 0,67 |
| Número de oócitos captados | 7,53 | 5,28 | 5,82 | 3,6 | 0,08 |
| Número de oócitos maduros | 5,52 | 3,58 | 4,44 | 3,08 | 0,13 |
| Taxa de fertilização (%) | 74,49 | 24,32 | 80,9 | 23,08 | 0,15 |
| Número de embriões boa qualidade | 1,71 | 1,03 | 1,57 | 1,05 | 0,75 |
| Número total de embriões formados | 2,64 | 1,23 | 2,38 | 1,09 | 0,39 |
| Número de embriões transferidos | 1,88 | 0,63 | 1,89 | 0,75 | 0,99 |
| Taxa de gestação clínica (%)* | 18/40 (45%) | 13/42 (30,95%) | 0,26 | ||
| Taxa de nascidos vivos* | 11/40 (27,5%) | 13/42 (30,95%) | 0,81 |
Nota: Dados apresentados como média±desvio padrão (DP). Taxa de fertilização: número de oócitos fertilizados dividido pelo número de oócitos injetados X 100; taxa de gestação clínica por transferência embrionária: número de ciclos com presença de pelo menos um embrião com batimento cardíaco visível ao US feito quatro a cinco semanas após a transferência embrionária dividido pelo número de ciclos com transferência embrionária X100; taxa de nascidos vivos por ciclos com transferência embrionária: número de ciclos com nascidos vivos dividido pelo número de ciclos com transferência embrionária X 100. Dados analisados pelo teste t ou teste de Mann‐Whitney. *Dados analisados pelo teste exato de Fisher. Nível de significância de 5% (p<0,05).
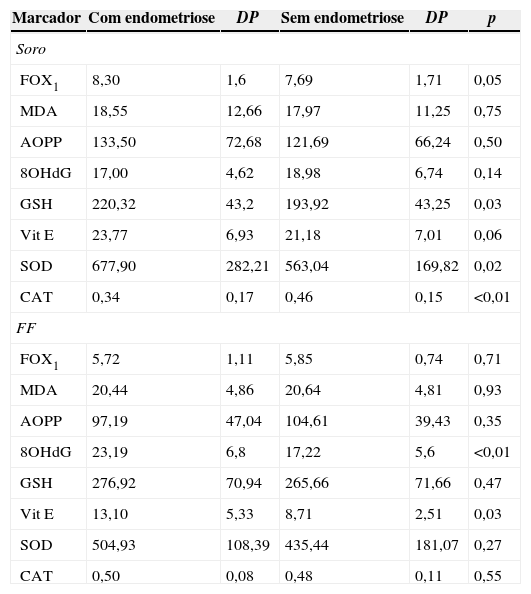
No soro, o grupo com endometriose apresentou maiores concentrações de GSH (220,32±43,2 nmol/g pt; p=0,03) e SOD (677,9±282,21 U/mL; p=0,02) e menores níveis de CAT (0,34±0,17 mEq Trolox/L; p<0,01) comparado ao sem endometriose (193,92±43,25 nmol/g pt, 563,04±169,82 U/mL, 0,46±0,15 mEq Trolox/L, respectivamente). Além disso, foi observada uma tendência a maiores concentrações de FOX1 no grupo endometriose (8,30 ±1,6μmol/g pt) comparado ao sem endometriose (7,69±1,71μmol/g pt; p=0,05; tabela 2).
Marcadores de estresse oxidativo no soro e fluido folicular de mulheres inférteis com e sem endometriose submetidas à estimulação ovariana controlada com gonadotrofinas no dia da captação oocitária
| Marcador | Com endometriose | DP | Sem endometriose | DP | p |
|---|---|---|---|---|---|
| Soro | |||||
| FOX1 | 8,30 | 1,6 | 7,69 | 1,71 | 0,05 |
| MDA | 18,55 | 12,66 | 17,97 | 11,25 | 0,75 |
| AOPP | 133,50 | 72,68 | 121,69 | 66,24 | 0,50 |
| 8OHdG | 17,00 | 4,62 | 18,98 | 6,74 | 0,14 |
| GSH | 220,32 | 43,2 | 193,92 | 43,25 | 0,03 |
| Vit E | 23,77 | 6,93 | 21,18 | 7,01 | 0,06 |
| SOD | 677,90 | 282,21 | 563,04 | 169,82 | 0,02 |
| CAT | 0,34 | 0,17 | 0,46 | 0,15 | <0,01 |
| FF | |||||
| FOX1 | 5,72 | 1,11 | 5,85 | 0,74 | 0,71 |
| MDA | 20,44 | 4,86 | 20,64 | 4,81 | 0,93 |
| AOPP | 97,19 | 47,04 | 104,61 | 39,43 | 0,35 |
| 8OHdG | 23,19 | 6,8 | 17,22 | 5,6 | <0,01 |
| GSH | 276,92 | 70,94 | 265,66 | 71,66 | 0,47 |
| Vit E | 13,10 | 5,33 | 8,71 | 2,51 | 0,03 |
| SOD | 504,93 | 108,39 | 435,44 | 181,07 | 0,27 |
| CAT | 0,50 | 0,08 | 0,48 | 0,11 | 0,55 |
Nota: Grupo com endometriose: soro n=43; fluido folicular (FF) n=29. Grupo sem endometriose: soro n=44; FF n=32. FOX1: total de hidroperóxidos, expresso em μmol/g proteína; MDA: malondialdeído, expresso em nmol/g proteína; AOPP: produtos avançados de oxidação proteica, expressos em μmol/L; 8OHdG: 8‐hidroxideoxiguanosina, expresso em ng/mL; GSH: glutationa reduzida, expressa em nmol/g proteína; Vit E: vitamina E, expressa em μmol/L; SOD: superóxido dismutase, expressa em U/mL; CAT: capacidade antioxidante total, expressa em mEq Trolox/L. Dados apresentados como média±desvio padrão (DP) e analisados com o modelo de regressão linear com efeitos mistos (efeitos aleatórios e fixos) e pós‐teste por contrastes ortogonais. Nível de significância de 5% (p<0,05).
No fluido folicular, o grupo com endometriose apresentou maiores concentrações de 8OHdG (23,19±6,8ng/mL; p<0,01) e Vit E (13,1±5,33μmol/L; p=0,03) comparado ao grupo sem endometriose (17,22±5,6ng/mL e 8,71±2,51μmol/L, respectivamente; tabela 2).
DiscussãoO presente estudo comparou as concentrações de oito marcadores de EO (FOX1, GSH Vit E, SOD, CAT, MDA, AOPP e 8OHdG) no soro do dia da captação oocitária e no FF de mulheres inférteis com e sem endometriose (infertilidade de causa tubária e/ou masculina) submetidas à EOC para ICSI.
Podemos considerar, didaticamente, que o EO é um processo que ocorre por meio de três etapas distintas. Na primeira observa‐se o aumento da produção de espécies reativas, na segunda, há a mobilização de antioxidantes na tentativa de prevenir os danos oxidativos aos seus principais alvos e na terceira ocorre o dano oxidativo a proteínas, lipídeos, DNA, entre outros alvos.30,31 Neste estudo, a primeira etapa foi avaliada por meio da mensuração do total de FOX1, considerado um marcador de produção de espécies reativas de oxigênio (ROS).32 A segunda etapa foi analisada por meio da medida da glutationa reduzida (GSH), importante antioxidante na proteção celular ao estresse oxidativo que atua na neutralização de peróxidos,33 da Vit E, que pode tanto bloquear o início da peroxidação lipídica como inibir primariamente a sua etapa de propagação,34 da SOD, que está presente no fluido folicular pré‐ovulatório em níveis mais altos que no soro e parece conferir proteção contra o dano oxidativo oocitário,35 e da CAT, que reflete o balanço antioxidante total da amostra, resultante das defesas antioxidantes enzimáticas e não enzimáticas, o que permite uma avaliação global desse processo.24,28 A terceira etapa, por sua vez, foi avaliada por meio da análise do MDA, um dos produtos finais da peroxidação lipídica e que pode ser usado como medida cumulativa desse processo,36 dos AOPP, que permitem uma estimativa da oxidação protéica,29 e da 8OHdG, que possibilita a análise do dano oxidativo ao DNA.37
Demonstramos maiores concentrações de GSH e SOD e menores concentrações da CAT no soro de mulheres com endometriose comparadas com as mulheres sem endometriose, o que sugere a ocorrência de EO sistêmico em pacientes inférteis com a doença e corrobora estudos de Lambrinoudaki et al.,18 Bordin et al.38 e Andrade et al.,19 que associam a endometriose ao EO sistêmico ao analisar marcadores de EO distintos dos aqui avaliados. O aumento de GSH e SOD sugere haver uma mobilização do sistema antioxidante sérico na tentativa de neutralizar o prévio aumento de agentes pró‐oxidantes, sugerido neste estudo pela tendência a maiores concentrações de FOX1 circulantes, uma vez que esse marcador, quando elevado, é indicador de maior produção de espécies reativas.32 O único estudo na literatura que analisou hidroperóxidos totais no soro de portadoras de infertilidade relacionada à endometriose foi publicado pelo nosso grupo.19 Analisou esse marcador na fase folicular precoce do ciclo natural, com achados similares aos aqui apresentados com amostras séricas obtidas após EOC no dia da captação oocitária. A GSH, por ter importante papel na neutralização do peróxido de hidrogênio e dos peróxidos orgânicos, esses produzidos abundantemente em processos inflamatórios,39 pode indicar uma resposta antioxidante sistêmica frente às reações inflamatórias provocadas pelos implantes endometriais ectópicos.6 Entretanto, contrariamente aos presentes achados, Jana et al.40 encontraram menores concentrações de GSH em soro de mulheres com endometriose comparadas com controles. Da mesma forma, as maiores concentrações de SOD no soro de mulheres com endometriose evidenciadas no presente estudo contrariam os resultados de Jana et al.40 e também os de Prieto et al.,14 que observaram menores valores desse marcador no grupo com endometriose. No entanto, o trabalho de Jana et al. foi feito com amostras coletadas na fase folicular precoce do ciclo menstrual,40 diferentemente do presente estudo, em que as amostras sanguíneas foram coletadas no dia da captação oocitária, o que dificulta a comparação dos dados e pode justificar as discrepâncias encontradas, uma vez que a EOC parece promover aumento da SOD em mulheres submetidas a FIV ou IUI.41 Prieto et al.,14 por sua vez, avaliaram apenas pacientes com endometriose moderada e grave. O avanço no estadiamento da doença pode estar relacionado à ocorrência de estresse oxidativo mais pronunciado,42,43 com maior consumo de antioxidantes. As menores concentrações da CAT encontradas no presente estudo indicam consumo de outros antioxidantes presentes, culminam com diminuição da capacidade antioxidante total no compartimento sérico e corroboram os achados de Jana et al.40 e de Szczepanska et al.,5 os quais evidenciaram menores concentrações desse marcador, respectivamente, no soro e fluido peritoneal de mulheres com a doença e sugeriram, também, que o compartimento sérico esteja refletindo o status redox do microambiente peritoneal.
Com relação ao compartimento folicular, o grupo com endometriose apresentou maiores concentrações de 8OHdG e Vit E no FF comparado ao grupo sem endometriose, o que sugere ocorrência de estresse oxidativo também nesse microambiente reprodutivo de pacientes inférteis com a doença submetidas a EOC. Esta é a primeira vez em que a 8OHdG é avaliada no FF de mulheres com endometriose, esse um achado de grande importância para o entendimento da etiopatogênese da infertilidade relacionada à doença. A presença de elevadas concentrações da 8OHdG no FF de mulheres inférteis com endometriose sugere a ocorrência de dano oxidativo ao DNA nesse microambiente reprodutivo, que pode promover comprometimento da qualidade gamética, como sugerido pelos estudos que serão apresentados a seguir. Segundo Seino et al.,44 concentrações elevadas da 8OHdG nas células da granulosa de mulheres inférteis submetidas a FIV têm correlação negativa com taxa de fertilização e formação de embriões de boa qualidade. Corroborando esses achados, Tamura et al.45 demonstraram que elevadas concentrações da 8OHdG no FF de mulheres submetidas a FIV foram correlacionadas com maiores taxas de oócitos degenerados. Isso sugere que a elevação desse marcador de EO a nível folicular tenha efeito tóxico sobre a maturação oocitária. Com base na análise imuno‐histoquíimica da 8OHdG, Matsuzaki et al.46 sugerem que o córtex ovariano saudável adjacente a um endometrioma é afetado mais severamente pelo EO do que o córtex adjacente a cistos ovarianos benignos de outra origem e indicam maior dano ao DNA no ovário de mulheres com a doença. Somado a isso, um estudo recente de Polak et al.47 aponta haver maiores concentrações de 8OHdG no FP de mulheres com endometriose comparadas com pacientes com cistos serosos e dermoides e sugerem que o FP dessas pacientes pode ter efeito na infertilidade relacionada a endometriose. Estudo publicado por nosso grupo48 sugeriu comprometimento e/ou retardo na conclusão da meiose de oócitos maturados in vitro, provenientes de ciclos estimulados de mulheres inférteis com endometriose. Outro estudo feito por nosso grupo demonstrou que o fluido folicular de mulheres inférteis com endometriose leve submetidas à EOC para ICSI promove anomalias meióticas oocitárias em modelo bovino.17 Analisando conjuntamente esses achados e os do presente estudo, hipotetizamos que a presença de estresse oxidativo no compartimento folicular de mulheres inférteis com endometriose, representada pela maior concentração de 8OHdG, esteja relacionada à ocorrência de dano oxidativo e anomalias oocitárias, participa da etiopatogênese da infertilidade relacionada à doença nessas mulheres e corrobora os achados em células da granulosa e fluido peritoneal apresentados na literatura.
A maior concentração de Vit E encontrada no FF de mulheres com a doença, por sua vez, indica uma mobilização do sistema antioxidante folicular na tentativa de neutralizar espécies reativas e evitar danos oxidativos oocitários. Entretanto, essa mobilização não teria sido capaz de prevenir o dano oxidativo ao DNA, como evidenciado pela maior concentração da 8OHdG. Esse achado contraria tanto um estudo recente de Singh et al.,15 que encontrou menores concentrações de Vit E no FF de mulheres com a doença, como os estudos de Campos Petean et al.36 e Prieto et al.,14 nos quais não foi evidenciada diferença nas concentrações de Vit E entre o FF de pacientes inférteis com endometriose e controles. Todavia, os critérios de elegibilidade dos sujeitos dos referidos estudos são heterogêneos, assim como os protocolos de estimulação ovariana, o que dificulta a comparação dos resultados. Associadamente a isso, nestes estudos não foi apresentado o poder de teste das análises feitas. Com base nos presentes achados e considerando um estudo de Tamura et al.,45 no qual a administração de vitamina E (α‐tocoferol, 600mg/dia), do quinto dia do ciclo anterior ao tratamento até o dia da captação oocitária de pacientes inférteis submetidas a FIV, reduziu as concentrações intrafoliculares da 8OHdG com relação ao ciclo prévio, questionamos a importância de terapias antioxidantes adicionais, especificamente da administração de Vit E, com vistas à prevenção de danos oxidativos ao DNA em pacientes inférteis com endometriose, o que necessita de estudos pertinentes.
Como limitações do estudo podemos considerar, primeiro, a pequena casuística, em virtude dos restritivos critérios de elegibilidade adotados, que limitaram a validade externa do estudo, porém eliminaram outros fatores potencialmente relacionados ao estresse oxidativo e à pioria da qualidade oocitária, fundamentais para aumentar a validade interna do estudo. Segundo, todas as pacientes foram submetidas a bloqueio hipofisário com agonista do GnRH e EOC e persiste a dúvida se os presentes achados podem ser extrapolados para os ciclos naturais dessas mulheres; mas, por questões éticas, não seria adequado propor a feitura de FIV ou ICSI em ciclos naturais. Terceiro, não é possível esclarecer se os achados oriundos da análise do FF de um único folículo representam o conjunto de folículos que responderam à EOC.
Resumidamente, os resultados do presente estudo indicam ocorrência de estresse oxidativo sistêmico, representado, sobretudo, pela menor CAT, e folicular, evidenciado principalmente pelas maiores concentrações de 8OHdG, marcador de dano oxidativo ao DNA em pacientes inférteis com endometriose submetidas à EOC para ICSI. Em decorrência dos restritivos critérios de elegibilidade usados no presente estudo, os achados podem ser generalizados apenas para mulheres inférteis que atendam a esses critérios. Se os presentes achados puderem ser extrapolados para os ciclos naturais dessas pacientes, acreditamos que tanto o EO sistêmico como o EO no microambiente folicular possam favorecer o comprometimento da qualidade oocitária e participar da etiopatogênese da infertilidade em mulheres com endometriose. Esses achados abrem perspectivas para o delineamento de estudos clínicos randomizados com poder de teste adequado que avaliem o impacto da suplementação de antioxidantes (como a vitamina E) na melhoria da fertilidade natural de mulheres inférteis com endometriose. Considerando que mesmo em países desenvolvidos o acesso às ART é limitado, intervenções que melhorem a fertilidade natural são de extrema relevância populacional.
FinanciamentoEste estudo recebeu suporte financeiro do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) (474858/2009‐0; 309056/2009‐8; 503867/2010‐1) e da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) (2008/58197‐6).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Os autores agradecem aos funcionários, biologistas e médicos do Laboratório de Reprodução Humana, Departamento de Ginecologia e Obstetrícia, Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo (FMRP‐USP), especialmente Maria Cristina Picinato e Roberta Cristina Giorgenon pela coleta do FF, ao Laboratório de Nutrição e Metabolismo, FMRP‐USP, especialmente a Paula Payão e Virginia Lipoli pelo suporte técnico, e a Jhenifer Kliemchen Rodrigues pela coleta de parte das amostras de FF e por auxiliar na quantificação de alguns marcadores.
Estudo conduzido na Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo (USP), Ribeirão Preto, SP, Brasil.