Avaliar a adesão das pacientes com doença trofoblástica gestacional (DTG) ao seguimento ambulatorial pós‐molar em um centro de referência na região Centro‐Oeste do Brasil.
MétodosEstudo observacional, retrospectivo, que incluiu todas as pacientes diagnosticadas com DTG na Maternidade‐Escola da Universidade Federal de Goiás em um ano. Foram colhidos dados referentes a idade, paridade e valores de B‐hCG. A adesão ao seguimento ambulatorial e o exame histopatológico do produto do esvaziamento uterino foram obtidos pela revisão de prontuários.
ResultadosEntre as 55 pacientes incluídas no estudo, apenas 27 (49%) prosseguiram com o tratamento de forma completa; das quais 11 (40,7%) tiveram indicação de quimioterapia segundo o protocolo do Serviço.
ConclusãoA taxa de adesão ao seguimento ambulatorial foi baixa. O alto índice de pacientes com necessidade de quimioterapia determina um cenário alarmante sobre o prognóstico das pacientes que não concluíram o seguimento pós‐molar. Esse estudo aponta a necessidade de estratégias efetivas para o manejo e o controle da doença.
To evaluate the adherence to outpatient follow‐up among patients with gestational trophoblastic disease (GTD) in a reference center in the Midwest region of Brazil.
MethodsThis was an observational, retrospective study that included all patients diagnosed with GTD in the Maternity School of the Universidade Federal de Goiás in one year. Data were collected regarding age, parity and B‐hCG values. Adherence to follow‐up and histopathological examination of the uterine evacuation product were obtained by chart review.
ResultsAmong the 55 patients included in the study, only 27 (49%) continued with the treatment properly; of which 11 (40.7%) had chemotherapy indication by the protocol service.
ConclusionThe adherence rate to outpatient follow‐up was low. The high rate of patients in need of chemotherapy determines an alarming scenario on the prognosis of patients who did not complete the follow‐up. This study highlights the need for effective strategies for the management and control of the disease.
A doença trofoblástica gestacional (DTG) constitui um grupo de tumores relacionados à gestação que apresentam a proliferação anormal do epitélio trofoblástico como característica comum.1 O processo etiológico dessa patologia permanece desconhecido, mas acredita‐se que a origem da DTG seja por gametogênese e fertilização anormais, além da transformação maligna do tecido trofoblástico.2
O conhecimento da história natural da DTG é fundamental para o manejo adequado das pacientes e encontra‐se em fase de consolidação. Entre os fenótipos identificados, destaca‐se a mola hidatiforme completa (MHC), a mola hidatiforme parcial (MHP), a mola invasora, o coriocarcinoma e o tumor trofoblástico de sítio placentário, os quais apresentam diferentes características clínicas, morfológicas e citogenéticas.1,3
O Centro de Referência (CR) para o atendimento das portadoras de DTG em Goiânia, implantado em 1970, foi o terceiro serviço especializado criado no Brasil. Inicialmente foi localizado no Hospital Geral de Goiânia até 1991; posteriormente, no Hospital Materno‐Infantil até 2004. Atualmente encontra‐se na Maternidade‐Escola do Hospital das Clínicas da Universidade Federal de Goiás (HC/UFG) e tem acesso facilitado de acordo com o Sistema Único de Saúde (SUS).
Considerando o potencial de malignidade a partir de gestações molares, o tratamento dessas pacientes exige um seguimento ambulatorial rigoroso após o esvaziamento uterino. O objetivo deste trabalho é avaliar a adesão das pacientes com DTG ao seguimento ambulatorial pós‐molar no CR de Goiânia, Goiás.
MétodosEstudo observacional, descritivo, retrospectivo, de abordagem quantitativa. As variáveis foram inicialmente coletadas no Caderno de Internações da Maternidade do HC/UFG, um banco de dados específico composto por todas as internações feitas no Serviço, entre agosto de 2012 e julho de 2013. Os dados ausentes no Caderno de Internações foram complementados com revisão direta dos prontuários médicos e sistema informatizado de laudos do Serviço.
Usou‐se o caderno de atendimentos do CR de Goiânia, Goiás, para determinação da adesão ao seguimento pós‐molar das pacientes previamente atendidas na Maternidade, com avaliação quantitativa dos valores de β‐hCG durante o acompanhamento clínico.
Dentre as pacientes que compareceram ao ambulatório, investigou‐se ainda o tempo (em semanas) para a negativação do β‐hCG, a necessidade de quimioterapia e o número de internações necessárias para o tratamento dessa enfermidade. Entre as variáveis referentes ao perfil socioeconômico, foi avaliada a idade ao diagnóstico (em anos) e a paridade. O diagnóstico histopatológico do produto do esvaziamento uterino e a adesão ao seguimento ambulatorial também foram obtidos pela revisão de prontuários. Também foi avaliado o estadiamento anatômico e o score prognóstico da doença, conforme a padronização da Federação Internacional de Ginecologia e Obstetrícia (FIGO).4–6
As informações foram anotadas em fichas apropriadas e transcritas para um banco de dados específico, criado com auxílio do software Windows Excel, versão 2007, por meio de dupla digitação. Foram feitas análises de frequências para as variáveis de interesse.
Por se tratar de um estudo observacional e retrospectivo, sem qualquer interferência no diagnóstico ou no tratamento da doença, não houve aplicação de Termo de Consentimento Livre e Esclarecido aos sujeitos de pesquisa. O estudo atual faz parte de uma linha de pesquisa desenvolvida na Maternidade do HC/UFG, com aprovação pelo Comitê de Ética em Pesquisa do Serviço (parecer n° 1.203.541).
ResultadosAs 65 pacientes foram responsáveis por 72 internações hospitalares (cinco pacientes necessitaram de duas internações e uma paciente necessitou de quatro).
O acesso ao exame histopatológico do produto do esvaziamento uterino não foi possível em cinco casos; três por prontuários incompletos e dois por se tratar de pacientes oriundas de outro Serviço já encaminhadas ao CR com diagnóstico de NTG. Dentre as 60 mulheres com exame histopatológico disponível, o diagnóstico de MC foi encontrado em 34 casos; MP em três casos; diagnóstico inconclusivo não excludente de MH em 13 casos; e restos ovulares ou alterações do tipo endométrio secretor em 10 casos.
Após a exclusão dos casos relacionados a endométrio normal ou restos ovulares, 55 pacientes permaneceram no estudo, com indicação de seguimento clínico ambulatorial. Todas se encontravam no estádio I da doença e na categoria de baixo risco de acordo com o escore prognóstico da Organização Mundial de Saúde (OMS) modificado pela Figo.4–6
A idade das pacientes variou entre 12 e 49 anos, 18 delas (32,7%) foram consideradas adolescentes pela definição da OMS (entre 10 e 19 anos) e oito (14,5%) com mais de 35 anos. Quanto à paridade, 16 (29%) eram primíparas e apenas uma (1,8%) apresentava histórico prévio de DTG.
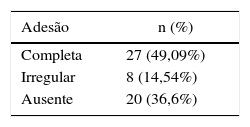
A avaliação do comparecimento ao ambulatório para o seguimento adequado mostrou que 20 pacientes (36,6%) não compareceram a qualquer consulta, compuseram o grupo de adesão ausente. Oito pacientes (14,5%) compareceram ao ambulatório, mas abandonaram o tratamento antes de ter recebido alta, configuraram o grupo da adesão irregular. Por fim, 27 (49,1%) completaram o tratamento de forma adequada (alta) (tabela 1).
Entre as 27 pacientes com adesão completa, 11 necessitaram de pelo menos um ciclo de quimioterapia (monoquimioterapia compatível com o estádio I, baixo risco: metotrexate 1,0mg/kg, via intramuscular [IM], nos dias 1, 3, 5 e 7; e ácido folínico 0,1mg/kg, via IM, nos dias 2, 4, 6 e 8). O número de ciclos necessários para cada paciente variou de um a nove (média de 2,81 ciclos por paciente). Entre as mulheres que completaram o tratamento, o tempo de negativação do β‐hCG sérico variou de seis a 56 semanas, com média de 15,6 semanas.
Durante o período avaliado, não houve caso com desfecho ao óbito. Dois casos evoluíram para histerectomia por suspeita de tumor de sítio placentário, em pacientes de 47 e 49 anos, respectivamente. O estudo anatomopatológico dos respectivos úteros evidenciou a presença de mola invasora e ambas as pacientes evoluíram com títulos decrescentes de β‐hCG sérico.
DiscussãoA capacitação médica constante e o domínio de novas tecnologias aplicadas à ultrassonografia, como o Doppler e a ultrassonografia volumétrica (3D/4D), tem aumentado a acurácia do método no diagnóstico precoce das gestações molares.7–9 No entanto, nas etapas iniciais da gestação molar, as imagens podem se assemelhar àquelas da gestação anembrionada e do abortamento retido; principalmente nos casos de MHP. Essa característica possivelmente justifica os dez casos suspeitos de MH cuja avaliação histopatológica revelou restos ovulares ou alterações endometriais sem atipias.
Em relação ao diagnóstico laboratorial, destaca‐se a dosagem do HCG. Trata‐se de um hormônio produzido pelo trofoblasto, cuja subunidade β é um marcador biológico altamente específico da atividade trofoblástica.1,10 Assim, a dosagem seriada do β‐HCG representa o método padrão‐ouro no seguimento clínico após o esvaziamento uterino.10 Na ocorrência de critérios bem estabelecidos, como níveis ascendentes ou níveis em platô (definido como um aumento ou redução inferior a 10% em três dosagens semanais consecutivas), considera‐se o diagnóstico de mola persistente e a discussão de tratamento quimioterápico conforme protocolos específicos.1,9,10
A avaliação do tempo de remissão do β‐HCG contribui para a identificação de fatores associados a pior prognóstico e desfechos clínicos desfavoráveis. Nesse sentido, Maestá et al. (2013) avaliaram 328 mulheres portadoras de NTG, com média de 46 dias para a remissão do β‐HCG. A presença de MHC, a presença de doença metastática, a necessidade de poliquimioterapia e os valores elevados no score da FIGO se mostraram fatores independentes em relação ao tempo de remissão do β‐HCG.11 No estudo atual, o tempo para a remissão do β‐HCG foi superior em relação ao levantamento prévio feito no mesmo Serviço, com média de 15,6 semanas no estudo atual e de oito semanas no levantamento anterior.12 Essa evolução temporal desfavorável será avaliada em um novo estudo, assim como os fatores clínicos associados a remissão do β‐HCG no CR de Goiânia e outras variáveis de interesse.
Do ponto de visto clínico, a DTG pode evoluir com complicações importantes, como pré‐eclâmpsia, crise tireotóxica, insuficiência respiratória e choque hemorrágico.7,13–15 Em um estudo recente (2014), foi avaliada uma coorte de 5.250 mulheres com DTG, das quais 1.144 (21,8%) foram diagnosticadas com NTG. Nessa população, 26 (2,3%) mulheres evoluíram ao óbito, com associação significativa entre a taxa de mortalidade e o score prognóstico da OMS.14 No estudo atual, não houve desfecho ao óbito na população analisada; possivelmente em decorrência do tempo de seguimento breve. Atualmente, encontra‐se em andamento um estudo colaborativo para avaliação da mortalidade materna em pacientes com DTG atendidas entre 2000 e 2013, em 12 CRs brasileiros.
O número de pacientes que necessitou de tratamento quimioterápico representa 20% da população analisada no estudo atual (11/55), o que está de acordo com outros estudos semelhantes.14,16,17 Entretanto, o rastreio de mola invasora foi efetivo apenas nas mulheres com adesão ao tratamento. Isso sugere que a taxa real de necessidade quimioterápica seja superior aos valores encontrados. Dessa forma, 40,7% das pacientes acompanhadas de forma adequada (11/27) necessitaram de quimioterapia, dados superiores aos encontrados na literatura.12,14,16,17
A taxa elevada de tratamento quimioterápico encontrada no estudo atual pode ser justificada pela característica da amostra, referente a um CR com admissão de casos com doença avançada e de maior complexidade. Em um levantamento prévio do CR de Goiânia, a quimioterapia havia sido prescrita em 11% das pacientes,12 o que revela a possibilidade de uma mudança no perfil de pacientes atendidas pelo respectivo CR.
Entre os diversos fatores associados à baixa adesão ao tratamento ambulatorial da DTG, destaca‐se a limitação socioeconômica, o desconhecimento acerca da patologia e o tempo prolongado de seguimento.14 Em estudo prévio feito em dez CRs brasileiros, 77,6% (52,6‐88%) das pacientes completaram o seguimento de forma adequada. Destaca‐se que a abordagem multidisciplinar, coordenada por um especialista com conhecimento geral de todas as intercorrências e características do tratamento da DTG, melhora a qualidade de vida da paciente e de sua família,18 o que justifica os esforços no sentido de priorizar o atendimento integral e multiprofissional dessas mulheres.
Em relação ao CR de Goiânia, apenas 49,1% das mulheres atendidas no período analisado completaram o seguimento ambulatorial de forma adequada. Essas informações geram questionamentos sobre o real conhecimento dessas mulheres acerca do agendamento das consultas, da importância do seguimento clínico e do potencial de morbimortalidade da patologia.
O alto índice de pacientes tratadas com quimioterapia no grupo de adesão total determina um cenário alarmante sobre o prognóstico das pacientes que não concluíram o seguimento pós‐molar e reforça a importância da busca ativa das pacientes que abandonam o tratamento. Após a verificação das informações levantadas pelo estudo atual, foram realizadas capacitações específicas aos profissionais da Maternidade‐Escola do HC/UFG; e criada uma ficha de atendimento própria, que irá facilitar o seguimento clínico e a busca ativa das pacientes que vierem a abandonar o tratamento.
ConclusãoAs pacientes portadoras de DTG diagnosticadas na Maternidade‐Escola da UFG apresentaram baixo índice de adesão ao seguimento ambulatorial, expuseram uma fragilidade no processo de acompanhamento das pacientes portadoras de DTG em Goiânia, Goiás.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Estudo realizado no Hospital das Clínicas, Universidade Federal de Goiás (UFG), Goiânia, GO, Brasil.