Verificar se há correlação entre os resultados obtidos via diagnóstico genético pré-implantacional (PGD) e os dados obtidos via monitoramento em tempo real (time-lapse) durante os três dias de desenvolvimento embrionário.
MétodoEstudo retrospectivo no qual foram avaliados embriões de ciclos de injeção intracitoplasmática de espermatozóides (ICSI) de março a junho de 2012. Após a ICSI, os embriões foram colocados em incubadora vertical com monitoramento time-lapse durante três dias. A seguir os embriões foram submetidos ao PGD. Os resultados obtidos foram baseados na análise do tempo de aparecimento e desaparecimento dos dois pró-núcleos, de início da primeira e da segunda clivagem e de intervalo entre esses eventos, além da observação dos corpúsculos polares.
ResultadosDados mostraram que 84,6% dos embriões apresentaram um padrão de ciclo celular assincrônico e a inviabilidade comprovada com os resultados do PGD, 7,7% dos embriões considerados normais nos resultados do PGD mostraram ter ciclos celulares fora dos padrões e 7,7% dos embriões com ciclo celular normal apresentaram ao PGD anomalias múltiplas. As diferenças foram estatisticamente significantes para p<0,05. Embriões com PGD normal podem apresentar um ciclo celular assincrônico, o que afeta sua implantação.
ConclusõesO estudo preliminar mostra que os dados obtidos com a metodologia time-lapse, em primeiro momento, podem ser usados para avaliar a qualidade embrionária em conjunto com a avaliação morfológica deles, independentemente dos resultados do PGD, pois alterações no padrão de desenvolvimento celular embrionário parecem afetar a implantação, salvo algumas exceções. Porém, como o N amostral ainda é pequeno, necessita-se de um período maior para a certificação dos eventos observados.
Investigate whether there is correlation between results obtained with PGD and data obtained monitoring “time lapse” during 3 days of embryonic development.
MethodThis is a retrospective study in which we assessed embryos ICSI cycles from March to December 2012. Upon completion ICSI, embryos were placed in an incubator with vertical monitoring “time lapse” for 3 days, then embryos were subjected to PGD. The results were based on analysis of the time of appearance of two pronuclei, disappearance, the start time of first and second cleavage and intervals between these events, and the observation of polar bodies.
ResultsData show that 84.6% of the embryos exhibited a pattern of cell cycle asynchronous and viability confirmed by the results of PGD, and 7.7% of embryos considered normal results of PGD, proved to have cell cycle asynchronous, 7.7% of embryos with normal cell cycle PGD showed multiple anomalies, differences were statistically significant at p<0.05. PGD embryos with normal can present asynchronous cell cycle, affecting its implantation.
ConclusionThe preliminary study shows that data obtained with method “time-lapse”, can be used to evaluate the embryo quality together with morphological evaluation same regardless outcome of PGD, because changes in pattern development of embryonic cell seem to affect development, with some exceptions. However, such as sample size remains small needs to be a longer period for certification of observed events.
O desenvolvimento de novas tecnologias no campo da reprodução humana permite observações de diversos eventos morfológicos durante o desenvolvimento embrionário.1 A influência das características morfológicas oocitárias nas taxas de fertilização, gravidez e implantação, assim como na qualidade embrionária, ainda é bastante controversa.2 O uso de microscopia óptica para avaliação dos embriões é um subsídio muito importante para o embriologista. Nos centros de reprodução humana o seu uso ocorre no momento da escolha do oócito para a injeção intracitoplasmática de espermatozoides (ICSI), bem como na escolha do pré-embrião para a transferência. Esses processos visam à melhoria nas taxas de gravidez.3
No entanto, o cultivo de embriões da maneira convencional, com intermitentes observações, pode causar perturbações no microambiente de cultura e levar ao estresse embrionário. A observação time-lapse usada em incubadoras com microscópios ópticos pode minimizar as alterações no ambiente de cultura e permitir o arquivamento em tempo real das imagens do desenvolvimento embrionário. Essa tecnologia é um avanço para melhor entendimento dos processos de fertilização, desenvolvimento e sobrevivência dos pré-embriões humanos.4
Muitos parâmetros de avaliação são usados e complementam-se, os pré-embriões podem ser avaliados de acordo com a classificação dos pró-núcleos, blastômeros, da morfologia, da sincronia, do número de blastômeros e do grau de fragmentação. A seleção do melhor embrião para transferência pode ser baseada ainda em um critério adicional de classificação que usa o diagnóstico genético pré-implantacional (PGD) como ferramenta para detecção de alterações genéticas e mutações.5
Porém, o desenvolvimento embrionário apresenta alta frequência de mosaicismo. Assim, essa seria uma limitação técnica para todos os métodos baseados na biópsia de blastômeros.6 Outro ponto que limita os resultados do PGD deve-se ao tempo de análise relativamente curto, ao limitado número de células analisadas e, ainda, às dificuldades, que podem se estender à amplificação das sequências de DNA e contaminações com DNA externo. Isso pode resultar em laudos “falsos” positivos e negativos, gerar riscos de transferir embriões comprometidos ou, ainda, deixar de transferir embriões sadios.7
Sendo assim, a escolha do embrião para a transferência não deve ser baseada somente na análise morfológica, no número de células ou mesmo nos resultados do PGD.8 Devem-se usar ferramentas que se complementem. Portanto, um aumento nas taxas de gravidez pode ser auxiliado se aliarmos a nova ferramenta de avaliação dos parâmetros de morfologia em tempo real, no qual podemos observar o exato tempo das divisões mitóticas, a sincronia das clivagens e a morfologia de maneira geral do embrião sem interferir no microambiente de cultivo, em complementação com os resultados obtidos dos embriões submetidos ao PGD.
MétodoEstudo retrospectivo no qual foram avaliados 207 pré-embriões de ciclos de injeção intracitoplasmática de espermatozoides (ICSI) de março de 2011 a dezembro de 2012. As pacientes tinham entre 20 e 38 anos, não tinham histórico de contato com radiação, substâncias químicas teratogênicas e/ou cancerígenas, drogas, apresentavam cariótipo normal, negativas para síndrome do X frágil e sem doenças sexualmente transmissíveis. Ainda, as pacientes selecionadas apresentavam um ciclo menstrual de 25 a 34 dias, Índice de Massa Corpórea (IMC) normal (18 a 28 Kg/m2), sem tratamento endocrinológico recente (como uso de gonadotropinas e contracepção oral) durante os três meses que precederam o início do estudo e ultrassonografia com laudo normal.
O padrão de exclusão usado foi: patologias como endometriose, hidrosalpinge, obesidade (IMC>30), patologias uterinas (miomas, adenomioses, endocrinopatias, trombofilias, anormalidades uterinas adquiridas ou congênitas), abortos recorrentes ou idade materna acima de 40 anos.
A estimulação ovariana controlada foi feita com o protocolo de ciclo curto e administração de 225 UI de recombinante do hormônio folículo estimulante (rFSH). Durante os dias 6 ao 10, iniciou-se a administração do antagonista do hormônio liberador de gonadotropina (GnRH) antagonista. Os níveis de hormônios de progesterona e estradiol nos dias 7 a 10 de estimulação foram dosados. No 10° dia foram administradas 250 mcg de recombinante de alfa gonadotrofina (rhCG). A aspiração dos oócitos ocorreu 34 horas após a administração do rhCG.
As pacientes foram submetidas à aspiração sob sedação, após 34 horas da administração da recombinante de alfa gonadotrofina (rhCG). A seguir o complexo oócito-cúmulus foi identificado ao microscópio e dissecado e o preparo seguiu os protocolos já estabelecidos na clínica. O sêmen coletado foi preparado em gradiente descontínuo. Após o preparo, o material foi usado para ICSI ou fertilização in vitro (FIV) convencional. As incubadoras usadas no estudo eram monitoradas diariamente para garantir condições adequadas de cultivo, tais como temperatura (37°C), pH (variação de 7,0 a 7,4), concentração de CO2 (7%) e umidade adequada.
Durante o estudo, 207 pré-embriões foram submetidos ao monitoramento automático em tempo real (Primo Vision, Cryo-Innovation Ltd., Hungria, uma foto a cada 25 minutos), sob condições-padrão de cultivo. Imagens sequenciais foram arquivadas e então classificadas de acordo com os seguintes critérios: a) tempo de surgimento dos dois pró-núcleos (8-18 horas); b) desaparecimento deles (20-22 horas); c) tempo do início da primeira clivagem (20-26 horas); d) tempo da segunda clivagem (30-38 horas) e e) intervalos de tempos entre a ocorrência da primeira e da segunda clivagem. Período até 12 horas considerou-se como embriões bons, além da observação dos corpúsculos polares.
O diagnóstico genético pré-implantacional (PGD) foi feito após três dias de desenvolvimento embrionário. Após a obtenção das células para análise, usou-se um dos seguintes tipos de PGD: a hibridação genômica comparada com o uso de microchips de DNA, designada por array CGH (a-CGH), e a fluorescence in situ hybridization (Fish), que é uma tecnologia de citogenética molecular usada na detecção de anomalias cromossômicas familiares.9,10
ResultadosOs resultados obtidos em nossos estudos foram considerados estatisticamente significantes para p<0,05 após aplicação da análise de Kruskal Wallis e pós-teste de Student. Os resultados mostrados são provenientes de 207 embriões analisados. Nos embriões avaliados no estudo 1,2% apresentou uma clivagem anormal, na qual se originavam três blastômeros a partir de uma única célula. Esses embriões continuaram o desenvolvimento normal até o terceiro dia.
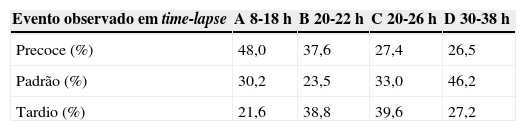
A tabela 1 mostra os tempos de clivagem dos embriões. Assim, o tempo padrão de aparecimento do pró-núcleo masculino e feminino ocorreu em 30,2% dos casos entre 13±5 horas, o tempo padrão de desaparecimento dos pró-núcleos ocorreu em 23,5% dos casos às 21±1 hora, ocorreu a primeira clivagem no tempo padrão em 33% dos casos às 23±3 horas e a segunda clivagem padrão ocorreu em 26,7% dos casos às 34±4 horas. Durante os estudos, 18% dos embriões pararam. O intervalo entre os eventos foi minuciosamente avaliado e observou-se que tempos de duração dos eventos demasiadamente longos ou curtos poderiam predizer resultados de PGD ruins.
Percentual de eventos registrados durante o monitoramento time-lapse
| Evento observado em time-lapse | A 8-18h | B 20-22h | C 20-26h | D 30-38h |
|---|---|---|---|---|
| Precoce (%) | 48,0 | 37,6 | 27,4 | 26,5 |
| Padrão (%) | 30,2 | 23,5 | 33,0 | 46,2 |
| Tardio (%) | 21,6 | 38,8 | 39,6 | 27,2 |
A, aparecimento dos pró-núcleos; B, desaparecimento do pró-núcleo; C, primeira divisão celular; D, segunda divisão celular.
A tabela 2 mostra a porcentagem de embriões em relação a sua morfologia anormal, na qual 4,8% dos embriões avaliados se enquadravam e 26,5% dos embriões apresentavam morfologia com grau de fragmentação I e II. E em relação aos embriões que estavam no dia 3 de desenvolvimento, esses representavam 36,4%.
O pool de embriões avaliados resultou em 11% de resultados com β-HCG positivo. Dentre esses embriões encontramos os seguintes números mostrados na tabela 3: 100% dos casos mostraram ter o aparecimento dos pró-núcleos masculinos e femininos em tempo padrão. Em relação ao desaparecimento desses pró-núcleos, 75% apresentaram tempo padrão e 25% tardio. A primeira clivagem ocorreu em 50% desses embriões em tempo padrão e 50% tardio e a segunda clivagem ocorreu 100% em tempo padrão.
Taxas dos embriões que evoluíram para B positivo em relação aos critérios A, B, C e D de avaliação
| Evento monitorado | A (8-18h) | B (20-22h) | C (20-26h) | D (30-38h) |
|---|---|---|---|---|
| Porcentagem de embriões | 100% padrão | 75% padrão25% tardio | 50% padrão50% tardio | 100% padrão |
A, aparecimento dos pró-núcleos; B, desaparecimento do pró-núcleo; C, primeira divisão celular; D, segunda divisão celular; h=horas.
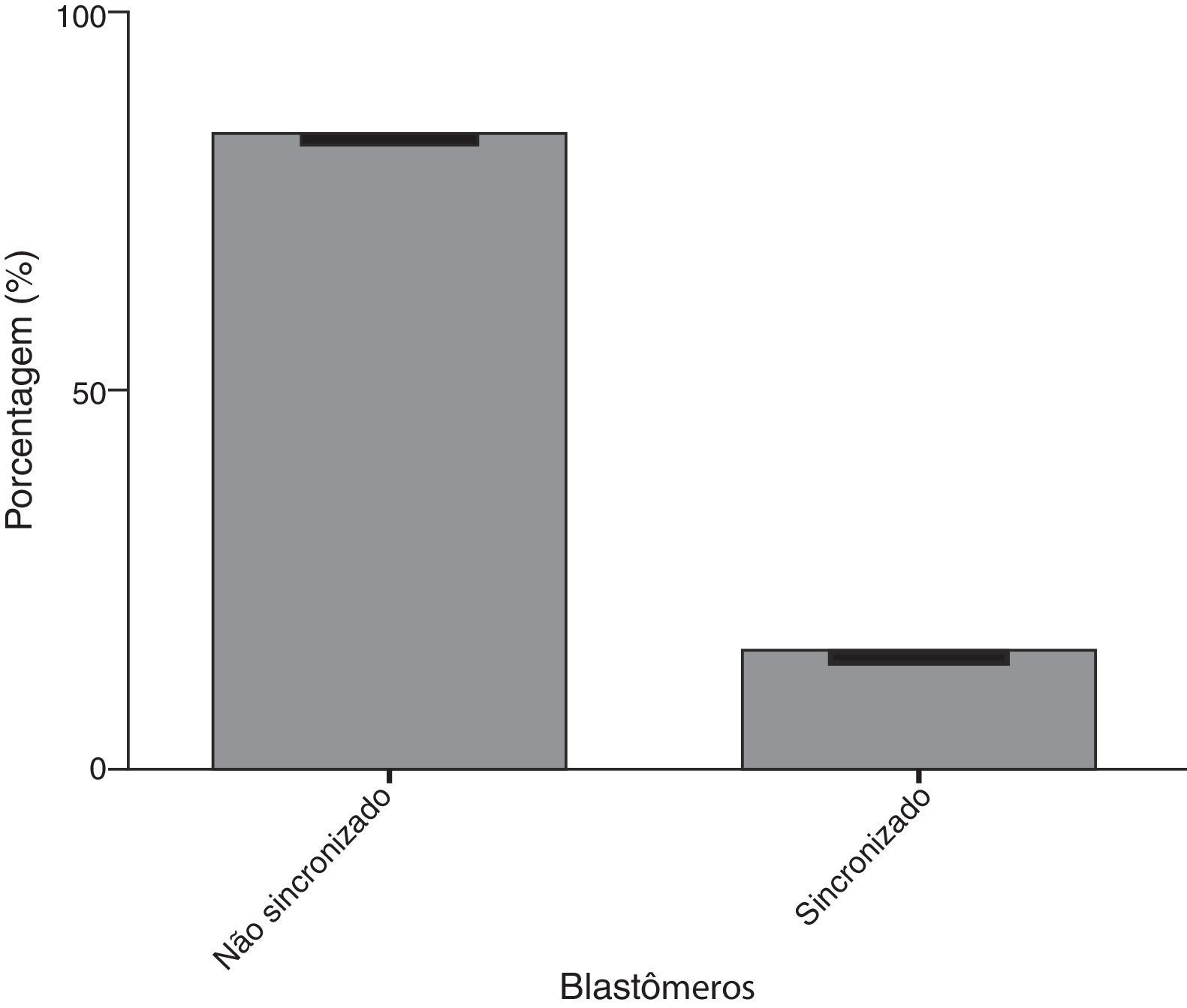
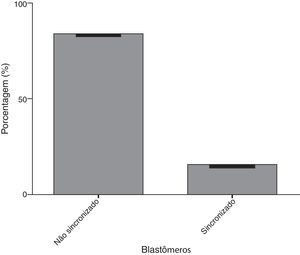
Em relação ao estudo comparativo das duas ferramentas de análise morfológica do embrião por meio do time-lapse versus diagnóstico genético pré-implantacional (PGD), obtivemos o seguinte: na figura 1 mostramos que dos embriões avaliados, 84,6% não apresentavam uma sincronização-padrão nos quatro quesitos analisados (aparecimento dos pró-núcleos, desaparecimento dos pró-núcleos, primeira divisão celular e segunda divisão celular) e apenas 15,4% apresentavam tempos com sincronização-padrão.
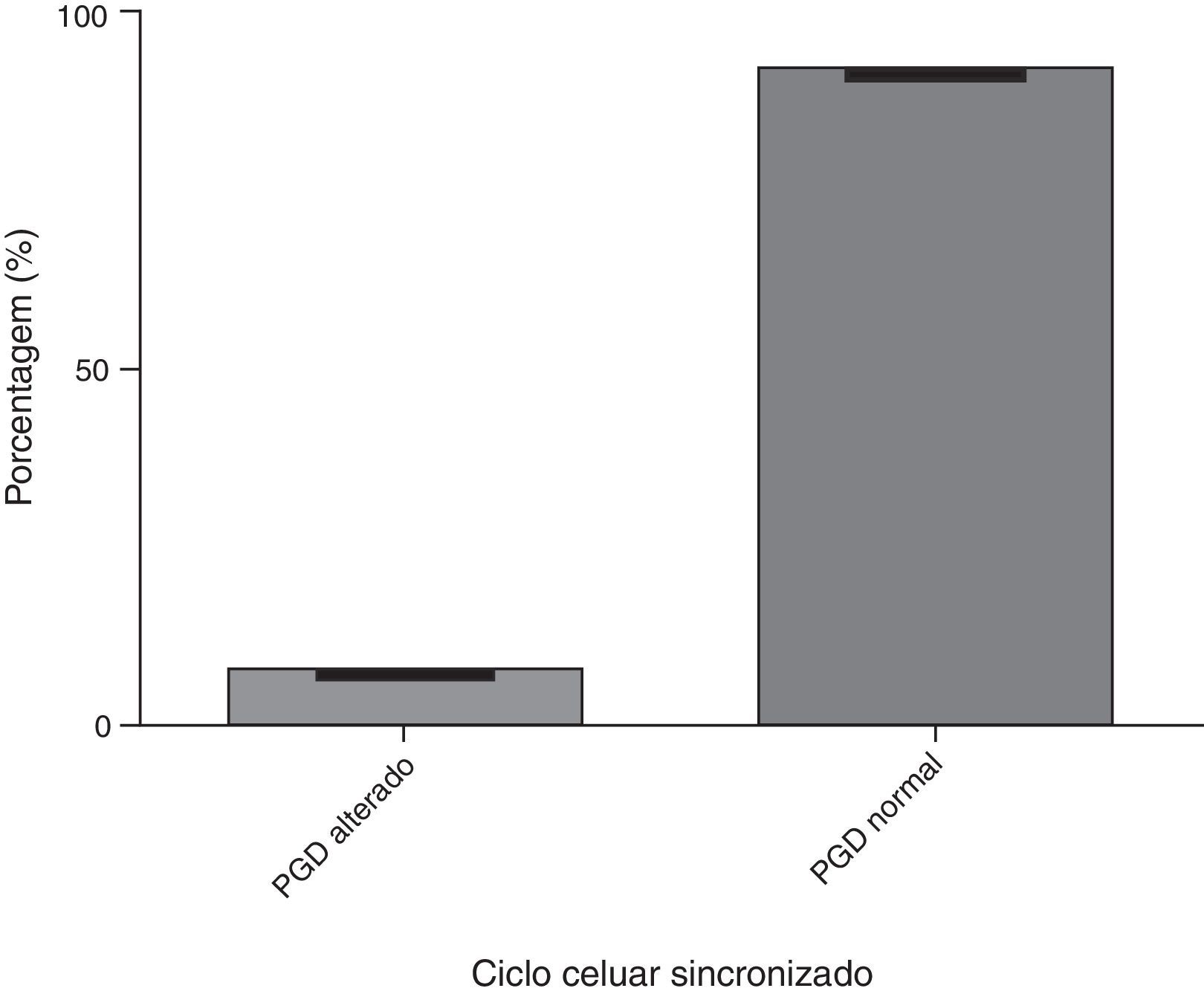
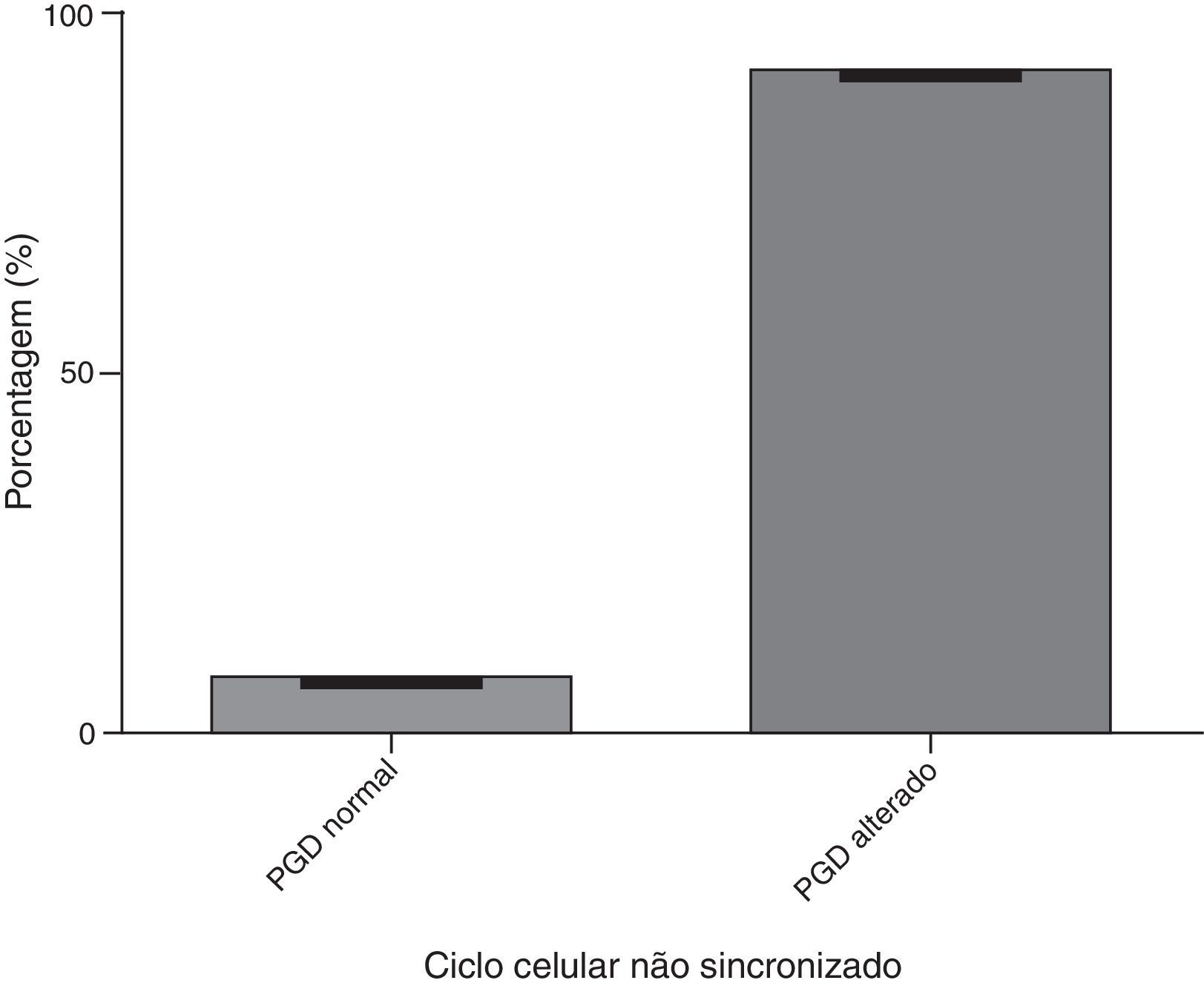
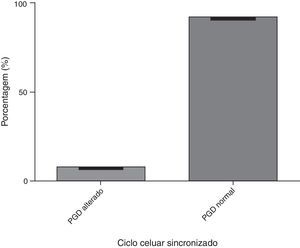
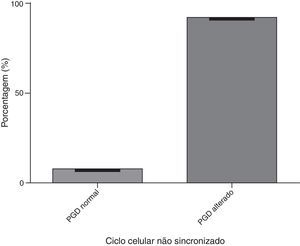
A figura 2 mostra a análise do ciclo dos embriões sincronizados. Em relação aos resultados do PGD, 92,3% apresentaram um resultado normal e 7,7% apresentaram um PGD alterado. A figura 3 mostra a análise dos embriões com ciclo celular não sincronizado, com 7,7% desses embriões com PGD normal e 92,3% com PGD alterado.
O monitoramento em tempo real permite ao embriologista retirar um maior número de informações em comparação com o monitoramento convencional. O estudo mostrou que embriões com ciclo normal podem apresentar um diagnóstico genético pré-implantacional (PGD) alterado, porém esse resultado pode muitas vezes não condizer com a verdadeira genética do embrião. Essa dúvida pode ocorrer porque durante a PGD podem ocorrer erros, seja durante a coleta do material ou durante a análise dele. Um exemplo já descrito pode ser a presença de esperma na zona pelúcida, primeiro erro de diagnóstico publicado após a execução da primeira série de PGD, que resultou na informação do sexo errado, pois durante a análise foram amplificadas células que continham o cromossomo Y.11
O estudo mostrou que embriões com PGD normal podem apresentar um ciclo celular assincrônico, o que poderia contribuir para a falha na implantação. Portanto, a análise dos dados obtidos a partir das imagens em tempo real mostrou que o embrião deve ser avaliado em conjunto com os resultados do PGD, pois muitos embriões com PGD normal apresentaram um ciclo celular não padronizado. Por outro lado, observou-se também que podem ocorrer resultados de β-HCG positivo em pacientes que tiveram a implantação de embriões com ciclo celular não sincronizado. Isso ressalta a importância do uso em conjunto das duas ferramentas de análise do embrião.
Assim, a tecnologia em time-lapse promove um desenvolvimento adequado na cultura de embriões, uma vez que permite a observação dos eventos mitóticos de forma detalhada sem a abertura constante da incubadora. O PGD também é uma importante ferramenta, principalmente para os casais com histórico de problemas genéticos familiares. Portanto, essas tecnologias devem ser usadas como ferramentas complementares, pois, apesar de serem tecnologias de última geração, ainda têm suas limitações quanto à porcentagem de resultados totalmente confiáveis da análise do embrião.
Conflitos de interesseOs autores declaram que não haver conflitos de interesse.