La esclerosis múltiple es una enfermedad neurodegenerativa común en poblaciones jóvenes en edad reproductiva; el embarazo ha sido motivo de controversia, dada la necesidad de manejo farmacológico, el riesgo de recaídas y la discapacidad resultante. Los estudios son escasos, aunque la mayoría aporta datos confiables.
ObjetivosOfrecer al médico una adecuada orientación preconcepcional y durante el embarazo en pacientes con esta enfermedad, así como una adecuada información acerca del uso de medicamentos y sus efectos a corto y largo plazo, tanto en la madre como en el feto.
Materiales y métodosPara la revisión de la literatura se estructuró una estrategia de búsqueda utilizando los términos embarazo, esclerosis múltiple, tratamientos inmunomoduladores y efectos teratogénicos (MeSH y no MeSH), los cuales se articularon con operadores booleanos en las siguientes bases de datos: Pubmed, Ebscohost y Embase, filtrando los resultados por artículos de revisión.
DiscusiónSe analizan el efecto protector del embarazo en esclerosis múltiple y la administración de vitamina D.
ConclusiónAunque no hay evidencia suficiente sobre el efecto nocivo del tratamiento en el recién nacido, se recomienda suspenderlo.
Multiple sclerosis is a neurodegenerative disease commonly affecting young adults of fertile age. Pregnancy has been a subject of controversy given that pharmacological management is required, there is a risk of relapses, and it may be disabling. Studies on the topic are scarce, although most of them report reliable data.
ObjectiveTo provide the physician with adequate preconception and pregnancy care guidelines for this disease, as well as, adequate information about medications and their effects in the short and long-term, for the mother and the foetus.
Materials and methodsA search strategy was created for reviewing the literature, using the terms, pregnancy, multiple sclerosis, immunomodulatory therapies and teratogenic effects (MeSH and not MeSH), which were articulated with Boolean operators in the following databases: Pubmed, Ebscohost and Embase, filtering the results by review article.
DiscussionThe protective effects of pregnancy on multiple sclerosis were evaluated, as well as, vitamin D administration.
ConclusionAlthough there is not enough evidence on the harmful effects of treatment on the newborn, discontinuing the treatment is recommended.
El embarazo es un estado común en la población de pacientes con esclerosis múltiple (EM) ya que la edad de inicio de esta enfermedad coindice con su etapa fértil, por esto ha sido un tema de controversia todo lo relacionado con el embarazo: durante largo tiempo se creía que el embarazo empeoraría el curso clínico de la enfermedad1. A pesar de que no hay estudios clínicos dirigidos al uso de terapia modificadora de la enfermedad, existen en la literatura registros que proporcionan datos confiables. Uno de estos es el europeo multicéntrico prospectivo (Pregnancy in múltiple sclerosis [PRIMS]) que demostró la existencia de una disminución de las tasas de recaída durante el embarazo, en especial durante el tercer trimestre, con un aumento de las recaídas durante los 3 primeros meses después del parto, lo cual sugiere un posible efecto inmunomodulador en este período2–4. El espectro de la EM en América Latina se caracteriza por particularidades geográficas, raciales y genéticas. Los reportes epidemiológicos indican que la incidencia de EM en América Latina es más compleja de lo que se pensaba; es consistente con la distribución geográfica (latitud) observada en otras partes del mundo, Colombia es considerada una región de bajo riesgo para la EM (menos de 5/100.000 habitantes) al igual que otros países situados cerca de la línea ecuatorial como Panamá y Ecuador5. Teniendo en cuenta lo anterior, se consideró relevante realizar una revisión de la literatura acerca del comportamiento de la EM durante el embarazo, así como de las consideraciones y aplicaciones de los diferentes tratamientos en esta importante etapa de la mujer, tanto por las repercusiones en el feto como en ella misma.
En un principio, se consideró que el hecho de tener EM aumentaría la tasa de abortos espontáneos, malformaciones fetales y complicaciones durante el embarazo. Actualmente se ha demostrado que la incidencia no cambia con respecto a la población general6, incluso un estudio prospectivo de 3 años reportó que no había diferencias en la tasa de mortalidad, en las anomalías congénitas, en el bajo peso al nacer ni en partos por cesárea con respecto a la población general7.
Sin embargo, un grupo de investigación en Noruega con una población de 649 hijos de madres con EM reportó fetos pequeños para la edad gestacional, con perímetro cefálico normal, partos vaginales que terminaban en inducción o en intervención quirúrgica por características de la enfermedad dadas por la debilidad y espasticidad perineal secundaria8.
Es importante establecer un plan de tratamiento, el cual debe individualizarse en cada caso, manteniendo un equilibrio entre los riesgos de exposición a fármacos para el feto y el de recaída en la madre, además de tener en cuenta el manejo durante la lactancia materna y las opciones de tratamiento en el posparto1.
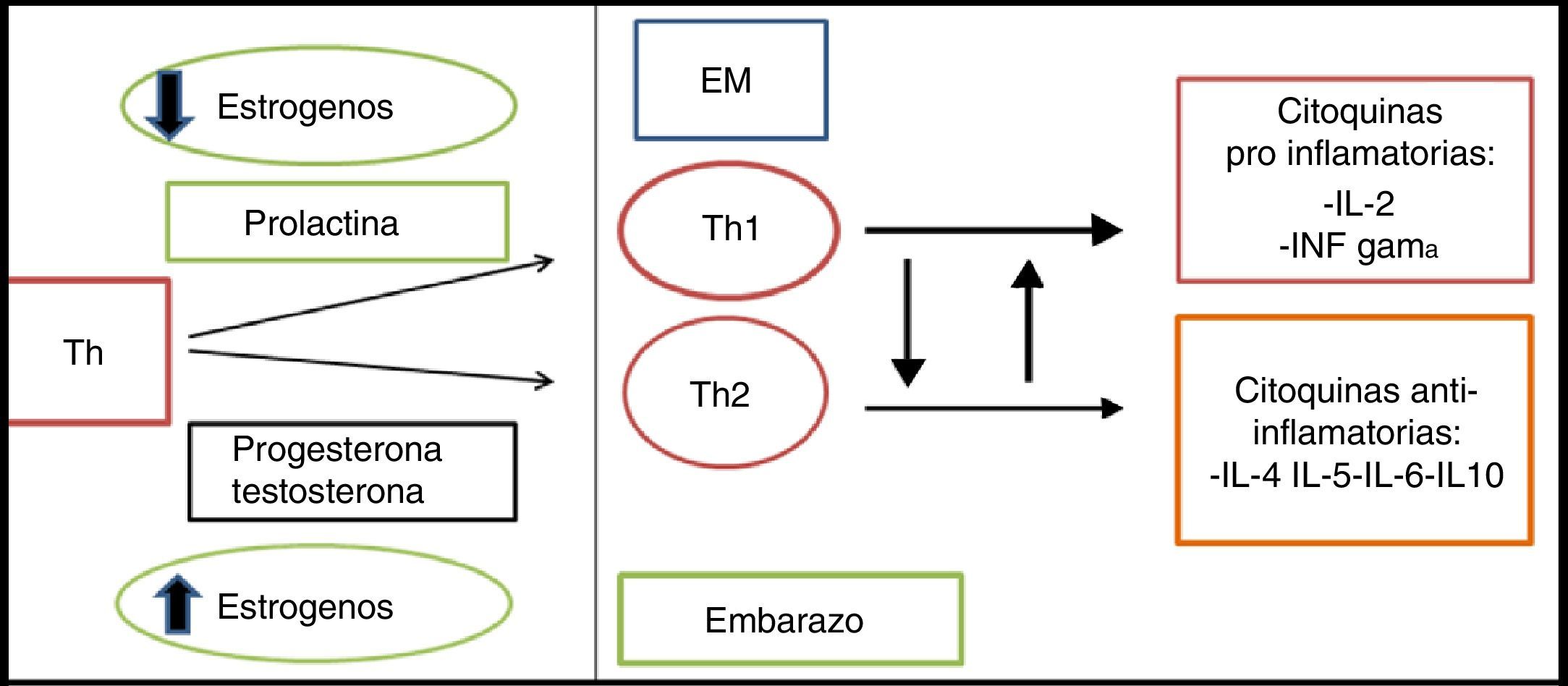
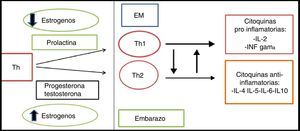
Efectos del embarazo sobre la esclerosis múltipleEl embarazo es un estado de tolerancia inmunológica transitoria para el feto; se podría decir que modula el curso de muchas enfermedades autoinmunes e infecciosas, incluyendo la EM9. Los estrógenos regulan la respuesta inmune durante el embarazo, lo que proporciona una respuesta antiinflamatoria Th2, esto inhibe la respuesta Th1 relacionada con una menor actividad de la enfermedad (fig. 1) la cual volvería a su estado basal (respuesta proinflamatoria Th1) después del parto, lo que se relaciona con la aparición de brotes en el período posparto10,11.
El feto estimula una reducción de las citocinas proinflamatorias, invirtiendo la respuesta Th1 (proinflamatoria) a Th2 (antiinflamatoria). El calcitriol, una forma de vitamina D, es una hormona importante durante el embarazo, se encarga de inhibir a las células T helper, la producción de citocinas y la proliferación de linfocitos. Se ha documentado que el calcitriol se eleva durante el primer trimestre de embarazo con un máximo en el tercero y luego disminuye sus niveles en el posparto, lo que aumenta los brotes de la enfermedad11,12.
La EM es una enfermedad autoinmune más frecuente en mujeres jóvenes en edad reproductiva, por lo cual es común la preocupación al plantear la posibilidad de tener un hijo, la influencia de la EM sobre el feto y la posibilidad de trasmisión de la EM. Para resolver estas preguntas se han desarrollado diversos estudios con el fin de responder múltiples hipótesis sobre el tema y dar una clara respuesta a las pacientes con EM por medio del análisis de la tasa de abortos, el número de cesáreas, las complicaciones obstétricas y la incidencia de abortos pre- y postérmino; la mayoría de estos estudios son retrospectivos y con sesgos de selección11.
Un estudio prospectivo realizado en Finlandia tuvo por objetivo evaluar la incidencia de complicaciones en el embarazo y el curso natural de la EM durante y después de este período, en 61 pacientes con EM que quedaron embarazadas durante los años 2003-2005, las cuales fueron seguidas de forma prospectiva desde el embarazo precoz hasta los 6 meses después del parto. Se concluyó que las mujeres con EM tenían mayor necesidad de técnicas de inseminación artificial en comparación con la población general (4,9 vs. 0,9%; p=0,0009); eran más propensas a requerir parto vaginal asistido en comparación con la cohorte general (16,4 vs. 6,5%; p=0,0017), todo lo cual ocurría por la presencia de fatiga, debilidad perineal o espasticidad, frecuente en estas pacientes13.
Un estudio británico de cohorte retrospectivo analizó los datos y realizó comparaciones entre los nacimientos de mujeres con EM (n=432) y sin EM (n=2.975). Nacieron de 2.958 mujeres sanas entre 1998 y 2009, sin encontrar diferencias estadísticas significativas en cuanto al bajo peso al nacer o la edad gestacional entre las 2 cohortes. Asimismo, tampoco se halló asociación con parto vaginal asistido (odds ratio [OR]: 0,78; intervalo de confianza [IC] del 95%: 0,50-1,16; p=0,20) o cesárea (OR: 0,94; IC 95%: 0,69-1,28; p=0,69). Sin embargo, se documentó un riesgo ligero de resultados adversos durante el parto en las madres con EM con mayores niveles de discapacidad, pero sin significación estadística. Por otro lado, aunque los resultados no fueron estadísticamente significativos, la duración de la enfermedad y la edad de inicio no se asociaron con resultados adversos14.
La fertilidad en pacientes con EM no se ve afectada, aunque puede haber dificultades de fecundación dadas por la inadecuada lubricación, por problemas posicionales por debilidad muscular, fatigabilidad y espasticidad11. Teniendo en cuenta los estudios anteriores, se puede deducir que las mujeres con EM no presentan mayores complicaciones relacionadas con el parto pretérmino y las malformaciones congénitas, pero ocurre un ligero incremento en la necesidad de inducción o cesárea en comparación con la población general, relacionado en especial con la escala de EDSS11.
Efectos a corto plazoSe realizaron diversos estudios, la mayoría retrospectivos, con el fin de determinar si durante el embarazo hay mayor aparición de brotes o, si, por el contrario, la enfermedad tiende a estabilizarse; para ello se realizó el seguimiento de pacientes con EM durante el embarazo hasta el posparto y se comparó con la población general sin EM11.
El primer estudio realizado en población israelí fue publicado en 1984 por Korn-Lubetzki en el cual se estudió a 338 mujeres. Se determinó en cada trimestre del embarazo y durante los primeros 6 meses del posparto el número de recaídas. Se concluyó que la mayoría de estas fueron en el posparto, en especial en los primeros 3 meses, con una disminución en el tercer trimestre del embarazo3,15.
En 1998 se realizó PRIMS el estudio más grande, multicéntrico, prospectivo y observacional diseñado para determinar el efecto del embarazo y el posparto en la EM; este incluyó a 254 pacientes de 12 países europeos y se analizó el número de recaídas por trimestre y la puntuación de la escala de discapacidad EDSS, y se comparó con la tasa de recaídas presentadas el año previo al embarazo. Se concluyó que hay una disminución de la tasas de recaídas durante el embarazo, en especial durante el tercer trimestre, con un aumento de las recaídas durante los 3 primeros meses después del parto; ni la anestesia epidural, ni la lactancia se relacionaron con mayor tasa de brotes ni con progresión de la discapacidad2,16.
En un segundo estudio (PRIMS) publicado en 2004 se realizó un seguimiento de pacientes con EM 2 años después del parto; se analizaron los factores clínicos que podrían estar relacionados con la probabilidad de una recaída en los 3 meses posparto. Los resultados mostraron que, en comparación con el año previo al embarazo, hubo una reducción en la tasa de recaída durante el tercer trimestre, sin embargo, en el segundo año esta fue similar al año previo al embarazo4.
Un estudio retrospectivo realizado en Brasil por Finkelsztejn recolectó datos de 128 mujeres (142 embarazos) con una edad media de 29,8 años (rango 16-42), una EDSS al inicio del embarazo de 1,5±1,4; una tasa de recaída en el año anterior de 1,2±1,5 y durante el embarazo de 0,20, con lo cual se demostró una disminución significativa en la tasa de recaídas durante el embarazo, con una prevalencia de complicaciones relativamente baja17,18.
Los estudios anteriores demuestran que el estado inmunológico durante el embarazo es un factor protector, ya que se observa menor tasa de recaídas, con una disminución significativa en el tercer trimestre y un aumento durante los primeros 3 meses posparto. Sin embargo, no se observó diferencia estadística significativa en cuanto al aumento del número de brotes y las recaídas presentadas en el año previo al embarazo.
Efectos a largo plazoLos datos acerca del riesgo de desarrollar EM en relación con el embarazo son escasos en la literatura; sin embargo, Runmarker y Andersen realizaron un estudio longitudinal poblacional y prospectivo que analizó el riesgo de un primer episodio de EM durante el embarazo o puerperio; se encontró una reducción estadísticamente significativa en el riesgo de presentar un primer brote de EM durante los 8 meses previos al parto, en comparación con el posparto y los períodos libres de embarazo. El riesgo de un primer brote era mayor en caso de nuliparidad3. Un estudio australiano realizado entre 2003 y 2006 en 282 pacientes de entre 18 y 59 años que presentaron un primer evento desmielinizante comparado con 542 controles concluyó que las mujeres multíparas tienen una reducción del riesgo de primer evento desmielinizante (OR ajustada: 0,51; IC 95%: 0,36-0,72, por nacimiento). Estos hallazgos son consistentes con un efecto beneficioso acumulativo del embarazo3.
Relación de la lactancia y los efectos sobre la enfermedadLa lactancia es un punto importante en las pacientes con EM. Se ha documentado en diversos estudios una menor cantidad de brotes durante la etapa de la lactancia; sin embargo, la consideración de un factor protector es controvertida, dada la necesidad de un inicio farmacológico con el fin de evitar recaídas4,16.
En 2002 se publicó un estudio que analizó el riesgo de recaídas durante la lactancia en mujeres con EM. Este tenía como objetivo determinar si la lactancia materna exclusiva protegía contra las recaídas después del parto y si existía alguna relación con la amenorrea prolongada durante esta. Se incluyó en forma prospectiva a 32 mujeres embarazadas con EM y 29 controles de la misma edad embarazadas; se analizaron entrevistas estructuradas durante cada trimestre y 2, 4, 6, 9 y 12 meses después del parto con los siguientes resultados, del 52% de las mujeres con EM que no amamantaron o iniciaron alimentación complementaria regular dentro de los 2 meses después del parto, el 87% tuvo una recaída después del parto, en comparación con el 36% de las mujeres con EM que amamantaron durante al menos 2 meses después del parto (OR: 5,0; IC 95%: 1,7-14,2; p=0,003; OR ajustada: 7,1; IC 95%: 2,1-24,3; p=0,002); el 60% informó que la principal razón para renunciar a la lactancia materna exclusiva fue el reinicio de la terapia farmacológica. Por otro lado, la amenorrea de la lactancia se asoció con un menor riesgo de recaídas después del parto (p=0,01), a pesar de ser un estudio limitado por el pequeño tamaño de la muestra. Teniendo en cuenta que el inicio de terapias con agentes inmunomoduladores, incluyendo interferón beta (INF-beta), acetato de glatiramer (AG) y natalizumab no se recomienda durante el embarazo ni la lactancia, las pacientes tienen que elegir si desean reanudar el tratamiento o permanecer sin manejo farmacológico19.
Un estudio publicado en el año 2010 por Aíras et al. constituido por 61 pacientes que ofrecieron lactancia concluyó que aquellas que tenían una enfermedad activa antes del embarazo decidieron no amamantar o lo hicieron por un período más corto de tiempo. Los resultados señalaron que, a pesar de una clara diferencia en la actividad de la enfermedad preembarazo, la tasa de brotes en el posparto no fue significativamente diferente entre los grupos que dieron lactancia por más de 2 meses y los de un período menor. Sin embargo, es de señalar una tendencia a mayor número de brotes en el grupo que amamantó por menos de 2 meses11.
Otro estudio publicado en 2010 realizó un seguimiento prospectivo de los embarazos ocurridos entre 2002 y 2008 en mujeres con EM reclutadas en 21 centros italianos, durante al menos un año después del parto. Se encontró que las pacientes que decidían amamantar a sus bebés al menos durante 2 meses tenían puntuaciones EDSS significativas más bajas en la concepción (1,3-1,0 vs. 1,6-1,0; p < 0,004), fueron tratados con menos frecuencia con fármacos modificadores de la enfermedad antes del embarazo (36,5% vs. 51,5% p 0,011), y experimentaron un menor número de recaídas, tanto durante el embarazo (0,06 0,3 vs. 0,14 0,4; p 0,041) y en el período de 12 meses después (0,35 0,5 vs. 0,66 0,9; p 0,001)20.
La decisión de no amamantar y de la menor duración de la lactancia materna se asoció con una mayor frecuencia de tratamiento con fármacos modificadores de la enfermedad antes del embarazo y puntuaciones más elevadas de EDSS. La duración de lactancia por un período de 6 meses se asoció con menor número de recaídas después del parto20.
Un estudio prospectivo buscó determinar si los niveles bajos de 25hidroxivitamina D (25[OH]D) contribuyen al aumento del riesgo de recaídas en el posparto en pacientes con EM. Se llegó a la conclusión de que el embarazo y la lactancia materna exclusiva están asociados con niveles bajos de 25(OH)D en mujeres con EM. Sin embargo, estos niveles bajos de vitamina D no se asociaron con un mayor riesgo de recaídas posparto. Estos datos señalan que los bajos niveles de vitamina D en forma aislada no son un factor de riesgo importante para el aumento de recaídas en el posparto en mujeres con EM21.
El embarazo y la alta concentración de vitamina D parecen generar una protección en la aparición de recaídas en la EM. Un estudio de casos y controles midió las concentraciones de vitamina D durante el embarazo y la lactancia de las madres con EM y las comparó con las medidas en las sanas. Quince madres con EM recaída-remisión fueron tratadas mediante medición de niveles de 25(OH)D3 en las semanas de gestación 10-12, 26-28 y 35-37, y 1, 3 y 6 meses después del parto. Se recogió una serie idéntica de muestras de 6 madres de control. La prevalencia de deficiencia de vitamina D (<50 nmol/L) durante el embarazo fue alta (73%) entre las pacientes con EM. Los niveles fueron mayores durante el embarazo en comparación con los valores del posparto inmediato. Al final del período de seguimiento, los niveles de vitamina D volvieron a los observados al comienzo del embarazo22.
En los controles sanos, las alteraciones durante y después del embarazo fueron similares en naturaleza, pero las concentraciones de vitamina D fueron más altas en todos los puntos de tiempo en comparación con las pacientes con EM (p=0,037). En conclusión, la deficiencia de vitamina D durante el embarazo y la lactancia parece ser común en las madres con EM y necesita ser tratada en forma adecuada22.
Se puede deducir que las mujeres con EM que tuvieran enfermedad sin brotes antes del embarazo pueden dar lactancia materna exclusiva a sus hijos durante los 2 a 3 primeros meses posparto, lo cual se relaciona con menor presentación de brotes. Por el contrario, si son formas muy activas de la enfermedad se debe iniciar tratamiento precoz y lactancia artificial. Es de vital importancia el suplemento de vitamina D durante el embarazo y en el posparto11,20–22.
Repercusión de esclerosis múltiple sobre el fetoLa EM es una enfermedad resultante de la interacción de varios factores tanto genéticos como ambientales, es decir se transmite una «predisposición». Existe un riesgo de 0,01% de enfermar en la población general, este se eleva al 3% en familiares de primer grado y hasta al 38% en gemelos univitelinos11,22.
El riesgo de desarrollar EM en personas cuyos familiares no padecen esta enfermedad es de alrededor del 1‰, el 80% de las personas que desarrollan EM no tienen miembros en su familia con esta enfermedad y el 20% tienen al menos un familiar afectado por la enfermedad. El riesgo de EM entre hermanos de una persona con EM es más alto. Una medición del componente genético de susceptibilidad a la enfermedad es el riesgo entre hermanos, el cual se define como la relación entre el riesgo de la enfermedad en un hermano de un individuo afectado y la población general. El riesgo entre hermanos para desarrollar EM puede oscilar entre 1/20 y 1/50; los parientes de primer, segundo y tercer grado de personas con EM tienen más probabilidades de desarrollar la enfermedad que la población general23.
Los estudios con medios hermanos mostraron un 2,35% de riesgo de EM en aquellos que comparten la misma madre y de 1,31% para quienes comparten el padre con EM, lo cual indica un efecto materno. El riesgo de transmitir EM de madre a hermanos fue más alto24,25. Los mellizos monocigóticos (idénticos) tienen mayor concordancia para la EM que los dicigóticos (26 vs. 2,4%), lo cual se correlaciona con el componente genético. Sin embargo, con un seguimiento a mellizos monocigóticos mayores de 50 años de edad, y utilizando los datos de los hallazgos clínicos y de la RMI, menos del 50% presentaron concordancia, lo cual indica que los factores ambientales cumplen un rol destacado23,26,27.
El factor más importante de riesgo conocido para la EM es la infección por el virus de Epstein-Barr (VEB) en comparación con los individuos no infectados, que es cerca de 15 veces más alto entre las personas infectadas con este virus en la infancia y de 30 entre las personas infectadas en la adolescencia o más tarde en la vida. Aunque los mecanismos que subyacen a esta asociación siguen sin estar claros, los datos proporcionan una fuerte evidencia de una relación causal entre la infección por VEB y el riesgo de EM. Sin embargo, se han descrito más factores asociados, los cuales son modificables, como el tabaquismo y la obesidad infantil28.
En Argentina se publicó un estudio sobre las características epidemiológicas del embarazo y parto de recién nacidos de mujeres con EM (EMEMAR) donde evidencian una mayor tasa de defectos del nacimiento en mujeres expuestas a inmunomoduladores. Se presentaron anormalidades en 3 recién nacidos de 16 pacientes expuestas a inmunomoduladores antes del embarazo y en 2 de 88 embarazos de pacientes no expuestas. Se encontró relación entre la presencia de estenosis uretral y el AG, ductus, foramen permeable y displasia de cadera en quienes usaron antes INF-beta 1b. Se observó aborto espontáneo en el 16% de los embarazos, se reportó un peso promedio entre 1.980 y 4.800 g, con 5,8% de nacimientos con bajo peso para la edad gestacional29.
Un estudio en Brasil realizado en mujeres con EM y embarazo recolectó datos sobre 128 mujeres en 21 ciudades de Brasil: el EDSS al inicio del embarazo fue de 1,5±1,4; la tasa de recaída en el año anterior al embarazo fue de 1,2±1,5, la exposición al tratamiento en cualquier momento durante el embarazo fue alta (69,7%), un 48,6% con INF-beta, un 14,1% con AG y un 7% con otros inmunomoduladores y fármacos inmunosupresores. Se describieron malformaciones neonatales en 2 mujeres expuestas a INF-beta 1a subcutáneo (Dandy-Walker y ventriculomegalia), pero no se demostró ninguna correlación significativa entre el uso de estos fármacos y dichas alteraciones. Los resultados obstétricos y neonatales tuvieron éxito en más del 90% de estas pacientes17,30.
Un estudio británico que comparó mujeres embarazadas con EM y sanas reveló que los recién nacidos de madres con EM no tenían diferencias estadísticas significativas en cuanto al peso al nacer y la edad gestacional en comparación con los recién nacidos de madres sin EM14.
El quimerismo fetal se ha asociado con EM, y plantea un mayor riesgo de EM en pacientes multíparas, con reducción del riesgo en nulíparas, relacionado con la presencia de microquimerismos en multíparas, lo cual condiciona el aumento de riesgo de enfermedades autoinmunes, incluida la EM31.
Fármacos en esclerosis múltiple y efectos sobre el embarazo y el recién nacidoMúltiples estudios se han realizado con el fin de determinar el efecto de los fármacos inmunomoduladores utilizados en EM durante el embarazo y en la salud del recién nacido.
Sandberg-Wollheim describió un total de 425 embarazos en pacientes con EM, con exposición al fármaco durante 28 días (solo 7 pacientes continuaron más allá del primer trimestre), la mayoría de los cuales finalizaron con niños sanos; el porcentaje de abortos espontáneos, con o sin defectos fetales, fue del 11,5% (dentro del rango normal para la población general: 10-20%), lo que señala una falta de relación entre la exposición al fármaco y el aborto11,32. En el estudio de Boskovic sobre los efectos del INF-beta en el embarazo, se organizaron 3 grupos: expuesto, no expuesto y comparativo saludable. En las seleccionadas y expuestas al INF-beta 1a (Avonex, Rebif) e INF 1b (Betaseron), se observó una disminución en el peso medio al nacer (3.189±416g) en comparación con los controles sanos (3.783±412g; p=0,002). Las mujeres expuestas al INF-beta tenían una mayor tasa de abortos involuntarios y mortinatos (39,1%) versus los controles sanos (5%) (p=0,03), incluso después de la corrección de los factores de confusión potenciales. Había 2 malformaciones principales (anormalidad en el cromosoma X y síndrome de Down) entre los fetos expuestos33.
Existen resultados controvertidos y discrepancias sobre el riesgo de abortos espontáneos y teratogénesis inducida por el tratamiento con INF en las personas con EM; un estudio retrospectivo realizó un seguimiento de los bebés hasta los 18 meses de nacidos en 38 mujeres de un total de 240 con EM en el centro clínico del Hospital de la Universidad de Catania (Italia). Las pacientes fueron agrupadas así: 1) expuesta a INF-beta in útero, 2) no tratadas y 3) las que suspendieron INF-beta antes de comenzar el embarazo. Los recién nacidos expuestos in útero tenían bajo peso al nacer (3.079,6± 313,3g), pero no había una diferencia estadística significativa en comparación con los otros grupos34.
Weber-Schoendorfer y Schaefer estudiaron un grupo de 69 embarazos de los cuales 38 recibieron tratamiento con INF-beta y 31 con AG durante el primer trimestre de embarazo, comparado con 2 grupos control, uno de embarazadas con EM sin exposición a fármacos y otro de mujeres sanas; la exposición a los fármacos fue de 7 semanas para el AG y de 8,8 semanas en el caso del INF. La tasa de abortos encontrada fue de 3,9 para AG y 11,7% para INF, ambos valores dentro del rango considerado normal. Se observaron 2 defectos congénitos en el grupo de AG, uno cardiaco y malformación de un pie; en el grupo expuesto a INF se produjeron 3 defectos pequeños, una displasia de cadera, postura anómala de pies (presentación de nalgas) y apéndice preauricular en la izquierda11,35.
El peso medio al nacer fue de 3.233g, en el grupo de INF de 3.479g y en el de AG de 3.328g. Se encontró que los niños nacidos de madres que habían presentado algún brote durante el embarazo tenían menor peso al nacer, lo que indica que la propia actividad de la enfermedad podría influir en ello, independientemente de la exposición a fármacos11,35.
Un estudio prospectivo observacional evaluó a 14 mujeres embarazadas con EM remitente-recurrente con alta actividad, expuestas a AG; 9 de los casos continuaron con AG durante todo el embarazo. Se encontró que no hubo defectos de nacimiento y el tratamiento fue bien tolerado, no se presentaron recaídas durante el embarazo en las que continuaron con el tratamiento, por lo que los autores del estudio señalan que puede ser razonable continuar con AG en aquellas pacientes con enfermedad activa36.
Hoevenaren et al. describieron el caso de 2 mujeres embarazadas que estaban en tratamiento con natalizumab; una lo utilizó en el período preconcepcional y la segunda tanto en el período preconcepcional como en toda la gestación. En el primer caso se indujo el parto en la semana 37 por una recaída de la enfermedad: el niño nació sin inconvenientes. En el segundo, en la semana 39 se inició tratamiento con metildopa por hipertensión inducida por el embarazo y el parto se indujo en la semana 41, que terminó en cesárea por sufrimiento fetal. El peso del recién nacido fue de 2.940 g, la paciente presentó un brote a los 10 días del parto y se resolvió tras 4 pulsos de metilprednisolona. Teniendo en cuenta la información derivada de la literatura, no se ha podido concluir si el uso de natalizumab es seguro, y los efectos a largo plazo no son conocidos. Se necesitan más investigaciones para establecer los efectos exactos en el embarazo y en el desarrollo intrauterino, así como aquellos a largo plazo37.
Un estudio prospectivo de seguimiento de las mujeres con EM encontró que la tasa de brotes durante el embarazo fue similar entre las expuestas a natalizumab y el grupo control no expuestas a fármacos modificadores de la enfermedad. Asimismo, observaron una tendencia a menor número de brotes durante el posparto en el grupo expuesto11.
Resumen de la evidencia en el tratamiento de la esclerosis múltiple durante el embarazoNingún medicamento ha sido etiquetado por la FDA como categoría A. El AG (categoría B) ha demostrado ser el más favorable, dada su seguridad en animales y los registros de no asociación con complicaciones relacionadas con el embarazo y los resultados fetales. Por otro lado, el INF-beta (categoría C) se asoció con bajo peso al nacer y parto pretérmino; natalizumab, (categoría C) sin aparentes efectos en el resultado del embarazo, y fingolimod, (categoría C) sin datos adecuados, reportan malformaciones cardiacas en animales38.
Los estudios realizados en medicamentos de reciente aparición demuestran que el dimetil-fumarato (categoría C) se asoció con embriotoxicidad en animales, aunque no hay estudios adecuados en humanos; el alentuzumab (categoría C) atraviesa la barrera placentaria y causa disminución de linfocitos en el feto; la teriflunomida (categoría X) ha mostrado malformaciones fetales y muerte en animales, pero no se conoce exposición accidental en humanos39.
Se denomina washout al tiempo de eliminación total del fármaco para el inicio seguro del embarazo. En cuanto al INF-beta y al dimetil-fumarato el rango es de un mes; el AG se considera seguro durante el embarazo, sin embargo, algunos neurólogos prefieren esperar un mes; natalizumab requiere de 1 a 3 meses, aunque los niveles disminuyen en forma significativa después del primer mes; la información del alentuzumab es incierta40.
ConclusiónEl embarazo tiene un efecto protector en las pacientes con EM, pues se ha concluido en diversos estudios que existe menor tasa de presentación de brotes durante el mismo. Las mujeres con EM que presenten la enfermedad sin brotes antes del embarazo pueden dar lactancia materna exclusiva a sus hijos durante los 2-3 primeros meses posparto, pues se ha relacionado con menor presentación de brotes. Por el contrario, si son formas muy activas de la enfermedad se debe iniciar tratamiento precoz y lactancia artificial.
Es importante administrar vitamina D durante el embarazo y en el posparto, ya que diversos estudios evidenciaron disminución de los niveles en pacientes con EM. Aunque se han realizado diversos estudios en relación con la exposición a inmunomoduladores, no hay evidencia suficiente que demuestre efectos nocivos sobre la salud de los recién nacidos; sin embargo, se recomienda suspender el tratamiento ante la posibilidad de embarazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.