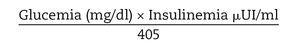Objetivos: evaluar la asociación entre presencia del síndrome metabólico (SM) o aumento de IGF-1 (insulin¿like growth factor-1) y el diagnóstico de cáncer de próstata (CaP).
Material y métodos: estudio prospectivo de 2010 a 2011 sobre 118 pacientes evaluando la asociación entre SM y el CaP. Se incluyeron pacientes con biopsia de próstata y estudio metabólico realizado. Se excluyeron a los que faltaba estudio de impedanciometría o algún parámetro analítico endocrino. las variables analizadas fueron: peso, talla, índice de masa corporal (IMC) y porcentaje de grasa central mediante impedanciometría usando el Abdominal Fat Analyser AB-140 TANITA. Previo a la biopsia, se cuantificaron niveles de PSA, IGF-1, insulinemia, índice de resistencia a la insulina (HOMA-RI), testosterona, colesterol total/fraccionado y triglicéridos. Se utilizaron los criterios de la Federación Internacional de Diabetes para definir el SM. Para evaluar la homogeneidad de los grupos con y sin CaP se utilizó la t de Student. Para evaluar la asociación entre estas variables y el diagnóstico de CaP, se ha utilizado el chi cuadrado categorizando la edad (≤ o > 65 años), IMC (≤ o > 29), insulinemia (≤ o > 25 μUI/ml), IGF-1(≤ o > 140 ng/ml), HOMA-RI (≤ o > 2,5) y PSA (≤ o > 4 ng/ ml). Para evaluar la relación con el CaP de alto grado se clasificó a los pacientes como de bajo riesgo: Gleason: ≤ 6 o 7 (3 + 4), y alto riesgo: Gleason: 7 (4 + 3) o ≥ 8. Para evaluar la homogeneidad de los grupos con CaP de alto o bajo grado se utilizó la t de Student. Para evaluar la asociación entre estas variables y el diagnóstico de CaP de alto grado, se utilizó el test chi cuadrado categorizando las mismas variables.
Resultados: la media de edad y PSA fue 64,89 ± 6,4 años y 7,9 ± 3 ng/ml, respectivamente; 33 pacientes eran obesos (28%) y 43 (36,8%) presentaron SM, con un porcentaje de grasa central elevado en el 89,9% (106). La biopsia de próstata diagnosticó CaP en 45 pacientes (38,1%). Los valores medios de edad, IMC, insulinemia, IGF-1, HOMA-RI y PSA fueron significativamente mayores en los pacientes con CaP encontrándose asociación del IMC, HOMA-RI, IGF-1, SM e hiperinsulinemia con el CaP. De los pacientes diagnosticados de CaP, 17 (37%) fueron tumores de alto grado y 28 (63%) de bajo grado. Los valores medios de parámetros del perfil metabólico no mostraron diferencias estadísticamente significativas entre los pacientes de alto o bajo grado. En relación a la IGF-1, aunque no mostró diferencias estadísticamente significativas, existe una tendencia a valores más altos en pacientes de alto grado (181,8 ng/ml frente a 167,6 ng/ml) (p = 0,07). Sí se demostró una asociación del cáncer de alto grado con el PSA, la grasa corporal total y central y el IMC.
Conclusiones: Los pacientes con CaP presentan mayor IMC, mayores valores de IGF-1, mayor porcentaje de grasa central y de SM que los que no tienen CaP. Los pacientes con cáncer de alto riesgo presentan mayor IMC y porcentaje de grasa central que los pacientes de bajo grado.
Purpose: To evaluate the association between presence of metabolic syndrome (MS) or increase of IGF-1 (insulin-like growth factor-1) and the diagnosis of prostate cancer (CaP).
Material and methods: Prospective study of 2010 to 2011 on 118 patients evaluating the association between MS and CaP. Patients with prostate biopsy and metabolic study performed were included. Those lacking impedanciometry study or any endocrine analytic parameter were excluded. The variables analyzed were: weight, height, BMI and percentage of central fat by impedanciometry using the Abdominal Rat Analyzer AB-140 TANITA. Prior to the biopsy, levels of PSA, IGF-1, insulinemia, insulin resistance index (HOMA-RI), testosterone, total/ fractionated cholesterol and triglyceride. The criteria of the International Federation of Diabetes was used to define MS. The Student's t test was used to evaluate the homogeneity of the groups with and without CaP. To evaluate the association between these variables and the diagnosis of CaP, the chi-squared was used, categorizing age (≤ or >65 years), BMI (≤ or >29), insulinemia (≤ or >25 μUI/ml), IGF-1 (≤ or >140 ng/ml), HOMA-RI (≤ or >2.5) and PSA (≤ or >4 ng/ml). To evaluate the relation with the high grade CaP, patients were classified as low risk Gleason: ≤6 or 7 (3+4), and high risk Gleason: 7 (4+3) or ≥8.The Student's t test was used to evaluate homogeneity of the group with high or low grade CaP. To evaluate the association between these variables and the diagnosis of high grade CaP, the chi-squared test, categorizing the same variables, was used.
Results: Mean age and PSA was 64.89±6.4 years and 7.9±3 ng/ml, respectively; 33p were obese (28%) and 43 (36.8%) had MS, with percentage of elevated central fat at 89.9% (106). Prostate biopsy diagnosed CaP in 45p (38.1%). Mean values of age, Bmi, insulinemia, IGF-1, HOMA-RI and PSA were significantly greater in patients with CaP, finding an association of the BMI, HOMA-RI, IGF-1, MS and hyperinsulinemia with the CaP. Of the patients diagnosed of CaP, 17(37%) were high grade tumors and 28 (63%) low grade. Mean values of metabolic profile parameters did not show statistically significant differences between high or low grade patients. In relation to the IGF-1, although it did not show statistically significant differences, there was a tendency to higher values in patients with high grade (181.8 ng/ ml vs 167.6 ng/ml) (p=0.07). An association of high grade cancer with PSA, total and central body fat and BMI was demonstrated.
Conclusions: Patients with CaP have greater BMI, higher IGF-1 levels, higher percentage of central fat and of MS than those who do not have CaP. Patients with high risk cancer have higher BMI and percentage of central fat than low grade patients.
Introducción
El CaP es el tumor más frecuente en el varón en la unión europea. Su incidencia estimada es de 110/100.000 habitantes, con una tasa de mortalidad baja. en la última década, otra "epidemia" que afecta a los varones del siglo xxi es la obesidad y el SM.
La federación internacional de diabetes (fid), define el SM como la presencia de obesidad central (circunferencia de cintura ≥ 94 cm para hombres y ≥ 80 cm para mujeres) más dos de los siguientes 4 factores1:
1) Nivel de triglicéridos (TG) ≥ 150 mg/dl (1,7 mmol/l), o tratamiento específico para esta anormalidad lipídica.
2) Colesterol HDL < 40 mg/dl (1,03 mmol/l) en hombres y < 50 mg/dl (1,29 mmol/l) en mujeres, o tratamiento específico para esta anormalidad lipídica.
3) TA sistólica ≥ 130 o ta diastólica ≥ 85 mmHg, o tratamiento de hipertensión previamente diagnosticada.
4) Glucosa plasmática en ayunas elevada ≥ 100 mg/dl (5,6 mmol/l), o diabetes tipo 2 previamente diagnosticada.
El objetivo de este estudio es determinar si el SM se asocia al diagnóstico de CaP. También se analizó como objetivo secundario si el diagnóstico de SM se asociaba al CaP de alto riesgo.
Material y métodos
Estudio prospectivo analítico y consecutivo de 118 pacientes a los que se les realizó una biopsia de próstata por PSA elevado (> 4 ng/ml) o tacto rectal sugestivo de malignidad entre 2010 y 2011. Se incluyó a todos los pacientes con estudio de impedanciometría y con estudio analítico endocrinológico completo.
Las variables analizadas fueron el IMC, porcentaje de grasa total, visceral, central y grasa magra (test de impedanciometría) y perímetro de cintura. la impedanciometría se realizó mediante el Abdominal Fat Analyser AB-140 TANITA.
Se realizó una analítica sanguínea donde se incluyó el perfil lipídico (colesterol total, HDL, LDL y triglicéridos), perfil glucémico (glucemia, insulina, hemoglobina c glucosilada, índice de resistencia a la insulina), perfil hormonal (testosterona, índice de andrógenos libres), bioquímica básica, IGF-1 y antígeno específico prostático (PSA).
Todos los pacientes fueron revisados por un endocrinólogo (RC) previamente a su inclusión en el estudio. Se definió el SM de acuerdo a los criterios de la FID.
La biopsia de próstata se realizó de forma ecoguiada y bajo profilaxis antibiótica, según el esquema de nuestro hospital, obteniendo un mínimo de 10 cilindros (3 muestras de la zona periférica y 2 muestras de los cuernos laterales en cada lóbulo).
Para evaluar la asociación del SM con el CaP, se dividió a los pacientes en dos grupos: Grupo i, pacientes con CaP en la biopsia de próstata y Grupo II, pacientes sin CaP en la biopsia.
Para el análisis estadístico se utilizó la t de Student para las variables cuantitativas y el test de chi cuadrado para la comparación de variables cualitativas. el test de Fisher se utilizó cuando las frecuencias observadas eran inferiores a 5. El nivel de significación utilizado fue de 0,05 (p < 0,05).
Se calculó el índice de resistencia a la insulina según la formula del HOMA-RI (Homeostasis Model Assessment):
siendo considerados valores normales hasta 2,5.
Se definieron como valores elevados de IGF-1 aquellos superiores a 140 ng/ml. El valor de corte fue derivado de los criterios de Rosenthal y Rubin.
Las variables edad, IMC, insulinemia, IGF-1, HOMA-RI y PSA fueron categorizadas para facilitar su análisis estadístico.
Para evaluar el objetivo secundario, a los pacientes del Grupo I se les subclasificó en aquellos de bajo riesgo, Gleason: ≤ 6 o 7 (3 + 4), y alto riesgo, Gleason: 7 (4 + 3) o ≥ 8. Se empleó la t de Student para determinar si existían diferencias entre las variables cuantitativas y el test de chi Cuadrado para evaluar la asociación de estas variables con el diagnóstico de CaP de alto grado.
Resultados
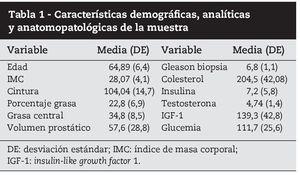
En la tabla 1 se recogen las características clínicas y analíticas de la muestra.
En cuanto a las variables endocrinas, usando el sistema de clasificación de la Organización Mundial de la Salud (OMS) para el IMC, se observó que 23 pacientes (28%) (33) eran obesos, 62 (52,2%) presentaron sobrepeso y sólo 23 (19,5%) (23) tenían normopeso. Según los criterios de la FID 43 (36,8%) cumplieron los requisitos del SM, presentando 33 pacientes (28%) un porcentaje de grasa central elevado en la impedanciometría.
Un total de 22 pacientes (18,6%) presentaban algún grado de resistencia a la insulina y 48 (41%), presentó valores elevados de IGF-1.
En lo que se refiere a los datos obtenidos de la biopsia prostática, se encontró un total de 45 pacientes (38,1%) con CaP. Este grupo se subdividió en pacientes de alto y bajo grado de forma que 17 (37%) fueron tumores de alto grado y 28 (63%) de bajo grado.
Análisis comparativo entre presencia y ausencia de CaP
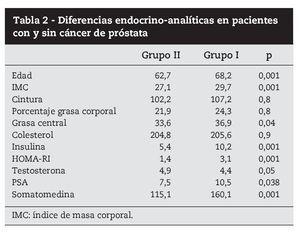
Se realizó el test de t de student para determinar si existían diferencias en el patrón endocrino-analítico entre estos pacientes (tabla 2). De acuerdo con nuestros resultados, los pacientes con CaP tenían valores de IMC, grasa central, insulina, HOMA-RI, PSA e IGF-1 significativamente mayores que aquellos sin CaP.
Análisis CaP bajo grado frente a CaP alto grado
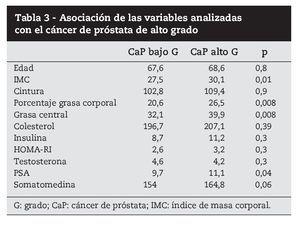
Se realizó el test de t de student para determinar si existían diferencias en el patrón endocrino-analítico entre estos pacientes. Los resultados se expresan en la tabla 3.
Los pacientes con CaP de alto riesgo en la biopsia eran pacientes con un mayor IMC, porcentaje de grasa corporal y con mayor porcentaje de grasa central. estos pacientes presentaban un valor de PSA mayor y una tendencia a valores más elevados de IGF-1.
Discusión
En las últimas décadas, la obesidad se ha convertido en un verdadero problema de salud para los países desarrollados, alcanzando hasta un 31,1% de la población de EE. UU. Estos pacientes suelen tener valores aumentados de IGF-1, estrógenos e insulina y valores descendidos de globulinas transportadoras de hormonas sexuales y testosterona2. Nuestro trabajo aporta un detallado estudio metabólico previo a la realización de la biopsia. Además, la valoración de la composición y distribución de la grasa corporal se realizó empleando el test de impedanciometría, un test mucho más eficaz que la medición del IMC, método en el que se basa la amplia mayoría de los trabajos de la literatura.
En lo que respecta al IMC, en nuestra población, en un ambiente mediterráneo, destaca un porcentaje de pacientes obesos del 28%. En cuanto a su relación con el CaP, observamos que es un factor asociado no sólo a la presencia de cáncer en la biopsia sino también a un mayor riesgo de que ese cáncer detectado sea de alto grado. En la literatura, la relación del IMC con el CaP es ambigua. en el estudio poblacional con mayor volumen de pacientes, realizado por Engeland A. et al3, con 950.000 pacientes se demuestra esta relación positiva entre IMC y CaP. En este estudio se analiza además un dato que puede ser el factor que determine los resultados dispares en cuanto a la relación del IMC con el CaP, y éste es la edad. observan como la edad de los pacientes que se incluyen en distintos trabajos es diferente, de forma que cuando la edad media de los pacientes es menor, la relación del IMC suele ser positiva y cuando los pacientes son de mayor edad, parece que ese riesgo se diluye. En nuestra serie, la edad media fue de 65 años, más acorde con las series de pacientes más jóvenes, quizá ello pueda haber influido en nuestros resultados. No obstante, hay que tener en cuenta que el perfil del paciente que actualmente, en la era del PSA, se diagnóstica de CaP, es éste y no el de un varón de 75 o más años.
Posteriormente, estos datos fueron corroborados por un estudio caso-control donde se encontró que la obesidad en edades tempranas, en torno a la cuarta década de la vida, se asociaba con mayor riesgo de CaP4. No obstante, hay autores que no han encontrado relación entre el IMC y el CaP, ya sea localizado o localmente avanzado-metastásico5-7. Dada esta discrepancia, se realizó un metaanálisis donde se evidenció una relación positiva, aunque débil, entre el CaP y el IMC8.
Se cree que los pacientes obesos, dada las menores tasas de testosterona circulantes y sus menores valores de PSA, podrían retrasar la detección de CaP y así presentar un mayor riesgo de cáncer avanzado9. En nuestros resultados, no hubo diferencias en los valores medios de PSA entre pacientes obesos y no obesos, aunque sí que se demostró que los pacientes con CaP de alto riesgo en la biopsia tenían IMC mayores.
Algunos autores no opinan que el IMC sea un buen indicador de la composición corporal, por lo que recurren a otras medidas como el perímetro de la cintura o la ratio cintura/cadera10. A este respecto, pensamos que la mejor forma de conocer este dato es la impedanciometría, que aporta una composición más exacta de la distribución de la grasa corporal.
Otro de los parámetros que evaluamos en nuestro trabajo fue la grasa corporal. en un estudio previo donde se compararon las características impedanciométricas de pacientes con y sin CaP no se evidenció diferencia en el porcentaje de masa grasa aunque sí en el de masa magra11. Tampoco Walstrom et al12 observaron que el porcentaje de grasa corporal total influyera en la aparición de CaP.
MacInnis et al13 tampoco encuentran asociación usando la impedanciometría. no obstante, no analizan de forma aislada la grasa central, que es la que se ha relacionado con la hiperinsulinemia y la resistencia a la insulina, otro de los factores que se están asociando con la aparición del CaP.
Nuestro estudio es el primero que analiza de forma directa el factor de la grasa corporal central mediante el uso de impedanciometría. nuestro test de impedanciometría incluye grasa corporal total, grasa magra, grasa central y visceral, siendo por tanto un análisis completo de la composición corporal.
En nuestros resultados, la grasa corporal central se asocia tanto a la presencia de adenocarcinoma de próstata como a la presencia de cáncer de alto grado en la biopsia.
En lo que se refiere a la relación del CaP con la IGF-1, a pesar de que el cáncer de próstata es en principio de crecimiento hormonodependiente, el hecho de que haya cánceres de próstata junto a niveles bajos de andrógenos hace pensar que haya otros factores que puedan influir como la insulina o la IGF-114.
A pesar de que en algunos trabajos no se encontró esta relación15 hay varios metaanálisis recientes en los que se aprecia, en todos ellos, una asociación con una or que varía entre 1,26 (ic 95%, 1,07-1,36) y 1,47 (ic 95%, 1,23-1,77) entre el aumento de IGF-1 y el adenocarcinoma de próstata16,17.
Nuestros resultados son coincidentes con los de los metaanálisis publicados. encontramos que los pacientes con CaP tenían valores significativamente mayores de IGF-1 que la media de la población sana, viendo una asociación entre los mismos. además, en cuanto a su relación con el adenocarcinoma de alto grado, de nuestros resultados se pueden establecer conclusiones similares a las del metaanálisis de Rowlands et al17 de forma que no hay una asociación estadísticamente significativa sino una tendencia a la significación.
En cuanto al SM, en nuestro trabajo, la presencia del mismo entre los pacientes con CaP fue significativamente mayor. No se obtuvo, no obstante, esa diferencia cuando se comparó a los pacientes con cáncer de alto o bajo grado. De ello, podemos concluir que el SM puede influir en la aparición del CaP, aunque no parece influir en la agresividad del mismo.
Nuestros resultados coinciden con otros trabajos como el de Laukkanen et al18. estos autores, hicieron un seguimiento sobre 1880 pacientes y encontraron que aquellos con SM tenían un riesgo 1,9 (ic 95%) veces mayor de desarrollar CaP una vez ajustado por edad. También otro estudio de casos y controles, aunque con un tamaño muestral pequeño aporta datos similares a los hallados en nuestro trabajo1.
Conclusiones
Los pacientes con CaP presentan mayor IMC, mayores valores de IGF-1, mayor porcentaje de grasa central y de SM que los que no tienen CaP. Los pacientes con cáncer de alto riesgo presentan mayor IMC y porcentaje de grasa central que los pacientes de bajo grado.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
INFORMACIÓN DEL ARTÍCULO
Historia del artículo:
Recibido el 13 de febrero de 2012
Aceptado el 10 de mayo de 2012
*Autor para correspondencia.
correo electrónico: edumoran@comv.es (E. Morán).