Purpose: The new therapies introduced in the treatment of the oncologic disease, known as molecular targeted therapies provide an increased survival of patients either when associated with chemotherapy or in monotherapy. Despite the efficacy of these new therapies, they also cause new patterns of toxicity, mainly skin toxicity. This review presents the main groups of drugs (Antibodies and Tyrosine Kinase Inhibitors) which are grouped according to the molecular target, and also the pathophysiology, prevention, clinical manifestations and treatment of skin diseases induced by inhibitors of receptors epidermal growth factor receptor (EGFR).
Material and methods: The methodology used is based on a published literature review, with access to PubMed using the following keywords: Cutaneous Side Effects, Molecular Targeted Therapies, Monoclonal Antibodies, Tirosin¿kinase inhibitors, EGFR, VEGFR, PDEGFR, Cetuximab, Panitumumab, Pertuzumab, Trastuzumab, Erlotinib and Gefitinib.
Results: With the constant evolution of the scientific knowledge and massive number of publications, the information described in this article will be updated soon.
Conclusions: This article is intended to guide physicians, as a useful tool for the time of diagnosis and treatment of skin toxicity, aiming to improve oncological therapies exequibility, and by these improving survival and quality of life of patients.
Objetivos: Las nuevas terapéuticas introducidas en el tratamiento de la enfermedad oncológica, conocidas como terapéuticas moleculares dirigidas (Molecular Targeted Therapies) aportan aumento en la sobrevida de los pacientes, bien asociadas a quimioterapia o bien en monoterapia. Junto con la eficacia terapéutica estos tratamientos provocan también nuevos patrones de toxicidad, fundamentalmente cutáneos. Esta revisión presenta los grandes grupos farmacológicos (anticuerpos e inhibidores de tirosincinasa) y los agrupa según la diana molecular. En esta primera parte se estudia la fisiopatología, clínica, profilaxis y tratamiento de las alteraciones cutáneas inducidas por inhibidores del receptor del factor de crecimiento epitelial (EGFR).
Material y métodos: Revisión bibliográfica de la literatura publicada, con acceso a la base de datos PubMed, Google y enlaces desde los artículos observados, utilizando las palabras clave: cutaneous side effects, molecular targeted therapies, monoclonal antibodies, tirosin¿kinase inhibitors, EGFR, VEGFR, PDEGFR, cetuximab, panitumumab, pertuzumab, trastuzumab, erlotinib, gefitinib.
Con estos criterios de búsqueda fueron consultados artículos y resúmenes según las referencias de los artículos de revisión y de los textos encontrados.
Resultados: La evolución del conocimiento y las publicaciones tienden a crecer y las informaciones aquí presentadas serán muy brevemente actualizadas.
Conclusiones: Este artículo pretende orientar a los clínicos con una herramienta eminentemente práctica a la hora del abordaje diagnóstico y terapéutico de la toxicidad cutánea, con la finalidad de mejorar el cumplimiento de la terapéutica oncológica, mejorando la sobrevida y la calidad de vida de los pacientes.
Introducción
La alopecia como señal de toxicidad cutánea inducida por tratamientos citostáticos ya era conocida y esperada por médicos y pacientes oncológicos, siendo precisamente una de las más temidas (junto con las náuseas y vómitos) por los enfermos y familiares, debido a su impacto visual y social. Hay otras alteraciones dermatológicas inducidas por la quimioterapia como fototoxicidad, alteraciones ungueales (onicolisis, alteraciones de la pigmentación), síndrome manopie y otras situaciones indeseadas. Estas alteraciones recientemente citadas fueron conocidas en las últimas décadas, inducidas por nuevos citotóxicos (taxanos, capecitabina, formulaciones liposomales y pegiladas de las antraciclinas...).
La causa directa de estas complicaciones es la acción de los citotóxicos sobre las células en ciclo permanente, entre las cuales están las de la piel y folículos pilosos.
En los últimos años, sin embargo, hemos asistido a un cambio paradigmático en la terapéutica y en la investigación básica y clínica aplicada al tratamiento del cáncer. El potencial de investigación y el arsenal médico actual para el tratamiento oncológico dedican los mayores esfuerzos al estudio y reconocimiento de moléculas y vías enzimáticas y metabólicas implicadas en los fenómenos biológicos condicionantes del cáncer; división celular, apoptosis, angiogénesis, procesos metabólicos y otros procesos vitales de la célula tumoral. El conocimiento más profundo de estas vías lleva implícito el desarrollo de moléculas (anticuerpos o inhibidores enzimáticos) que bloquean específicamente esas nuevas vías conocidas.
Terapéuticas dirigidas
Las terapéuticas citostáticas clásicas utilizan medicamentos (citotóxicos) que tienen acción sobre moléculas con acción importante en la vida de la célula (tumoral y no tumoral), como bases púricas y primidínicas, el adn, microtúbulos, topoisomerasas...
Aunque los citotóxicos clásicos tienen, sensu stricto, una diana molecular, el concepto de terapia dirigida es claramente diferente. Así, entendemos como terapéutica dirigida (molecular targeted therapy) la estrategia terapéutica en la que se diseñan fármacos específicos para bloquear las moléculas (receptores de membrana, moléculas solubles o enzimas) que consideramos implicadas en el proceso de transformación neoplásica celular en cualquiera de sus puntos: división celular, proliferación, angiogénesis, apoptosis1. Estas drogas se han ido desarrollando y diseñando en laboratorio paralelamente al descubrimiento de las moléculas implicadas en la carcinogénesis.
La entrada de las nuevas moléculas terapéuticas (terapéuticas dirigidas), algunas en monoterapia y otras asociadas a esquemas citotóxicos clásicos, ha permitido el aumento de la sobrevida global de los pacientes, así como esquemas terapéuticos más tolerables para el paciente, pero también ha aportado unos nuevos padrones de toxicidad. Esta nueva toxicidad, habitualmente no es entendida como de riesgo vital, pero implica, a veces, impacto muy negativo en la percepción de la calidad de vida del paciente2.
Clasificación etiológica
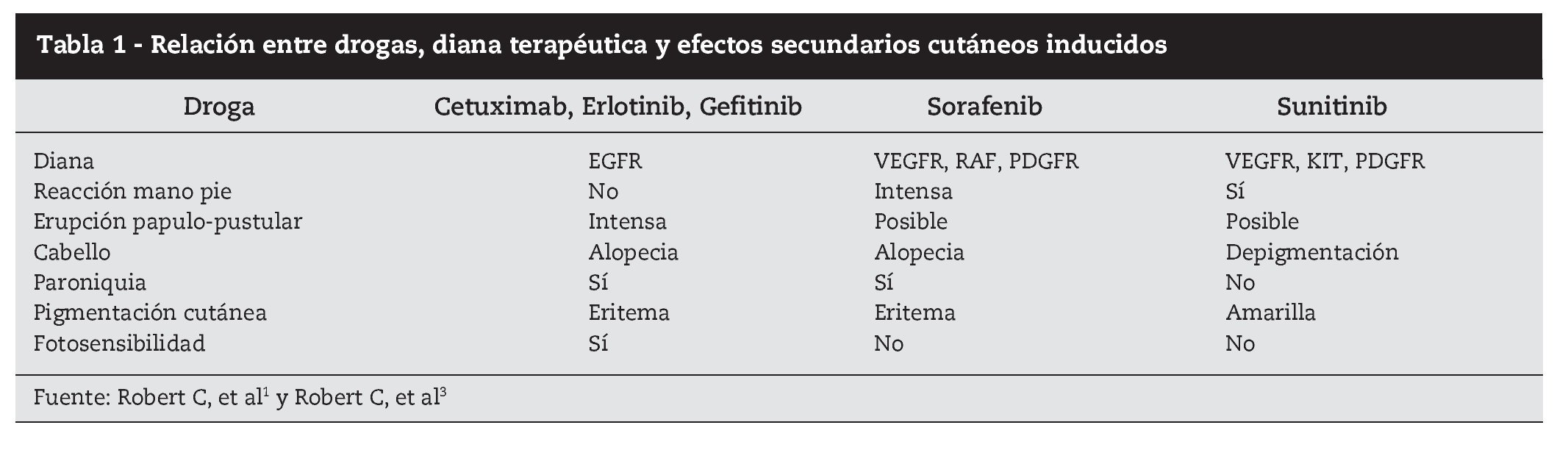
La clasificación etiológica queda reflejada en la tabla 1. Aunque el perfil de toxicidad de las terapéuticas dirigidas es muy amplio y frecuente, la mayoría de estos nuevos fármacos parece presentar una predilección especial por la piel como diana de efectos secundarios.
Clasificación farmacológica
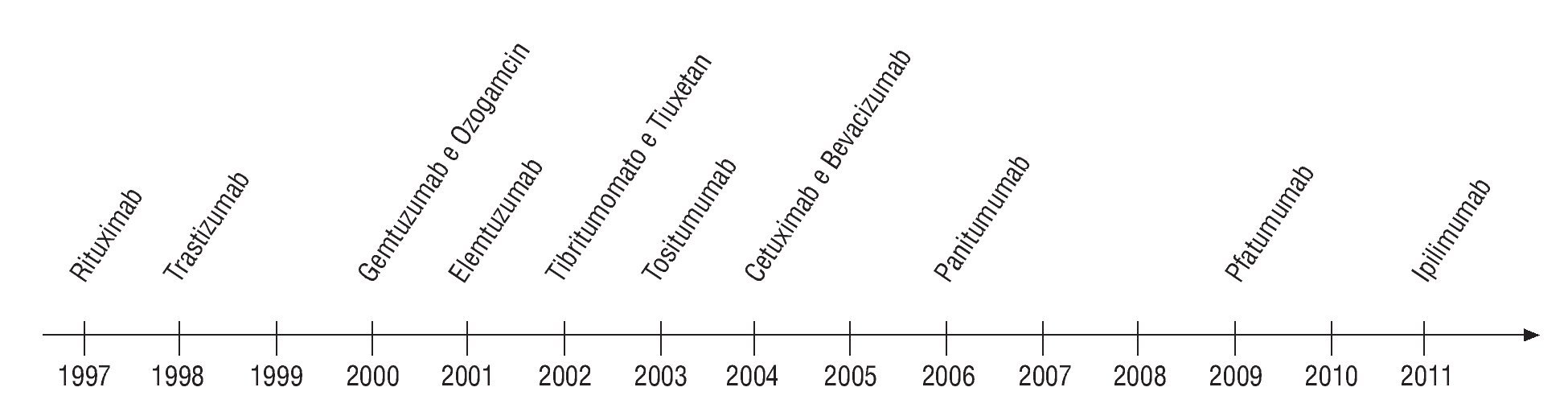
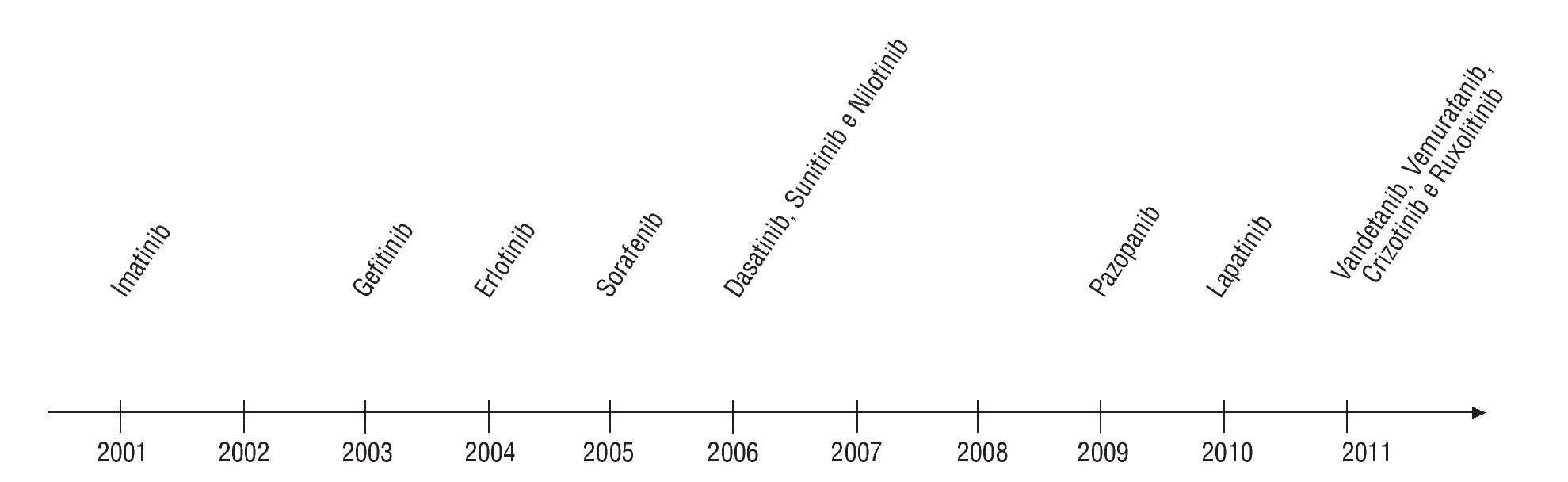
Podemos clasificar las terapéuticas dirigidas en 2 grandes grupos farmacológicos: los anticuerpos monoclonales (MoAb) (fig. 1) y los inhibidores de tirosincinasas (TCI) (fig. 2). Otras clases terapéuticas se encuentran actualmente en diferentes grados de desarrollo y de investigación (inmunoterapia, terapia genética, rnaantisense, transportadores...).
Fig. 1¿ Evolución temporal de aprobación de Ac monoclonales para el tratamiento de enfermedades oncológicas. Fuente: cita 4.
Fig. 2¿ Evolución temporal de aprobación de inhibidores tirosincinasa para el tratamiento de enfermedades oncológicas. Fuente: citas 4,5.
Relativamente al lugar de actuación preferencial de estas moléculas, podemos también, de forma simplista, dividir en tres grandes grupos: los inhibidores HER (trastuzumab, pertuzumab, cetuximab, panitumumab, erlotinib y lapatinib); los antiangiogénicos (bevacizumab, sorafenib, sunitinib), y otros (rituximab, imatinib, dasatinib, bortezomib, everolimus, temsirolimus).
Muchas otras moléculas están en diferentes fases de desarrollo clínico antes de ser definitivamente aprobadas para la utilización en terapéutica humana (figs. 1 y 2).
Relación toxicidad¿eficacia
Desde los primeros estudios realizados con terapéuticas dirigidas6 se ha descrito también la relación entre la intensidad clínica de la reacción cutánea y la eficacia del tratamiento y la sobrevida del paciente, siendo, en la mayor parte de los casos, una relación directamente proporcional7. Aunque los datos no son coherentes y corresponden a ensayos clínicos aislados, lo cierto es que estudios con todos los inhibidores EGFR apuntan en el mismo sentido (cetuximab8,9, erlotinib10, gefitinib11 y panitumumab12). Los mecanismos que rigen esta relación toxicidadeficacia no están todavía claramente definidos, pero probablemente, el estudio y mejor conocimiento de esta relación permitirá descubrir un biomarcador de eficacia de la droga. Esta correlación entre severidad del efecto secundario y eficacia terapéutica puede ayudar al paciente a soportar con mayor estoicismo los efectos secundarios más severos13.
El aumento constante de nuevas terapéuticas dirigidas y la frecuencia de la toxicidad cutánea son los motivos por los cuales, en los últimos años, hemos asistido a un aumento de la necesidad, sentida por todos los oncólogos médicos, de estudiar y conocer la fisiopatología de esta yatrogenia, así como de establecer colaboración más estrecha con los dermatólogos.
Fisiopatología
Este nuevo perfil de toxicidad se entiende conociendo la gran riqueza de concentración de receptores del tipo EGFR, VEGFR, RAF, KIT, PDGFR, MAPK, PI3K, Akt, proteincinasa activada por el estrés, STAT (Signal Transducer and Activator of Transcription) y otros similares en la hipodermis, dermis, epidermis y en todos los anejos cutáneos14.
Todos estos receptores actúan en vías de transmisión de señal que habitualmente están implicadas en la oncogénesis y pueden estar alterados en su función. También estos receptores actúan en el funcionalismo normal de la piel, en el metabolismo de los queratinocitos y de las diferentes estirpes celulares de la dermis, epidermis y anejos. El bloqueo de una o varias de estas vías fisiológicas de transmisión de señal originan manifestaciones clínicas indeseadas en los pacientes tratados.
Alteraciones cutáneas inducidas por inhibidores EGFR
El "Epidermal Growth Factor Receptor", o EGFR pertenece a la familia de receptores Her. Esta familia de receptores transmembrana, con dominio tirosincinasa intracelular, interviene en la transmisión de señal de proliferación celular y su sobreexpresión, en tejido tumoral, induce la división celular, inhibe la apoptosis, altera la adhesión celular e incrementa la motilidad y la capacidad invasiva tumoral15. Los receptores mejor conocidos son HER1/EGFR y HER2 (este último bloqueado selectivamente por trastuzumab, que no será visto en este capítulo porque la toxicidad cutánea que induce es despreciable1.
Globalmente de un 30 a 100% de los tumores expresan EGFR y en ellos la activación del receptor es señal de mal pronóstico16. De facto, la sobreexpresión del EGFR está fuertemente asociada con el desarrollo de cáncer y con la progresión de un número importante de enfermedades oncológicas16.
Dentro de los anticuerpos monoclonales antiEGFR, cetuximab fue el primero aprobado por la fda para el tratamiento del carcinoma colorrectal17 y posteriormente para el tratamiento del cáncer de cabeza y cuello18. Es un anticuerpo quimérico que se une específicamente a la porción extracelular del receptor transmembrana EGFR, con gran afinidad, inhibiendo la transducción de la señal de proliferación y sobrevivencia celular 19. Panitumumab es un anticuerpo humanizado de mecanismo de acción similar a cetuximab20. Otros fármacos, actualmente en diferentes fases de desarrollo clínico son pertuzumab (anti EGFR y antiHER2) a finalizar estudios fase III para cáncer de mama, nimotuzumab (indicado en tumores de cabeza y cuello y tumores del sistema nervioso central -Snc-: astrocitoma y glioblastoma multiforme)21,22.
Los inhibidores del dominio intracelular tirosincinasa del EGFR hoy aprobados son erlotinib, para el tratamiento de cáncer de pulmón y cáncer de páncreas, y gefitinib, para el tratamiento de cáncer de pulmón15. Lapatinib, también un inhibidor tirosincinasa, inhibe específicamente dos vías de transmisión de señal, EGFR y Her2. Está aprobado en el tratamiento de cáncer de mama metastásico o recurrente HER2 positivo23.
Erupción pápulo¿pustular, rash pápulo¿pustular o rash acneiforme
Casi todos los inhibidores EGFR aprobados actualmente (a excepción de trastuzumab) se asocian a erupción pápulopustular, siendo este el efecto secundario más frecuente de este grupo de fármacos. El 90% de los pacientes presentan erupción pápulopustular de cualquier grado cuando son tratados con cetuximab24. La incidencia en los pacientes tratados con panitumumab es similar pero en los tratados con erlotinib, gefitinib y lapatinib es menor, variando entre 45 y 75%. En estos casos también la intensidad es menor 3.
Fisiopatología
La activación de EGFR desempeña un papel importante en la división, proliferación, diferenciación, movilidad e invasión tumoral25. Este receptor se encuentra también sobreexpresado de forma fisiológica en queratinocitos de estratos basales de la epidermis y del folículo piloso, en glándulas sebáceas y glándulas ecrinas26. El EGFR interviene en procesos fisiológicos como proliferación, protección contra daños inducidos por ultravioleta, inhibición de la inflamación y aceleración de los procesos de cicatrización27. El bloqueo de EGFR altera las vías de señalización intracelular, interrumpiendo el crecimiento celular, induciendo apoptosis, disminuye la migración celular y provoca respuesta inflamatoria mediada por citoquinas6,28. La combinación de estos fenómenos provoca oclusión y ruptura folicular, facilitando la sobreinfección bacteriana y el desarrollo del cuadro cutáneo con la erupción pápulopustular característica29.
También se ha demostrado que en los pacientes tratados con inhibidores EGFR la piel es más sensible a los daños inducidos por las radiaciones ultravioleta, y que la reparación de estas lesiones está comprometida.
Nomenclatura
Existe controversia y poca definición sobre el nombre del cuadro clínico cutáneo inducido por inhibidores EGFR. Rash acneiforme, acnélike o incluso, "acné", son términos utilizados. Sin embargo, debe diferenciarse claramente del acné, por motivos clínicos e histopatológicos. La distinción es también de tipo terapéutico, pues la erupción pápulopustular inducida por inhibidores EGFR no responde al tratamiento habitual del acné30.
Histología
El estudio histológico muestra la presencia de alteraciones de la queratinización, infiltrados de neutrófilos, eosinófilos y monocitos, alteraciones en las glándulas sebáceas y folículos pilosos31. Esta histología es claramente diferente de la que aparece en el acné típico.
Calidad de vida
El estudio de calidad de vida de los pacientes portadores de erupción pápulopustulosa por inhibidores EGFR, con la herramienta Skindex16 (un instrumento de calidad de vida específico para la piel) y la escala CTCAE versión 4.0 indican que las emociones de los pacientes se ven muy afectadas por síntomas como irritación, dolor, escozor y prurito, sin embargo los profesionales sanitarios consideran que el efecto más impactante para la calidad de vida del paciente es el estético. Esta discordancia puede inducir a una orientación inadecuada de los tratamientos32.
Clínica
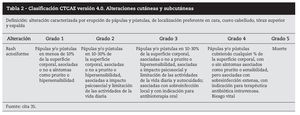
El cuadro consiste en la aparición de erupción de pápulas y pústulas que se localizan típicamente en cara, cuero cabelludo, parte superior del tronco y espalda, en zonas ricas en folículos sebáceos33. Comienza con alteraciones de la sensibilidad, irritación, prurito, escozor y, a veces, dolor, acompañados de eritema y edema (primera semana) seguida de erupción de lesiones pápulopustulosas que pueden cubrirse de costras entre la tercera y quinta semana. Evoluciona posteriormente a eritema, xerosis y telangiectasias en las áreas previamente afectadas por la erupción34 (tabla 2).
Tratamiento
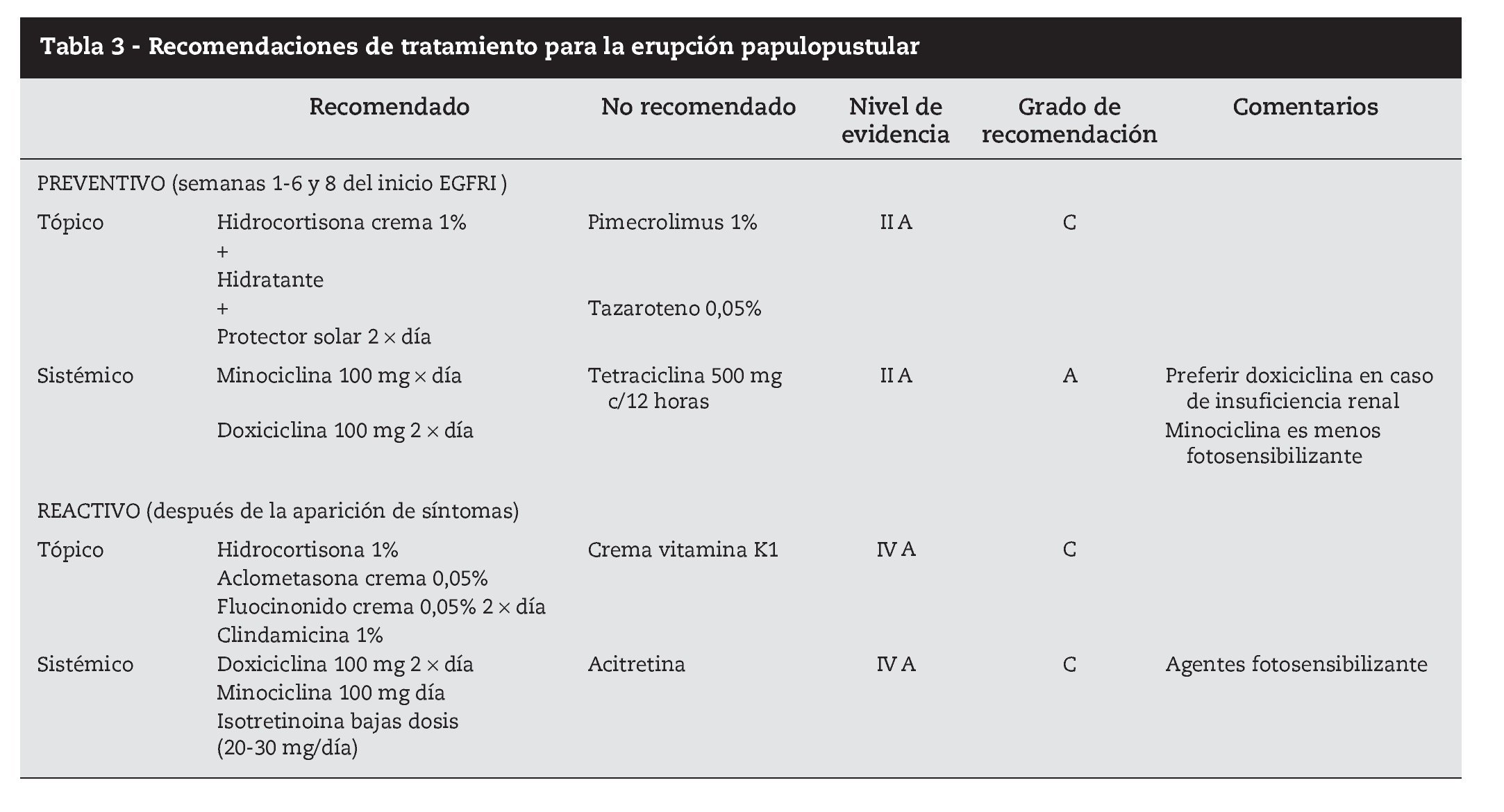
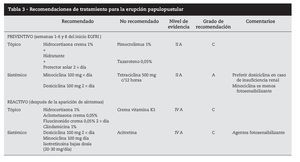
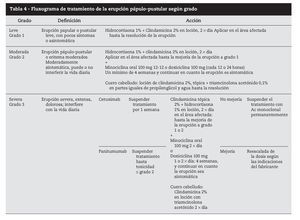
Hasta el momento no se han publicado metaanálisis que permitan orientar el tratamiento basado en la evidencia, y los ensayos clínicos aleatorizados son muy pocos. Las recomendaciones de tratamiento se fundamentan en la experiencia de centros y en artículos publicados por especialistas, con números muy variables de pacientes36 (tabla 3).
Con los datos disponibles podemos diferenciar dos tipos diferentes de abordaje terapéutico: tratamiento preventivo y tratamiento reactivo.
El tratamiento preventivo37 consiste en iniciar tratamiento antes de los primeros síntomas con la aplicación de crema de hidrocortisona al 1% en las zonas de localización habitual de la erupción, dos por día, junto con doxiciclina 100 mg/1212 horas por vía oral, crema hidratante y crema protectora solar con factor de protección superior a 15. Este esquema terapéutico demostró una disminución superior al 50% del riesgo de aparición de toxicidad grado 23 asociada a inhibidores EGFR.
El tratamiento reactivo consiste en la administración de fármacos una vez que el cuadro clínico ya está instituido y varía según el grado clínico. Es consensual que se deben evitar los tratamientos antiacné habituales (retinoides, benzoilo, pimecrolimus).
Para toxicidad grado 1 es eficaz la administración de hidrocortisona 1% aplicación tópica dos por día, antibioterapia tópica (doxiciclina, eritromicina, metronidazol) dos por día, crema hidratante y protección solar.
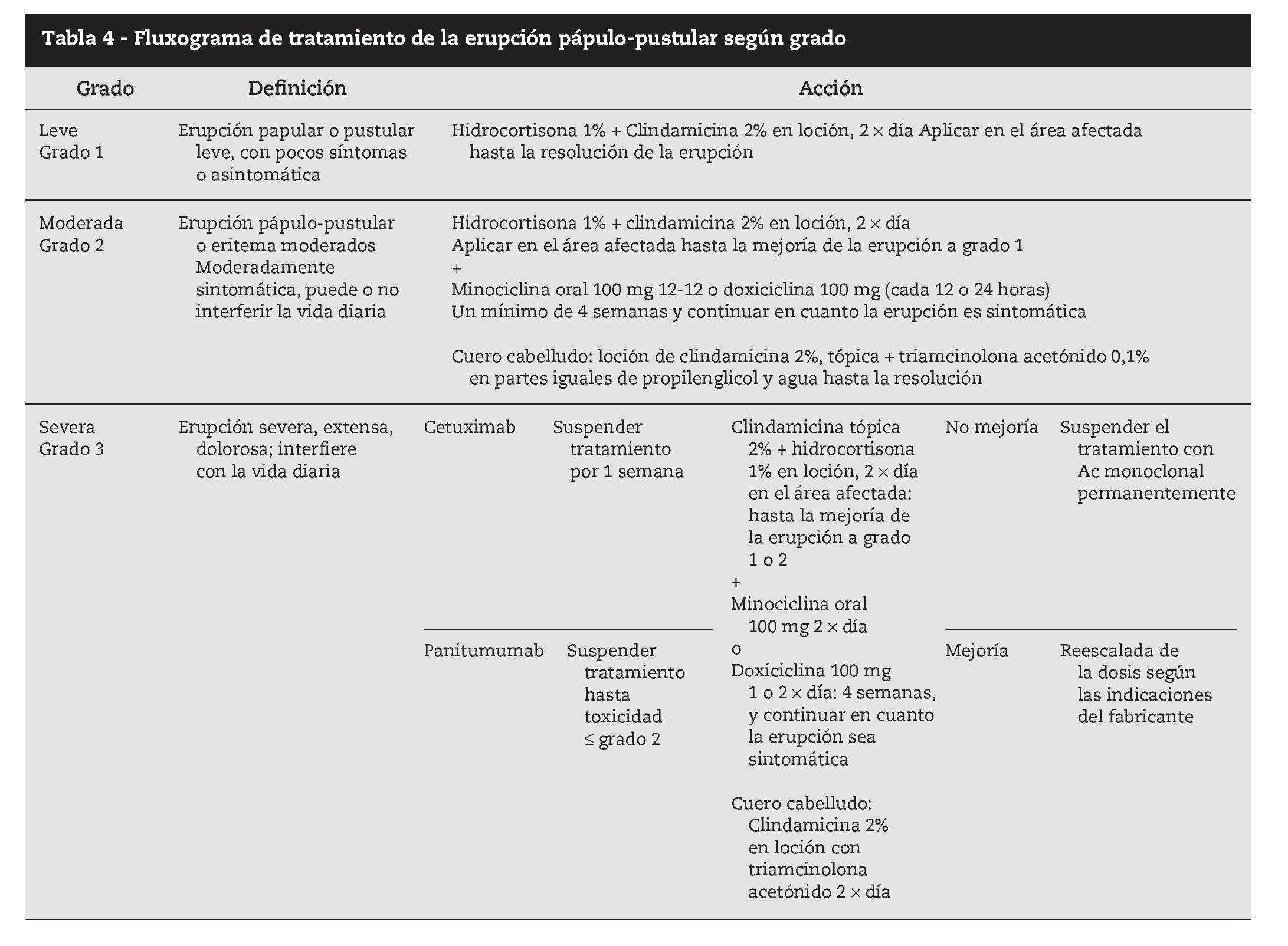
Para los grados 2 y 3 dexametasona 0,5 mg/kg por vía oral 1212 horas, hidrocortisona 1% tópica en las zonas más expuestas, minociclina 100 mg oral 1212 horas, crema hidratante y protección solar. Puede ser necesario disminuir la dosis de citostático, y reiniciar en cuanto la sintomatología llega a grado 2. En casos más severos, o con recidivas de toxicidad grado 3 el citostático puede tener que ser suspendido (tabla 4).
Eritema facial
Es un eritema de tipo fluctuante, que origina sensación de calor e incomodidad. Las tetraciclinas tópicas son ineficaces, pero mejora con la colocación de compresas con salino fresco1.
Tratamiento
Hasta el momento no se han publicado metaanálisis que permitan orientar el tratamiento basado en la evidencia, y los ensayos clínicos aleatorizados son muy pocos. Las recomendaciones de tratamiento se fundamentan en la experiencia de centros y en artículos publicados por especialistas, con números muy variables de pacientes36. Con los datos disponibles podemos diferenciar dos tipos diferentes de abordaje terapéutico: tratamiento preventivo y tratamiento reactivo.
El tratamiento preventivo37 consiste en iniciar tratamiento antes de los primeros síntomas con la aplicación de crema de hidrocortisona al 1% en las zonas de localización habitual de la erupción 2 × día, junto con doxiciclina 100 mg/1212 horas vía oral, crema hidratante y crema protectora solar con factor de protección superior a 15. Este esquema terapéutico demostró una disminución superior al 50% del riesgo de aparición de toxicidad grado 23 asociada a inhibidores EGFR.
El tratamiento reactivo consiste en la administración de fármacos una vez que el cuadro clínico ya está instituido y varía según el grado clínico.
Es consensual que se deben evitar los tratamientos antiacné habituales (retinoides, benzoilo, pimecrolimus).
Para toxicidad grado 1 es eficaz la administración de hidrocortisona 1% aplicación tópica 2 × día, antibioterapia tópica (doxiciclina, eritromicina, metronidazol) 2 × día, crema hidratante y protección solar.
Para los grados 2 y 3 dexametasona 0,5 mg/kg por vía oral 1212 horas, hidrocortisona 1% tópica en las zonas más expuestas, minociclina 100 mg oral 1212 horas, crema hidratante y protección solar. Puede ser necesario disminuir la dosis de citostático, y reiniciar en cuanto la sintomatología llega a grado 2. En casos más severos, o con recidivas de toxicidad grado 3 el citostático puede tener que ser suspenso.
Xerosis y prurito
Aparece más tarde, 23 meses después de la erupción pápulopustulosa y en las mismas zonas afectadas, pero con una extensión superior34. La alteración en la diferenciación y en el funcionamiento normal de los queratinocitos provoca alteración de la estructura proteica de la dermis, en un tercio de los pacientes38. La alteración funcional y anatómica del estrato córneo de la piel y de las glándulas sebáceas llevan a una incapacidad para retener agua28. Sin tratamiento, evoluciona a dermatitis xerótica crónica, con riesgo de disrupción cutánea y sobreinfección39.
Debe recomendarse a los pacientes utilizar agua templada para lavarse, evitar en lo posible el baño, recomendar duchas rápidas y poco frecuentes, lavados rápidos, evitar jabones detergentes. Evitar pomadas y cremas hidratantes, porque ocluyen los folículos. Pueden utilizarse corticoides suaves durante una o dos semanas, y es necesario vigilar con cuidado las señales de aparición de sobreinfección24.
Habitualmente asociado a la xerosis aparece prurito, de difícil control clínico. La aplicación de anti pruriginosos tópicos (Eucerin®, Aveeno®), compresas frías locales, corticoides tópicos ayudan al control sintomático. Los antihistamínicos orales tienen efecto sedativo, no anti pruriginoso. Pregabalina oral ha demostrado alguna eficacia en el prurito inducido por cetuximab y es resistente a otros tratamientos.
Fisuras
Resultan de la evolución de xerosis o de la reacción cutánea manopie. Se localizan en áreas de hiperqueratosis (dedos, talones, codos, rodillas). Limitan las actividades de la vida diaria del paciente por el dolor asociado a la manipulación de objetos y están sujetas a riesgo elevado de sobreinfección. La prevención de traumas y microtraumas, curas hidrocoloides, cura oclusiva con solución de propilenglicol al 50% y ácido salicílico al 10%, cura oclusiva con óxido de cinc, o cianoacrilato líquido (Superglue 3®) pueden mejorar los síntomas de dolor y acelerar la evolución40.
Alteraciones del pelo
Es frecuente encontrar alopecia parcial y fragilidad del pelo en los pacientes tratados con inhibidores EGFR, más frecuentemente con tci, y aparece varios meses después de iniciado el tratamiento29. Hipertricosis facial y tricomegalia aparecen también varios meses después de iniciado el tratamiento citostático. Es necesario cortar las pestañas para evitar la aparición de triquiasis y entropión, en cuyo caso será necesaria la intervención del oftalmólogo para el tratamiento de úlcera corneal consecuente41.
Alteraciones ungueales
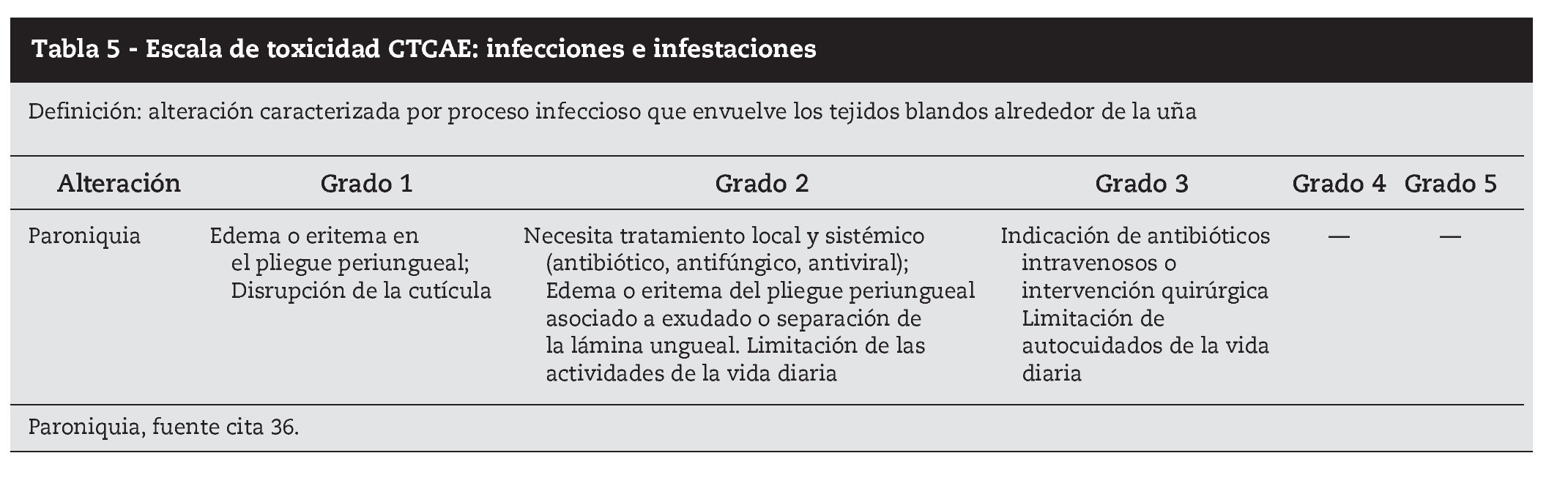
Prácticamente todos los pacientes que reciben tratamientos dirigidos tienen riesgo de desarrollar alteraciones ungueales, que suelen comenzar a los dos meses del inicio del tratamiento42. Las alteraciones ungueales son una de las más molestas para el paciente, fundamentalmente por el dolor y la incapacidad funcional que causan, siendo de tratamiento difícil43. Las alteraciones más frecuentes son la paroniquia, granuloma piogénico periungueal y alteraciones de la lámina ungueal (onicolisis y onicodistrofia).
Paroniquia es la inflamación con edema, a veces purulento, del lecho ungueal. Es dolorosa y afecta igualmente a los dedos de los pies y las manos, más frecuentemente a los pulgares13. En los casos más severos evoluciona a granuloma piogénico periungueal, con aspecto similar al de uña incarnada.
La paroniquia es inicialmente un proceso inflamatorio, estéril, pero la alteración de la barrera cutánea puede facilitar la sobreinfección. La evolución es oscilante, con periodos de exacerbación y de disminución de los síntomas. En los casos más severos es conveniente el estudio del foco con antibiograma, para tratamiento específico que debe ser sistémico44.
La prevención con calzado holgado, cuidado extremo en la higiene de pies y manos, evitar los microtraumas, podrán ayudar a prevenir esta situación que, una vez que se establece, necesita tratamiento.
La evolución a granuloma piogénico periungueal es muy frecuente, y se manifiesta como un crecimiento anómalo de tejido vascularizado, friable y fácilmente sangrante. No es bien conocida la causa de esta alteración, pero probablemente se deba a una alteración del metabolismo del ácido retinoico inducido por los inhibidores EGFR45.
Una vez establecida la paroniquia puede estar indicada la aplicación de clobetasol 0,05% dos por día. En caso de sobreinfección se aplicará doxiciclina 100 mg 1212 horas durante 6 semanas46 o minociclina 100, 1212 horas 6 semanas, impedirán sepsis y podrán favorecer la cicatrización.
El tratamiento químico con baños de vinagre blanco y agua (1:10), 15 minutos al día, nitrato de plata semanal, ácido tricloroacético, nitrógeno líquido y electrodisección si fuera necesaria, pueden evitar la escisión quirúrgica del tejido de granulación y de la lámina ungueal, que a veces es inevitable (tabla 5).
Mucositis
Las complicaciones orales con estos tratamientos no son frecuentes en monoterapia, pero la asociación con esquemas de quimioterapia o de radioterapia puede potenciar el riesgo de mucositis. Anticuerpos y tci tienen el mismo potencial yatrogénico.
La mucositis puede ser de grado ligero a moderado y suele evolucionar espontáneamente, sin necesitar intervenciones específicas47.
Radiodermitis
La combinación de altas dosis de radioterapia con cetuximab es actualmente la terapéutica indicada en cáncer de cabeza y cuello avanzado, con disminución confirmada de la mortalidad de estos pacientes48. En el primer estudio realizado por Bonner et al.48 no se evidenciaron diferencias significativas en la incidencia y grado de radiodermitis inducida por radiaciones entre el brazo de radioterapia y el brazo de tratamiento concomitante con cetuximab. Sin embargo, nuevos estudios, la experiencia acumulada con un mayor número de tratamientos y un reciente metaanálisis demuestran un riesgo mayor de radiodermitis y mucositis en los pacientes tratados con radioterapia e inhibidores EGFR, así como una mayor intensidad de las lesiones en estos pacientes49. Este efecto es particularmente marcado en la combinación de radioterapia y regímenes con panitumumab y erlotinib49.
Clinicamente, las lesiones de radiodermitis asociadas a inhibidores EGFR se manifiestan desde eritema en los casos más leves, descamación seca o húmeda, hasta necrosis cutánea o ulceración de toda la espesura de la piel con hemorragia espontánea6.
Curiosamente, áreas previamente irradiadas parecen estar protegidas de erupción pápulopustular24,50.
El tratamiento consiste en una técnica radioterápica exquisita para prevención, así como las estrategias habituales de prevención y tratamiento de la erupción pápulopustular, corticoides de moderadaalta potencia, doxiciclina o mi nociclina.
Conclusión
Los nuevos esquemas terapéuticos oncológicos, con la adición de nuevas moléculas, aumentan la sobrevida de los pacientes y no tienen asociada la toxicidad de los citotóxicos clásicos (alopecia, náuseas y vómitos, alteraciones medulares...), sin embargo presentan nuevos patrones de toxicidad, fundamentalmente de tipo cutáneo.
Se trata de toxicidad que hasta ahora era poco conocida y con factores fisiopatológicos relacionados con la inhibición de vías de transmisión de señal que, si bien son fundamentales para el proceso de oncogénesis, también lo son para el correcto funcionalismo del órgano "piel". El bloqueo de estas vías con finalidad de terapéutica oncológica implica el desarrollo de toxicidad cutánea.
No hay hasta el momento grandes estudios aleatorizados ni metaanálisis que nos permitan sacar conclusiones y recomendaciones basadas en la evidencia, pero una revisión de los trabajos publicados hasta ahora permite presentar una serie de orientaciones clínicas y tratamientos que nos permitirán mejorar la calidad de vida de nuestros pacientes.
Agradecimientos
A Diana Soares y Marlene Costa, del Servicio de Investigación del Centro Hospitalar Baixo Vouga, Aveiro.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
Información del artículo
Historia del artículo:
Recibido el 1 de mayo de 2012
Aceptado el 31 de mayo de 2012
Autor para correspondencia.
Correo electrónico: mellidez@gmail.com (J.D. Mellídez).