INTRODUCCIÓN
El descenso en los niveles de estrógenos tras la menopausia conduce a una disminución de la masa ósea con el consiguiente aumento del riesgo de fractura. Asimismo, se conoce el hecho de que la falta de andrógenos conlleva también un descenso en la masa del hueso y un aumento del riesgo de fractura1,2.
El análisis de los resultados obtenidos tras el uso clínico de diversos tipos de fármacos, orientados en un principio a producir un aumento de la densidad mineral ósea (DMO), llevó a la conclusión de que no siempre un mayor aumento de la masa ósea producía la máxima disminución del riesgo de fractura3. Esta circunstancia condujo incluso a reconsiderar la definición oficial de osteoporosis, pasando a tener más importancia el concepto de calidad ósea que el de masa ósea (contenido mineral óseo)4.
De hecho, en la actualidad está universalmente aceptado que la disminución de la fragilidad ósea, es decir, del riesgo de fractura, está asociada al concepto denominado calidad ósea5. La calidad ósea engloba múltiples cualidades del hueso y no sólamente la cantidad de masa ósea. De hecho, dentro de este concepto están incluidas, entre otras propiedades, la geometría, la microarquitectura, la conectividad trabecular, la capacidad de reparación de microfracturas, las propiedades físicas del material óseo y la composición química de la matriz.
Como se ha comentado anteriormente la falta de estrógenos y de andrógenos conduce a un aumento de la fragilidad ósea constituyendo un importante problema de salud pública. Las drogas utilizadas para combatir tanto la osteoporosis postmenopáusica como la debida a la falta de andrógenos, se pueden clasificar en dos grupos principales: los inhibidores de la resorción ósea, como los bifosfonatos y el raloxifeno; y los estimuladores de la formación, como la hormona paratiroidea (PTH).
Cada una de estas estrategias ha originado tratamientos que reducen de modo significativo el riesgo de fractura. Sin embargo, estos fármacos no están completamente exentos de producir efectos potencialmente negativos sobre la calidad del tejido óseo6.
Los objetivos de este trabajo han sido:
1. Estudiar cómo influye la depleción estrogénica o androgénica sobre una serie de parámetros implicados directamente en la calidad del tejido óseo, como son: la tasa de densidad mineral ósea, medida por el método clásico de absorciometría de rayos X de doble energía (DEXA), la microarquitectura ósea, cuantificada a través de técnicas histomorfométricas y las propiedades biomecánicas del hueso, realizando ensayos de torsión. Asimismo, se han analizado las variaciones producidas en el remodelado óseo por la falta de estrógenos y andrógenos; ya que se sabe actualmente que el nivel de remodelado óseo es un proceso que está implicado directamente en la reparación de las microfracturas y en el grado de mineralización del tejido óseo7.
2. Analizar cómo afecta a la calidad ósea el tratamiento intermitente con PTH (1-34) de rata a animales con osteoporosis debida a la falta de estrógenos y andrógenos, tanto a nivel preventivo como curativo.
Este estudio se ha realizado utilizando como modelos experimentales, ampliamente validados, ratas ovariectomizadas y ratas orquidectomizadas8,9.
MATERIAL Y MÉTODO
ANIMALES DE EXPERIMENTACIÓN
Se estudiaron 97 ratas Wistar macho (M) y 92 ratas Wistar hembra (H) de 9 meses de edad y un peso medio de 523 ± 74 g y 354 ± 66 g, respectivamente, que fueron SHAM-operadas (SHAM), orquidectomizadas (OQX) u ovariectomizadas (OVX) y se repartieron en 2 estudios:
1. Estudio A (prevención de la osteopenia inducida por depleción hormonal). Grupo formado por ratas SHAM (SHAMM n = 15 y SHAMH n = 10) tratadas con placebo durante 72 días; ratas castradas (OQX n = 12 y OVX n = 10) tratadas también con placebo durante 72 días, y ratas castradas y tratadas inmediatamente después de la operación con PTH durante 72 días (OQX+PTH n = 13 y OVX+PTH n = 10).
2. Estudio B (tratamiento de la osteopenia establecida). Grupo formado por ratas SHAM sacrificadas 6 meses después de la operación simulada (SHAMM1 n = 11 y SHAMH1 n = 12), ratas sacrificadas 6 meses después de la ovariectomía u orquidectomía (OQX1 n = 11 y OVX1 n = 12), ratas SHAM tratadas con placebo durante 72 días comenzando 6 meses después de la operación simulada (SHAMM2 n = 5 y SHAMH2 n = 16), ratas operadas tratadas con placebo durante 72 días comenzando 6 meses después de la castración (OQX2 n = 15 y OVX2 n = 10), y por último, ratas operadas y tratadas con PTH durante 72 días comenzando el tratamiento 6 meses después de la castración (OQX2+ PTH n = 15 y OVX2 + PTH n = 12).
Para la administración de la PTH se utilizó el fragmento 1-34 de la PTH de rata (SIGMA-ALDRICH, Germany) a una dosis de 4 μg/kg/día. Ésta se diluyó en una solución de ácido acético glacial y albúmina al 0,1% en agua, se procedió a su liofilización y se almacenó a 4 °C hasta el momento de su uso. El día de su utilización, la PTH se disolvió en suero fisiológico y se administró diariamente a las ratas vía subcutánea durante 72 días inmediatamente después de la operación en el caso del estudio A, y 6 meses después de la operación en el caso del estudio B.
Un día después del último día de tratamiento se procedió al sacrificio de las ratas bajo anestesia etérea, por exanguinación mediante punción cardíaca.
La sangre obtenida en el sacrificio de los animales fue centrifugada a 2.500 r.p.m. durante 15 minutos para la obtención de sueros. Estos sueros fueron alicuotados y almacenados a 70 °C hasta su utilización en la determinación de marcadores de remodelado óseo y parámetros bioquímicos.
En este momento se procedió también a la extracción de las dos tibias de las ratas para su posterior uso en los ensayos histomorfométricos.
Las ratas fueron después congeladas a 20 °C hasta el día anterior a la realización de las densitometrías óseas, momento en el cual se descongelaron, manteniéndose en nevera a 4 °C. Cuando los animales estuvieron descongelados se procedió a la extracción del fémur izquierdo y a la realización posterior de la determinación de la masa ósea en dicho fémur. También se extrajo en ese momento el fémur derecho para la posterior determinación de las propiedades biomecánicas del hueso. A continuación, se determinó la DMO en columna lumbar in situ.
DETERMINACIÓN DE LA DENSIDAD MINERAL ÓSEA
Densitometría ósea
Las densitometrías óseas se realizaron en el fémur izquierdo tras su extracción y en la columna lumbar (L2, L3, L4) in situ, mediante DEXA con tecnología HOLOGIC QDR-1000TM, y con un software acoplado para el análisis de huesos pequeños10. Los coeficientes de variación de esta técnica son 0,53-1,2%.
Estudios histomorfométricos
Las tibias fueron aisladas, cortadas longitudinalmente o transversalmente, con una sierra de precisión de diamante (Isomet 1.000) y fijadas con formol neutro durante 10 horas a 4 °C. Después se procedió a realizar secciones de 2,5-4 μm de grosor con un microtomo HM360 microm, con carburo de tungsteno y utilizando cuchillas de diamante (Diatome) de 8 mm.
Se tiñeron en primer lugar con azul de metileno (azur II) para visualizar la morfología general, y después se procedió de diferentes maneras, según el estudio histomorfométrico a realizar.
En las ratas hembra la morfometría ósea (espesor cortical de la tibia) fue realizada mediante tinción de la parte mineral de cortes transversales de la diáfisis tibial con von Kossa, y la microarquitectura en 3D del hueso trabecular (área trabecular aparente) fue estudiada en secciones inorgánicas longitudinales de tibia (0,5 mm) usando un microscopio óptico estereoscópico.
En las ratas macho, para la histomorfometría estática, se tiñó la parte mineral de las secciones longitudinales de hueso con von Kossa, y después, se utilizaron dichas secciones para obtener una imagen en blanco y negro (1 bit), con la que se calculó el volumen trabecular total (BV/TV) mediante un recuento de píxeles con el programa Image J (NIH), así como el espesor trabecular (Tb.Th) y la separación entre trabéculas (Tb.Sp) mediante mediciones directas.
MARCADORES DE REMODELADO ÓSEO
Marcadores de formación ósea
Las determinaciones de osteocalcina (BGP) en suero se realizaron mediante un ensayo inmunorradiométrico (IRMA) comercial específico para BGP de rata (Rat Osteocalcin IRMA kit, Immutopics). Los coeficientes de variación intra e interensayo de este método fueron 2,3% y 4,0%, respectivamente. La sensibilidad de este ensayo fue de 0,01 ng/ml.
La fosfatasa alcalina total (ALP) en suero fue medida mediante la estandarización IFCC, con un autoanalizador Roche modular DDPP. Los coeficientes de variación intra e interensayo de este método fueron 0,67% y 0,67%, respectivamente y la sensibilidad, 1 UI.
Marcadores de resorción ósea
Las determinaciones del telopéptido carboxiterminal del colágeno tipo I (CTX) en suero se realizaron mediante un inmunoensayo (ELISA) comercial específico para CTX de rata (Rat-Laps ELISA, Nordic Bioscience Diagnostics). Los coeficientes de variación intra e interensayo de este método fueron 5,6% y 10,5%, respectivamente. La sensibilidad de este ELISA fue de 2 ng/ml.
Otros parámetros bioquímicos
Las determinaciones de calcio en suero se realizaron por el método de la cresolftaleína-complexona punto final, utilizando un autoanalizador Roche modular DDPP. Los coeficientes de variación intra e interensayo de este método fueron 0,9% y 1,5%, respectivamente y la sensibilidad 0,2 mg/dl.
Las determinaciones de creatinina sérica se analizaron por el método de Jaffé punto final, un método colorimétrico con picrato alcalino, utilizando para ello un autoanalizador Roche modular DDPP. Los coeficientes de variación intra e interensayo fueron de 0,7% y 2,3%, respectivamente y la sensibilidad de 0,1 mg/dl.
Propiedades biomecánicas del hueso
Para estudiar el comportamiento mecánico del hueso de estos animales se realizó un ensayo de torsión a baja velocidad (10°/min) sobre el fémur derecho de cada rata (previa extracción del animal y retirada de tejidos blandos).
Se utilizó una máquina electromecánica Schenk-Trebel modelo RTP 0,6 con indicador digital M 1602, eje de rotación horizontal y capacidad de carga de 0-2 Nm.
Al realizar el test biomecánico de la muestra de hueso se obtenían directamente los siguientes parámetros:
1. El momento torsor (M. torsor) hasta la rotura (Nm).
2. El ángulo girado máximo (ángulo) hasta la rotura (grados).
3. La energía absorbida (E. abs) hasta la rotura (Julios).
4. La rigidez intrínseca (rigidez) del hueso (nm/grados).
En primer lugar se obtiene el momento torsor máximo, representado en la gráfica como la altura máxima de la curva (eje de coordenadas), y la deformación angular correspondiente al valor del momento torsor máximo (eje de abcisas).
La energía absorbida viene determinada por la estructura ósea y se corresponde con el área obtenida bajo la curva. Por último, la rigidez intrínseca del hueso se representa como la pendiente de la curva en la zona elástica (zona intermedia de la curva).
RESULTADOS
CONTENIDO MINERAL ÓSEO (ABSORCIOMETRÍA DE RAYOS X DE DOBLE ENERGÍA E HISTOMORFOMETRÍA)
Hembras
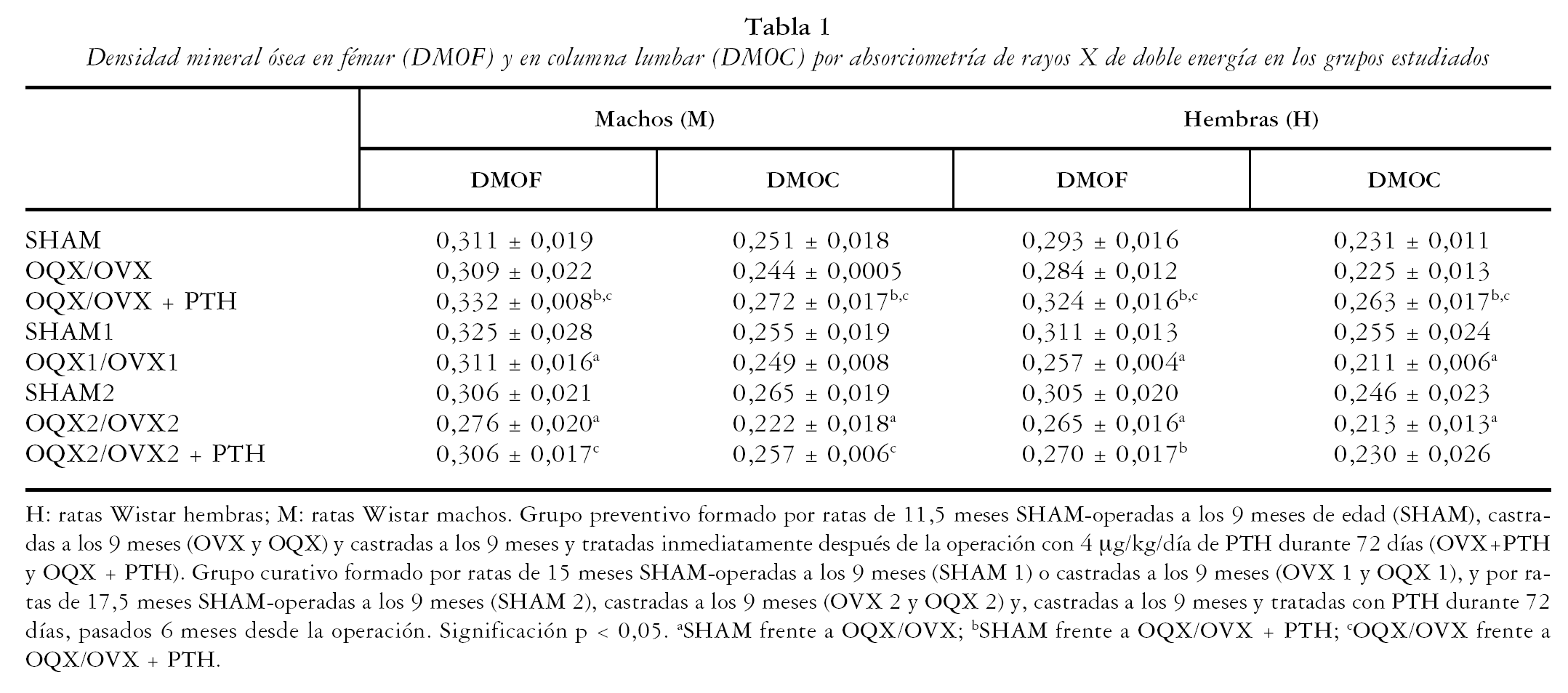
La tabla 1 muestra la DMO en fémur (DMOF) y en columna lumbar (DMOC) por DEXA de los grupos experimentales estudiados. Tras 72 días de OVX no se observaron diferencias significativas ni en la DMO del fémur ni en la de columna. Sin embargo, tanto después de 6 meses (OVX1) como de 8,5 meses (OVX2) desde la operación, se observó un descenso significativo de la DMO tanto en fémur como en columna.
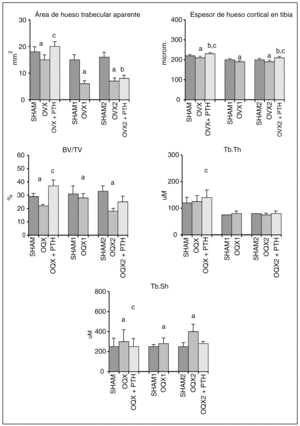
A pesar de no observar cambios en la DMO mediante DEXA, en la figura 1 se pone de manifiesto una disminución del espesor del hueso cortical en la tibia de las ratas ovariectomizadas, estadísticamente significativa tras 72 días de OVX y que se hace aun más pronunciada después de 6 meses (OVX1) y 8,5 meses (OVX2) desde la castración.
Lo mismo ocurre con el área trabecular aparente en la tibia (fig. 1). Ésta desciende significativamente en las ratas a los 72 días de ser operadas (OVX), y desciende aún más después de 6 y 8,5 meses (OVX1 y OVX2).
Fig. 1. Espesor de hueso cortical de la tibia y área trabecular aparente en ratas Wistar hembras (H), y volumen óseo/volumen óseo total (BV/TV), grosor trabecular (Tb.Th) y separación entre trabéculas (Tb.Sp) en ratas Wistar machos (M). Grupo preventivo formado por ratas de 11,5 meses SHAM-operadas a los 9 meses de edad (SHAM), castradas a los 9 meses (OVX y OQX), y castradas a los 9 meses y tratadas inmediatamente después de la operación con 4 μg/kg/día de hormona paratiroidea (PTH) durante 72 días (OVX+PTH y OQX + PTH). Grupo curativo formado por ratas de 15 meses SHAM-operadas a los 9 meses (SHAM 1) o castradas a los 9 meses (OVX 1 y OQX 1), y por ratas de 17,5 meses SHAM-operadas a los 9 meses (SHAM 2), castradas a los 9 meses (OVX 2 y OQX 2) y castradas a los 9 meses y tratadas con PTH durante 72 días, pasados 6 meses desde la operación. (OVX2+PTH y OQX2+PTH) Significación p < 0,05;aSHAM frente a OQX/OVX; bSHAM frente a OQX/OVX + PTH; cOQX/OVX frente a OQX/OVX + PTH.
La administración de PTH inmediatamente después de la ovariectomía durante 72 días (OVX + PTH) produjo un aumento de la DMO tanto femoral como lumbar con respecto a los animales control (SHAM) (tabla 1). Sin embargo, la administración de PTH a las ratas con un descenso significativo de la DMO después de 6 meses de ovariectomía (OVX2 + PTH) no fue capaz de restablecer los niveles normales de DMO ni a nivel femoral ni a nivel lumbar, aunque existe una tendencia al incremento de este parámetro especialmente en columna lumbar.
El tratamiento preventivo con PTH durante 72 días inmediatamente después de la ovariectomía (OVX + PTH) evitó el descenso del espesor del hueso cortical de la tibia produciendo incluso un aumento significativo en este parámetro con respecto a las ratas control (SHAM). Asimismo, el tratamiento con PTH durante 72 días inmediatamente después de la castración (OVX + PTH), evitó el descenso del área trabecular aparente de las ratas ovariectomizadas.
El tratamiento con PTH de las ratas tras 6 meses de ovariectomía (OVX2 + PTH) con una osteopenia establecida consiguió una recuperación del espesor óseo cortical, superando incluso los niveles de las ratas controles (SHAM2), aunque no fue capaz de producir modificaciones sobre el área trabecular aparente.
Machos
Transcurridos 72 días desde la orquidectomía (OQX) no se observaron diferencias significativas en la DMO ni a nivel femoral (DMOF) ni a nivel lumbar (DMOC) (tabla 1). Sin embargo, después de 6 meses de la orquidectomía (OQX1) se observó ya un descenso significativo de la DMO en fémur, aunque no en columna, y a los 8,5 meses desde la castración (OQX2), un descenso significativo de la DMO en fémur y en columna. De manera similar a lo que ocurre en hembras, la osteopenia no es observable mediante DEXA a los 72 días después de la orquidectomía (OQX), pero sin embargo, sí se observa un descenso significativo de los niveles del volumen mineral óseo medido por histomorfometría (BV/TV) (fig. 1). Dicho descenso se mantiene a los 6 meses de la orquidectomía (OQX1) y a los 8,5 meses (OQX2).
En la orquidectomía a todos los tiempos estudiados (OQX, OQX1 y OQX2) se observa una disminución del volumen mineral óseo (BV/TV) seguido de una mayor separación entre trabéculas (Tb.Sp), con un grosor (Tb.Th) conservado de las mismas (fig. 1).
El tratamiento con PTH inmediatamente después de la orquidectomía (OQX + PTH) produjo un aumento de la DMO por encima incluso de las ratas control (SHAM) tanto a nivel femoral como lumbar (tabla 1).
La administración de PTH a ratas que habían desarrollado osteopenia tras 6 meses de orquidectomía (OQX2 + PTH) restauró los niveles de DMO tanto en fémur como en columna lumbar con respecto a las ratas control (SHAM2).
El tratamiento con PTH durante 72 días inmediatamente después de la orquidectomía (OQX + PTH) evitó la desaparición de las trabéculas (Tb.Sp) y mantuvo su grosor (Tb.Th) (fig. 1). La administración de PTH a las ratas osteopénicas tras 6 meses de orquidectomía (OQX2 + PTH) disminuyó la pérdida de trabéculas debida a la orquidectomía produciendo un aumento en el número de las mismas, aunque sin alcanzarse los niveles de las ratas control (SHAM2).
REMODELADO ÓSEO (MARCADORES DE FORMACIÓN: DETERMINACIONES DE OSTEOCALCINA Y FOSFATASA ALCALINA Y DE RESORCIÓN: TELOPÉPTIDO CARBOXITERMINAL DEL COLÁGENO TIPO I)
Hembras
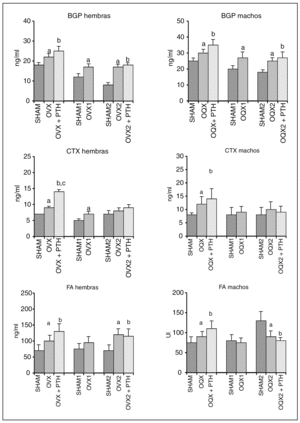
En la figura 2 se observa que la ovariectomía produjo un aumento significativo del remodelado óseo tanto a nivel de resorción (CTX) como de formación (BGP y FA), durante los 72 días inmediatos a la ovariectomía (OVX). Dicho aumento del remodelado se mantuvo a los 6 meses de la operación (OVX1). Después de 8,5 meses de la operación se siguió detectando el aumento del remodelado a nivel de la BGP y la FA, pero no ya a nivel del CTX.
Fig. 2. Osteocalcina en suero (BGP), telopéptido carboxiterminal del colágeno I en suero (CTX) y fosfatasa alcalina (FA) en ratas Wistar hembras (H) y machos (M). Grupo preventivo formado por ratas de 11,5 meses SHAM-operadas a los 9 meses de edad (SHAM), castradas a los 9 meses (OVX y OQX), y castradas a los 9 meses y tratadas inmediatamente después de la operación con 4 μg/kg/día de hormona paratiroidea (PTH) durante 72 días (OVX+PTH y OQX + PTH). Grupo curativo formado por ratas de 15 meses SHAM-operadas a los 9 meses (SHAM 1) o castradas a los 9 meses (OVX 1 y OQX 1), y por ratas de 17,5 meses SHAM-operadas a los 9 meses (SHAM 2), castradas a los 9 meses (OVX 2 y OQX 2) y castradas a los 9 meses y tratadas con PTH durante 72 días, pasados 6 meses desde la operación (OVX2+PTH y OQX2+PTH). Significación p < 0,05;aSHAM frente a OQX/OVX; bSHAM frente a OQX/OVX + PTH; cOQX/OVX frente a OQX/OVX + PTH.
El tratamiento de las ratas con PTH inmediatamente después de la ovariectomía (OVX + PTH) mantuvo los niveles elevados de formación ósea (BGP y FA) producidos por la castración. Estos niveles fueron significativamente superiores a los de las ratas control (SHAM) y con tendencia a ser más elevados incluso que los de las ratas ovariectomizadas no tratadas con PTH (OVX). Los niveles de CTX se mantuvieron significativamente elevados en las ratas ovariectomizadas durante el tratamiento preventivo (OVX), siendo incluso superiores a los de las ratas castradas sin tratamiento (OVX). Sin embargo, la PTH no modificó los valores de este marcador cuando se trataron ratas con osteopenia establecida después de 6 meses desde la ovariectomía (OVX2 + PTH). Los niveles de BGP y FA en este grupo de ratas con osteopenia (OVX2 + PTH) se mantuvieron significativamente elevados respecto de las ratas control (SHAM2).
Machos
Los valores de la figura 2 muestran un aumento significativo del remodelado óseo, tanto a nivel de formación (BGP y FA) como a nivel de resorción (CTX), tras 72 días de realizarse la orquidectomía (OQX) a los animales. Dicho aumento, sin embargo, solamente fue mantenido en el caso de la BGP tras 6 (OQX1) y 8,5 meses (OQX2) desde la operación. El marcador de resorción estudiado (CTX) en ratas operadas durante 6 (OQX1) y 8,5 meses (OQX2), mantuvo unos valores similares a los valores de las ratas control (SHAM1 y SHAM2, respectivamente). Los niveles de FA en ratas orquidectomizadas durante 8,5 meses (OQX2) se encontraban significativamente disminuidos respecto a los de las ratas control (SHAM2); pero eran similares a éstos a los 6 meses de la operación.
El tratamiento con PTH inmediatamente después de la orquidectomía durante 72 días (OQX + PTH), mantuvo los niveles significativamente elevados de remodelado óseo (BGP, FA y CTX) respecto de los valores de las ratas control (SHAM); y con tendencia, aunque no significativa, a ser incluso más elevados que los de las ratas orquidectomizadas sin tratamiento (OQX).
A partir de 6 meses desde la orquidectomía (OQX2 + PTH), sólo continuaron significativamente elevados, por efecto de la PTH, los niveles de los marcadores de formación (BGP y FA) respecto de los de las ratas control (SHAM2), mientras que los niveles del marcador de resorción (CTX) no fueron estadísticamente diferentes.
BIOQUÍMICA (CREATININA Y CALCIO)
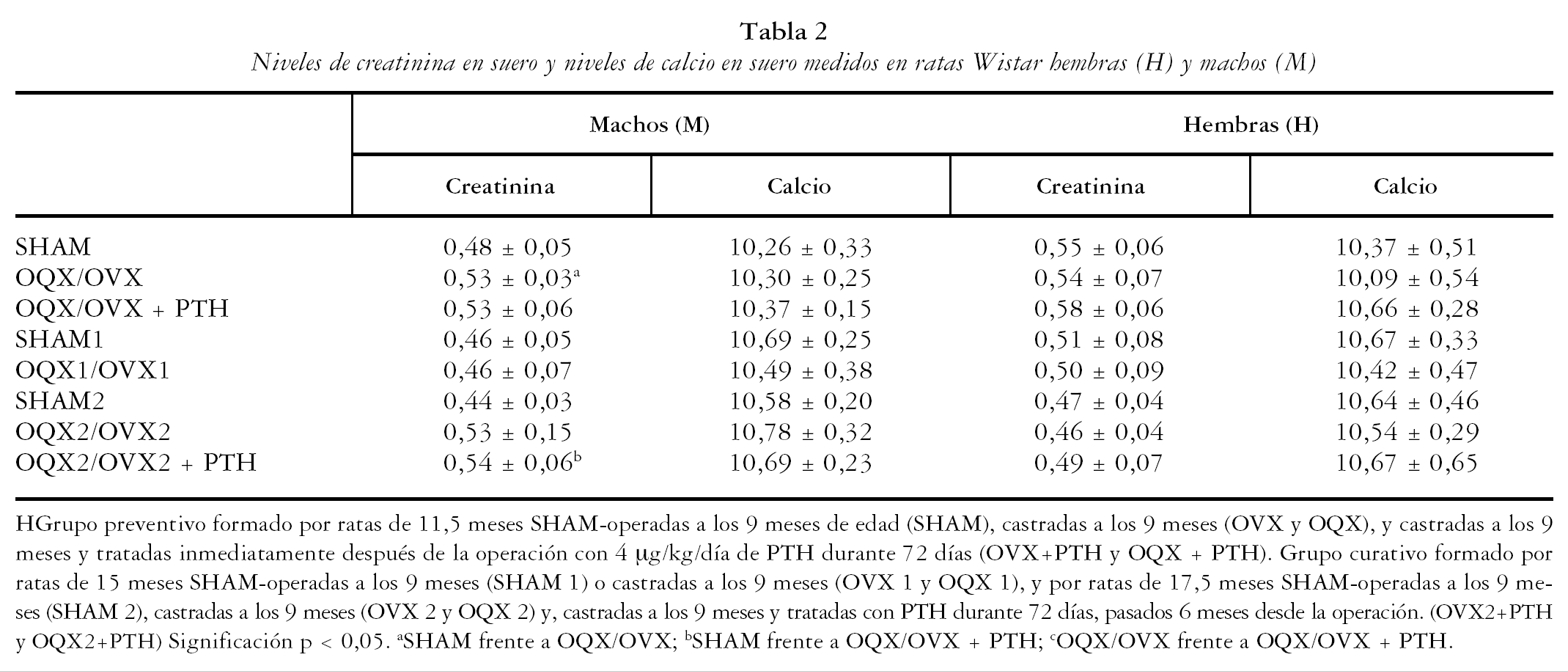
Es interesante destacar que el tratamiento con PTH no afectó a los niveles de creatinina en ninguno de los grupos estudiados y que se mantuvieron los niveles de calcemia (tabla 2).
BIOMECÁNICA
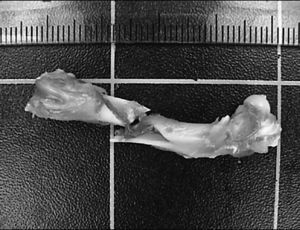
En la determinación de las propiedades mecánicas del hueso se aceptaron para este ensayo aquellos huesos cuyas roturas se produjeron en el tercio central de la diáfisis y con un ángulo aproximado de 45°, como se muestra en la figura 3.
Fig. 3. Ejemplo de ensayo de torsión correcto. La rotura del fémur se produjo en el tercio central de la diáfisis y con un ángulo aproximado de 45°.
Hembras
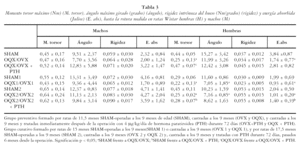
Los resultados obtenidos al realizar los ensayos de torsión (tabla 3) muestran que la ovariectomía produjo una disminución significativa del momento torsor (M. torsor) de las ratas tanto a los 72 días (OVX) como a los 6 (OVX1) y 8,5 (OVX2) meses desde la operación.
Tras 6 meses desde la ovariectomía (OVX1) y tras 8,5 (OVX2); se produjo una disminución del ángulo que necesita ser girado un hueso para que se produzca la rotura (ángulo). Se observó también una tendencia de este descenso a los 72 días de la ovariectomía aunque no llega a ser significativo. Del mismo modo, la cantidad de energía absorbida por el hueso necesaria para producir la rotura (E. abs) sufre un descenso significativo tras la ovariectomía en todos los grupos de ratas estudiados.
La administración de PTH inmediatamente después de la ovariectomía (OVX + PTH) evita la disminución del M. torsor y de la E. abs. Sin embargo, en nuestras condiciones experimentales, tras 6 meses de ovariectomía (OVX2 + PTH), el tratamiento con PTH no es capaz de revertir los efectos producidos por la ovariectomía, ni sobre el M. torsor, ni sobre la E. abs.
Machos
No se observó ninguna diferencia estadísticamente significativa en las propiedades biomecánicas de ninguno de los grupos de ratas estudiados (tabla 3).
DISCUSIÓN
Aunque la PTH induce efectos catabólicos cuando actúa de forma continuada sobre el hueso, está demostrado que es anabólica cuando se administra intermitentemente11.
Generalmente, en los estudios previos en los que se ha utilizado como modelo experimental la rata ovariectomizada u orquidectomizada, partían de ratas más jóvenes que en el presente estudio12-15. En estos trabajos se empleaban animales con una edad media de entre 3 y 6 meses, que son sexualmente maduros, pero aún en crecimiento; sin embargo, en nuestro trabajo hemos partido de ratas de 9 meses de edad, que han finalizado ya su etapa de crecimiento16. La finalidad buscada era asemejar la situación metabólica de estas ratas con la de los humanos que suelen sufrir la osteoporosis postmenopáusica o por depleción androgénica.
En general, en trabajos experimentales previos, las dosis de PTH administradas a los animales son muy elevadas (40 μg/kg, 80 μg/kg)15,17 en comparación con las utilizadas en estudios clínicos, que generalmente no sobrepasan los 2 μg/kg18-21. En nuestro diseño experimental se ha utilizado una dosis de PTH de 4 μg/kg, más cercana a la administrada a humanos. Es interesante también mencionar que en este estudio con ratas se ha utilizado el fragmento de PTH (1-34) de esta especie animal y no la PTH (1-34) humana.
Como era de esperar, la ovariectomía produjo un aumento significativo del remodelado tanto a nivel de resorción como a nivel de formación ósea a todos los tiempos estudiados. Este hecho está ampliamente documentado tanto en estudios en humanos como en modelos experimentales animales8,22,23. Se conoce que la falta de estrógenos actúa directamente aumentando la actividad osteoclástica, lo que provoca un aumento asociado de la actividad osteoblástica, pero con un balance desequilibrado y negativo con respecto a la integridad del hueso24. Las variaciones del remodelado óseo afectan directamente a la calidad del hueso. El incremento de la resorción con respecto a la formación, por una parte conduce a un descenso de la DMO, lo que implica una mayor fragilidad. Por otra parte, este aumento del remodelado podría ser positivo en cuanto a que aumentaría la capacidad de reparación de microfracturas, pero esto sólo sucedería si la actividad formadora y destructiva estuvieran equilibradas, cosa que no ocurre en este caso.
La depleción estrogénica debida a la ovariectomía provocó, como consecuencia directa del desequilibrio en el remodelado, alteraciones en la integridad del hueso, que aunque después de 72 días de la cirugía no fueron detectables mediante la técnica de DEXA, sí lo fueron mediante estudios histomorfométricos. En estudios previos ya se había observado que el volumen trabecular (BV/TV) y el área trabecular son parámetros más sensibles que la densidad mineral ósea9. Sin embargo, al cabo de 6 meses de ovariectomía, la osteopenia es mucho más pronunciada y ya es observable tanto a nivel de DEXA como de análisis histomorfométricos. Lo mismo sucede tras 8,5 meses desde la intervención quirúrgica.
En nuestro estudio, en las ratas ovariectomizadas disminuyó el área trabecular aparente, llegando a observarse un descenso drástico a partir de los 6 meses después de la operación (fig. 4). Por otra parte, también se observa una disminución significativa, a todos los tiempos estudiados, del espesor cortical de la tibia. Sería por tanto lógico pensar que las cualidades estructurales anteriores provocaran unas diferencias en las propiedades biomecánicas de las ratas ovariectomizadas, que es lo mismo que decir en su riesgo de fractura (o fragilidad). En efecto, como se puede ver en la tabla 3, el momento torsor, es decir, la fuerza que es necesario aplicar para conseguir romper el hueso, desciende significativamente tras 72 días y tras 6 y 8,5 meses desde la ovariectomía. De la misma manera, la energía que absorbe el hueso de estas ratas hasta romperse es también menor a los 72 días después de la castración y aún más pequeña tras 6 y 8,5 meses. Es importante destacar que en este trabajo se han estudiado sólamente las propiedades biomecánicas realizando ensayos de torsión. Otros autores como Stewart et al12 observaron variaciones semejantes tras la ovariectomía, realizando ensayos de flexión.
Fig. 4. Microarquitectura en 3D del hueso trabecular de la tibia (área trabecular aparente) de ratas Wistar hembras. OVX: ovariectomía; PTH: hormona paratiroidea. (Ver detalles en materiales y métodos).
El tratamiento con PTH (1-34) de rata mantenido durante los 72 días siguientes a la ovariectomía, no causó cambios en los elevados niveles de recambio óseo; ni a nivel de formación (BGP y FA) ni a nivel de resorción (CTX). Este hecho, en principio, sería positivo con respecto a la capacidad de reparación de las microfracturas. Pero, como se comentó anteriormente, esto sólo ocurriría si existiera un equilibrio y una distribución adecuados de las unidades activas de remodelado. A partir de los resultados numéricos obtenidos de los marcadores de resorción y formación en las ratas ovariectomizadas y en las ovariectomizadas tratadas con PTH es imposible deducir si el incremento en el remodelado observado en ambos casos tiene un balance positivo o negativo. Sólo somos capaces de apreciar su aumento neto. Sin embargo, al analizar otros parámetros en las ratas tratadas con PTH como los histomorfométricos, queda claro en este caso que la formación está superando a la resorción con lo que se podría concluir que el balance es claramente positivo a favor de la formación de masa ósea ([fig. 4] estudio preventivo), impidiéndose, por acción de la PTH, la pérdida del entramado trabecular del hueso, así como manteniendo el espesor de la capa cortical de la tibia.
Es decir, la administración de PTH (1-34) de rata inmediatamente después de la ovariectomía ha impedido que la falta de estrógenos afectara a los parámetros de calidad ósea estudiados, lo que se ha traducido también en un mantenimiento de las propiedades biomecánicas del hueso.
Nuestros resultados coinciden con los obtenidos por Sato et al25, que administrando 8 y 40 µg/kg/día de PTH a ratas Sprague-Dawley de 9 meses de edad, ovariectomizadas y tratadas inmediatamente después de la operación durante 6 meses, logran evitar el efecto negativo producido por la ovariectomía sobre la estructura trabecular ósea y sobre las propiedades biomecánicas.
Una situación diferente se presenta partiendo de ratas francamente osteopénicas (después de 6 meses de ovariectomía) a las que se pretende curar tratándolas con PTH. En este caso se sigue observando una alta tasa de remodelado, lo cual es lógico teniendo en cuenta que la PTH es una sustancia anabólica cuando es administrada de forma intermitente. Sin embargo, con la dosis administrada en este trabajo, la PTH no es capaz de revertir los efectos producidos por la ovariectomía, ni a nivel de densitometría, ni de área trabecular aparente. En un trabajo anterior, realizado por Stewart et al12, se consiguió recuperar este parámetro histomorfométrico en ratas ovariectomizadas a los 5 meses y tratadas con PTH un mes después de la operación durante 6 meses. De hecho, después de este tiempo de tratamiento, el área trabecular de las ratas tratadas con PTH era incluso significativamente superior al de las ratas intactas. La diferencia entre los resultados de estos autores y los nuestros se deben posiblemente a que la dosis de PTH empleada en su estudio (40 μg/kg/día) era 10 veces mayor a la utilizada en el nuestro (4 μg/kg/día). De hecho, la dosis de PTH administrada parece ser un factor crucial. En efecto, en otro trabajo, realizado por Tsuchida et al26, en el cual utilizaron una dosis de PTH de 6 μg/kg/día, se observó un incremento en la conectividad trabecular con respecto a las ratas ovariectomizadas sin tratar, aunque sin llegar a recuperar los niveles de las ratas control. Por otra parte, otro factor que parece ser clave es el momento de inicio del tratamiento. En el trabajo de Stewart12 se comenzó el tratamiento con PTH un mes después de realizarse la castración, mientras que en nuestro trabajo las ratas permanecieron 6 meses ovariectomizadas, con lo que partíamos de una situación de osteopenia mucho más marcada. En el trabajo de Tsuchida et al26 los resultados mostraron que la recuperación de la conectividad trabecular al tratar ratas ovariectomizadas con PTH, era menor si el tratamiento se iniciaba tres meses después de la operación que si se iniciaba un mes después. Estos hallazgos condujeron a los autores a sugerir que debía existir un límite tras la depleción hormonal a partir del cual la conectividad trabecular no se recupera después de la administración de PTH; es decir, que el retraso en el tratamiento con PTH puede llevar a la no recuperación de la conectividad trabecular.
En nuestro trabajo, a pesar de que el tratamiento con este fármaco no produjo cambios en la conectividad trabecular, sí consiguió aumentar significativamente el espesor del hueso cortical de la tibia. Sin embargo, esto no evitó el descenso en el momento torsor y en la energía absorbida observados en las ratas tratadas que eran semejantes a los de las ratas ovariectomizadas sin tratar con PTH. Este hecho se debe posiblemente a que la resistencia ósea se ve más afectada por cambios producidos en la conectividad trabecular (área trabecular aparente), que por cambios en el espesor del hueso cortical27.
Nuestros resultados sugieren, por tanto, que la dosis de PTH utilizada es suficiente para prevenir la pérdida de calidad ósea tras la ovariectomía, pero no lo es para recuperar las propiedades de un hueso intensamente afectado por la falta de estrógenos.
A los setenta y dos días tras la orquidectomía en las ratas macho se observó un aumento significativo del remodelado óseo, tanto a nivel de formación ósea (BGP y FA) como de resorción (CTX). Después de 6 meses y 8,5 meses desde que fueron operadas se siguió manteniendo el nivel elevado de BGP, con niveles normales de CTX y niveles significativamente disminuidos de FA. Esto podría deberse a dos causas: por un lado, que la BGP sea un marcador de remodelado óseo más sensible que el CTX para detectar los cambios producidos tras la orquidectomía; o bien, que el aumento de la resorción ósea sea mayor en el período inmediato a la orquidectomía y que se estabilice tras varios meses de depleción androgénica. Con respecto a los bajos niveles de FA, no se han tenido en cuenta debido a la poca especificidad y sensibilidad de este marcador con respecto a la BGP.
El desequilibrio en el remodelado debido a la falta de andrógenos, de la misma manera que en las hembras, produjo a los 72 días desde la orquidectomía un hueso marcadamente osteopénico, con unos valores de BV/TV significativamente menores que los de las ratas controles, y que se mantuvieron a los 6 y 8,5 meses desde la cirugía. Es interesante destacar que el área de hueso trabecular aparente en las ratas ovariectomizadas era significativamente menor tras 6 y 8,5 meses que tras 72 días tras la ovariectomía; sin embargo, en el caso de los machos, la pérdida neta de trabéculas con respecto a las ratas SHAM al cabo de 72 días es similar a la observada tras 6 y 8,5 meses desde la orquidectomía. Esto parece indicar que la depleción androgénica produce una pérdida importante de volumen trabecular óseo en un primer momento y que luego se estabiliza, mientras que en las hembras, la pérdida de estrógenos produce un descenso neto del volumen trabecular óseo, respecto de las ratas SHAM, muy significativo, que va aumentando en gravedad y sin estabilizarse con el paso del tiempo.
En todos los casos estudiados, y a partir de los datos de espesor trabecular (Tb.Th) y separación entre trabéculas (Tb.Sp), se deduce que la disminución del volumen trabecular óseo (BV/TV) se debe a una mayor separación entre trabéculas, pero con un grosor conservado de las mismas.
Del mismo modo que en las hembras, el descenso en la DMO medida por DEXA, tanto en fémur como en columna, no es observable tras 72 días de orquidectomía, aunque sí lo es tras 6 y 8,5 meses.
En el caso de la orquidectomía, y al contrario de lo que ocurre a los mismos tiempos y misma edad en las ratas ovariectomizadas, la pérdida de material óseo no provocó como consecuencia variaciones en las propiedades biomecánicas analizadas en este estudio, indicando alteraciones menores de la calidad ósea que el caso de la pérdida de estrógenos. Es difícil concluir si estas variaciones entre la ovariectomía y la orquidectomía se deben a diferencias en el modo en que se afecta el remodelado óseo, o bien, a otra serie de factores intrínsecos ligados al sexo, que hacen que el hueso de los machos esté mejor defendido frente a una pérdida de masa ósea y su consecuente aumento en el riesgo de fractura, que el de las hembras. Estas razones podrían deberse a diferencias en el tamaño, en la geometría o en la composición de la matriz. De hecho, en condiciones basales y partiendo de la misma edad, las ratas macho tienen una DMO mayor que las ratas hembra.
El tratamiento con PTH (1-34) inmediatamente después de la orquidectomía no produjo variaciones significativas en los niveles incrementados del remodelado observados en las ratas tratadas en relación con las ratas orquidectomizadas sin tratamiento, ni en los marcadores de formación (BGP y FA), ni en los de resorción (CTX). Sin embargo, y al igual que se observó en el tratamiento preventivo de la ovariectomía, es necesario analizar los resultados obtenidos en la histomorfometría para poder deducir el balance positivo del remodelado tras el tratamiento con PTH. De hecho, el tratamiento con esta hormona tras la ovariectomía evitó, de igual modo que en las hembras, la pérdida de trabéculas óseas. Más aún, las ratas orquidectomizadas tratadas inmediatamente con PTH llegaron a presentar, al cabo de los 72 días de tratamiento, unos niveles de DMO en fémur y en columna mayores que los de las ratas intactas de la misma edad.
El efecto del tratamiento preventivo con PTH consistió fundamentalmente en la conservación del número de trabéculas existiendo una tendencia no significativa al engrosamiento de las mismas. Estas acciones sobre la calidad ósea producidas por la PTH no causaron ninguna diferencia en las propiedades biomecánicas del hueso estudiadas en este trabajo, lo que indica ausencia de posibles efectos negativos sobre la fragilidad ósea.
Cuando se trataron con PTH las ratas orquidectomizadas que habían alcanzado unos niveles significativos de osteopenia, 6 meses después de la operación, se mantuvieron los valores elevados de BGP, y los valores normales de CTX. El tratamiento con PTH a las ratas operadas se tradujo, en este caso, en un aumento del grosor trabecular (Tb.Th) en el hueso hasta niveles que tienden a ser suprafisiológicos, aunque no de forma significativa, y a una recuperación parcial, sin ser significativa tampoco, del número de trabéculas (Tb.Sp). En un trabajo realizado en el 2005, Gabet et al15 observaron también mediante análisis de la tibia por microtomografía computarizada (µTC) un incremento suprafisiológico del espesor trabecular y una marcada, aunque incompleta, restauración del número de trabéculas al tratar con una dosis de 80 μg/kg/día a ratas de 13 semanas de edad, orquidectomizadas durante 6 semanas y tratadas con PTH durante otras 6 semanas. En otro estudio realizado por Oxlund et al28 con ratas macho de 24 meses de edad sanas, con una osteopenia muy grave debida a su avanzada edad, se observó que el tratamiento con PTH (62,5 μg/kg/día) durante 56 días, daba como resultado la formación, muy significativa estadísticamente, de hueso trabecular nuevo (BV/TV), tanto en su número (Tb.Sp) como en su grosor (Tb.Th).
En el caso del tratamiento de ratas ovariectomizadas, el tratamiento con PTH en condiciones similares sólo logró restaurar la DMO en fémur, pero no en columna lumbar. Posiblemente porque en el caso de las hembras no hubo recuperación alguna del área trabecular aparente, observándose únicamente una recuperación del espesor cortical tras el tratamiento.
Al igual que en el caso del tratamiento preventivo de la orquidectomía, el curativo de la osteopenia de las ratas orquidectomizadas durante 6 meses no produjo ningún cambio en las propiedades biomecánicas después del ensayo de torsión del fémur de estos animales.
Los resultados de este trabajo sugieren que esta dosis de PTH es suficiente tanto para impedir el desarrollo de osteopenia después de la orquidectomía como para revertir casi completamente (no se recupera ni el BV/TV, ni el número de trabéculas) los efectos causados por la falta de andrógenos.
Es importante en este punto destacar el hecho de que la dosis de PTH utilizada en este trabajo, como hemos mencionado anteriormente, menor que la utilizada habitualmente en otros estudios experimentales, no provocó en ningún caso estudiado variaciones en la determinación de creatinina sérica, indicando una correcta función renal en los animales. Del mismo modo, no produjo en ningún caso hipercalcemia en las ratas que recibieron tratamiento con PTH. Autores anteriores observaron hipercalcemia en las ratas bajo tratamiento con PTH, así como en estudios clínicos29,30. Dado que el grado de calcemia es uno de los factores determinantes del grado de mineralización del hueso, un exceso de calcio podría producir un aumento de la rigidez del hueso, lo que constituiría un factor negativo sobre la fragilidad. Como puede observarse en nuestros resultados no hemos encontrado diferencias significativas en este parámetro en ninguno de los grupos estudiados.
En conclusión, los resultados obtenidos en este trabajo apoyan los obtenidos en trabajos previos en el sentido de que tanto la ovariectomía como la orquidectomía producen alteraciones significativas sobre la calidad de hueso al nivel de remodelado, estructura trabecular y densidad mineral ósea. Sin embargo, en unas condiciones similares de edad y de tiempo tras la depleción de hormonas sexuales, estos cambios provocan variaciones significativas en propiedades biomecánicas del fémur de las ratas hembra, pero no tienen consecuencias sobre el fémur de las ratas macho, indicando que la pérdida estrogénica tiene consecuencias más graves sobre la calidad del hueso que la falta de andrógenos. Una dosis de PTH de 4 μg/kg/día administrada durante 72 días a ratas de 9 meses de edad inmediatamente después de la castración, es capaz de evitar los efectos negativos producidos por la ovariectomía y por la orquidectomía sobre la calidad ósea. Sin embargo, la misma dosis administrada a animales con la misma edad inicial y una marcada osteopenia tras 6 meses de ovariectomía u orquidectomía, sólo es capaz de revertir los efectos sobre la integridad del hueso en el caso de las ratas macho, y de modo parcial. Estos resultados sugieren que es posible que exista un límite en cuanto a pérdida de integridad ósea en que el retraso en el tratamiento con PTH impide la recuperación de la conectividad trabecular, aunque no puede descartarse la posibilidad de obtener mejores resultados con dosis mayores y durante más tiempo de tratamiento.
Esta misma dosis de PTH, además, no produce efectos negativos en la calcemia ni en la rigidez intrínseca.
Aunque no se puede realizar una extrapolación directa de los resultados obtenidos en ratas a los humanos, estos modelos experimentales utilizados permiten profundizar en los mecanismos de degradación de la calidad ósea que se producen tras la depleción de hormonas sexuales, así como en la capacidad de reparación de estos desórdenes mediante el tratamiento con PTH.
AGRADECIMIENTOS
Agradecemos la ayuda de Pilar Manzano, Juana de la Cruz y Mª Luisa Valbuena, del Animalario de la Fundación Jiménez Díaz, en el cuidado y manejo de las ratas.
*Este trabajo ha sido financiado con la ayuda de los Fondos de investigación sanitaria (FIS) PI02/0646 del Instituto de Salud Carlos III de Madrid.
Correspondencia: C. de la Piedra Gordo.
Fundación Jiménez Díaz-ute.
Av. de los Reyes Católicos, 2.
28040 Madrid. España.
Correo electrónico: cpiedra@fjd.es