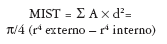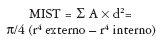Hoy en día se considera que la resistencia ósea, entendiendo como tal la fuerza necesaria para desencadenar el fracaso biomecánico de un hueso, es el resultado de la integración de dos variables, la cantidad y la calidad ósea, factores dependientes a su vez del remodelado óseo. Mientras la cantidad de hueso depende directamente de su densidad mineral, la calidad del mismo depende de variables tales como la estructuración jerárquica y la composición química del material que lo forma. Cada uno de estos determinantes primarios de la resistencia ósea comprende a su vez una serie de determinantes secundarios, responsables directos de alguna de las propiedades biomecánicas óseas específicas. En conjunto, determinantes primarios y secundarios ayudan a establecer un hueso sano, resistente y biomecánicamente competente, mientras que sus alteraciones son responsables del desarrollo de osteopatías fragilizantes, procesos fisiopatológicos que incrementan el riesgo de fractura.
INTRODUCCION
A diferencia de otros profesionales de la medicina que también tienen al hueso y a la patología ósea dentro del contenido de su especialidad, los cirujanos ortopédicos destinamos gran parte de nuestra formación y vida profesional al diagnóstico y tratamiento de las fracturas, es decir, al estudio de las causas y consecuencias del fracaso biomecánico del mismo. Bajo este prisma profesional, consideramos que sólo se puede comprender la fisiopatología de dichos fracasos cuando se es capaz de ver al hueso sano como un órgano-tejido vivo dotado de una composición química, una estructura jerarquizada y un sistema de modulación estructural responsables de sus propiedades biomecánicas y de su resistencia. Esta perspectiva mecanicista del hueso, mucho más traumatológica que otras aproximaciones, nos ayuda igualmente a entender cuáles son las alteraciones que se producen y lo que es necesario corregir en un esqueleto afecto de una enfermedad ósea fragilizante1, de igual manera que nos facilita la comprensión de la eficacia antifractura de ciertos fármacos y los fundamentos de alguno de los procedimientos quirúrgicos de osteosíntesis.
A lo largo de esta revisión intentaremos analizar cuáles son los principios de esta perspectiva, centrando nuestro interés en el estudio de los factores determinantes de la resistencia ósea.
JERARQUIZACION DE LA ESTRUCTURA ÓSEA
NIVELES ESTRUCTURALES OSEOS
El hueso está formado básicamente por una matriz orgánica mineralizada de alta complejidad, viva y dinámica, jerarquizada estructuralmente en tres niveles diferentes: el macro, el micro y el ultraestructural.
El nivel macroestructural o macroarquitectural define las características estructurales del hueso en su conjunto y permite diferenciar a éstos, además de por sus características de forma, tamaño y geometría, en dos subtipos tisulares óseos con estructura y comportamiento biomecánico absolutamente diferente: el hueso cortical y el trabecular.
Debido a que la macroestructura de un hueso está relacionada con sus propiedades biomecánicas2, numerosos autores, durante esta última década, han analizado en diferentes regiones anatómicas, y mediante radiografía convencional simple y digitalizada3, absorciometría por rayos X de doble energía (DEXA)4 o tomografía computarizada (TC)5,6, las características morfológicas de los huesos y su correlación con dichas propiedades. La TC, y particularmente la TC cuantitativa volumétrica (vQ-TC), es la única técnica que además de aportar datos sobre la macroestructura de un hueso, permite de manera precisa y específica diferenciar in vivo el hueso trabecular y el cortical en cualquier localización del esqueleto5,6.
El nivel microestructural o microarquitectural describe al tejido óseo como la resultante de la distribución espacial de los materiales que lo componen. Así, el hueso cortical se presenta como una estructura compacta de distribución lamelar, que aporta a la unidad ósea un excelente armazón. En cambio, el hueso trabecular, con una estructura mineralizada tipo panal, formada por tubos y placas interconectadas entre sí y con la superficie endostal cortical, se comporta de manera semejante a un conjunto de muelles capaces de deformarse almacenando energía. Este tipo de arquitectura proporciona una gran rigidez al armazón cortical, lo que permite a la unidad ósea adaptarse a sus requerimientos biomecánicos7.
Una serie de técnicas de imagen, entre las que se encuentran la radiografía convencional, la macrorradiografía digitalizada, la TC de alta resolución (TC-AR) y la resonancia magnética nuclear de alta resolución (RMN-AR), son capaces de evaluar de forma no invasiva la microestructura del hueso trabecular. En la actualidad, aunque con métodos de análisis textural de la imagen radiográfica digitalizada, como el análisis fractal, se pueden obtener de manera accesible y con mínima exposición a radiaciones ionizantes una aproximación a dicha microestructura8, los mejores resultados tanto in vivo como in vitro se obtienen con la TC-AR9,10. La micro tomografía computarizada (µ-TC) y la histomorfometría ósea en 2D y 3D son técnicas que permiten analizar igualmente una serie de parámetros microestructurales, todos ellos determinantes de las propiedades biomecánicas del hueso (distribución espacial, tamaño, grosor, separación y conectividad trabecular).
El nivel ultraestructural describe la composición y arquitectura de la red molecular ósea. Esta red está compuesta fundamentalmente por un 80% de colágeno tipo I dispuesto en fibras (matriz celular) y un 20% de componentes inorgánicos (matriz mineral), entre los que destacan el calcio, el fosfato y el carbonato, en proporción 10:6:1. Estos componentes inorgánicos se encuentran ordenados en forma de cristales de hidroxiapatita (HA) y de fosfato cálcico amorfo.
Las técnicas de análisis ultraestructural óseo más utilizadas hoy en día son la espectroscopia de infrarrojos mediante transformada de Fourier (FT-IR) y la emergente microespectroscopia Raman, técnicas que sólo se pueden emplear para el análisis in vitro de dicha ultraestructura11,12 (fig. 1).
Fig. 1. Análisis de composición química ósea mediante microespectroscopia Raman.
Estos niveles de jerarquización permiten al hueso acometer sus tres funciones fundamentales: dotar al organismo de una estructura rígida y articulada que facilite al mismo tiempo el sostén y la locomoción (integridad mecánica), la protección de órganos esenciales y blindaje de la médula ósea y la reserva de minerales esenciales para el metabolismo.
Desde un punto de vista fisiopatológico, el fracaso de dicha integridad mecánica supone la existencia de una serie de alteraciones en las propiedades estructurales de cada uno de los niveles de jerarquización ósea, asociados a cambios más o menos llamativos en la composición química del mismo.
PROCESOS DE TRANSFORMACION DE LA ESTRUCTURA OSEA
Cada uno de los mencionados niveles de jerarquización sufren, a lo largo de la vida, diferentes procesos de transformación modulados por factores de tipo hormonal y por las cargas mecánicas que el hueso recibe, actuando para ello como efectores las distintas subpoblaciones celulares óseas: células de revestimiento, osteoclastos, osteoblastos, osteocitos y sus precursores.
En general, la transformación del hueso como órgano y tejido vivo involucra a tres procesos diferentes: crecimiento, modelado y remodelado óseo. Se denomina crecimiento al proceso de alargamiento del esqueleto que ocurre durante la infancia y juventud, y que dura hasta el cierre de las epífisis. El proceso de modelado está relacionado con la expansión transversal del hueso y la adquisición de su forma exterior durante la etapa de crecimiento. El remodelado óseo es el mecanismo por el cual el hueso adulto se renueva para mantener intacta su competencia estructural y biomecánica, evitando la acumulación de microlesiones causadas por la fatiga del material. Como consecuencia de esta renovación, el remodelado óseo no solamente asegura un abastecimiento de hueso nuevo y de baja densidad mineral, sino que contribuye a la homeostasis del calcio7.
La remodelación ósea comienza con la activación de una unidad básica multicelular (UBM) como respuesta a distintos estímulos (carga mecánica, fatiga material, etc.). Esta activación produce en ella un aumento de la actividad metabólica, con liberación de enzimas proteolíticas que dejan expuestas sustancias quimiotácticas (colágeno tipo I, osteonectina, etc.) encargadas de reclutar a células mononucleares precursoras de los osteoclastos. Generados y activados éstos, los osteoclastos comienzan a erosionar el hueso (fase de resorción), lo que da lugar, en el hueso cortical, a un túnel denominado "cono penetrante" y, en el hueso trabecular, a una zanja llamada "laguna de Howship". Esta fase dura aproximadamente tres semanas y durante este período la UBM prolonga su desplazamiento en las tres direcciones del espacio. Finalizada la fase de resorción, los osteoclastos son reemplazados por preosteoblastos y por células mononucleares, que depositan sobre la cavidad formada una capa de cemento. Esta fase, denominada de inversión, no del todo conocida hasta el momento, dura alrededor de dos semanas y permite el equilibrio entre resorción y formación ósea. Finalmente, comienza la fase de formación, donde los osteoblastos sintetizan la matriz osteoide. Coexistiendo con este proceso se inicia la fase de mineralización primaria de dicha matriz, de manera que el hueso recién formado va aumentando progresivamente su densidad mineral. Todo este ciclo completo de remodelación ósea dura entre 4 y 8 meses7. La fase de mineralización secundaria, más lenta y gradual que la primaria, puede prolongarse 6 años o más7.
Analizados los niveles jerárquicos y los procesos de transformación estructural del hueso, revisemos cuáles son los elementos que tanto a nivel general como particular actúan como factores determinantes de la resistencia ósea.
FACTORES DETERMINANTES DE LA RESISTENCIA OSEA
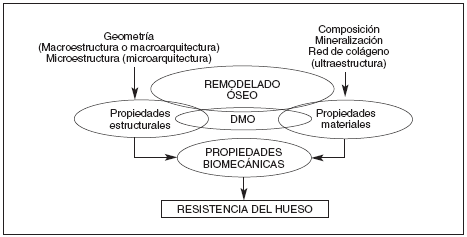
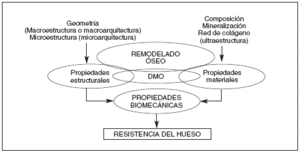
Denominamos resistencia ósea a la fuerza necesaria para desencadenar bajo unas condiciones específicas de carga, el fracaso biomecánico del hueso4. De manera general, este fracaso se produce cuando la concentración de fuerzas que actúan sobre un hueso sobrepasa su capacidad local para contrarrestarlas. Y aunque se sabe que existen varios factores responsables de esta capacidad, hoy en día se considera que la resistencia ósea depende básicamente de la integración entre dos variables: la cantidad y la calidad ósea13. Mientras que la cantidad es responsable, in vitro, del 60% al 80% de la resistencia biomecánica del hueso, la calidad ósea, como variable en general, es responsable del 20% al 40% restante14-16. Pero si bien la cantidad de hueso depende directamente de su densidad mineral (DMO), la calidad del mismo depende de variables tales como la macroestructura, la microestructura y la ultraestructura-composición (composición química, mineralización de la matriz y distribución de ambas), propiedades que, al igual que la DMO, dependen en última instancia del remodelado óseo. Desde el punto de vista de resistencia, la composición orgánica y mineral de la matriz, conjuntamente con su organización ultraestructual, determinan las propiedades materiales del hueso, mientras que los niveles macro y microestructurales determinan las propiedades estructurales del mismo (fig. 2).
Fig. 2. Factores determinantes de la resistencia ósea. DMO: densidad mineral ósea.
LA CANTIDAD OSEA
La cantidad de mineral óseo presente en el esqueleto depende básicamente de la cantidad adquirida, a modo de reserva ósea, durante la fase de desarrollo y maduración esquelética. Esta cantidad alcanza su valor máximo (pico de masa ósea) en la edad adulta, alrededor de los 35 años, siendo de un cuarto a un tercio mayor en el hombre que en la mujer. Factores genéticos (raza blanca caucásica), nutricionales (malnutrición, déficit de calcio y vitamina D, etc.), ambientales (mínima actividad física diaria o inmovilización, tabaquismo, etc.) y factores hormonales (menarquia tardía, insuficiencia gonadal primaria o secundaria, menopausia precoz, etc.) son factores que influyen negativamente en la consecución de una adecuada reserva ósea7.
Alcanzado el pico de masa ósea, comienza casi inmediatamente la pérdida de hueso cortical en ambos sexos, a la que se va añadiendo progresivamente una reducción de la masa ósea trabecular, primero lenta (fase de pérdida lenta) y después más rápida (fase de pérdida rápida), sobre todo en mujeres a partir de los 45-50 años. Esta pérdida de DMO en las mujeres se debe fundamentalmente al aumento de la reabsorción ósea inducida por el déficit estrogénico posmenopáusico, lo que determina una tasa promedio de pérdida del 10% por década hasta los 75 años, edad a partir de la cual se estabiliza, con una tasa de pérdida del 3% por década (fase de pérdida continua)7. Sin embargo, en los hombres sanos, la pérdida de DMO parece ser consecuencia más de una disminución de la formación que de un aumento en la resorción ósea, razón por la cual la tasa de pérdida suele ser baja, probablemente entre un 3% y un 5% por década, lo que explicaría en parte la menor incidencia de fracturas osteoporóticas en los hombres7.
Desde el punto de vista biomecánico, la importancia del descenso de DMO parece clara si tenemos en cuenta que la resistencia a la compresión del hueso trabecular es proporcional al cuadrado de la DMO, por lo que disminuciones comparativamente pequeñas de ésta estarían asociadas a decrementos significativos de la resistencia ósea7. In vitro, tanto para
fémur proximal como para columna lumbar, cuanto mayor es la DMO mayor es la rigidez del hueso y, por tanto, la tensión máxima que éste es capaz de tolerar antes de fracturarse17,18. Sin embargo, in vivo, una alta DMO no implica necesariamente una mayor competencia biomecánica, lo que verificaría el hecho de que existen factores independientes a
la DMO relacionados con la resistencia ósea19.
La alta precisión alcanzada con las técnicas densitométricas de medición de masa ósea (DEXA, Q-TC) ha permitido, por un lado, establecer el umbral diagnóstico de la osteoporosis7, y por otro, constatar que la DMO, además de disminuir con la edad20, es el factor de riesgo más importante para fracturas vertebrales y no vertebrales por fragilidad21,22.
Pero, como comentábamos anteriormente, la correlación in vivo entre DMO y resistencia ósea no es siempre lineal, existiendo pacientes con fractura típica por fragilidad con valores de DMO en intervalo no osteoporótico. Igualmente, la reducción de fracturas vertebrales tras la administración de fármacos antirresortivos no es directamente proporcional a la ganancia de masa ósea, habiéndose demostrado, mediante análisis de regresión, que sólo una pequeña fracción del porcentaje de disminución del riesgo de fractura tras este tipo de tratamientos puede ser atribuido al incremento de DMO23.
Por ello si el riesgo de fracturas o la eficacia antifractura de los fármacos antirresortivos no depende exclusivamente de esta variable, se deben considerar otros factores, que relacionados con la denominada calidad ósea, justifiquen la pérdida o ganancia de resistencia del hueso.
LA CALIDAD OSEA
Denominamos calidad ósea al conjunto de todos aquellos factores independientes de la DMO relacionados con la capacidad de un hueso para resistir fuerzas de fractura.
Macroestructura ósea
Desde el punto de vista macroestructural dos son los factores determinantes de la resistencia ósea: la morfología y la proporción de los diferentes subtipos tisulares óseos que lo componen.
La morfología del hueso, entendiendo como tal su forma y geometría, es uno de los factores más importantes relacionados con la resistencia ósea, ya que, de acuerdo con los principios de la ingeniería básica, alguno de sus parámetros dimensionales guarda relación con las propiedades biomecánicas del mismo2. Siguiendo este criterio, Glüer et al24 analizaron la capacidad de ciertas medidas morfológicas de la pelvis y del fémur para predecir fracturas de cadera. En su estudio, y de manera independiente, un grosor disminuido de la cortical del cuello femoral, un diámetro intertrocantérico elevado y un grosor disminuido de la cortical de la diáfisis femoral, se correlacionaban con un mayor riesgo de fractura en dicha localización anatómica. Yoshikawa et al3 introdujeron dos factores matemáticos en el estudio de la influencia de la geometría del cuello de fémur sobre el riesgo de fractura: el factor de seguridad (SF) o índice de resistencia del cuello femoral mientras se camina, y el índice de caída (FI) o índice de resistencia del cuello femoral durante la misma. Estos dos índices, relacionados ambos con el área y el momento de inercia de la sección transversal del cuello femoral, disminuyen con la edad, lo que justificaría, al menos en parte, el aumento del riesgo de ese tipo de fracturas con el envejecimiento. Recientemente Beck et al han demostrado mediante DEXA la existencia de una relación entre DMO y los diámetros del cuello femoral, región intertrocantérica y región diafisaria4,25.
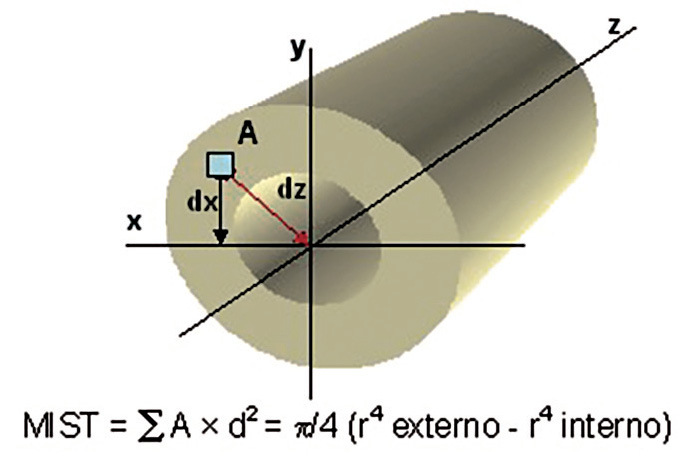
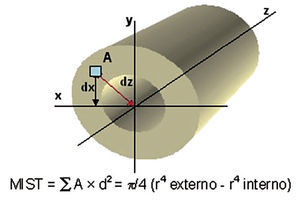
Desde el punto de vista biomecánico, el área de sección transversal y momentos de inercia polar y axial de una determinada región ósea son los factores geométricos determinantes de la resistencia ósea más importantes. A igualdad de grosor de corticales, la capacidad de un hueso para resistir fuerzas de flexión y torsión viene determinada por la distancia del endostio al centro del canal medular (área de sección transversal o AST). Del mismo modo, los momentos de inercia polar y axial de una determinada sección transversal (MIST) son igualmente proporcionales al valor del radio de dicho hueso elevado a la cuarta (r4)26, en una relación determinada por la fórmula:
Según ello, cuanto más lejos del centro del canal medular se distribuya la masa ósea, mayor será la eficiencia de un hueso para resistir cargas de flexión y torsión19,26,27 (fig. 3).
Fig. 3. Momento de inercia de la sección transversal de un hueso (MIST).
La importancia clínica de este factor es de suma importancia, ya que éste es el mecanismo por el cual nuestro esqueleto compensa la resorción endóstica que se produce durante el envejecimiento. Con la edad, tanto en hombres como en mujeres, se va produciendo simultáneamente una pérdida de hueso por resorción endostal y una formación ósea por aposición perióstica, proceso este último que por razones desconocidas es más importante en el hombre que en la mujer. De esta manera, si bien por un lado disminuye el grosor de las corticales, por otro va aumentando el radio total del hueso, y por tanto su AST, con lo que se compensa el déficit de resistencia generado por dicha resorción. Se calcula que de esta forma una unidad de aposición perióstica compensa biomecánicamente tres unidades de resorción endóstica19,26.
Condicionado genéticamente por la evolución de la especie y motivado por la necesidad de responder a un determinado patrón mecánico, la proporción de hueso cortical y trabecular es diferente según la región anatómica considerada, determinando en parte las características biomecánicas de dicha zona. Así, la columna vertebral dorsolumbar, acostumbrada por la bipedestación a una carga prácticamente monoaxial al eje y a unos movimientos de flexo-extensión y rotación, está formada aproximadamente por un 75% de hueso trabecular y un 25% de hueso cortical. Sin embargo, en la cadera, responsable de la transmisión de carga desde la pelvis a las extremidades inferiores, el cuello femoral contiene aproximadamente un 25% de hueso trabecular y un 75% de hueso cortical, presentando la región intertrocantérica una misma proporción de ambos tipos de hueso (50% de hueso cortical y esponjoso).
Por otra parte, a pesar de que el hueso cortical supone prácticamente el 80% del hueso del esqueleto, es responsable únicamente del 20% del remodelado óseo total, ya que este subtipo tisular presenta una baja relación superficie-masa (cercana a 90 cm2/g), lo que le proporciona una escasa superficie útil para la remodelación ósea. Sin embargo, el hueso trabecular, con sólo el 20% del hueso total, es responsable del 80% de la remodelación ósea, ya que su relación superficie-masa es casi diez veces mayor que la del hueso cortical (900 cm2/g)7. Ésta podría ser una de las razones por las que la osteoporosis y sus fracturas asociadas se expresan de manera más temprana y acentuada en los huesos en los que predomina el subtipo trabecular7.
Microestructura ósea
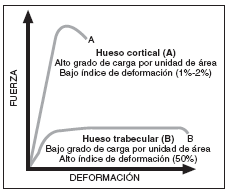
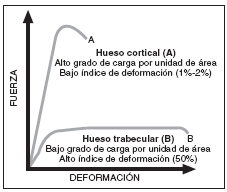
Desde el punto de vista microarquitectural, el hueso cortical está formado por unas pequeñas unidades estructurales óseas cilíndricas (UEOc, osteonas o sistemas de Havers) que se disponen de forma compacta formando lamelas circunferenciales e intersticiales. Esta distribución tiene una importancia biomecánica muy alta, ya que gracias a ella el hueso cortical es capaz de soportar un alto grado de carga por unidad de área con un bajo índice de deformación (1%-2%), lo que confiere gran rigidez a las unidades óseas en donde este subtipo es predominante19 (fig. 4). Sin embargo, el hueso trabecular, formado también por UEO denominadas en este caso paquetes trabeculares (UEOt), presenta una microestructura, una distribución y un comportamiento biomecánico totalmente diferente al cortical. Si se observa la sección sagital de una vértebra de un individuo joven y se analiza la organización de sus trabéculas, se ve que éstas determinan prácticamente una rejilla perfecta, con sus componentes horizontales y verticales orientados de manera perpendicular. Pero si la vértebra se analiza en las tres dimensiones del espacio, se aprecia que esa rejilla es en realidad un entramado multiplanar. Esta estructura soporta menos grado de carga por unidad de área que el hueso cortical, pero con un mayor índice de deformación (50%), lo que confiere cierto grado de elasticidad a las unidades óseas en donde este tipo tisular predomina19 (fig. 4).
Fig. 4. Subtipos titulares óseos: diferencias biomecánicas. Modificada de Seeman E. 200326.
Pero por otro lado, en este entramado, y de acuerdo con la Ley de Wolf, las trabéculas se orientan, condensan y refuerzan según la intensidad y la dirección de las cargas a las que están sometidas. Esta orientación heterogénea de las trabéculas (anisotropía ósea) es responsable biomecánicamente de que el hueso trabecular no responda igual en todas las direcciones del espacio. Así, para las vértebras, se ha demostrado que el valor máximo del módulo de Young y la máxima resistencia a la carga se obtienen en la orientación cráneo-caudal, seguida de la antero-lateral y de la medio-lateral6.
Estas propiedades biomecánicas diferenciales entre hueso cortical y trabecular dependen a su vez de una serie de factores microestructurales específicos de cada uno de los subtipos tisulares óseos.
En el hueso cortical, la densidad de los conductos de Havers, la disposición espacial de los mismos y de las lamelas intersticiales (que actúan como determinantes de su anisotropía) y la porosidad cortical, son los factores determinantes secundarios más importantes de la resistencia ósea.
La porosidad cortical resulta un factor crítico desde el punto de vista biomecánico. Un hueso cortical normal, con una microestructura no alterada, presenta como únicos poros los correspondientes a los vasos sanguíneos situados en el centro de las UEOc. Con la resorción endostal relacionada con el envejecimiento, y sobre todo como consecuencia del remodelado óseo acelerado de la osteoporosis posmenopáusica, se van desarrollando pequeñas lagunas de resorción alrededor de estas unidades, lagunas que acaban por unirse entre sí formando los denominados canales haversianos gigantes. Estos canales, asociados a las mencionadas lagunas de resorción, dan al hueso cortical afecto un aspecto esponjoso, fenómeno conocido como trabecularización del hueso cortical28. Este fenómeno parece tener una importancia biomecánica crítica, ya que para el hueso y los materiales cerámicos la relación entre resistencia y porosidad sigue una ley exponencial. De esta manera pequeños incrementos en la porosidad cortical producirían grandes disminuciones de la resistencia ósea29. Además, no todas las lagunas ni todos los canales haversianos gigantes tienen la misma importancia biomecánica, ya que hay regiones corticales que soportan una mayor transferencia de cargas y, por tanto, una mayor tensión mecánica, por lo que una alteración estructural a un determinado nivel puede generar puntos críticos de rotura (stress riser corticales) capaces de desencadenar una fractura en el hueso30.
Los trabajos del grupo de Bell, Crabtree, Jordan y Loveridge han demostrado fehacientemente que todas estas alteraciones están relacionadas con las fracturas intracapsulares osteoporóticas de cadera. En sus trabajos demuestran que en este tipo de fracturas por fragilidad existe una resorción cortical interna, con un 22,2% de reducción en la anchura cortical del cuadrante antero-inferior del cuello femoral, y un incremento del 13% en el diámetro del canal medular. A este proceso se le asocia una trabecularización del hueso cortical, con un 41% más de porosidad en el cuadrante anterior que en el inferior, y una incidencia dos veces mayor de canales haversianos gigantes en dicho cuadrante anterior. Estas alteraciones serían responsables de la existencia de un disbalance entre la resistencia mecánica del cuadrante postero-superior y el antero-inferior del cuello femoral, que pudiera estar relacionado con la génesis de las mencionadas fracturas28,31.
Sin embargo, para el hueso trabecular el tamaño, la separación y la conectividad de las trabéculas, la anisotropía trabecular y el cúmulo de microlesiones constituyen los factores de mayor relevancia como determinantes secundarios de la resistencia ósea.
Cuando a consecuencia de la edad o por la osteoporosis posmenopáusica se produce una disminución del número y/o del grosor trabecular, se puede llegar a desencadenar una importante reducción de la resistencia ósea. Así, con un adelgazamiento trabecular importante el hueso puede llegar a perder hasta un 20%-25% de su resistencia, debido a que también el momento de inercia de la sección transversal de una trabécula (MISTt) es directamente proporcional a su grosor elevado a la cuarta potencia. Pero mientras una pérdida del 10% de la masa ósea vertebral atribuible únicamente a la reducción del grosor trabecular determina una disminución del 20% en la resistencia ósea, la misma pérdida de masa atribuible a una reducción en el número de trabéculas supone una disminución del 65% en dicha resistencia32, indicando que este factor es más importante, desde el punto de vista biomecánico, que la mera pérdida de grosor. Por otro lado, al igual que ocurría en el hueso cortical, tampoco todas las zonas de adelgazamiento trabecular tienen la misma importancia biomecánica, ya que hay regiones trabeculares con una mayor transferencia de cargas y, por tanto, sometidas a mayores tensiones. Por ello, un adelgazamiento trabecular en dichas localizaciones puede generar también puntos críticos de rotura (stress riser trabeculares)30, aunque se considera actualmente que más que el adelgazamiento en sí, es la resorción trabecular localizada del punto crítico la que produce una mayor disminución de la resistencia ósea trabecular33.
Pero si bien en la osteoporosis senil predomina este fenómeno de adelgazamiento, en la osteoporosis posmenopáusica se produce preferentemente una pérdida de la conectividad trabecular. Esta pérdida de conectividad puede llegar a generar una disminución de hasta 16 veces la resistencia ósea a la compresión34, sobre todo cuando existe una marcada disminución del número de puentes horizontales35. Además, mientras que el hueso trabecular normalmente interconectado es anisotrópico, los pacientes con una fractura osteoporótica de cuello femoral presentan alteraciones en el patrón de orientación de sus trabéculas, con proporcionalmente menor cantidad de elementos trabeculares transversales al eje primario de compresión, lo que redundaría en una disminución de la resistencia ósea36.
Además, con el paso del tiempo, y debido a las sobrecargas repetidas y al envejecimiento, las trabéculas óseas sufren microfracturas relacionadas con la fatiga del material, microlesiones que en condiciones no patológicas serían capaces de desencadenar un proceso de remodelado reparador. Pero en la osteoporosis posmenopáusica esto no ocurre así, con lo que la acumulación de microfracturas puede llegar a reducir la resistencia ósea vertebral hasta en un 21%, favoreciendo la progresión de la noxa mecánica y el colapso del hueso19,26,37.
Ultraestructura y composición ósea
Ultraestructuralmente, la interconexión entre los componentes materiales orgánicos (colágeno tipo I) e inorgánicos (cristales de HA y fosfato cálcico amorfo) de la matriz confiere al tejido óseo parte de sus propiedades biomecánicas características, sobre todo las de resistencia a la tracción y a la compresión, si bien es cierto que todavía no se conocen con exactitud cuáles son las propiedades biomecánicas específicas de cada uno de ellos, ni las interacciones necesarias que expliquen en conjunto el comportamiento biomecánico del hueso desde el punto de vista material38.
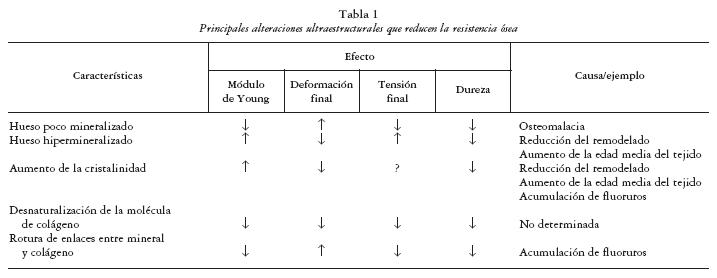
En este sentido, la red de fibras de colágeno, más dúctil que la cristalina, otorgaría al tejido óseo, por un lado, una trama continente para los componentes inorgánicos de la matriz, y por otro, debido a su propia estructura tridimensional, proporcionaría al hueso fundamentalmente rigidez y resistencia a la tracción en sentido longitudinal. Pero seguramente el colágeno, además de ser responsable de esta característica de resistencia elástica, proporcione al hueso parte de sus propiedades plásticas. Ambos efectos biomecánicos dependen de parámetros tales como la cantidad de colágeno, su estabilidad molecular y la estabilidad de sus enlaces intermoleculares. Patologías óseas, como la osteomalacia, la osteoporosis o la osteogénesis imperfecta, al inducir cambios en estos parámetros producen una alteración en las propiedades materiales y en las ultraestructurales de dicha trama, lo que repercute en el comportamiento elástico-plástico normal del hueso, en la resistencia general del mismo y en el riesgo de fractura. Así, en la osteogénesis imperfecta se reduce la deformación plástica del hueso hasta en un 60%, con la consiguiente reducción de la energía necesaria para fracturarlo39.
Por otro lado, los cristales de HA, de forma hexagonal alargada debido en parte a la orientación de las fibras de colágeno, y los de fosfato amorfo proporcionarían al tejido óseo resistencia y rigidez a la compresión. Estos efectos de los componentes minerales de la matriz están relacionados con el proceso de mineralización ósea, existiendo al menos cuatro factores dependientes del mismo que pueden afectar claramente a la resistencia ósea: el grado de mineralización (cantidad, grado de empacamiento y ordenación de los microcristales alrededor de las fibras de colágeno), grado de heterogeneidad de la misma, el grado de cristalinidad del mineral (tamaño de los cristales) y el contenido de iones que sustituyen al calcio en la matriz mineral40,41.
En los huesos longevos y en los osteoporóticos, además de alteraciones en el patrón de mineralización, se ha observado una abundancia anómala de cristales de HA de pequeño tamaño, lo que contribuiría a aumentar su fragilidad42 (fig. 5). Por otra parte, con la inhibición del remodelado óseo acelerado mediante fármacos antirresortivos, al prolongar éstos el período de mineralización secundaria, se consigue aumentar el contenido mineral del hueso en un 40%-50%, con el consecutivo incremento de la resistencia ósea26. Además, y debido a que en la fase de mineralización secundaria se produce también un aumento del tamaño de los cristales, la prolongación de esta fase determinaría cristales de HA más grandes, quedando por demostrar si este aumento de tamaño ejerce efectos positivos, negativos o despreciables sobre las propiedades biomecánicas del hueso43.
Fig. 5. Residuo mineral posincineración de una muestra de hueso osteoporótico.
La heterogeneidad de la mineralización osteonal (relación entre el contenido mineral y el colágeno) depende de las diferentes velocidades de remodelado óseo, siendo responsable, más que de la resistencia ósea propiamente dicha, de la velocidad de transmisión de la energía necesaria para fracturar un hueso. Así, cuando un traumatismo actúa sobre una unidad ósea con DMD elevada y mineralización homogénea, se requiere una menor energía para que dicho impacto se transmita a su través y, consecutivamente, a las unidades vecinas, si es que éstas presentan una mineralización igualmente homogénea. Esta situación suele ocurrir en huesos con una remodelación ósea excesivamente lenta, lo que da lugar a un desproporcionado incremento del tiempo de mineralización secundaria19,26.
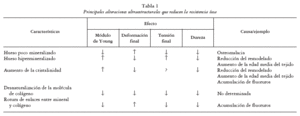
A modo de resumen, en la tabla 1 se recogen las principales alteraciones ultraestructurales que reducen la resistencia ósea y las causas que las originan.
CONCLUSIONES
La resistencia ósea es resultado, por tanto, de la integración de cuatro factores, DMO, macroestructura, microestructura y ultraestructura-composición, variables todas ellas dependientes a su vez del proceso de remodelación ósea. Cada uno de estos determinantes primarios de la resistencia ósea integra a su vez una serie de determinantes secundarios, responsables específicos de algunas de las propiedades biomecánicas óseas. Determinantes primarios y secundarios ayudarían, en conjunto, a establecer un hueso sano y biomecánicamente competente, mientras que sus alteraciones serían responsables del desarrollo de una osteopatía fragilizante, proceso que incrementa el riesgo de fracaso biomecánico del mismo.
Por tanto, el conocimiento de estos factores, su fisiopatología y las técnicas invasivas y no invasivas necesarias para su análisis, permiten a los profesionales médicos poder diagnosticar precozmente, tratar y hacer un seguimiento más preciso de todos los pacientes con este tipo de enfermedades, cuyo mayor exponente, la osteoporosis y las fracturas a ella asociadas, afecta hoy en día a más de un tercio de la población española mayor de 50 años44.