INTRODUCCIÓN
La osteoporosis (OP) es una enfermedad sistémica caracterizada por una disminución de la masa mineral ósea y deterioro de la microarquitectura ósea, con el consecuente incremento en la fragilidad ósea y susceptibilidad para las fracturas1. La OP tiene importancia clínica y para la salud pública porque es causa de fracturas2.
La existencia de una masa ósea baja ha sido uno de los conceptos más constantemente vinculados a la osteoporosis, y revela el proceso subyacente en esta patología: la alteración de la remodelación ósea. Sin embargo, no es el único factor a tener en consideración, debiendo pensar en otros relacionados con la calidad del hueso.
La disminución de la masa ósea por sí misma no provoca síntomas, y es buen índice de predicción de fractura en la región concreta donde se ha estimado. La medición de la densidad mineral ósea (DMO) en la cadera mediante absorciometría radiológica de doble energía (DEXA) se ha establecido como el patrón de oro en términos de localización, por ofrecer el mayor valor predictivo para la fractura de la cadera, que es la complicación más grave de la OP y predice el riesgo de todas las fracturas tan bien como otras técnicas3.
Bajo la denominación de densitometría ósea se incluyen varias técnicas que permiten de forma incruenta el cálculo preciso y fiable de la masa ósea (tomografía axial computarizada [TAC], DEXA o la radiogrametría). En general, estas técnicas se basan en el uso de los rayos X pudiendo determinar la DMO en cualquier región del esqueleto, e incluso del esqueleto completo, o realizar determinaciones en zonas concretas (densitometría axial) o localizadas de las extremidades (densitometría periférica). La densitometría central aventaja a la periférica en cuanto al rendimiento diagnóstico, debido a su capacidad para explorar las zonas de mayor interés clínico (columna lumbar y tercio proximal del fémur).
El uso de la densitometría periférica también se correlaciona con el incremento en el riesgo de fractura, aunque en menor medida que las DEXA axiales4. Sin embargo, el punto de corte clasificatorio de OP para las DEXA periféricas no coincide con el de las DEXA axiales si nos atenemos a la definición de la Organización Mundial de la Salud (OMS). Estudios recientes5 demostraron que los equipos de densitometría deben ajustar sus puntos de corte dependiendo del hueso donde se realiza la medición.
Existen factores claros de influencia en la OP que ha permitido distinguir en la OP primaria entre senil y menopáusica. La OP senil es el resultado de una deficiencia de calcio relacionada con la edad y de un desequilibrio entre la velocidad de degradación y de regeneración ósea. Esta pérdida progresiva de hueso es común a los dos sexos a partir de los 30-35 años, momento en el que alcanza su máxima densidad ósea. En la mujer esta pérdida se acelera, además, al principio del periodo posmenopáusico, sobre todo en las zonas con una elevada proporción de hueso trabecular, lo cual puede explicar la mayor prevalencia del proceso entre las mujeres.
En España la dimensión de este problema no es despreciable. Un estudio de ámbito nacional6 estimó la prevalencia de osteopenia y OP en la población femenina española estableciendo cifras de un 12,7% para la presencia de OP, ya sea en columna lumbar o en cadera de fémur entre las mujeres españolas mayores de 50 años.
El objetivo del presente estudio es estimar en la población femenina climatérica de un departamento sanitario de la Comunidad Valenciana (departamento 12), la prevalencia de baja masa ósea (osteopenia y osteoporosis), relacionarla con factores sociodemográficos y ginecológicos y medir la fuerza-asociación con estos últimos.
SUJETOS Y MÉTODO
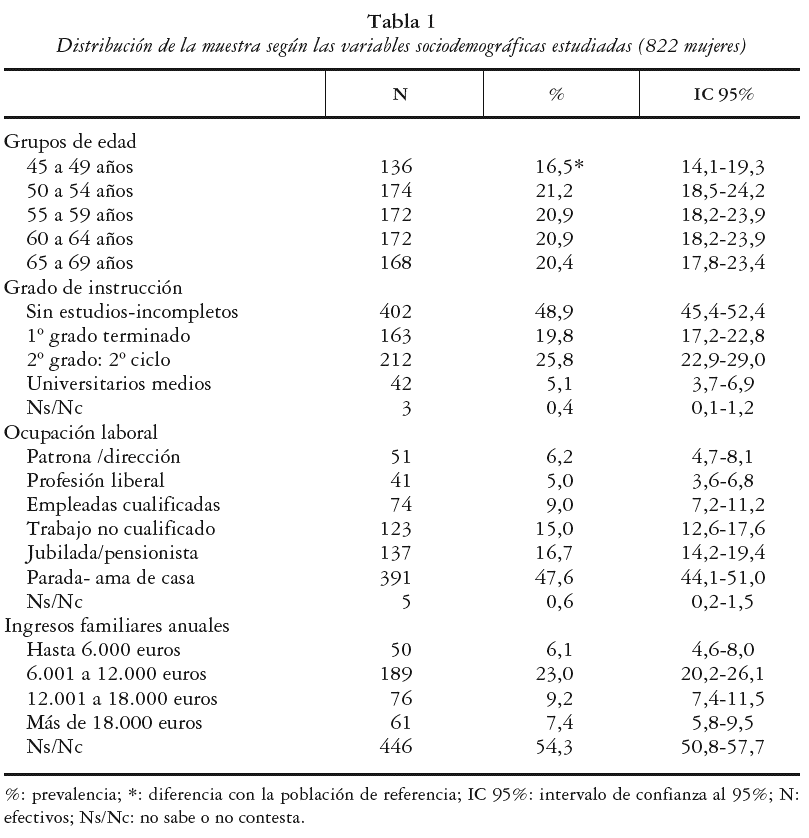
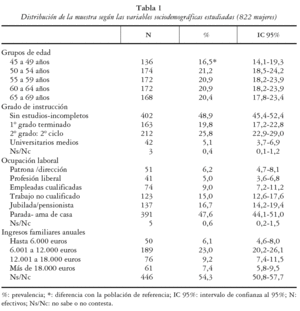
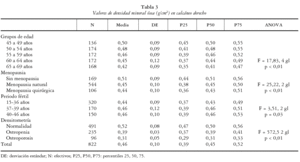
Se ha realizado un estudio transversal de base poblacional entre las mujeres de 45 a 69 años del Departamento de Salud 12 (Gandía) de la Comunidad Valenciana. Para ello se procedió a un muestreo aleatorio simple estratificado para 5 grupos de edad a través del Servicio de Información Poblacional (SIP) de la Conselleria de Sanitat de la Generalitat Valenciana. Se remitió por carta la invitación a participar en el estudio a 1.500 mujeres, presentando y pidiéndoles consentimiento informado para la realización de una encuesta, mediciones antropométricas y determinación de la masa ósea a través de una prueba no cruenta en el talón (DXA periférica de calcáneo). Se reclutaron 841 mujeres (participación del 56,1%) de las que finalmente se pudieron obtener datos completos para el presente estudio (cuestionario y exploración densitométrica) en un total de 822 mujeres (54,8% de la muestra total). La distribución por edades de la muestra fue similar a la de la población origen para todos los grupos de edad, a excepción de las mujeres participantes de 45 a 49 años que estuvieron infrarrepresentadas con respecto a la población femenina de ese rango de edad del Departamento de Salud 12 (16,5% frente a 20,5%). La media de edad de la muestra participante fue de 57,54 años con una desviación estándar (DE) de 7,01.
El trabajo de campo se efectuó entre abril y noviembre de 2002. La recogida de datos se realizó en el Hospital Francesc de Borja de Gandía (Valencia) y en los Centros de Atención Primaria de Gandía-Grao, Gandía-Beniopa, Gandía-Corea, Tavernes de Valldigna, Oliva y Bellreguard asociados al proyecto, a los que correspondían las mujeres seleccionadas. Tres matronas fueron entrenadas específicamente para pasar el cuestionario, tomar medidas antropométricas y manejar el equipo de densitometría.
El cuestionario contemplaba las siguientes variables sociodemográficas y ginecológicas. Entre las sociodemográficas se recogió:
1. Edad: se establecieron 5 grupos: 45-49, 50-54, 55-59, 60-64 y 65-69 años.
2. Nivel de instrucción (4 categorías): sin estudios o incompletos («no lee ni escribe»,«sin estudios»,«EGB» y«estudios primarios sin terminar»); primer grado terminado («hasta 5° de EGB o primaria»); segundo grado («bachiller elemental»,«8° de EGB»,«graduado escolar»,«bachiller superior»,«formación profesional»,«BUP o similar»); estudios universitarios («perito»,«ingeniería técnica»,«escuelas universitarias»,«licenciaturas»,«ingenierías superiores»,«doctores»).
3. Nivel de ocupación (tres categorías): en el hogar («ama de casa»,«parada»,«jubilada» o«pensionista»); cuenta ajena («empleadas cualificadas» y«trabajadoras no cualificadas»), cuenta propia («patronas»,«directivas»,«profesionales liberales»).
4. Ingresos anuales familiares (5 categorías): hasta 6.000 euros; de 6.001 a 12.000 euros, de 12.001 a 18.000 euros y más de 18.000. Además se consideró como categoría independiente el grupo de no respuesta (54,3%) a esta pregunta.
Con referencia a las variables ginecológicas se consideró:
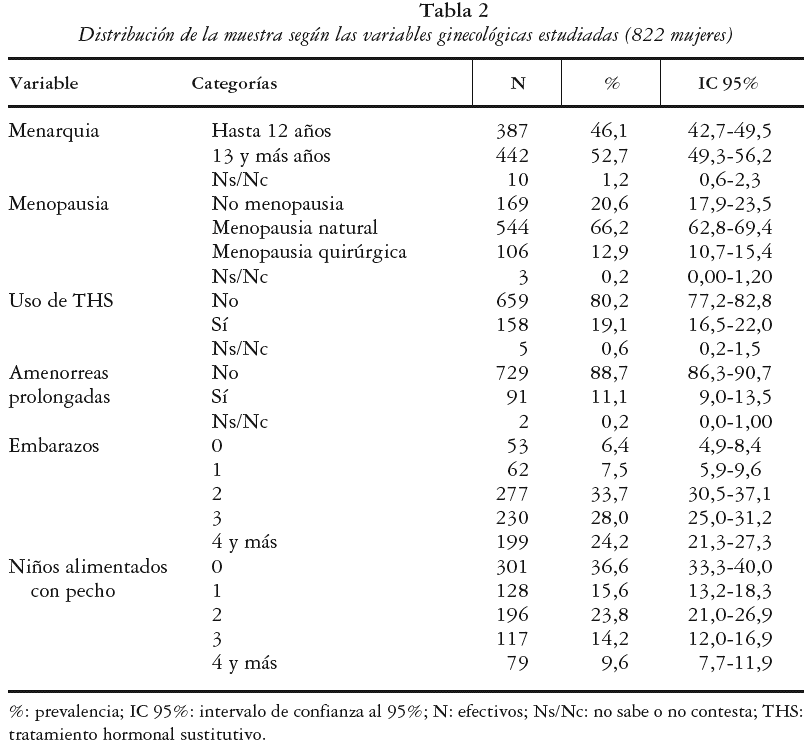
1. Edad de menarquia, que posteriormente se categorizó en dos grupos: presentación de menarquia hasta los 12 años y desde los 13 o más años.
2. Menopausia clasificada como: no menopausia, menopausia natural y menopausia quirúrgica.
3. Edad fértil (diferencia entre edad de menopausia y edad de menarquia) calculado sólo para aquellas mujeres en las que constaba la edad de menarquia y edad de menopausia (n = 640). Debido al gran número de mujeres en las que no se pudo establecer esta variable se constituyó una categoría«no calculada» para su análisis: a) uso de terapia hormonal sustitutiva («no»,«sí»); b) periodos de amenorrea mayores de 3 meses («no»,«sí»); c) número de embarazos (0, 1, 2, 3 y 4 o más); y d) número de niños alimentados a pecho (0, 1, 2, 3 y 4 o más).
La distribución de la muestra según sus características sociodemográficas se puede observar en la tabla 1.
La determinación de la DMO se realizó mediante densitometría periférica en calcáneo derecho con un único y mismo instrumento: PIXI Lunar®. Se determinaron los valores cuantitativos (DMO) de dicha prueba para el talón derecho expresados en gramos por centímetro cuadrado (g/cm2). Para el presente estudio se ha considerado el concepto baja masa ósea (BMO) para referirse al estado mermado de la cantidad de masa ósea en la localización estudiada, que reúne las condiciones de osteopenia y OP. Para correlacionar los valores de la densitometría periférica con los criterios densitométricos de la OMS, y proceder a la clasificación dicotómica normali-dad/BMO patológica y no OP/OP; se tomaron como punto de corte las puntuaciones T<0,6 y T<1,6, respectivamente.
Los datos obtenidos se analizaron mediante el programa informático EPIINFO® versión 3.3.2. Se estimaron para las variables cuantitativas las medias (x) con sus DE y percentiles 25, 50 y 75 (P25, P50 y P75) y los valores superior e inferior de la serie (límites de rango). Para la comparación de medias se ha utilizado la prueba de la«t» de Student o el análisis de la varianza (ANOVA) según ha sido pertinente.
Para las variables cualitativas (distribución de BMO, osteopenia y OP) se han estimado las prevalencias con sus respectivos intervalos de confianza al 95% (IC 95%). Para la comparación de proporciones se ha utilizado la prueba de Chi cuadrado.
La fuerza de asociación se midió mediante la odds ratio (OR) de prevalencia y su intervalo de confianza según el método de Yates (IC 95%), presentándose los valores crudos (ORc), y dado el reconocimiento de la edad como factor determinante de la masa ósea se determinó la OR ajustada por edad (ORaj) de las variables sociodemográficas y ginecológicas consideradas.
RESULTADOS
VARIABLES GINECOLÓGICAS
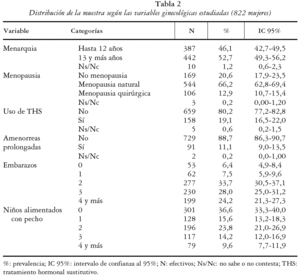
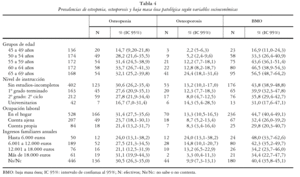
En la tabla 2 se expone el reparto de la muestra según las variables ginecológicas. La media de la edad de menarquia fue de 12,7 años (DE ± 1,6) situándose en un rango de 8 a 19 años. La edad media de menopausia se estimó en 48,2 años (DE ± 5,4) encontrándose en los límites entre los 27 y los 58 años. En referencia a la existencia y tipo de menopausia del grupo estudiado un 79,2% presentaban menopausia confirmada, correspondiendo un 12,9% a menopausia quirúrgica. Se estimó la duración del periodo fértil para 640 mujeres con menopausia, cuyos datos permitieron su cálculo. La media estimada de periodo fértil fue de 35,5 años (DE ± 5,6) situándose los valores límites entre 15 y 46 años. Un 11% manifestó haber tenido de forma repetida etapas de amenorrea prolongada (no embarazo) y un 19,1% declaró haber utilizado, o emplear en el momento del estudio, terapia hormonal sustitutiva (THS).
Un 93,6% de las mujeres participantes había estado embarazada en algún momento de su vida. La media de embarazos para la muestra fue de 2,8 por mujer (DE ± 1,6) observándose un rango entre 0 y 11 embarazos. Se estableció una media para la muestra de 2,6 partos (DE ± 1,3) y de 1,7 niños alimentados a pecho (DE ± 1,6). Para aquellas mujeres con niños se estimó un periodo medio de duración de la lactancia de 5,6 meses por bebé, estableciendo como valor moda los 3 meses.
DENSIDAD MINERAL ÓSEA
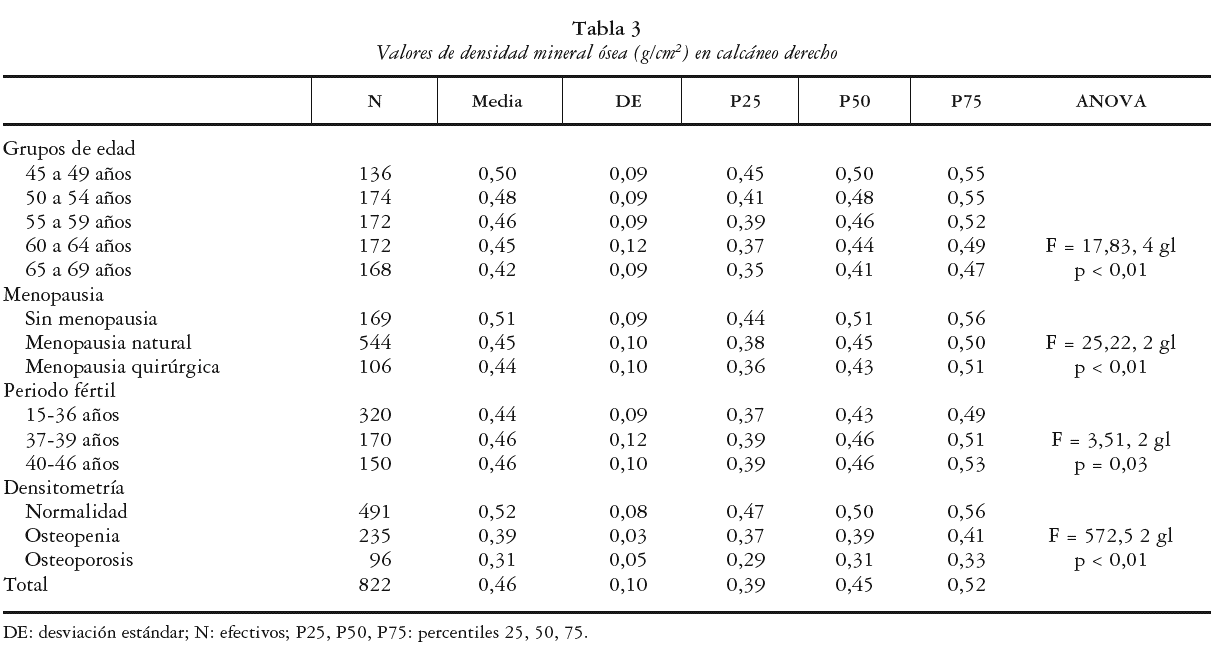
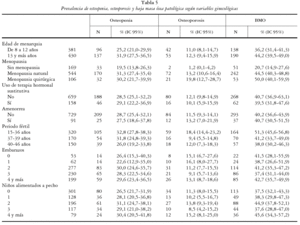
En la tabla 3 se exponen los valores de la DMO en calcáneo obtenidos por variables de interés recogidas: grupos de edad, menopausia, años de edad fértil y clasificación según la masa ósea. Se obtuvo para el conjunto de la muestra una media de DMO sobre el talón del pie derecho de 0,46 g/cm2 (DE ± 0,10) con valores de 0,25 g/cm2 para el P25 y de 0,52 g/cm2 para el P75 y una mediana de 0,45 g/cm2.
Las cifras medias de DMO estimadas disminuyeron de forma estadísticamente significativa (p < 0,01) con la edad, pasando de 0,50 g/cm2 (DE ± 0,09) para el grupo de 45-49 años hasta un mínimo de 0,42 g/cm2 (DE ± 0,09) para el de entre 65 y 69 años.
Las cifras medias de cantidad de masa ósea observada fue diferente según la presencia de menopausia y el tipo de la misma (p < 0,01). La media estimada para las mujeres sin menopausia fue de 0,51 g/ cm2 (DE ± 0,09), de 0,45 g/cm2 (DE ± 0,10) para la menopausia natural y de 0,44 g/cm2 (DE ± 0,10) para la menopausia quirúrgica.
Con respecto a la edad fértil se estimaron medias de DMO diferentes (p= 0,03) según la edad fértil tuviera una duración entre 15-36 años (0,44 g/cm2, DE ± 0,09) o de 37 a 46 años (0,46 g/cm2, DE ± 0,11).
PREVALENCIA DE BAJA MASA ÓSEA
Fue estimada una prevalencia de BMO patológica del 40,3% (IC 95%: 36,9-43,7), repartida en un 28,7% (IC 95%: 25,5-31,8) para criterios de osteopenia, y del 11,7% (IC 95%: 9,6-14,1) para OP. Un 59,7% (IC 95%: 56,3-63,1) de las mujeres presentaron valores de masa ósea normal.
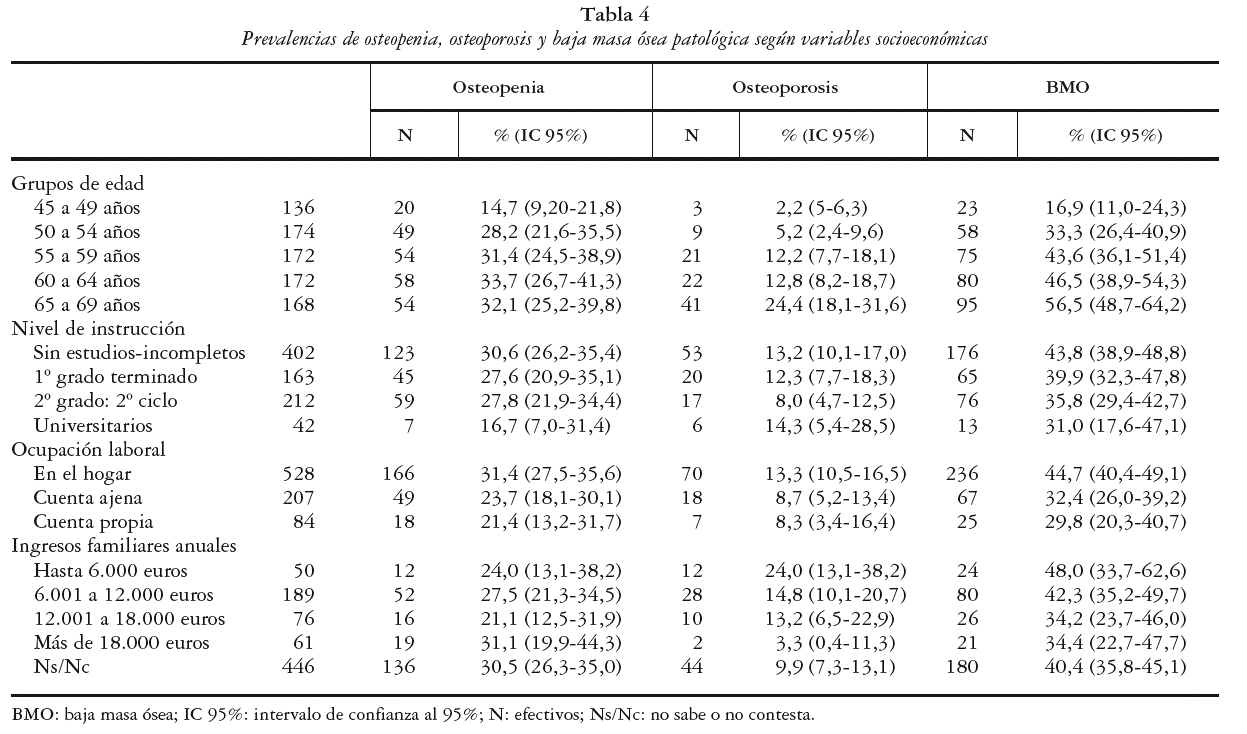
En la tabla 4 se exponen las prevalencias de BMO, osteopenia y OP según las variables sociodemográficas estudiadas. Se observó un aumento de la frecuencia de BMO según aumentaba la edad de los grupos considerados, pasando de una prevalencia del 16,9% para el grupo de mujeres más jóvenes (45 a 49 años) hasta una ocurrencia máxima de 56,5% para el grupo de mayor edad (Chi cuadrado para tendencias de 53,04; p < 0,01). Este mismo efecto se encontró cuando se consideró la categoría OP, pasando del 2,2% para el grupo de edad más joven hasta alcanzar una prevalencia del 24,4% para el grupo de mujeres de mayor edad. La media de edad estimada en las mujeres con BMO fue de 59,9 años (DE ± 6,5), mientras que para las que tenían una masa ósea normal fue de 56 años (DE ± 6,9) diferencia estadísticamente significativa (T = 8,18; p < 0,01). La media de edad estimada para osteopenia fue de 59 años (DE ± 6,5) y de 62,1 años (DE ± 6,05) para el grupo con osteoporosis.
La prevalencia de BMO disminuyó conforme se incrementaba el nivel educativo, estimándose una frecuencia máxima para la categoría de mujeres sin estudios o incompletos (43,8%).
Según la ocupación laboral se encontraron diferencias estadísticamente significativas (p < 0,01) entre las prevalencias estimadas de BMO para aquellas mujeres que desarrollaban la suya en el hogar (44,7%) con respecto a las que trabajaban por cuenta ajena (32,4%). Las prevalencias de BMO estimadas según la cantidad de ingresos anuales familiares fue similar en todos los grupos considerados, si bien, en cuanto a la OP, las diferencias fueron estadísticamente significativas (p < 0,01) entre las mujeres que declararon ingresos familiares anuales superiores a 18.000 euros (3,3%) y las que ingresaban 6.000 euros o menos anualmente (24%).
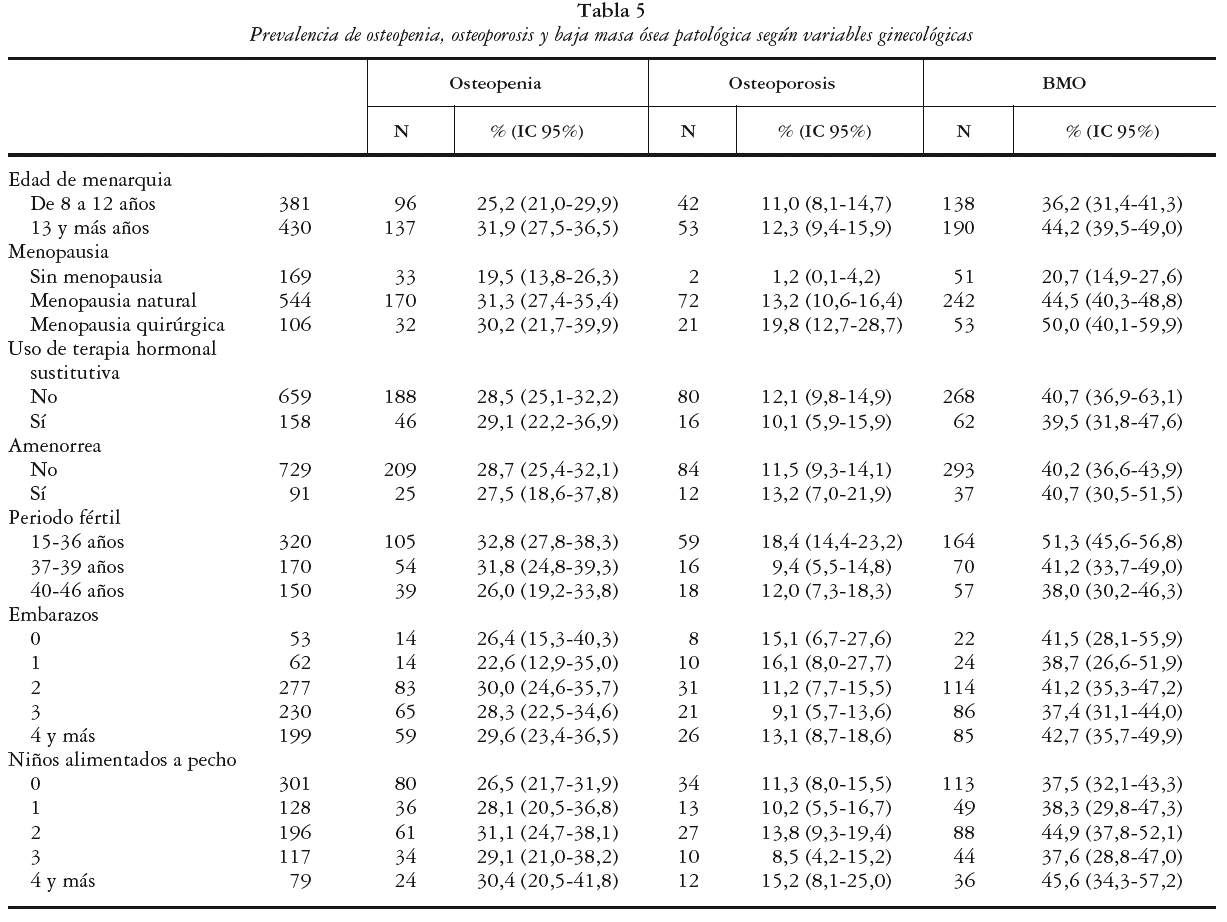
En la tabla 5 se muestra la prevalencia de osteopenia, OP y BMO patológica estimadas según las variables ginecológicas consideradas. Se observó una mayor prevalencia de BMO entre las mujeres cuya edad de menarquia fue a los 13 o más años (44,2%) que las que manifestaron esta situación antes de los 13 años (Chi cuadrado de 5,31; p = 0,02). Con respecto a la presencia de menopausia las mujeres con menopausia presentaron una mayor prevalencia de BMO que aquellas que no la tenían (45,4% frente a 20,7%), estadísticamente significativas (Chi cuadrado de 32,89, p < 0,01). Se encontraron diferencias en la prevalencia de BMO considerando también el tipo de menopausia: 44,5% para la menopausia natural y 50,0% para la quirúrgica. Estas prevalencias también resultaron mayores para las mismas condiciones si nos referimos a la OP (13,2% y 19,8% respectivamente). En referencia al periodo fértil se observaron diferencias estadísticamente significativas según su duración, de tal forma que la prevalencia de BMO fue mayor conforme el periodo fértil era menor (Chi cuadrado de tendencias 8,36; p < 0,01). La media de edad fértil estimada para las mujeres con BMO fue de 34,9 años (DE ± 5,7) y para OP de 34,4 años (DE ± 5,8), menor en ambos casos a la estimada para las mujeres que presentaban una masa ósea normal (35,9 años; DE ± 5,5); estas diferencias resultaron estadísticamente significativas (T = 1,99; p = 0,047).
Con respecto a las restantes variables: uso de THS, periodos de amenorrea, embarazos y niños alimentados a pecho no se encontraron diferencias entre las prevalencias de BMO estimadas para las distintas categorías de DMO consideradas.
FUERZA DE ASOCIACIÓN
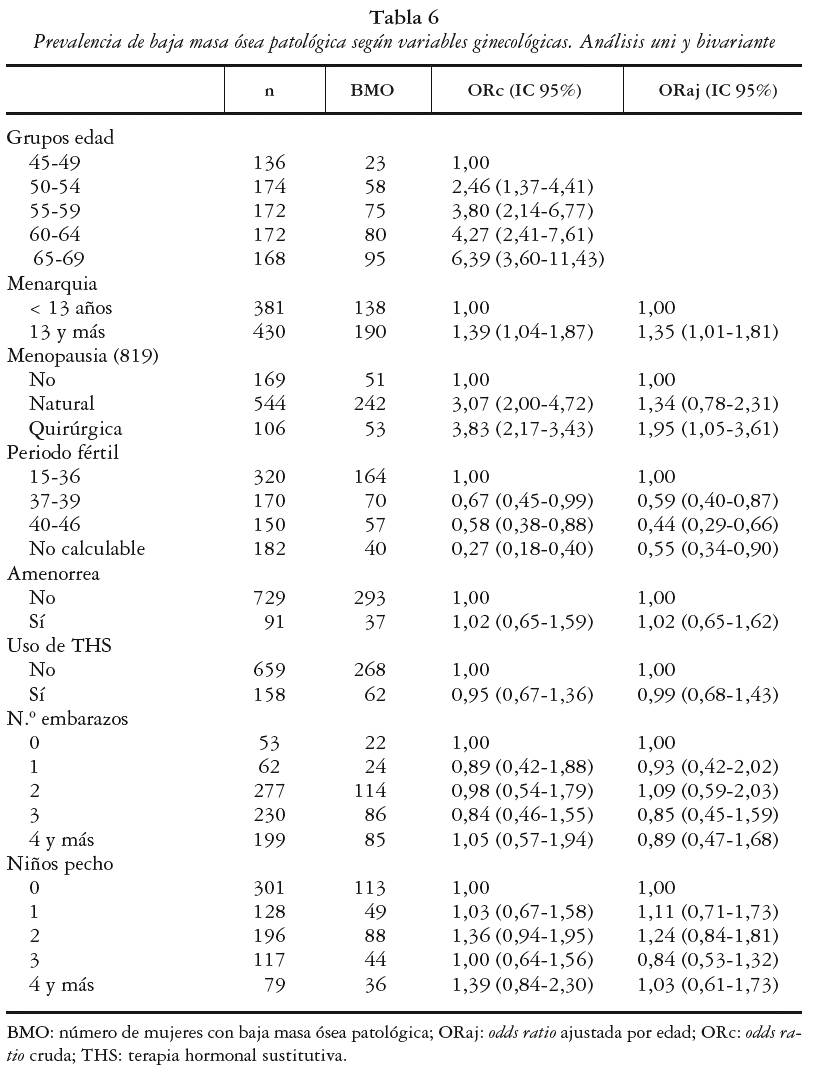
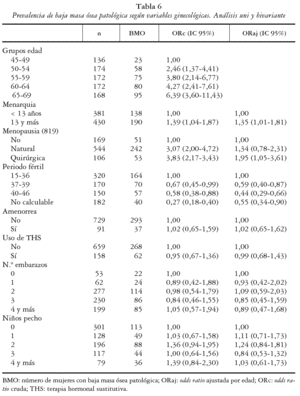
En la tabla 6 se muestran las odds ratio crudas (ORc) del análisis univariante y ajustadas por la edad (ORaj) de las variables ginecológicas.
La edad se asoció positivamente a la baja masa ósea patológica, observándose un claro aumento del riesgo con la edad que alcanzó valores máximos en el grupo de 65 a 69 años, el cual presentó un 6,39 (IC 95%: 3,60-11,43) veces más riesgo de presentar BMO que las mujeres de 45 a 49 años (categoría de referencia).
Se observó una asociación positiva entre la edad de menarquia y la BMO, estimándose un mayor riesgo para aquellas mujeres cuya edad de menarquia ocurrió entre los 13 o más años, ORc de 1,39 (IC 95%: 1,04-1,87) con respecto a las que la presentaron hasta los 12 años. El momento de la menarquia se mantuvo como un factor independiente tras ajustar por la edad, presentando una ORaj de 1,35 (IC 95%:1,01-1,81).
La asociación entre menopausia establecida y BMO fue analizada considerando la no existencia de menopausia como categoría de referencia. De forma dicotómica el riesgo de BMO en las mujeres menopáusicas fue 3,18 (IC 95%: 2,13-4,76) veces mayor que entre las no menopáusicas, sin embargo, al ajustar por la edad esta variable no se asoció significativamente con la masa ósea. Cuando esta variable se analizó según el tipo de menopausia, el riesgo de BMO para una menopausia natural fue de 3,07, y para la menopausia quirúrgica fue de 3,83. Tras ajustar por la edad, la ORaj para la menopausia quirúrgica fue del 1,95 (IC 95%: 1,05-3,61).
Para medir la asociación entre periodo fértil y el riesgo de BMO se tomó como categoría de referencia las mujeres con un periodo fértil de entre 15 y 36 años. El periodo fértil se comportó como un factor protector para la masa ósea de forma que para la categoría de 37 a 39 años la ORc fue de 0,67, y para aquellas mujeres con un mayor periodo de años fértiles (40-46 años) fue de 0,58. Tras ajustar por la edad las ORaj fueron de 0,59 (IC 95%: 0,40-0,87) y de 0,44 (IC 95%: 0,29-0,66) para las categorías de 37 a 39 años y de 40 a 46 años, respectivamente.
No se encontró asociación de otras variables ginecológicas estudiadas con la BMO (amenorreas, uso de THS, número de embarazos y niños alimentados a pecho).
DISCUSIÓN
Los resultados del presente estudio manifiestan una situación de alta prevalencia de BMO en mujeres climatéricas valencianas. Una de cada 2,5 mujeres entre 45 y 69 años presentan una masa ósea disminuida y una de cada 8, OP. Otro estudio en Valencia mediante ultrasonografía cuantitativa, estimó cifras del 50,4% para OP y 29,6% para osteopenia, que pueden ser explicadas entre otras causas por haber sido realizado el estudio entre usuarias posmenopáusicas y de edades avanzadas (entre 49 y 85 años) de un Centro de Atención Primaria7. Las circunstancias sociodemográficas y ginecológicas entre las que se observaron mayores proporciones de BMO patológica fueron la edad cronológica, la edad de menarquia (de 13 y más años), la existencia de menopausia y su tipo y, como variable derivada, la duración de la edad fértil. En el análisis presentado debe tenerse en cuenta que lo que se ha testado son marcadores de riesgo que se asocian a un factor de riesgo cuantificable relacionado con la OP (el valor de la DMO). Un metaanálisis, con datos de 12 estudios de cohortes que recoge la información sobre 29.082 mujeres, evidencia un riesgo relativo de fractura de cadera a los 65 años de 2,88 (IC 95%: 2,31-3,59) por cada disminución de la DMO equivalente a 1 DE; efecto dependiente de la edad, y que presenta un gradiente significativamente mayor entre los 50 y 80 años8.
Los análisis efectuados nos indican los grupos de población femenina en los que la presencia de esta condición es mayor, y por tanto, podrían acotar sectores que pueden ser objeto de mensajes de salud relacionados con los estilos de vida que incidan en el riesgo de posibles fracturas por esta causa. Una reciente revisión establece como factores de riesgo elevado o moderado modificables: el bajo peso corporal, la inactividad física, el consumo de tabaco, la baja o nula exposición solar o la ingesta de calcio menor de 500-850 mg/día9.
La elección de la muestra a través del Sistema de Información Poblacional (SIP), de forma independiente al conocimiento previo y diagnóstico de su patología, garantiza la aleatoriedad de las mujeres, sin embargo la aceptación de su inclusión en el estudio no asegura la posible existencia de un sesgo de participación que no ha sido analizado.
Los resultados se han obtenido mediante encuesta y determinación de la DMO a través de un aparato pDEXA. Si bien el estándar oro establecido para una clasificación de la OP a través de la determinación de la densidad mineral ósea ha sido realizada con DEXA axial de cadera, la utilización del PIXI no deja de ser una aproximación al valor T que se habría obtenido si se hubiera realizado una densitometría en columna o cadera. Los criterios de la OMS no deben ser utilizados para interpretar mediciones con otras técnicas (TAC, ultrasonidos o PIXI) tal como describieron Faulkner et al10, ya que si se comparan los rangos de referencia con respecto a la edad, las curvas obtenidas marcan notables diferencias. Mientras la curva perteneciente a la TAC de columna decrece rápidamente con la edad para cruzar el punto crítico de T < -2,5 a los 60 años, en el otro extremo encontramos la perteneciente a los ultrasonidos en talón, que produciría este cruce a una edad de 100 años. Las curvas que representan DEXA de columna, cuello femoral y antebrazo son semejantes y realizan el corte a los 75 años.
El nivel de correlación entre ambas técnicas se encuentra en un rango entre 0,5 y 0,6911, por lo que es imposible evitar un cierto número de falsos positivos y falsos negativos. Con un punto de corte T menor de -1,3 cabe esperar la máxima precisión con 16,4% de falsos positivos y un 30,4% de falsos negativos12. En nuestro caso datos obtenidos de una submuestra de 100 mujeres, a las que se determinó la DMO por PIXI-lunar en calcáneo y DEXA-lunar en columna y fémur, nos ofrecieron una sensibilidad para BMO del 82% y 93,7% en los resultados medidos respectivamente en columna y fémur, y una especificidad del 57,9% y 57,7% para los resultados de BMO en columna y fémur13. La máxima precisión observada fue de un 9,1% de falsos positivos y de un 32,8% de falsos negativos, tomando como referencia la DEXA de cadera.
Con todo ello, el punto de corte utilizado (T < -0,6) en nuestro estudio para la equiparación de resultados con la definición de BMO en DEXA central, va a producir una sobreestimación de la prevalencia de BMO.
Una reciente revisión14 discute la evidencia disponible y el papel de la DEXA central en comparación con otros métodos alternativos de determinación de la DMO para el diagnóstico y control de la OP. Sin embargo, el nuevo algoritmo de la OMS para el tratamiento de pacientes sobre la base del riesgo individual de fractura sigue tomando como fundamento la información de la DMO en cuello de fémur en función de la DEXA central15.
Resulta dificultoso comparar los resultados del estudio sobre prevalencia de OP por las distintas metodologías, técnicas y puntos de corte empleados. Sin embargo, los valores obtenidos de OP (11,7%) no son muy diferentes de los encontrados por otros grupos de investigadores en nuestro país; recientemente Pérez-Castrillón et al5 publicaban una prevalencia de OP entre mujeres del 12,4% determinada con PIXI Lunar. Otro estudio realizado con DEXA axial o de cuello de fémur estimó que la prevalencia de OP, bien en columna lumbar, bien en cuello femoral en la población femenina española mayor de 50 años, fue del 12,73%6.
La lista de factores de riesgo para la OP es larga y su estudio puede verse dificultado, entre otras razones, por la enorme variabilidad entre la repercusión de unos y otros (la existencia previa de dos o más fracturas vertebrales implica un riesgo relativo de 11,8 para una nueva fractura vertebral), o su distinta influencia en según qué localización de la fractura (la historia materna de fractura de fémur se asocia con un riesgo aumentado de fractura de fémur, pero no de antebrazo). Por otra parte, existen fenómenos que no son factores de riesgo de OP, pero sí lo son del riesgo de caí-da (uso de benzodiazepinas), al tiempo que existen otros que se asocian a ambas circunstancias, como el sedentarismo16.
La deficiencia de estrógenos acaecida con la edad ha sido implicada como uno de los factores más importantes en la patogénesis de la fragilidad ósea17. La pérdida acelerada de hueso en las mujeres, una vez alcanzada la menopausia, se produce porque la deprivación estrogénica se acompaña de un incremento de la intensidad de la remodelación ósea y de osteoclastogénesis18.
Nuestro estudio se ha centrado en la asociación de la BMO con variables ginecológicas y en los resultados presentados no se abordan otros riesgos mayores, como antecedentes familiares, y otros que podrían modificar o modula a la presencia de BMO, de forma independiente a la edad: la edad de la menarquia, el tipo de menopausia y el periodo reproductivo o fértil.
En última instancia los tres factores pueden ser considerados como diferentes indicadores para medir un mismo fenómeno: la menor exposición temporal de la mujer a los efectos de los estrógenos entre aquellas que presentan BMO, si bien su consideración por separado presenta limitaciones. Para establecer el periodo fértil se necesita contar con una mujer posmenopáusica para poder proceder al cálculo; la menopausia quirúrgica implica conocer si en el proceso quirúrgico hubo además ooforectomía bilateral; por su parte, el conocimiento de la edad de menarquia puede posibilitar el establecimiento de una sospecha para una BMO.
En referencia al momento de menarquia en las mujeres, el estudio europeo EPOS ha observado asociación con una menarquia tardía (a los 16 o más años) tanto con la incidencia de fractura vertebral osteoporótica19, como con la fractura distal de antebrazo (fractura de Colles)20, si bien en nuestro estudio este fenómeno ha sido ya observado con un punto de corte de edad más temprano, el de los 13 años.
Otros estudios que han considerado factores reproductivos como embarazo y amamantamiento tampoco han encontrado asociaciones estadísticamente significativas con los valores obtenidos por ultrasonometría cuantitativa (QUS), a pesar de considerar muestras mayores (2.080 mujeres posmenopáusicas)21.
En el estudio presentado no hemos encontrado ninguna relación del uso prolongado de THS con respecto a la presentación de una mayor DMO. La duración media estimada de uso de THS fue de 42,8 meses. Dicha terapia ha sido utilizada en el control de síntomas asociados con la menopausia, y como tratamiento en la OP posmenopáusica, aun conociendo que su efecto desaparece al interrumpir el tratamiento. Su uso para evitar fracturas queda cada vez más limitado al disponer de fármacos más seguros y potentes. Los resultados del Women's Health Initiative22 evidenciaron que el uso de estrógenos-progestágenos de forma continuada se asociaba a un aumento significativo de enfermedad coronaria23, cáncer invasor de mama24, infarto de miocardio y tromboembolismo venoso25. Por otra parte, los hallazgos del Million Women Study en el Reino Unido, que también constataron el riesgo de cáncer de mama asociado a estrógenos en monoterapia y con el uso de THS combinada26.
El reconocimiento de estos marcadores asociados a una BMO podrían resultar de ayuda para determinar grupos de mayor riesgo donde focalizar actuaciones de educación sanitaria, consejo médico sobre los hábitos de vida que contribuyeran a aumentar la salud ósea e incluso poder iniciar un seguimiento más en concreto sobre esta patología. En este contexto los esfuerzos rea-lizados por algunas administraciones públicas, como el desarrollo del Plan de prevención y control de la OP en la Comunidad Valenciana27 han significado un notable impulso en la toma de conciencia de los profesionales, en el aumento de la accesibilidad a ciertos medios diagnósticos y en la racionalidad en el abordaje de esta patología. No obstante, el hallazgo de estas observaciones debería ser objeto de estudios más profundos para estimar su comportamiento y validarlos como factores conducentes a la práctica de acciones diagnósticas de mayor coste y especificidad.