ANDRÓGENOS Y HUESO
MECANISMOS MOLECULARES DE ACCIÓN: RECEPTORES
Los esteroides sexuales desempeñan un papel fundamental en el desarrollo y mantenimiento del esqueleto. En este sentido tanto los estrógenos como los andrógenos influyen en el metabolismo tanto del hueso cortical como trabecular, en la adquisición del pico de masa ósea, en la inhibición de la pérdida ósea...etc. Pero mientras los efectos bioquímicos y clínicos de los andrógenos (y su déficit) en general están bien definidos, los mecanismos moleculares de acción de los mismos sobre la célula ósea no están tan claros.
Los andrógenos son hormonas lipofílicas que, por esta condición, son capaces de atravesar la membrana plasmática de la célula y la membrana nuclear; una vez en el núcleo se une a su receptor intranuclear y genera una serie de reacciones en cascada. Primero se induce un cambio conformacional del receptor androgénico (RA) y éste sufre cambios de fosforilación y dimerización. El complejo formado por hormona-receptor actúa como un factor de transcripción nuclear que se une a la cadena de ADN iniciándose así la transcripción1.
Estos RA, clonados recientemente , se dividen en dos tipos, RA tipo A (de 87 kDa) y tipo B (de 110 kDa). El receptor tipo B es cuatro veces más abundante que el tipo A, funcionalmente son muy parecidos. La afinidad de los RA que hay en el hueso por la hormona es comparable a la de otros RA en otras localizaciones, como puede ser la próstata, aunque la concentración de receptores en esta localización es mucho menor.
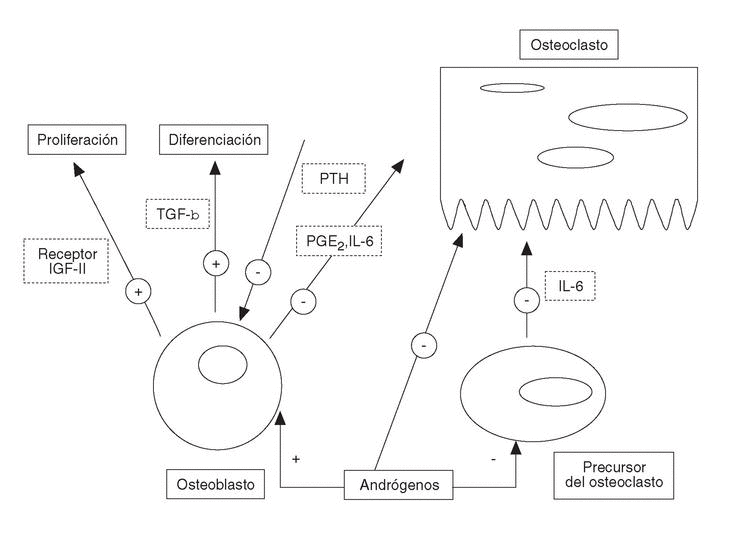
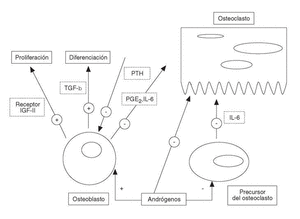
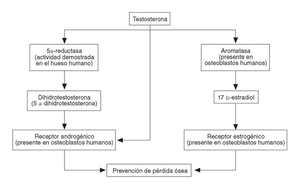
Los andrógenos inhiben la resorción ósea directamente a través de la inhibición de interleucina-6 (IL-6), de prostaglandinas (PGE2) y de la hormona paratiroidea en su acción sobre los osteoblastos o indirectamente sobre la inhibición de la osteoclastogénesis2 (fig. 1).
Figura 1. Efecto estimulador e inhibidor de los andrógenos sobre las células óseas.
ANDROPAUSIA Y HUESO
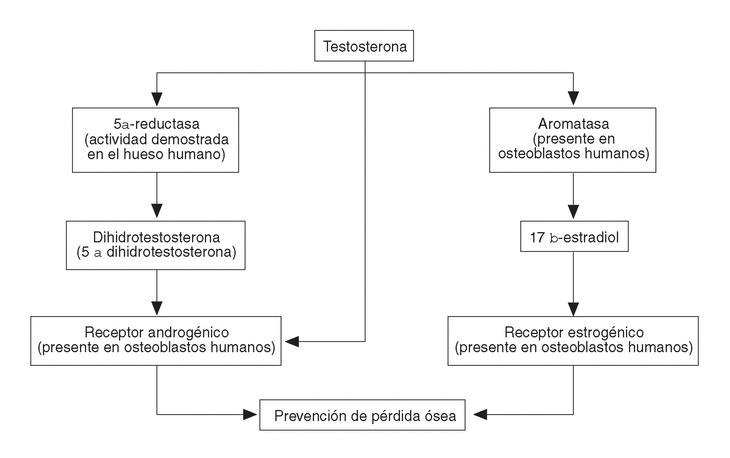
Los andrógenos sobre el hueso ejercen una serie de efectos (ya descritos) debido a la estimulación del propio receptor androgénico; pero también sus efectos van a estar mediados por el receptor estrogénico, ya que los andrógenos sufren un proceso de aromatización (fig. 2).
Figura 2. Metabolismo de los andrógenos en el hueso.
En cualquier caso, los andrógenos influyen directa o indirectamente en el crecimiento del hueso y en la adquisión del pico de masa ósea de manera que en sujetos con pubertad retrasada hay un descenso de este pico de masa ósea debido al déficit de andrógenos en una etapa crucial del crecimiento como es la pubertad3.
Por otra parte, tanto en hombres como en mujeres, la densidad mineral ósea (DMO) disminuye con la edad. Mientras existen numerosos estudios sobre la osteoporosis postmenopáusica, el descenso de la DMO en varones no se ha valorado de forma tan extensa y se desconocen datos sobre cuánta es la contribución de los andrógenos a esta pérdida.
Se han llevado a cabo estudios en ratas orquiectomizadas, lo que se ha criticado por algunos autores, ya que hay que tener en cuenta que éste puede no ser el modelo idóneo puesto que la rata, a diferencia del ser humano, continúa creciendo durante toda su vida. Hay un estudio en varones sanos (n = 90) en el que se confirmó el descenso paralelo de las cifras de testosterona libre con la edad y el descenso de DMO. También se estudian los cambios en la composición corporal que ocurren con la edad observándose cómo hay un aumento de masa grasa en detrimento de la masa magra4.
Pero la fisiopatología de la osteoporosis en los varones es multifactorial y además del descenso de la función gonadal hay otros factores, como el descenso de la función de los osteoblastos que ocurre con la edad, la disminución del estímulo mecánico sobre el hueso debido a una vida más sedentaria, un balance negativo de calcio, valores circulantes elevados de hormona paratiroidea y la reducción de masa magra.
DÉFICIT DE ANDROGENOS Y ENFERMEDAD OSEA
Al igual que en las mujeres, el hipogonadismos en varones es un factor de riesgo para la osteoporosis; de hecho es la segunda causa de osteoporosis secundaria en el varón tras el tratamiento continuado con esteroides5. La prevalencia del hipogonadismo es cinco veces mayor en varones con fractura de cadera, y un 5% de los varones con osteoporosis vertebral tienen hipogonadismo6. En algunos estudios se relaciona la osteoporosis vertebral de los varones con hipogonadismo con una disminución de la absorción de calcio junto con unas concentraciones bajas de 1,25 dihidroxivitamina D7.
Los hipogonadismos se pueden dividir en primarios o hipergonadotropos y secundarios o hipogonadotropos, tablas 1 y 2. Dada la función trófica de los esteroides sexuales sobre el hueso cabe pensar que en todas estas circunstancias habrá un déficit de la DMO, y que el tratamiento sustitutivo con testosterona mejora este defecto.
Pero de todas estas causas merece mención especial el hipogonadismo que sufren los varones que padecen cáncer de próstata y que son tratados de forma continuada con antiandrógenos. El tratamiento de deprivación androgénica es una terapia muy efectiva que recibe un porcentaje elevado de enfermos con cáncer de próstata recurrente y/o metastásico. Los efectos secundarios a corto plazo consisten en crisis de sofocos y disminución de la libido mientras que más a largo plazo presentan disminución de la masa muscular y de la DMO que, en muchos casos, no se considera importante por los enfermos y sus médicos. Se han descrito hasta un 9% de fracturas en enfermos que reciben estos fármacos8.
Un estudio reciente9 valora el efecto sobre la DMO en un grupo de enfermos que recibieron análogos de la gonadotropinas, algunos de ellos con matástasis óseas (n = 7). Los resultados confirmaron que algunos de estos enfermos mantenían una DMO normal a pesar de llevar años en tratamiento antiandrogénico y de mantener cifras de testosterona en el rango de castración. Lo más importante fue que esta DMO disminuía de forma importante si el enfermo al inicio del tratamiento ya partía de una situación de osteopenia, atribuible a la edad.
En este estudio se concluye que sería conveniente estudiar la masa ósea de los enfermos que van a iniciar el tratamiento antiandrogénico con el objeto de instaurar un complemento específico que frene la pérdida de hueso.
El carcinoma prostático por sí mismo puede inducir osteomalacia a través de una pérdida renal de fosfatos o por un incremento de la captación de calcio por las lesiones osteoblásticas asociadas. En este sentido tenemos un estudio aún más reciente10 en el que se analizan las causas de la pérdida de masa ósea en enfermos con carcinoma prostático. La etiología multifactorial es la norma en estos casos, de manera que este cáncer se suele presentar en personas de edad avanzada en los que hay una susceptibilidad mayor a tener déficit de vitamina D, por una menor exposición solar, por una menor capacidad de la piel a sintetizar vitamina D y en los que a veces se asocia una insuficiencia renal. En este estudio sobre 16 enfermos con carcinoma prostático avanzado resistente al tratamiento hormonal se observa una mejoría de los dolores óseos y, por tanto, de la calidad de vida si recibían un suplemento de vitamina D. Esta mejoría también se ha confirmado en enfermos que recibían tratamiento antiandrogénico y que tenían alto riesgo de desarrollar osteoporosis11.
ANDRÓGENOS Y LA MUJER
ANDRÓGENOS Y MENOPAUSIA
Los andrógenos clásicamente se han considerado como las hormonas masculinas, de manera que siempre se ha dado una mayor importancia al efecto que tenía un exceso de estas hormonas masculinas en la mujer que su déficit. Pero en la mujer hay una producción de andrógenos en el ovario (androstenediona, testosterona y dehidroepiandrosterona) y en la suprarrenal (sulfato de dehidroepiandrosterona [DHEA-S]. Al menos el 50% de la testosterona circulante proviene de la conversión periférica de los principales preandrógenos (sobre todo la androstenediona). Los andrógenos ováricos son secretados por las células de la teca bajo el control de la hormona luteinizante (LH), de forma que en una mujer con ciclos ovulatorios la secreción de los mismos tiene un ritmo cíclico.
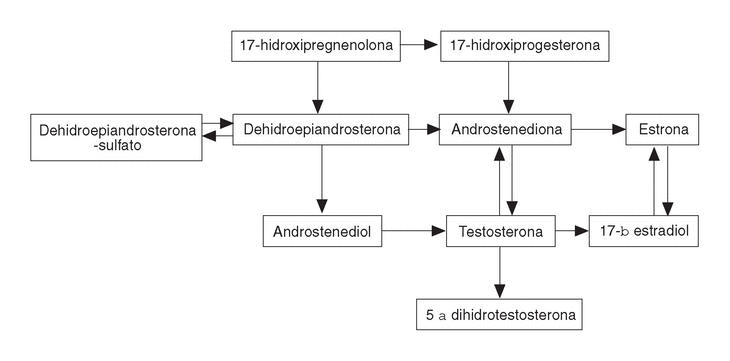
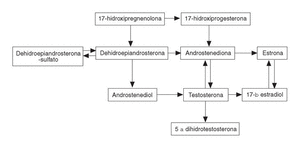
Las suprarrenales liberan grandes cantidades de DHEA y DHEA-S que, a nivel periférico, se convierten en androstenediona y ésta a su vez en testosterona y dihidrostestosterona (DHT) así como en estrógenos (fig. 3). Sólo el 1%-2% de la testosterona circulante es biológicamente activa; el resto está unida a la proteína ligadora de hormonas sexuales (SHBG) y a la albúmina. El orden de afinidad de estos esteroides sexuales a la SHBG es: DHT>testosterona>androstenediol>estradiol> estrona12.
Figura 3. Vías metabólicas de los andrógenos.
Algunos autores han encontrado un descenso (aproximadamente del 15%) en los valores de testosterona y androstenediona en los primeros seis meses de la menopausia. Tras una ooforectomía, tanto la testosterona como la androstenediona descienden en un 50%13.
Este descenso de la producción de andrógenos en la mujer, con la edad o bien tras una menopausia quirúrgica, se manifiesta como alteraciones en la actividad sexual, afectación del estado de bienestar, pérdida de energía y un efecto negativo sobre la masa ósea. Dado que este descenso de las cifras plasmáticas de andrógenos comienza ya en la década que precede a la menopausia, estos síntomas se pueden observar ya en los primeros años tras el cese de la menstruación14.
Con respecto a la sexualidad femenina, se ha observado que la deprivación androgénica tras la menopausia contribuye a un descenso en el interés sexual, con una menor frecuencia coital. Aunque es posible que los efectos de una posible restitución de las cifras de andrógenos se deban a la aromatización periférica de los mismos se ha visto, en estudios controlados, que tras la sustitución estrogénica se obtienen pocos o ningún cambio en la libido15.
En cuanto a los efectos sobre el hueso se conoce que los andrógenos desempeñan un papel importante en el mantenimiento de la masa ósea, tanto en hombre como en mujeres. En los años que preceden a la menopausia la masa ósea está correlacionada con el peso mientras la obesidad lleva a una disminución de los niveles de SHBG de forma que aumenta el porcentaje de testosterona libre. En mujeres premenopáusicas esto puede explicar la relación existente entre obesidad, testosterona libre y aumento de masa ósea.
TRANSEXUALES
Durante la fase de adaptación al sexo contrario, los transexuales reciben un tratamiento hormonal (estrógenos en varones y andrógenos en mujeres) que conlleva un cambio completo del ambiente hormonal del organismo. La nueva asignación del sexo incluye una gonadectomía, tras la cual se sigue el tratamiento hormonal para evitar el hipogonadismo. Generalmente en varones se administra un antiandrógeno (acetato de ciproterona) junto con estrógenos (en forma transdérmica u oral) durante unos 20-24 meses, y posteriormente se lleva a cabo la orquiectomía; después ya no será necesario el tratamiento con antiandrógenos y el sujeto seguirá tomando estrógenos para mantener la apariencia femenina y mantener también el metabolismo del hueso.
En el caso de las mujeres se inicia tratamiento con testosterona por vía parenteral cada dos semanas, llevándose a cabo una ooforectomía una vez han pasado 13-20 meses. Posteriormente seguirá con tratamiento de testosterona cada dos o tres semanas. También se puede usar un decanoato de testosterona en presentación oral 16.
Estas intervenciones sobre el "ambiente hormonal" de estos enfermos han brindado la oportunidad de estudiar el efecto que tiene sobre el hueso la administración de estrógenos en el varón y de andrógenos en la mujer.
De esta manera se ha observado que unos años de tratamiento con estrógenos en combinación con antiandrógenos en varones sanos induce una disminución de los valores de formación (fosfatasa alcalina y osteocalcina) y de resorción óseas (calcio urinario/creatinina e hidroxiprolina/creatinina). Esto se debe en principio a un descenso del remodelado óseo que también se observa en mujeres menopáusicas tras la instauración de una terapia hormonal sustitutiva. Así observamos en estos enfermos un aumento de la DMO en la columna lumbar, explicable por una disminución en el número de ciclos de remodelado. Los cambios en la DMO se correlacionan con los cambios en el peso. Se ha visto que cuando se utilizan estrógenos transdérmicos aparecen menos cambios en la DMO que cuando éstos son administrados oralmente17.
La administración de acetato de ciproterona que es un antiandrógeno a la vez que un progestágeno, influye sobre el metabolismo del hueso pero su efecto es imposible de distinguir del derivado del tratamiento estrogénico. En otros estudios más a largo plazo se ha visto que, aunque este aumento de masa ósea se produce al principio, posteriormente se estabiliza pasados unos 28-63 meses15.
Con respecto al tratamiento con testosterona en mujeres se ha visto que tras un año no hay cambios significativos en los marcadores bioquímicos de resorción ósea y no hay variaciones en la masa ósea con respecto a los valores antes de iniciar tratamiento (aunque existía un aumento pero no estadísticamente significativo). Sin embargo, en estudios a más largo plazo se ha observado que se obtiene un descenso significativo de la DMO a los 28-63 meses de tratamiento.
En definitiva, el tratamiento con estrógenos en varones previene la pérdida ósea debida a la deprivación androgénica y que el tratamiento con testosterona en mujeres es incapaz de mantener la masa ósea. Al analizar las causas de este hecho, se ha visto que en las mujeres no se consiguió suprimir los valores de LH y que éstos se correlacionaban positivamente con la pérdida ósea; de manera que se propone utilizar las cifras de LH como marcador de una buena sustitución hormonal, eficaz para el hueso.
TUMORES VIRILIZANTES Y HUESO
Una serie de tumores, generalmente ováricos, derivados de las células de Leydig, son productores de andrógenos, y, por tanto, cabe pensar que tendrían repercusión sobre el hueso. Sin embargo, no hay en la literatura ninguna referencia a este aspecto; posiblemente porque los síntomas de virilización que se producen llevan a consultar a estas enfermas antes de que se produzca ningún efecto óseo por la exposición continuada a los andrógenos.
ANDRÓGENOS COMO TERAPÉUTICA EN EL VARÓN
HIPOGONADISMOS MASCULINOS
Las causas de hipogonadismos primarios (testicular) y secundario (hipogonadotropo) se exponen en las tablas 1 y 2. En todas estas situaciones hay un común denominador que es una baja producción de testosterona. Conocemos cómo los andrógenos influyen en la proliferación de los osteoblastos, en la producción de citocinas y factores de crecimiento, en la producción de proteínas de la matriz ósea, etc.
En la pubertad, los andrógenos estimulan especialmente un aumento en el hueso cortical mediante el crecimiento periostal y endostal, además de incrementar el hueso trabecular en las zonas epifisiarias. Durante esta época de la vida, el hipogonadismo produce un marcado efecto sobre el desarrollo del hueso cortical que se puede evitar mediante la administración de testosterona. La DMO puede aumentar hasta en un 26% tras un año de tratamiento en enfermos con retraso constitucional de la pubertad comparado con un incremento de 0,5% en sujetos controles no tratados18.
El hipogonadismo de larga evolución en varones adultos se asocia a una disminución del remodelado, valores séricos bajos de 1,25 dihidroxi-vitamina D y un descenso de la formación ósea que es reversible tras un tratamiento sustitutivo adecuado19. En enfermos con síndrome de Klinefelter se ha visto cómo el área cortical se correlaciona positivamente con las cifras séricas de testosterona20.
La hemocromatosis, trastorno metabólico con acumulación de hierro en distintas zonas del organismo, incluidas las células gonadotropas de la hipófisis, cursa con hipogonadismo. La baja DMO de estos enfermos tiene como causa principal los bajos niveles de testosterona21.
OTRAS CAUSAS DE OSTEOPOROSIS
En el largo listado de las causas de osteoporosis secundarias cabe destacar las dos más frecuentes. En ninguno de los casos, aunque cursan con hipogonadismo, está indicado el tratamiento con andrógenos sino el de la causa subyacente.
En el varón la causa más frecuente de osteoporosis es el tratamiento prolongado con corticoides; este antecedente aparece en el 16% de las fracturas vertebrales. Debe desempeñar un papel en este tipo de osteoporosis el efecto que tienen los corticoides al descender los valores de testosterona. Por otra parte, la interrupción del tratamiento parece revertir, al menos parcialmente, la pérdida de masa ósea.
El consumo del alcohol también puede asociarse a osteoporosis y a un riesgo aumentado de fracturas. Esto se debe a la frecuente asociación del alcoholismo con la predisposición a las caídas, a un estado de malnutrición, un aumento de la excreción renal de calcio y magnesio, una malabsorción intestinal del calcio y el hipogonadismo secundario que induce. Además el alcohol tiene un efecto directo sobre la función osteoblástica. El cese del consumo de alcohol mejora todos estos parámetros.
ANDRÓGENOS Y OSTEOPOROSIS FEMENINA
DHEA EN MENOPAUSIA
Al nacimiento las cifras de DHEA están muy altas con respecto al rango normal de un adulto, cayendo rápidamente hasta la época de la adrenarquia en que sufre un aumento en ambos sexos. El pico de DHEA se alcanza sobre la tercera década de la vida y luego descienden progresivamente con la edad. El significado fisiológico de este fenómeno se desconoce, pero dado el importante papel de los andrógenos en el metabolismo óseo se ha intentado valorar los efectos de la administración de DHEA en mujeres postmenopáusicas22. Muchos de estos estudios se han realizado en períodos tan breves (máximo 28 días) que no se puede observar ningún efecto a nivel óseo.
ARTRITIS REUMATOIDE Y ANDRÓGENOS
Los enfermos con artritis reumatoide tiene valores séricos de andrógenos menores que los controles. En un principio no estaba claro si esto era una causa o una consecuencia de la propia enfermedad, pero existe hoy día una hipótesis que apoya la teoría de que es más bien una causa de
la misma23.
El antígeno de histocompatibilidad HLA-DR4, que está asociado a la artritis reumatoide se ha visto que confiere unos menores valores de testosterona a las mujeres que lo portan. Esta asociación de determinados HLA con las cifras de testosterona se ha confirmado también en otros casos, como el HLA-B27 que suele conllevar valores elevados en varones, pero no en mujeres, y el HLA-B8 que se asocia a testosterona baja en mujeres pero no en hombres.
Se ha confirmado que estos enfermos tienen una DMO significativamente menor que los controles. Una de las causas puede ser los valores de andrógenos disminuidos que encontramos en estos enfermos.
ANDRÓGENOS COMO ANABOLIZANTES ÓSEOS
Los efectos virilizantes de los andrógenos en la terapéutica de la mujer ha limitado su uso, a pesar del conocido efecto beneficioso sobre el hueso. Durante los últimos 25 años se han desarrollado esteroides anabolizantes que son análogos a la testosterona pero que carecen de estos efectos, o al menos son menos importantes. De esta manera, el término anabolizante define un menor efecto androgénico con respecto a los efectos sobre la masa muscular (que aumenta en relación a la masa grasa).
Los compuestos más utilizados son el decanoato de nandrolona y el estanazolol. El primero se utiliza por vía intramuscular en formulación de liberación retardada, mientras que el segundo se administra por vía oral a diario.
Los efectos bioquímicos que se han observado con estos compuestos son un descenso marcado de la calciuria junto con una disminución de la liberación del calcio desde el hueso. No hay un aumento de las cifras de PTH, lo que hace pensar que este efecto es mediado por aumento de la sensibilidad renal a la PTH que induce una mayor reabsorción tubular de calcio. Con respecto al metabolismo óseo, estudios realizados in vitro han confirmado una estimulación de las células osteoblásticas con fenómenos de proliferación ante la exposición a estos agentes.
Se han realizado estudios clínicos para valorar su efecto sobre el hueso; en un grupo de 47 enfermos tratados con estanazolol (6 mg/día) se observó un aumento significativo de la masa ósea total que se mantenía durante los 29 meses que duró el estudio, pero estos cambios en la masa ósea son diferentes según la zona que se estudiara. Se observó que el beneficio se aprecia fundamentalmente a nivel del hueso trabecular y menos a nivel cortical24.
Los efectos del decanoato de nandrolona también se han evaluado mediante la valoración de la DMO antes y después de su administración (duración media de 14 meses, dosis de 50 mg/2-3 semanas) observándose un aumento del 20% en la DMO vertebral25.
En cuanto a los efectos secundarios se ha observado una elevación de las cifras de transaminasas hepáticas, que a veces es transitoria, y que no contraindica el tratamiento a menos que estos niveles excedan el doble del límite superior de la normalidad. Los efectos virilizantes de hirsutismo hacen que las enfermas abandonen el tratamiento aunque existe una gran variabilidad individual.
Hoy día el uso de estos fármacos está más limitado por los potenciales efectos secundarios, ya que disponemos de otros muy potentes y que tienen menos inconvenientes en su utilización.
ANÁLISIS DE RIESGO-BENEFICIO
Riesgos potenciales y efectos secundarios
Cáncer de próstata/hiperplasia prostática benigna. No hay datos en la actualidad para afirmar que el tratamiento con andrógenos acelere la evolución de un cáncer de próstata que esté en situación preclínica. De la misma forma, aunque sabemos que son necesarios tanto los andrógenos como los estrógenos para el aumento de tamaño prostático se desconoce el efecto nocivo que tendría un tratamiento con andrógenos a largo plazo sobre esta proliferación celular.
Perfil lipídico. Los varones tienen un perfil lipídico con colesterol HDL menor y colesterol LDL mayor que las mujeres premenopáusicas. Esto sugiere que las diferencias observadas en la mortalidad cardiovascular entre estos dos grupos de población pueden obedecer en gran medida a estas diferencias en la relación HDL/LDL. También se ha visto que el tratamiento con esteroides anabolizantes produce un marcado descenso del colesterol HDL junto con un aumento del colesterol LDL. Esto no se ha observado en tratamientos con testosterona, probablemente debido a que ésta se transforma a nivel periférico en estradiol, lo que contrarresta el efecto androgénico sobre los lípidos.
Toxicidad hepática. Fundamentalmente observada con los esteroides anabolizantes aunque hay una gran variabilidad individual que incluye desde leves y transitorias elevaciones de las transaminasas hasta peliosis hepática, hepatomas o colestasis.
Hirsutismo y virilización. Son síntomas muchas veces mal tolerados por las enfermas lo que hace que a menudo rechacen el tratamiento. Al igual que la toxicidad hepática, existe variabilidad individual en esta respuesta.
Posibles beneficios
Osteoporosis. Está demostrado el efecto beneficioso sobre el hueso que tiene el tratamiento con testosterona en los casos de hipogonadismo, pero menos en sujetos sin alteraciones en el eje gonadotropo.
Sexualidad. Los andrógenos son necesarios para mantener el deseo sexual tanto en varones como en mujeres por lo que puede utilizarse este efecto como coadyuvante de otras indicaciones.
Hoy por hoy la indicación de tratamiento con andrógenos está aceptada para el tratamiento de la osteoporosis asociada al hipogonadismo masculino en adultos. El tratamiento del hipogonadismo en niños ha de realizarse con mucha precaución para conseguir un desarrollo puberal completo y asegurarnos llegar a la talla diana26.