Comparar el índice de reserva de perfusión miocárdica (IRPM) medido por resonancia magnética cardíaca de estrés (RMC-estrés) con regadenosón en sujetos trasplantados frente a no trasplantados.
Material y métodosSe compararon, de forma retrospectiva, 20 trasplantados cardíacos consecutivos, asintomáticos y sin sospecha clínica de enfermedad microvascular, a quienes se realizó RMC-estrés con regadenosón y coronariografía por TC (CTC) para descartar enfermedad vascular del injerto (EVI) respecto a 16 sujetos no trasplantados, con RMC-estrés realizada por indicación clínica, negativa para isquemia y sin signos de cardiopatía estructural. El IRPM se estimó de forma semicuantitativa tras calcular el valor de la pendiente durante la perfusión de primer paso y dividir el valor obtenido en estrés respecto al reposo. Se comparó IRPM en ambos grupos. Los pacientes con RMC-estrés positiva para isquemia o CTC con estenosis coronaria significativa fueron derivados a coronariografía convencional.
ResultadosMás de la mitad de los sujetos permanecieron asintomáticos durante la prueba de estrés. La RMC-estrés resultó positiva para isquemia en dos trasplantados, que se confirmó mediante CTC y coronariografía convencional. Los pacientes trasplantados presentaron menor volumen telediastólico indexado (59,3 ±15,2 ml/m2 frente a 71,4±15,9 ml/m2, p=0,03), menor IRPM (1,35±0,19 vs. 1,6±0,28, p=0,003 y menor respuesta hemodinámica al regadenosón que los no trasplantados (incremento medio de la frecuencia cardíaca de 13,1±5,4 lpm frente a 28,5±8,9 lpm, p<0,001).
ConclusiónLa RMC-estrés con regadenosón es una técnica segura. En ausencia de enfermedad coronaria epicárdica significativa, los trasplantados presentan menor IRPM que los no trasplantados, lo que sugiere enfermedad microvascular. En pacientes trasplantados, la respuesta hemodinámica esperable al regadenosón es menor que en no trasplantados.
To compare the myocardial perfusion reserve index (MPRI) measured during stress cardiac magnetic resonance imaging (MRI) with regadenoson in patients with heart transplants versus in patients without heart transplants.
Material and methodsWe retrospectively compared 20 consecutive asymptomatic heart transplant patients without suspicion of microvascular disease who underwent stress cardiac MRI with regadenoson and coronary computed tomography angiography (CTA) to rule out cardiac allograft vasculopathy versus 16 patients without transplants who underwent clinically indicated stress cardiac MRI who were negative for ischemia and had no signs of structural heart disease. We estimated MPRI semiquantitatively after calculating the up-slope of the first-pass enhancement curve and dividing the value obtained during stress by the value obtained at rest. We compared MPRI in the two groups. Patients with positive findings for ischemia on stress cardiac MRI or significant coronary stenosis on coronary CTA were referred for conventional coronary angiography.
ResultsMore than half the patients remained asymptomatic during the stress test. Stress cardiac MRI was positive for ischemia in two heart transplant patients; these findings were confirmed at coronary CTA and at conventional coronary angiography. Patients with transplants had lower end-diastolic volume index (59.3±15.2 ml/m2 vs. 71.4±15.9 ml/m2 in those without transplants, p=0.03), lower MPRI (1.35±0.19 vs. 1.6±0.28 in those without transplants, p=0.003), and a less pronounced hemodynamic response to regadenoson (mean increase in heart rate 13.1±5.4 bpm vs. 28.5±8.9 bpm in those without transplants, p <0.001).
ConclusionStress cardiac MRI with regadenoson is safe. In the absence of epicardial coronary artery disease, patients with heart transplants have lower MPRI than patients without transplants, suggesting microvascular disease. The hemodynamic response to regadenoson is less pronounced in patients with heart transplants than in patients without heart transplants.
El trasplante cardíaco es el tratamiento de elección para pacientes con insuficiencia cardíaca terminal1. En esta población, la enfermedad vascular del injerto (EVI) continúa siendo la principal causa de fallo del injerto y muerte tras el primer año del trasplante. La EVI es una forma de arteriosclerosis acelerada en la que existe una infiltración vascular por macrófagos repletos de lípidos y se produce como consecuencia del rechazo crónico. Aunque su patogenia no es bien conocida, se postulan factores inmunológicos y no inmunológicos que provocan una respuesta inmunitaria crónica que favorece el desarrollo de la enfermedad2. Se manifiesta como un engrosamiento difuso y concéntrico de la capa intimal de las arterias epicárdicas e intramurales del injerto2. En estudios de seguimiento, se estima que aproximadamente un 58% de los pacientes presenta engrosamiento intimal significativo tras el primer año del trasplante por ecografía intravascular (IVUS) y que el 42% de los pacientes presenta algún signo angiográfico de EVI a los 5 años del trasplante2.
Dada la importancia clínica de la EVI, los pacientes trasplantados son sometidos a un control estricto y a revisiones anuales. En este seguimiento tienen un papel clave las pruebas de imagen. El estándar de referencia para diagnosticar la EVI es la coronariografía convencional asociada a la IVUS. Dada la afectación de la microvascularización distal, en el contexto del trasplante cardíaco y, sobre todo para detectar EVI subclínica, las técnicas de imagen funcionales pueden tener mayor utilidad que las pruebas anatómicas. En estudios realizados con tomografía por emisión de positrones (PET), recientemente se ha observado que los pacientes trasplantados poseen valores de flujo miocárdico disminuidos respecto a los sujetos no trasplantados3. Algunos trabajos también han evaluado el papel de la resonancia magnética cardíaca (RMC) en esta población, y han demostrado que esta técnica también se puede emplear para detectar precozmente la microvasculopatía del injerto, tanto mediante estudios convencionales4 como con protocolos de estrés, que permiten analizar la perfusión miocárdica5. La mayoría de estos trabajos de perfusión se han llevado a cabo empleando los fármacos vasodilatadores tradicionales (adenosina y dipiridamol)6. Se ha descrito que la adenosina puede estar relativamente contraindicada en pacientes con trasplante cardíaco debido a que el nodo sinusal del corazón denervado posee mayor sensibilidad a la adenosina exógena que el nodo inervado. Por tanto, potencialmente este grupo de pacientes posee mayor riesgo de bloqueo auriculoventricular prolongado7,8. Apenas se conoce la utilidad del regadenosón en este contexto clínico9.
Este trabajo se realizó con el objetivo de establecer la utilidad diagnóstica de la RMC-estrés con regadenosón para detectar disfunción de la microvascularización en pacientes con trasplante cardíaco. Se postula que la RMC-estrés podría detectar EVI en estadios precoces y ser de utilidad en el manejo clínico de los pacientes.
Material y métodosSujetosSe estudiaron de forma retrospectiva 20 pacientes consecutivos con trasplante cardíaco ortotópico a quienes se realizó RMC-estrés y coronariografía por TC (CTC) para descartar EVI en un intervalo de tiempo menor de 1 semana. Los pacientes se encontraban asintomáticos en el momento del estudio y sin sospecha clínica de enfermedad microvascular. Estos pacientes fueron comparados con 16 sujetos control, no trasplantados, emparejados por edad y sexo, a quienes se realizó RMC-estrés por indicación clínica y cuyo resultado fue negativo, no mostraron realce tardío de gadolinio ni otros signos de cardiopatía estructural. Se excluyeron los pacientes trasplantados con síntomas sugestivos de isquemia, sospecha clínica de enfermedad microvascular o situación hemodinámica inestable. A los pacientes se les pidió que no tomaran café ni otras bebidas o comidas que contuvieran sustancias estimulantes 24 horas antes de la exploración. El protocolo de estudio fue aprobado por el comité de ética de nuestro centro (proyecto 149/2015) y todos los pacientes firmaron el consentimiento informado para participar en el estudio.
Protocolo de RMC-estrésLos estudios de RMC se realizaron en un equipo de 1,5 Tesla (Magnetom Aera, Siemens Healthineers, Erlangen, Alemania), con una bobina de superficie de 6 canales. Se empleó un protocolo de RMC-estrés/reposo convencional que incluía secuencias específicas para valorar la anatomía y función del corazón, secuencias de perfusión miocárdica y secuencias de caracterización tisular10. Se utilizó regadenosón (Rapiscan, GE Healthcare) como fármaco vasodilatador para inducir el estrés, administrado como dosis intravenosa única de 0,4mg (5 ml). El fármaco se administró mediante una infusión manual de unos 10 segundos de duración. El estudio de perfusión de estrés se llevó a cabo aproximadamente 70 segundos después de la administración del vasodilatador en tres cortes representativos del ventrículo izquierdo (basal, medioventricular y apical), con una secuencia Turbo-FLASH (TR: 2,96 ms; TE: 1,1ms, matriz: 160×82, campo de visión: 380×285mm, tamaño del vóxel: 2,4×2,4×10 mm; 10mm de grosor de corte, 59 segmentos, 50 adquisiciones), durante la administración de 0,075 mmol/kg de peso de gadobutrol (Gadovist, Bayer AG, Berlín, Alemania) a un flujo de 4 ml/s, con un inyector de doble cabezal (Medrad Inc, Warrendale, Pennsylvania, Estados Unidos). La perfusión de reposo se llevó a cabo 10 minutos después de la infusión del agente vasodilatador, empleando la misma secuencia y el mismo protocolo de inyección de contraste. Se utilizó eufilina intravenosa (200 mg) inmediatamente después de realizar la perfusión de estrés para revertir el efecto del regadenosón10.
Los pacientes fueron monitorizados durante todo el procedimiento mediante la toma de presión arterial (PA) y frecuencia cardíaca (FC) y se recogió cualquier efecto adverso que pudiera estar relacionado con el fármaco administrado, como broncoespasmo, bloqueo auriculoventricular, arritmias, taquicardia ventricular, fibrilación ventricular, necesidad de ingreso hospitalario, infarto de miocardio o fallecimiento.
Para conocer el efecto hemodinámico del regadenosón, se tomó la PA y la FC en reposo y bajo estrés farmacológico y se calculó su diferencia (FC pico – FC basal y PA pico – PA basal).
Protocolo de coronariografía-TCLas CTC se realizaron con un equipo de TC de doble fuente (SOMATOM Definition, Siemens Healthineers, Forchheim, Alemania) con el paciente en decúbito supino, en inspiración, en sentido craneocaudal y con sincronización ECG-retrospectiva. Se emplearon 120 kVp, 350mA para cada tubo, grosor de corte 64×0,6mm, colimación 64×0,6mm, tiempo de rotación de gantry 330ms y resolución temporal 83ms. Se utilizó un pitch variable (0,2-0,45) adaptado a la FC. La corriente del tubo se moduló de manera automática (ECGpulsing), administrándose la máxima dosis de radiación entre el 35% y el 70% del ciclo cardíaco y reduciéndose la corriente nominal del tubo al 5% en el resto de las fases del ciclo cardíaco. Los estudios se adquirieron tras inyectar 70ml de contraste yodado (Iohexol, OmnipaqueTM 300 mg/ml, General Electric, Madrid) seguidos de un bolo de 50ml de suero fisiológico a través de una vena antecubital a una velocidad de flujo constante de 5 ml/s con un inyector de doble jeringa (CT Stellant, Medrad Inc. Indianota, EE. UU.). El tiempo de retraso se calculó mediante la técnica de bolus tracking con la región de interés colocada en la aorta ascendente y un umbral de disparo de 100 unidades Hounsfield (UH). Las imágenes se reconstruyeron con un grosor de corte de 0,75mm, incremento de reconstrucción de 0,4mm y filtro de partes blandas (B26f). Las imágenes se archivaron en el sistema de archivo digital del hospital (Picture Archiving and Communication System, PACS).
Análisis de los estudiosLos estudios fueron evaluados por dos radiólogos de manera independiente. Un radiólogo con 16 años de experiencia en radiología cardíaca analizó los estudios de CTC sin conocer los resultados de la RMC y otro con 3 años de experiencia analizó los estudios de RMC sin conocer los resultados de la CTC. El análisis de los estudios de RMC se llevó a cabo en una estación de trabajo equipada con un programa específico (cmr 42, Circle Cardiovascular Imaging Inc., Calgary, Canadá). Para la valoración de la función ventricular se trazaron manualmente los contornos endocárdicos y epicárdicos del ventrículo izquierdo en las imágenes telediastólicas y telesistólicas obtenidas en el eje corto11. Los músculos papilares fueron excluidos del cálculo volumétrico y se incluyeron como masa miocárdica. Se obtuvieron la fracción de eyección (FE), el volumen telediastólico (VTD), el volumen telesistólico (VTS) y la masa miocárdica. Los parámetros se indexaron por área de superficie corporal.
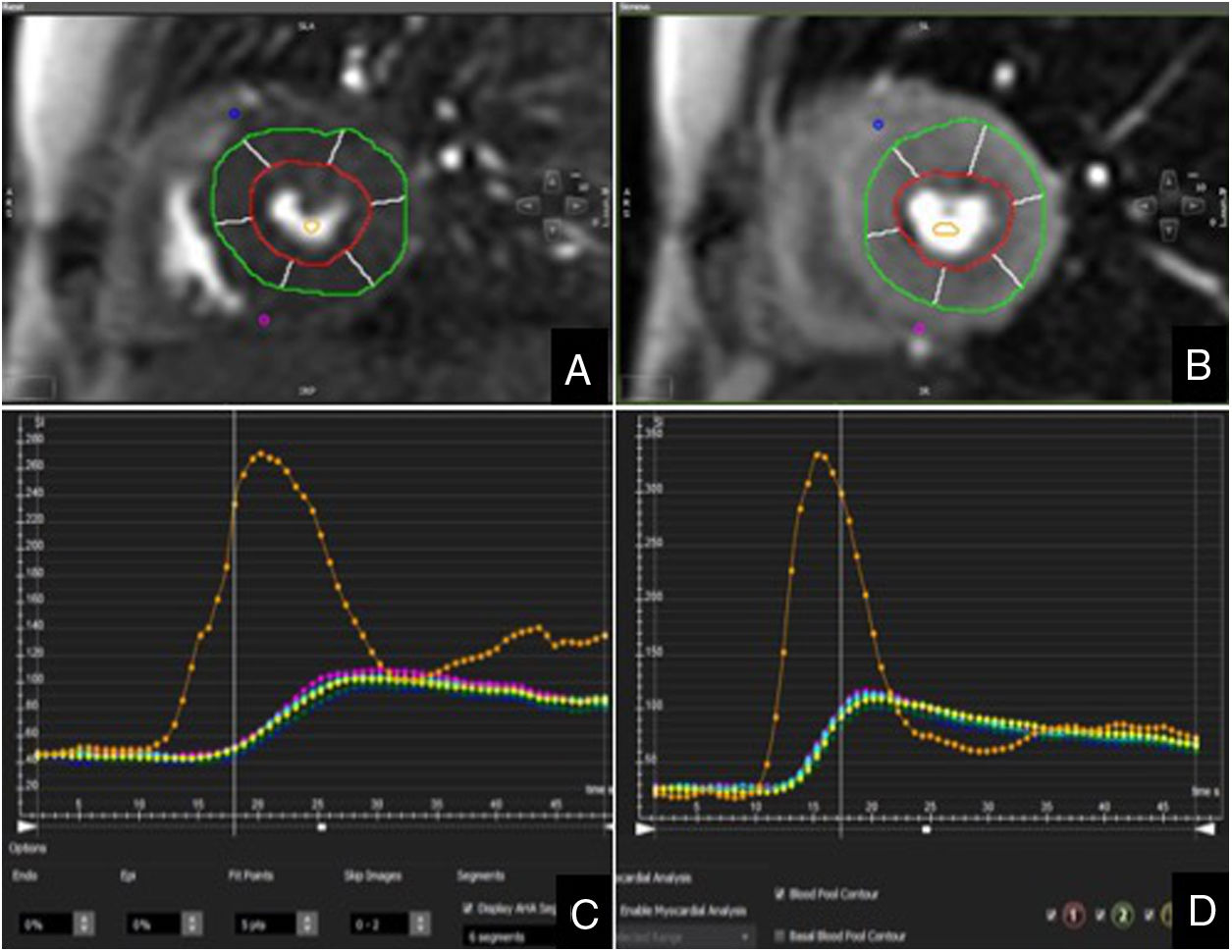
El análisis de la perfusión miocárdica se realizó de manera cualitativa y semicuantitativa. Para el análisis cualitativo o visual, el ventrículo izquierdo fue dividido en seis segmentos equiangulares en los cortes basal y medioventricular y en cuatro segmentos en el corte apical, según las recomendaciones de la American Heart Association12. Se evaluaron de forma simultánea las imágenes adquiridas en estrés y en reposo en el mismo visor y en modo cine. Se diagnosticó isquemia cuando en un segmento miocárdico se detectó ausencia de realce en la secuencia de perfusión de estrés, realce normal en la secuencia de perfusión en reposo y ausencia de hiperseñal en la secuencia de realce tardío. El análisis semicuantitativo se llevó a cabo en los segmentos medioventriculares. Primero se trazaron de manera manual los contornos endocárdicos y epicárdicos, excluyendo el miocardio más interno (10%) y más externo (30%), para evitar artefactos de volumen parcial. Posteriormente, se definieron los puntos de unión interventricular para dividir el miocardio en seis segmentos equiangulares y se dibujó una región de interés en la cavidad ventricular como muestra del contenido sanguíneo. Finalmente, los contornos fueron propagados a todas las imágenes. De esta manera se determinó la intensidad de señal del miocardio en todos los puntos temporales para calcular el tiempo al pico, el índice de perfusión y la pendiente para cada segmento miocárdico tanto en estrés como en reposo (fig. 1). Los valores de pendiente fueron corregidos por la intensidad de señal de la cavidad ventricular para compensar los cambios que se pudieran producir en la compactación y velocidad del bolo de contraste13,14. Se calculó el índice de reserva de perfusión miocárdica (IRPM) tras dividir la pendiente en máxima vasodilatación (estrés) respecto al reposo15. Se consideró patológico un valor de IRPM <1,216. Se excluyeron del análisis los estudios incompletos o de baja calidad. Tampoco se incluyeron en el análisis los segmentos miocárdicos que presentaran realce tardío de gadolinio secundario a infarto.
Trazado manual de los contornos endocárdicos y epicárdicos del ventrículo izquierdo en un corte medioventricular en reposo (A) y en estrés (B), con sus correspondientes curvas de perfusión en reposo (C) y en estrés (D). Eje de abscisas: tiempo en segundos; eje de ordenadas: intensidad de señal.
Las CTC se analizaron con un software comercial equipado con herramientas de posprocesamiento cardíaco avanzado (syngo.via, Siemens Healthineers), empleando la terminología CAD-RADS (Coronary Artery Disease Reporting and Data System)17, de manera que se consideró estenosis coronaria significativa la que presentara una reducción del diámetro de la luz del vaso de al menos un 50% (CAD-RADS ≥ 3).
Los pacientes con RMC-estrés positiva para isquemia o CTC con estenosis coronaria significativa fueron derivados a coronariografía convencional, considerándose como resultado positivo una reducción del diámetro de la luz del vaso de al menos un 50%. El análisis de los estudios de RMC se hizo por segmentos miocárdicos y la correlación entre CTC y coronariografía convencional, por vaso.
Análisis estadísticoLos datos se presentan como media±desviación estándar para las variables cuantitativas y como frecuencias y porcentajes para las variables cualitativas. La distribución normal de los datos se comprobó con la prueba de Kolmogorov-Smirnov. Se empleó la prueba de la t de Student para muestras independientes, para comparar las características de los sujetos, los parámetros ventriculares, los cambios en la FC y la PA y las diferencias en el IRPM. Para el análisis estadístico se utilizó el programa SPSS para Mac (versión 20.0/SPSS Inc., Chicago, IL). Se consideró estadísticamente significativo un valor de p <0,05.
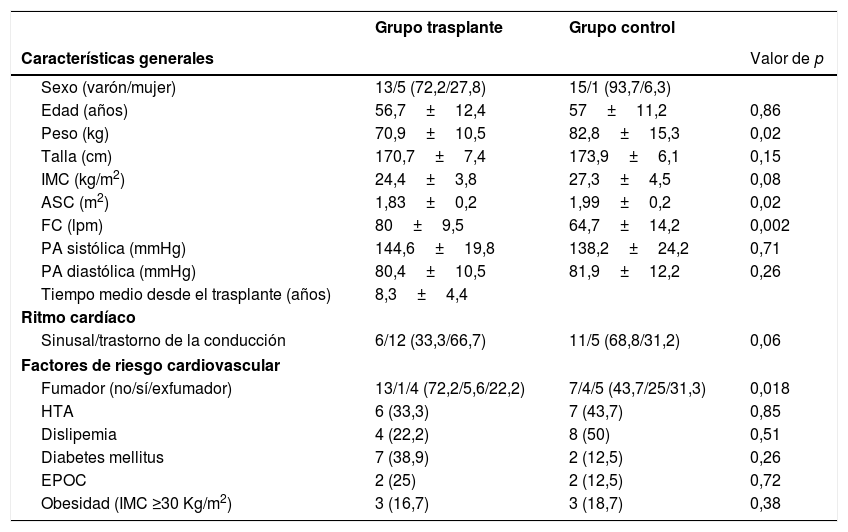
ResultadosPoblación de estudioDe los 20 pacientes trasplantados inicialmente se excluyeron 2 pacientes por problemas técnicos durante la adquisición del estudio de RM. De los 18 pacientes analizados, 13 eran varones y 5 mujeres, con una edad media de 56,7±12,4 años. El tiempo medio transcurrido entre el trasplante y el estudio de RMC fue de 8,3±4,4 años. De los 16 pacientes control, 15 eran varones y 1 mujer, con una edad media de 57±11,2 años. Los pacientes trasplantados presentaban una FC basal más alta que los del grupo control. Por el contrario, los controles mostraron mayor peso y área de superficie corporal que los pacientes trasplantados (p=0,02 y p=0,02, respectivamente). Las características demográficas generales, el ritmo cardíaco que presentaban al realizar el estudio y los factores de riesgo cardiovascular de ambos grupos se comparan en la tabla 1.
Características clínicas de los pacientes incluidos en el estudio
| Grupo trasplante | Grupo control | ||
|---|---|---|---|
| Características generales | Valor de p | ||
| Sexo (varón/mujer) | 13/5 (72,2/27,8) | 15/1 (93,7/6,3) | |
| Edad (años) | 56,7±12,4 | 57±11,2 | 0,86 |
| Peso (kg) | 70,9±10,5 | 82,8±15,3 | 0,02 |
| Talla (cm) | 170,7±7,4 | 173,9±6,1 | 0,15 |
| IMC (kg/m2) | 24,4±3,8 | 27,3±4,5 | 0,08 |
| ASC (m2) | 1,83±0,2 | 1,99±0,2 | 0,02 |
| FC (lpm) | 80±9,5 | 64,7±14,2 | 0,002 |
| PA sistólica (mmHg) | 144,6±19,8 | 138,2±24,2 | 0,71 |
| PA diastólica (mmHg) | 80,4±10,5 | 81,9±12,2 | 0,26 |
| Tiempo medio desde el trasplante (años) | 8,3±4,4 | ||
| Ritmo cardíaco | |||
| Sinusal/trastorno de la conducción | 6/12 (33,3/66,7) | 11/5 (68,8/31,2) | 0,06 |
| Factores de riesgo cardiovascular | |||
| Fumador (no/sí/exfumador) | 13/1/4 (72,2/5,6/22,2) | 7/4/5 (43,7/25/31,3) | 0,018 |
| HTA | 6 (33,3) | 7 (43,7) | 0,85 |
| Dislipemia | 4 (22,2) | 8 (50) | 0,51 |
| Diabetes mellitus | 7 (38,9) | 2 (12,5) | 0,26 |
| EPOC | 2 (25) | 2 (12,5) | 0,72 |
| Obesidad (IMC ≥30 Kg/m2) | 3 (16,7) | 3 (18,7) | 0,38 |
EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IMC: índice de masa corporal. Los porcentajes se muestran entre paréntesis.
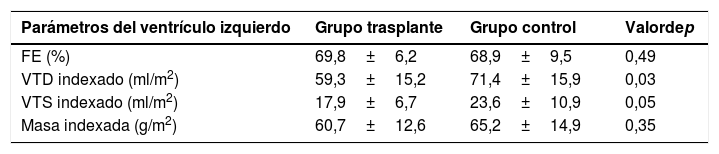
Los resultados del estudio de RMC-estrés se resumen en la tabla 2. Respecto al grupo control, los pacientes trasplantados presentaron un VTD indexado menor (59,3±15,2 ml/m2 frente a 71,4±15,9 ml/m2, p=0,03). Se observó hipertrofia concéntrica del ventrículo izquierdo en 38,9% de los pacientes trasplantados, remodelado concéntrico en 27,8% y morfología normal en 33,3%. En el grupo control, el ventrículo izquierdo presentó morfología normal en la mayoría de los pacientes (75%), y se observó remodelado concéntrico en el 12,4%, hipertrofia concéntrica en el 6,3% e hipertrofia excéntrica en el 6,3%.
Comparación de los volúmenes y la fracción de eyección del ventrículo izquierdo en los pacientes trasplantados y el grupo control
| Parámetros del ventrículo izquierdo | Grupo trasplante | Grupo control | Valordep |
|---|---|---|---|
| FE (%) | 69,8±6,2 | 68,9±9,5 | 0,49 |
| VTD indexado (ml/m2) | 59,3±15,2 | 71,4±15,9 | 0,03 |
| VTS indexado (ml/m2) | 17,9±6,7 | 23,6±10,9 | 0,05 |
| Masa indexada (g/m2) | 60,7±12,6 | 65,2±14,9 | 0,35 |
FE: fracción de eyección; VTD: volumen telediastólico; VTS: volumen telesistólico.
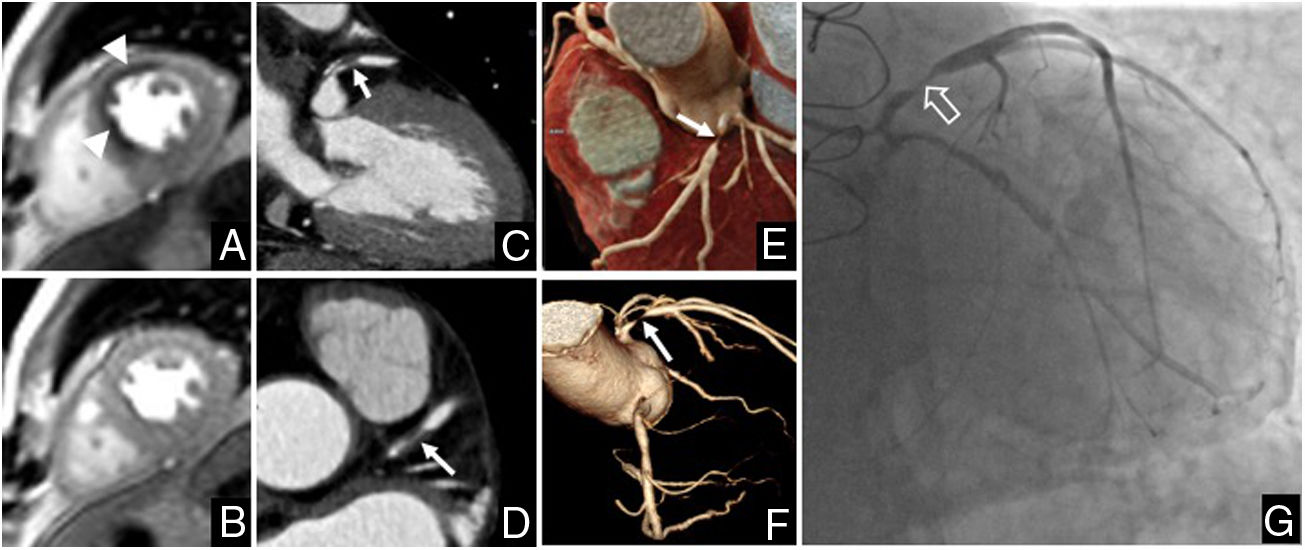
En el análisis cualitativo, la prueba de estrés resultó positiva en 2 pacientes trasplantados (11,1%). Se observó isquemia en los segmentos anterior y anteroseptal en un paciente e isquemia en los segmentos anterior y anterolateral en otro paciente. En CTC se observó estenosis del 70-99% en el segmento proximal de la arteria coronaria descendente anterior en un paciente y estenosis del 70-99% en el ramo intermedio en otro paciente, que se confirmaron mediante coronariografía convencional (fig. 2). Todos los pacientes trasplantados con RMC-estrés negativa presentaron CAD-RADS <3 en CTC.
Estudio realizado en un paciente varón de 65 con trasplante cardíaco 15 años antes por insuficiencia cardíaca secundaria a cardiopatía isquémica. A) RMC perfusión de estrés. B) RMC perfusión de reposo. El estudio mostró isquemia miocárdica en los segmentos anterior y anteroseptal medios (puntas de flecha). C a F) Coronariografía por tomografía computarizada (CTC). C y D) Reconstrucción multiplanar. E) Reconstrucción cinemática. F) Reconstrucción volumétrica del árbol coronario. En la CTC se observó estenosis del 70-99% en el segmento proximal de la arteria coronaria descendente anterior (flechas), que se confirmó mediante cateterismo (flecha hueca en G).
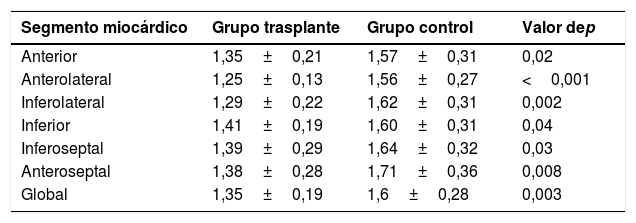
Al realizar el análisis semicuantitativo, se confirmó un IRPM <1,2 en los segmentos isquémicos. En un paciente se observó IRPM de 1,1 en los segmentos anterior y anteroseptal. En otro paciente, el IRPM fue de 1 en el segmento anterior y de 1,1 en el segmento anterolateral. En los trasplantados con RMC-estrés negativa se observó menor IRPM que en los sujetos del grupo control, tanto al analizarlo de forma global (1,35±0,19 vs. 1,6±0,28, p=0,003) como por segmentos miocárdicos (tabla 3).
Comparación por segmentos miocárdicos (corte medioventricular) de los índices de reserva de perfusión miocárdica entre los pacientes trasplantados con RMC-estrés negativa y el grupo control
| Segmento miocárdico | Grupo trasplante | Grupo control | Valor dep |
|---|---|---|---|
| Anterior | 1,35±0,21 | 1,57±0,31 | 0,02 |
| Anterolateral | 1,25±0,13 | 1,56±0,27 | <0,001 |
| Inferolateral | 1,29±0,22 | 1,62±0,31 | 0,002 |
| Inferior | 1,41±0,19 | 1,60±0,31 | 0,04 |
| Inferoseptal | 1,39±0,29 | 1,64±0,32 | 0,03 |
| Anteroseptal | 1,38±0,28 | 1,71±0,36 | 0,008 |
| Global | 1,35±0,19 | 1,6±0,28 | 0,003 |
La mayoría de los pacientes trasplantados mostraron un patrón de realce tardío de gadolinio no isquémico (72,2%). No se objetivó realce que sugiriera la presencia de infarto. En el grupo control, ningún paciente presentó realce tardío de gadolinio.
Síntomas clínicos, seguridad y respuesta hemodinámica del regadenosónMás de la mitad de los pacientes trasplantados permanecieron asintomáticos durante la administración del fármaco (55,6%). Los síntomas clínicos más frecuentes fueron la opresión centrotorácica (16,7%) y el enrojecimiento facial (16,7%). Un paciente refirió disnea y otro paciente, palpitaciones. En el grupo control, las manifestaciones clínicas debidas al regadenosón fueron similares: 10 (62,5%) pacientes permanecieron asintomáticos, 3 (18,7%) pacientes refirieron disnea, 2 (12,5%) pacientes opresión centrotorácica y 1 (6,3%) paciente enrojecimiento facial. No se observaron complicaciones que precisaran atención médica. Ningún paciente requirió ingreso hospitalario.
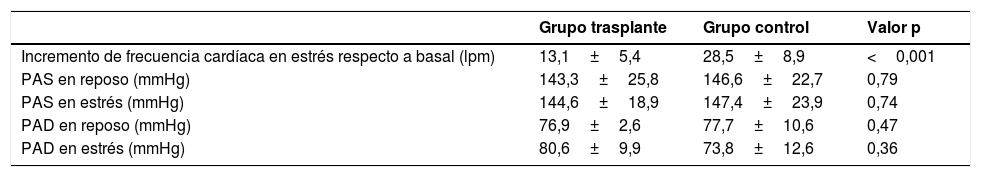
Como efecto de la vasodilatación inducida por el regadenosón se observó un incremento medio de la FC de 13,1±5,4 lpm en los pacientes trasplantados y de 28,5±8,9 lpm en los pacientes del grupo control (p <0,001). Las cifras medias de PA sistólica y diastólica en estrés y en reposo fueron similares en ambos grupos (tabla 4).
Comparación de parámetros de respuesta hemodinámica (frecuencia cardíaca y presión arterial) inducidos por el regadenosón entre los pacientes trasplantados y el grupo control
| Grupo trasplante | Grupo control | Valor p | |
|---|---|---|---|
| Incremento de frecuencia cardíaca en estrés respecto a basal (lpm) | 13,1±5,4 | 28,5±8,9 | <0,001 |
| PAS en reposo (mmHg) | 143,3±25,8 | 146,6±22,7 | 0,79 |
| PAS en estrés (mmHg) | 144,6±18,9 | 147,4±23,9 | 0,74 |
| PAD en reposo (mmHg) | 76,9±2,6 | 77,7±10,6 | 0,47 |
| PAD en estrés (mmHg) | 80,6±9,9 | 73,8±12,6 | 0,36 |
lpm: latidos por minuto; mmHg: milímetros de mercurio; PAS: presión arterial sistólica; PAD: presión arterial diastólica.
Este trabajo subraya la utilidad de la RMC-estrés para realizar una valoración global del corazón trasplantado. Además de cuantificar los parámetros ventriculares y caracterizar el tejido miocárdico, el estudio de perfusión permitió detectar isquemia miocárdica y poner de manifiesto una reducción del IRPM en este grupo de pacientes, hecho que sugiere disfunción microvascular.
En pacientes con trasplante cardíaco, actualmente se recomienda emplear la RMC como alternativa a la ecocardiografía en pacientes con mala ventana acústica con los objetivos de establecer los volúmenes y función de las cavidades cardíacas, excluir rechazo agudo y/o realizar el seguimiento de la EVI18. La RMC proporciona una medición exacta de los volúmenes y de la fracción de eyección de ambos ventrículos. Además, empleando las secuencias de realce tardío de gadolinio o técnicas más novedosas como los mapas paramétricos T1 y T2, permite cuantificar cambios en la estructura miocárdica y detectar alteraciones tisulares, como el edema y la fibrosis, secundarias al rechazo agudo o a la EVI4,19–21. En el caso concreto de la RMC-estrés se ha demostrado una reducción del flujo sanguíneo miocárdico en pacientes con EVI con respecto a la población normal, lo que permite estratificar la gravedad de la enfermedad vascular5,22. Los resultados de nuestro trabajo apuntan en la misma línea. En la población estudiada se objetivó que los pacientes trasplantados con RMC-estrés negativa presentaron menor IRPM que los pacientes del grupo control (1,35±0,19 frente a 1,6±0,28, p=0,003), una observación también similar a la llevada a cabo en estudios de PET, en los que se objetiva que los pacientes trasplantados presentan valores de perfusión miocárdica disminuidos respecto a los del grupo control en ausencia de defectos de perfusión cualitativos3. Un menor índice de perfusión miocárdica sugiere la existencia de disfunción microvascular secundaria a vasculopatía del injerto, fenómeno en el que las arterias coronarias epicárdicas no muestran lesiones significativas, pero en el que existe afectación de la microvascularización distal. De hecho, se ha descrito que el gradiente de perfusión endocárdico/epicárdico en reposo puede ser suficiente para establecer vasculopatía del injerto tras excluir la hipertrofia y el rechazo previo5. Por otra parte, el proceso de hipertrofia y remodelado ventricular que se da en los pacientes trasplantados implica un desequilibrio entre el aporte y la demanda de oxígeno del miocardio, de manera que se reduce la reserva de perfusión miocárdica. Nuestra población de trasplantados presentaba un VTD indexado significativamente menor que los pacientes del grupo control, observándose alteración de la morfología ventricular hasta en dos tercios de los sujetos, secundaria al proceso de remodelado descrito. Otra de las consecuencias de la afectación de la microvasculatura es que se pueden producir microinfartos, lo que podría justificar la presencia de focos de realce tardío de gadolinio. En nuestro grupo observamos depósito de gadolinio en el 72,2% de los pacientes trasplantados.
Una particularidad del estudio que se presenta es que se empleó regadenosón como fármaco vasodilatador. Tradicionalmente, los estudios de RMC-estrés se han realizado con adenosina o dipiridamol, aunque existe controversia sobre su seguridad, dado que la adenosina podría provocar bloqueo auriculoventricular prolongado en pacientes trasplantados debido a la mayor sensibilidad a la adenosina exógena del corazón denervado7,8. Según nuestro conocimiento, es el segundo trabajo que evalúa la eficacia y seguridad de dicho fármaco en estudios de RMC realizados en pacientes con trasplante cardíaco9. En nuestra cohorte observamos que la mayoría de los pacientes (el 55,6% de los trasplantados y el 62,5% de los no trasplantados) permanecieron asintomáticos durante su administración y que no ocurrieron efectos adversos, lo que subraya la seguridad del fármaco. La aparición de reacciones adversas al emplear otros vasodilatadores no es infrecuente. Por ejemplo, en el estudio Adenoscan, en el que se utilizó adenosina, se observaron efectos secundarios en la mayoría de los pacientes (81,1%)23. De la misma manera, en estudios llevados a cabo con dipiridamol, Rahnosky et al. objetivaron 2 casos de muerte por infarto de miocardio, 6 casos de infarto de miocardio y 6 casos de broncoespasmo agudo en una cohorte de 3911 pacientes24. La menor incidencia de efectos adversos relacionados con el regadenosón podría explicarse por su mecanismo de acción, que es selectivo del receptor A2a de la adenosina. De esta forma se evita la acción sobre los receptores A1, A2b y A3, responsable del broncoespasmo y del bloqueo auriculoventricular de alto grado que puede ocurrir al utilizar los demás vasodilatadores.
Una observación interesante de este trabajo es que, en los pacientes trasplantados, como respuesta hemodinámica inducida por el regadenosón, se observó menor incremento de la FC que en el grupo control (13,1±5,4 lpm frente a 28,5±8,9 lpm, p <0,001). Este hecho puede deberse a la disfunción autonómica que caracteriza al corazón trasplantado. Al encontrarse denervado, el injerto funciona de manera independiente, sin responder de forma fisiológica a los estímulos endógenos o exógenos que regulan su función, por lo que no responde al estímulo taquicardizante de la misma manera que un corazón fisiológicamente normal.
Este estudio posee limitaciones. Se incluyó un número de pacientes pequeño. Sin embargo, los hallazgos observados se encuentran en la línea de lo publicado por otros grupos. En nuestro trabajo se observaron defectos de perfusión atribuibles a enfermedad de arterias epicárdicas en 2 pacientes. En un estudio multiinstitucional se describe que a los 5 años del trasplante se observa enfermedad coronaria hasta en el 42% de los trasplantados, de manera leve en el 27%, moderada en el 8% y grave en el 7%25. El periodo postrasplante en que se realizó el estudio de RMC fue variable y no se evaluó la asociación entre el tiempo transcurrido desde el trasplante y los hallazgos de RMC. Tampoco se comprobó la existencia o no de enfermedad microvascular posteriormente para confirmar los hallazgos de la RMC. Por otra parte, no se dispone de coronariografía convencional de todos los pacientes. No obstante, en todos los trasplantados se realizó una CTC, una técnica que posee un elevado valor predictivo negativo para descartar enfermedad coronaria significativa en este grupo de sujetos26. Por último, la cuantificación del índice de reserva de perfusión miocárdica se realizó de manera semicuantitativa. Es necesario corroborar estos hallazgos con nuevas técnicas de perfusión por RMC, que permiten valorar de manera cuantitativa el flujo sanguíneo miocárdico27,28.
Como conclusión, la RMC y, en particular la RMC-estrés, es una técnica que permite realizar una valoración global del injerto cardíaco en el paciente trasplantado. Aun en presencia de RMC-estrés negativa, los pacientes trasplantados poseen menor IRPM que los sujetos no trasplantados, lo que posiblemente refleje una disfunción a nivel microvascular. El regadenosón es un fármaco vasodilatador seguro y bien tolerado por los pacientes trasplantados, aunque la respuesta hemodinámica esperable es menor que en sujetos normales, probablemente debido a la disfunción autonómica que les caracteriza. Se requiere realizar estudios adicionales para confirmar los resultados observados y establecer la utilidad clínica de la RMC para estratificar el riesgo y establecer su valor pronóstico en el seguimiento de este grupo de pacientes.
FinanciaciónEste trabajo muestra los resultados preliminares del proyecto 01 GBA INVESTIGACION SERAM 2015 financiado por una beca SERAM Industria 2015.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Autoría- 1.
Responsable de la integridad del estudio: JMJJ, AE, JMSD, MC, GR, GB.
- 2.
Concepción del estudio: JMJJ, AE, JMSD, MC, GB.
- 3.
Diseño del estudio: JMJJ, JMSD, GB.
- 4.
Obtención de los datos: JMJJ, AE, JMSD, GB.
- 5.
Análisis e interpretación de los datos: JMJJ, AE, JMSD, GB.
- 6.
Tratamiento estadístico: JMJJ, GB.
- 7.
Búsqueda bibliográfica: JMJJ, JMSD, MC, GR, GB.
- 8.
Redacción del trabajo: JMJJ, GB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectuales relevantes: JMJJ, AE, JMSD, MC, GR, GB.
Aprobación de la versión final: JMJJ, AE, JMSD, MC, GR, GB.