Evaluar el comportamiento de los adenomas y las metástasis suprarrenales mediante TC con energía espectral, analizando el coeficiente de atenuación en imágenes monocromáticas a tres niveles energéticos diferentes (45, 70 y 140KeV), y la concentración tisular de grasa, agua y iodo obtenidos en los mapas de descomposición de materiales, con el fin de establecer puntos de corte óptimos que permitan diferenciarlos, y comparar nuestros resultados con la evidencia publicada.
Materiales y métodosSe diseñó un estudio retrospectivo de casos y controles que incluyó pacientes oncológicos con diagnóstico de metástasis suprarrenal en los 6-12 meses anteriores al estudio y con seguimiento en el Hospital entre enero y junio de 2020. Por cada caso (paciente con metástasis) incluido en el estudio se seleccionó un control (paciente con adenoma suprarrenal) con un nódulo de tamaño similar. Todos los pacientes fueron estudiados con un equipo de TC con intercambio rápido de Kilovoltaje, con protocolo de adquisición bifásico. Se analizó la concentración de iodo en el par iodo-agua; la de grasa en el par grasa-agua y la de agua en los pares agua-iodo y agua-grasa, tanto en fases arterial como portal. También se analizó el coeficiente de atenuación en imágenes monocromáticas (a 55, 70 y 140KeV) en fases arterial y portal.
ResultadosEn las imágenes monocromáticas, el coeficiente de atenuación fue significativamente mayor en el grupo de las metástasis que en el grupo de los adenomas en todos los niveles energéticos, tanto en fase arterial como en fase portal. Esto permitió calcular el punto de corte óptimo para clasificar las lesiones como metástasis o adenomas, menos para la fase arterial a 55KeV, donde el área bajo la curva (ABC) para el umbral estimado fue 0,68 y no fue considerado un buen criterio para clasificar las lesiones. Para la fase arterial a 70KeV, el ABC y su intervalo de confianza (IC 95%), el punto de corte óptimo y sus valores de sensibilidad (S) y especificidad (E) fueron de: 0,76 (0,663-0,899); 42,4 UH, 92% y 60%, respectivamente. Para 140KeV, fueron de: 0,94 (0,894-0,999) 18,9 UH; 88% y 94%, respectivamente. Para la fase portal a 55KeV, el ABC y su intervalo de confianza (IC 95%), el punto de corte óptimo y sus valores de S y E fueron de: 0,76 (0,663-0,899); 95,4 UH, 68% y 84%, respectivamente. A 70KeV, los valores fueron: 0,82 (0,757-0,955); 58,4 UH; 80% y 84%, respectivamente. A 140KeV: 0,9 (0,834-0,987);16.35 UH; 96%; 84%, respectivamente. En los mapas de descomposición de materiales, en la fase arterial únicamente se encontraron diferencias estadísticamente significativas en el par agua-iodo, donde la concentración de agua fue mayor para el grupo de las metástasis que para los adenomas (1018,8±7,6mg/cm3 vs 998,6±8,0mg/cm3, p<0,001). El ABC y su intervalo de confianza (IC 95%), el punto de corte óptimo y sus valores de S y E fueron de: 0,97 (0,893-0,999); 1012,5mg/cm3; 88%, 96%. El par agua-iodo en fase portal también evidenció diferencias significativas, con concentraciones de agua de nuevo mayores para metástasis que para adenomas (1019,7±12,1mg/cm 3 vs 998,5±9,1mg/cm3, p<0,001). El ABC y su intervalo de confianza (IC 95%), el punto de corte óptimo y sus valores de S y E fueron de 0,926 (0,807-0,977); 1009,5mg/cm3; 92%;92%. En el par agua-grasa portal, a pesar de observarse resultados significativos, no se obtuvo un ABC en la curva ROC que permitiera utilizarlo como buen criterio para clasificar las lesiones. Sin embargo, no se encontraron diferencias estadísticamente significativas en los mapas grasa-agua ni iodo-agua ni en fase arterial ni portal, ni el de agua-grasa en fase arterial.
ConclusionesLas imágenes monocromáticas evidencian diferencias en el comportamiento entre adenomas y metástasis suprarrenales en pacientes oncológicos estudiados con TC con contraste intravenoso, con atenuación mayor para el grupo de metástasis que para el de adenomas, tanto en fase arterial como en fase portal, con un patrón acorde con la evidencia publicada para adenomas. Sin embargo, no tenemos conocimiento de otras publicaciones que describan umbrales de corte en este tipo de diferenciación en imágenes monocromáticas con contraste con equipos con intercambio rápido de Kilovoltaje, y esa es la primera aportación novedosa de nuestro estudio. Sobre los mapas de descomposición de materiales, nuestros resultados sugieren que el par agua-iodo es una buena herramienta para discriminar metástasis y adenomas suprarrenales tanto en fase arterial como en fase portal, y se proponen umbrales de corte, sin que tengamos otra referencia previa en la literatura de un umbral en fase portal con contraste con equipos de intercambio rápido de kilovoltaje.
To evaluate the behavior of adrenal adenomas and metastases with dual-energy CT, analyzing the attenuation coefficient in monochromatic images at three different levels of energy (45, 70, and 140KeV) and the tissue concentrations of fat, water, and iodine in material density maps, with the aim of establishing optimal cutoffs for differentiating between these lesions and comparing our results against published evidence.
Materials and methodsThis retrospective case-control study included oncologic patients diagnosed with adrenal metastases in the 6-12 months prior to the study who were followed up in our hospital between January and June 2020. For each case (patient with metastases) included in the study, we selected a control (patient with an adrenal adenoma) with a nodule of similar size. All patients were studied with a rapid-kilovoltage-switching dual-energy CT scanner, using a biphasic acquisition protocol. We analyzed the concentration of iodine in paired water-iodine images, the concentration of fat in the paired water-fat images, and the concentration of water in the paired iodine-water and fat-water images, in both the arterial and portal phases. We also analyzed the attenuation coefficient in monochromatic images (at 55, 70, and 140KeV) in the arterial and portal phases.
ResultsIn the monochromatic images, in both the arterial and portal phases, the attenuation coefficient at all energy levels was significantly higher in the group of patients with metastases than in the group of patients with adenomas. This enabled us to calculate the optimal cutoffs for classifying lesions as adenomas or metastases, except for the arterial phase at 55KeV, where the area under the receiver operating characteristic curve (AUC) for the estimated threshold (0.68) was not considered accurate enough to classify the lesions. For the arterial phase at 70KeV, the AUC was 0.76 (95% CI: 0.663-0.899); the optimal cutoff (42.4 HU) yielded 92% sensitivity and 60% specificity. For the arterial phase at 140KeV, the AUC was 0.94 (95% CI: 0.894-0.999); the optimal cutoff (18.9 HU) yielded 88% sensitivity and 94% specificity). For the portal phase at 55KeV, the AUC was 0.76 (95% CI: 0.663-0.899); the optimal cutoff (95.4 HU) yielded 68% sensitivity and 84% specificity. For the portal phase at 70KeV, the AUC was 0.82 (95% CI: 0.757-0.955); the optimal cutoff (58.4 HU) yielded 80% sensitivity and 84% specificity. For the portal phase at 140KeV, the AUC was 0.9 (95% CI: 0.834v0.987); the optimal cutoff (16.35 HU) yielded 96% sensitivity and 84% specificity. In the material density maps, in the arterial phase, significant differences were found only for the iodine-water pair, where the concentration of water was higher in the group with metastases (1018.8±7.6mg/cm3 vs. 998.6±8.0mg/cm3 for the group with adenomas, p<0.001). The AUC was 0.97 (95% CI: 0.893-0.999); the optimal cutoff (1012.5mg/cm3) yielded 88% sensitivity and 96% specificity. The iodine-water pair was also significantly higher in metastases (1019.7±12.1mg/cm3 vs. 998.5±9.1mg/cm3 in adenomas, p<0.001). The AUC was 0.926 (95% CI: 0.807-0.977); the optimal cutoff (1009.5mg/cm3) yielded 92% sensitivity and 92% specificity. Although significant results were also observed for the fat-water pair in the portal phase, the AUC was insufficient to enable a sufficiently accurate cutoff for classifying the lesions. No significant differences were found in the fat-water maps or iodine-water maps in the arterial or portal phase or in the water-fat map in the arterial phase.
ConclusionsMonochromatic images show differences between the behavior of adrenal adenomas and metastases in oncologic patients studied with intravenous-contrast-enhanced CT, where the group of metastases had higher attenuation than the group of adenomas in both the arterial and portal phases; this pattern is in line with the evidence published for adenomas. Nevertheless, to our knowledge, no other publications report cutoffs for this kind of differentiation in contrast-enhanced monochromatic images obtained in rapid-kilovoltage-switching dual-energy CT scanners, and this is the first new contribution of our study. Regarding the material density maps, our results suggest that the water-iodine pair is a good tool for differentiating between adrenal adenomas and metastases, in both the arterial and portal phases. We propose cutoffs for differentiating these lesions, although to our knowledge no cutoffs have been proposed for portal-phase contrast-enhanced images obtained with rapid-kilovoltage-switching dual-energy CT scanners.
Los incidentalomas adrenales se observan en un 5% de los pacientes a los que se realiza una tomografía computarizada (TC). La mayoría son benignos, siendo el adenoma el más frecuente incluso en pacientes oncológicos. El radiólogo debe saber diferenciar entre adenoma y metástasis, para minimizar estudios complementarios que implican costes adicionales, exposición a radiaciones ionizantes y estrés para el paciente1–3.
El algoritmo diagnóstico para los incidentalomas adrenales del American College of Radiology2 se basa en una combinación de datos endocrinológicos, biopsia, estudios de imagen [tomografía por emisión de positrones-tomografía computarizada (PET-TC), TC y resonancia magnética (RM)], antecedentes oncológicos y estabilidad/crecimiento de la lesión.
En RM, la técnica más útil es la del desplazamiento químico (“chemical shift”). Cualitativamente, los adenomas presentan en fase opuesta una caída de señal. Cuantitativamente, puede calcularse el índice de intensidad de señal y la ratio de intensidad de señal adrenal/bazo. Un índice superior al16,5% y una ratioinferior a 0,71 son diagnósticos para adenoma. Ambos abordajes ofrecen resultados similares2–4.
La TC convencional analiza la densidad de una lesión y su tasa de lavado en una fase sin contraste y dos adquisiciones poscontraste: un portal a los 60-90 segundos y una tardía a los 15 minutos. Una densitometría inferior a 10 unidades Hounsfield (UH) en la fase sin contraste es diagnóstica de adenoma rico en lípidos, aunque hasta un tercio de ellos son pobres en lípidos, con atenuación mayor de 10 UH. En estos, el cálculo del porcentaje de lavado absoluto [(atenuación portal-atenuación tardía)/(atenuación portal-atenuación basal) × 100] y relativo [(atenuación portal-atenuación tardía)/atenuación portal × 100] son útiles, con ratios ≥ 60% y ≥40% diagnósticos de adenoma, respectivamente. Esto ha demostrado mejores resultados que el desplazamiento químico en la caracterización de adenomas con densitometría mayor de 20 UH2–11. Un parámetro alternativo es la ratio de realce relativo (atenuación portal-atenuación basal/atenuación basal × 100%), que con un umbral del 210% diferencia adenomas pobres en lípidos de no adenomas7.
La TC con energía espectral (dual o multienergía) permite diferenciar materiales por su diferente perfil de atenuación a distintos niveles energéticos. Esto, en la práctica, se consigue adquiriendo imágenes a dos niveles energéticos. Existen diferentes aproximaciones tecnológicas, según la fuente de rayos X o el detector. Por tipo de fuente, encontramos equipos con: doble tubo (DT, dos fuentes ortogonales que trabajan a diferentes voltajes, cada una con su detector); intercambio rápido de kilovoltaje (IRKV, un tubo alterna rápidamente entre kilovoltaje alto y bajo en cada rotación); “dual spin” (dos adquisiciones consecutivas, en cada rotación a un voltaje diferente) y “split-filter” (el haz atraviesa un filtro de oro y estaño, y es separado en el eje “z” en dos haces diferentes). Atendiendo al detector, están comercializados los equipos con detectores de doble capa (DDC, “dual layer”), con una capa superior e inferior que absorben los fotones de baja y alta energía, respectivamente. En un futuro cercano, el recuento de fotones (“photon-counting”), mediante detectores con un material semiconductor, permitirá detectar fotones con energías concretas12–14.
La TC con energía espectral aporta nuevas familias de imágenes 12–14:
- •
Imágenes sin contraste virtual (ISCV): una sustracción digital del iodo le confiere una apariencia similar a una imagen sin contraste (ISC).
- •
Imágenes monocromáticas (IMC): simulan la apariencia de las que se obtendrían si adquiriésemos con una fuente monoenergética; a bajos niveles energéticos aumenta la resolución del contraste y el realce vascular (pero también el ruido), y a altos niveles se reduce el artefacto metálico.
- •
Mapas de descomposición de materiales (MDM): permiten valorar la concentración tisular de un material mediante una aproximación por pares de materiales o algoritmos de descomposición multimaterial (tres o más materiales), asumiendo que en un vóxel solo existen los materiales preseleccionados, cuya composición es conocida, y se estima su proporción basándose en su perfil de atenuación a dos niveles energéticos. Esto permite crear mapas que muestran selectivamente el material que interese según las necesidades diagnósticas. El más frecuentemente empleado es el de iodo-agua.
Las ISCV fueron ampliamente estudiadas para la valoración de los adenomas por su potencial para obviar la fase sin contraste y reducir la dosis de radiación al paciente15–18. Se han descrito valores de sensibilidad (S) comparables, aunque algo menores, para el diagnóstico de adenoma comparando ISC e ISCV3,15. Un metaanálisis realizado por Conolly et al.1 describe una S similar entre ISC (57%) e ISCV (54%), aunque se han descrito rangos entre el 50% y el 71%19,20.
Es conocida la tendencia a la sobreestimación de la atenuación en las ISCV, independientemente del fabricante1,21–23. Botsikas et al.24 encontraron diferencias estadísticamente significativas de atenuación entre ISCV obtenidas a partir de la fase portal e ISC, con una diferencia media de 4,02 UH. Esto podría hacer que una lesión sea falsamente considerada como indeterminada al sobrepasar el umbral clásico de 10 UH en las ISCV, y está relacionado con la fase en la que se adquiere la serie de la que se originan las ISCV: dado que los adenomas alcanzan su pico de realce a los 60 segundos y luego experimentan un lavado, la atenuación en ISCV que provenga de una adquisición a 60 segundos (o más precoz) puede estar sobreestimada cuando se compara con las obtenidas a partir de adquisiciones más tardías. Se han propuesto umbrales de ≤22 UH para mejorar la S en el diagnóstico de adenoma rico en lípidos, aunque con menor especificidad (E)21,23. Por otro lado, se ha descrito S similar entre ISC e ISCV para distinguir entre nódulos benignos y malignos, tanto para equipos de DT como IRKV1,17,25.
Sin embargo, en la mayoría de los estudios oncológicos no se dispone de ISC, lo que obliga a elaborar estrategias para diferenciar entre adenomas y metástasis sin necesidad de volver a citar al paciente. El análisis de las IMC y MDM es una buena alternativa.
En las IMC, la atenuación de un tejido depende de su composición y del nivel energético empleado, y disminuye a medida que aumenta el nivel energético12,13. Numerosos estudios han evaluado la curva de atenuación espectral en estudios sin y con contraste en la diferenciación entre adenomas y no adenomas/metástasis 8,15,19,24–27.
Sobre los MDM existen menos referencias que describan el comportamiento de los adenomas y metástasis con equipos de DT (que analizan la densidad de iodo y fracción grasa)15,25, equipos de DDC (analizan la densidad de iodo)8,23 y equipos con IRKV (que analizan mapas de grasa-iodo y agua-iodo18, grasa-agua sin contraste26, grasa-iodo, iodo-grasa, grasa-agua y agua-grasa-agua28).
Un estudio piloto desarrollado por nuestro grupo, con un equipo de IRKV, valoró diferencias entre adenomas y metástasis suprarrenales en pacientes oncológicos, estudiando IMC y MDM en TC bifásicas con contraste. Se encontraron diferencias de atenuación en las IMC y en las concentraciones tisulares de iodo-agua, agua-iodo, grasa-agua y agua-grasa entre ambos grupos de lesiones29, y estos datos nos impulsaron a realizar este estudio con una muestra más amplia que nos permitiera analizar curvas ROC. Por tanto, el objetivo del estudio es evaluar el comportamiento de los adenomas y las metástasis suprarrenales mediante TC con energía espectral, analizando en el coeficiente de atenuación en IMC a tres niveles energéticos diferentes (45, 70 y 140 keV), y la concentración tisular de grasa, agua y iodo obtenidos en los MDM, con el fin de establecer puntos de corte óptimos que permitan diferenciarlos, y comparar nuestros resultados con la evidencia publicada.
Materiales y métodosEl protocolo de investigación de este estudio observacional, analítico, transversal y retrospectivo fue aprobado por la Comisión de Investigación del hospital.
Se incluyó a pacientes oncológicos con seguimiento en nuestro centro entre enero de 2018 y junio de 2020, con estudio de TC toraco-abdominopélvica bifásica (fase arterial y portal) adquirida con protocolo estandarizado de TC con energía espectral y estudios previos que sustentaran el diagnóstico de adenoma (control) o metástasis (caso) como mínimo desde los 6-12 meses anteriores al estudio y disponibles en el Picture Archiving and Communication System (PACS). Fueron excluidos aquellos pacientes en los que no se pudo acceder a los datos crudos (que permiten realizar el posproceso) en el PACS, y con hiperplasia suprarrenal, entendida como aumento de tamaño unilateral o bilateral (>10 mm de grosor), con forma nodular o márgenes uniformes, pero morfología preservada. Todos los pacientes incluidos firmaron en el documento de consentimiento informado su autorización para la utilización de sus datos clínicos en estudios de investigación antes de la realización de la prueba.
La referencia estándar para el diagnóstico de adenoma fueron los criterios diagnósticos descritos anteriormente para TC con contraste, RM y PET-TC y la estabilidad a lo largo del tiempo de seguimiento de cada paciente. Para las metástasis, el diagnóstico fue hecho ante la nueva aparición y/o crecimiento de una lesión adrenal en TC o RM, o con aumento de la actividad celular en PET-TC. En ningún caso se obtuvo confirmación histopatológica.
Por cada metástasis incluida en el estudio, se seleccionó un adenoma con un tamaño similar, como se describe en “Resultados”. Todos los pacientes fueron estudiados con un equipo de TC con IRKV (Revolution CT; GE Healthcare, Waukesha, WI). Se empleó contraste iodado (Iopamiro 300 mg/ml solución inyectable, Bracco Imaging S.P.A), administrándose un volumen de 90 cc a un flujo de 4 cc/s. La fase arterial se adquiere monitorizando la llegada del contraste a la aorta torácica descendente (a nivel de la carina). Se coloca una región de interés (ROI) en esta localización y comienza la adquisición arterial a los 15 segundos de superarse un umbral de 100 UH. La fase portal se adquiere a los 35 segundos tras la finalización de la fase arterial. El protocolo de adquisición de imágenes espectrales fue: adquisición helicoidal; tiempo de rotación: 0,6 s; cobertura del detector: 80 mm; pitch: 0,992:1; velocidad de cobertura: 132,29 mm/s; FOV: 38,5 cm; 195 mA; noise index 20,0; grosor de corte: 1,25 mm; intervalo 0,8 mm; ASIR-V: 50%.
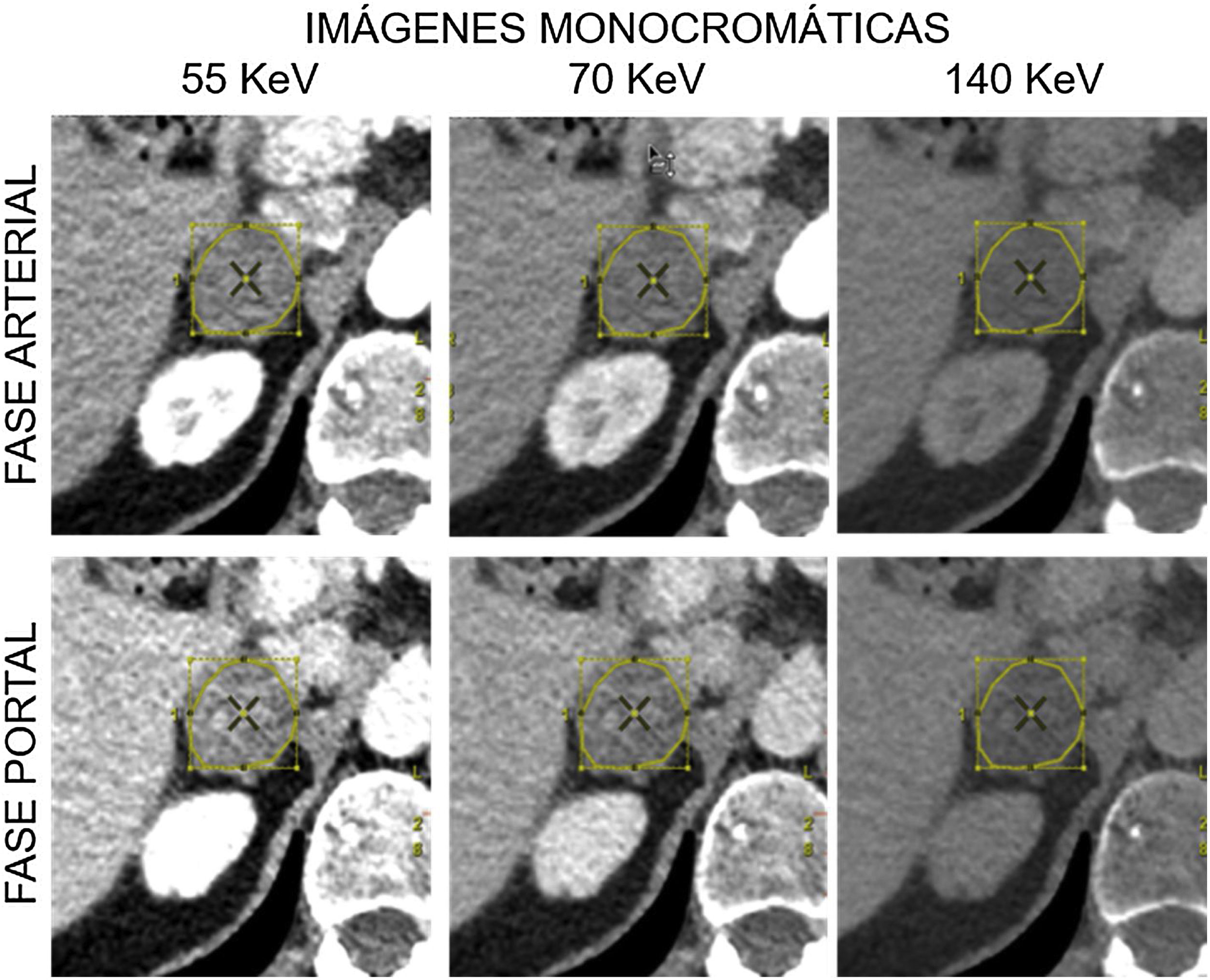
Se revisaron las TC y la historia clínica para obtener las variables de estudio: tumor primario, tipo de lesión (adenoma/metástasis), lateralidad (derecha/izquierda), coeficiente de atenuación en IMC (a 55, 70 y 140 keV) en fase portal y arterial (fig. 1); concentración de iodo en el par iodo-agua; concentración de grasa en el par grasa-agua y concentración de agua en los pares agua-iodo y agua-grasa, todo ello en fases arterial y portal (fig. 2). Cada nódulo fue valorado a ciegas por un mismo radiólogo con 10 años de experiencia en radiología del abdomen. En pacientes con más de un nódulo, se eligieron un máximo de dos, escogiendo aquellos de mayor tamaño o morfología nodular más evidente. Se empleó un programa proporcionado por el fabricante para generar un protocolo de carga con los niveles energéticos y los mapas elegidos con centro y ancho de ventana constantes (Advantage Workstation Server 3.2 Ext 3.2, GE Healthcare,Waukesha, WI). Se dibujó una ROI a mano alzada cubriendo el 50-75% del área de cada lesión en el corte axial en el que su morfología nodular fuera más evidente (evitando artefactos, calcificaciones, estructuras vasculares y áreas necróticas/hemorrágicas), que se clonó y propagó a las diferentes series del estudio, con un posproceso aproximado de 15 minutos por nódulo. Todos los resultados se almacenaron en el PACS y se recogieron de datos en una base de datos disociada, conforme a la legislación vigente.
En el análisis estadístico, para la descripción de la población de estudio, las variables cualitativas se expresan como frecuencias absolutas (n) y relativas (%). Todas las variables cuantitativas presentaron una distribución normal (prueba de Shapiro-Wilk), por lo que se aportan valores medios±desviación estándar (DE).
Se aplicó la prueba t de Student para comparar la concentración tisular de grasa en el par grasa-agua, iodo en el par iodo-agua, y agua en los pares agua-grasa y agua-iodo obtenida mediante MDM (expresados en mg/cm3) y también los coeficientes de atenuación (UH) en las IMC (a 55, 70 y 140 keV) entre metástasis y adenomas.
En aquellos parámetros en los que se evidenciaron diferencias entre adenomas y metástasis, se construyeron curvas ROC y se calculó el área bajo la curva (ABC) y su intervalo de confianza (IC) al 95% para valorar la bondad de la clasificación de la lesión. Se consideró que un parámetro clasificaba la lesión de forma aceptable cuando el ABC era superior a 0,7, en cuyo caso se calculó el punto de corte óptimo, y S y E de la clasificación para tal punto.
Las diferencias se consideraron estadísticamente significativas cuando el valor de p fue inferior al 5%. El análisis de los datos se realizó con Stata IC, v. 14 (StataCorp LLC., Texas USA).
ResultadosEntre enero de 2018 y junio de 2020, de los 133 pacientes elegibles, 52 cumplieron los criterios de inclusión/exclusión. Diecinueve pacientes presentaron un total de 25 nódulos metastásicos. Los restantes 33 presentaron un total de 43 adenomas, y se eligió a los 19 pacientes que presentaban los 25 adenomas con un tamaño similar a las metástasis. La figura 3 resume estos datos y describe la demografía de la muestra. La tabla 1 describe el tamaño de las lesiones tras aplicar el criterio de emparejamiento. Con respecto al tumor primario de los pacientes incluidos en el estudio, el pulmón fue el más frecuente en ambos grupos, y todos los pacientes contaban con al menos TC previas para comparar, presentando algunos además PET-TC y/o RM para confirmar la sospecha diagnóstica de metástasis o adenoma (tabla 2).
Tamaño de los nódulos suprarrenales clasificados como adenomas o metástasis
| Adenomas suprarrenales (n=25) | Metástasis suprarrenales (n=25) | P-valor* | |||
|---|---|---|---|---|---|
| Tamaño en eje antero-posterior (Mediana [Q1-Q3], mm) | 19 | [16-27] | 25 | [19-35] | 0.089 |
| Tamaño en eje transversal (Mediana [Q1-Q3], mm) | 15 | [12-20] | 20 | [14-27] | 0.05 |
Tumor primario de los pacientes oncológicos incluidos en el estudio y correlación con estudios previos para sustentar el diagnóstico, bien sean de la misma modalidad de imagen (TC) o diferente (PET-TC o RM)
| Primario | Correlacion con previos | ||||
|---|---|---|---|---|---|
| Localizacion | Frecuencia | TC | RM | PET-TC | |
| Pacientes con adenomas suprarrenales (n=19) | Pulmón | 10 (52,6%) | 10 (100%) | 0 | 4 |
| Mama | 4 (21%) | 3 (75%) | 1 (25%) | 0 | |
| Estómago | 1 (5,2%) | 1 (100%) | 0 | 0 | |
| Linfoma No Hodgkin | 1 (5,2%) | 1 (100%) | 0 | 0 | |
| Recto y colangiocarcinoma | 1 (5,2%) | 1 (100%) | 0 | 0 | |
| Laringe y pulmón | 1 (5,2%) | 1 (100%) | 0 | 0 | |
| Esófago | 1 (5,2%) | 1 (100%) | 0 | 0 | |
| Pacientes con metástasis suprarrenales (n=19) | Pulmón | 13 (68,4%) | 10 (77%) | 1 (7,6%) | 9 (69,2%) |
| Renal | 2 (10,5%) | 2 (100%) | 0 | 1 (50%) | |
| Estómago | 2 (10,5%) | 3 (100%) | 0 | 0 | |
| Colon | 1 (5,3%) | 1 (100%) | 0 | 0 | |
| Mama | 1 (5,3%) | 1 (100%) | 0 | 0 | |
Para las IMC, la tabla 3 resume el coeficiente de atenuación de las metástasis y los adenomas a 55, 70 y 140 keV, en fase arterial y portal. En todos los casos, el coeficiente de atenuación fue significativamente superior en el grupo de las metástasis que en el grupo de los adenomas. La figura 4 muestra las curvas ROC y ABC de todas las combinaciones, que fue mayor de 0,7. Esto permitió calcular el punto de corte óptimo para clasificar las lesiones como metástasis o como adenomas, menos para la fase arterial a 55 keV, donde el ABC para el umbral estimado fue de 0,68 y no fue considerado un buen criterio para clasificar las lesiones. Para la fase arterial, a 70 keV, la curva ROC presentó un ABC de 0,76 (IC95%: 0,663-0,899) para un punto de corte óptimo de 42,4 UH (S: 92%, E: 60%). A 140 keV, la curva ROC presentó un ABC de 0,94 (IC95%: 0,894-0,999) para un punto de corte óptimo de 18,9 UH (S: 88%, E: 94%). Para la fase portal, a 55 keV, la curva ROC presentó un ABC de 0,76 (IC95%: 0,663-0,899) para un umbral de 95,4 UH (S: 68%, E: 84%). A 70 keV, la curva ROC presentó un ABC de 0,82 (IC95%: 0,757-0,955) para un punto de corte óptimo de 58,4 UH (S: 80%, E: 84%). A 140 keV, la curva ROC presentó un ABC de 0,9 (IC95%: 0,834-0,987) para un punto de corte óptimo de 16,35 UH (S: 96%, E: 84%).
Coeficientes de atenuación (media±DE, UH) en nódulos suprarrenales clasificados como adenomas o metástasis
| Adenomas suprarrenales (n=25) | Metástasis suprarrenales (n=25) | Diferencia* (IC 95%) | P-valor** | ||
|---|---|---|---|---|---|
| Arterial | |||||
| 55 KeV | 68.7±33,74 | 96.66±36,1 | -28.0±9,9 | (-47,8, -8,1) | 0.007 |
| 70 KeV | 39.9±21,1 | 64.7±19,7 | -24.8±5,8 | (-36,4, -13,2) | <0,001 |
| 140 KeV | 7.7±9,3 | 28.8±5,9 | -21.2±2,2 | (-25,6, -16,7) | <0,001 |
| Portal | |||||
| 55 KeV | 73.9±34,9 | 112.0±35,0 | -38.1±8,5 | (-55,1, -21,0) | <0,001 |
| 70 KeV | 42.8±16,2 | 73.9±19,8 | -31.2±5,1 | (-41,4, -20,9) | <0,001 |
| 140 KeV | 8.2±9,7 | 31.4±10,4 | -23.2±2,8 | (-28,9, -17,6) | <0,001 |
En los MDM (tabla 4), en fase arterial solo se encontraron diferencias estadísticamente significativas en el par agua-iodo, con concentraciones de agua mayores para las metástasis que para los adenomas. La curva ROC reveló un ABC de 0,97 (IC95%: 0,893-0,999). El punto de corte óptimo para clasificar la lesión como metástasis o adenoma fue de 1012,5 mg/cm3 (S: 88%, E: 96%, fig. 5).
Mapas de descomposición (media±DE, mg/ml) en nódulos suprarrenales clasificados como adenomas o metástasis
| Adenomas suprarrenales (n=25) | Metástasis suprarrenales (n=25) | Diferencia* (IC 95%) | P-valor** | ||
|---|---|---|---|---|---|
| Fase arterial | |||||
| Grasa-Agua | -1186.3±540,6 | -1318.7±685,7 | 132.4±174,6 | (-218,7, 483,5) | 0.452 |
| iodo-Agua | 15.3±7,1 | 17.1±9,0 | -1.7±2,3 | (-6,4, 2,9) | 0.412 |
| Agua-Grasa | 2189.8±546,0 | 2343±686,8 | -153.2 | (-506,1, 199,6) | 0.389 |
| Agua-iodo | 998.6±8,0 | 1018.8±7,6 | -100.5±80,1 | (-261,6, 60,6) | <0,001 |
| Fase portal | |||||
| Grasa-Agua | -1267.8±360,1 | -1557.6±676,8 | 289.7±153,3 | (-18,5, 598,0) | 0.065 |
| iodo-Agua | 16.5±4,7 | 20.3±8,9 | -3.9±2,0 | (-7,9, 0,2) | 0.061 |
| Agua-Grasa | 2278.4±363,5 | 2592.1±677,3 | -313.6±153,7 | (-622,7, -4,5) | 0.047 |
| Agua-iodo | 998.5±9,1 | 1019.7±12,1 | -101.8±80,3 | (-263,2, 59,6) | <0,001 |
En la fase portal, los adenomas presentaron una tendencia a mayor concentración de grasa en el par grasa-agua que las metástasis, mientras que las metástasis tendieron a presentar mayor concentración de iodo en el par iodo-agua que los adenomas, con resultados no significativos (tabla 4). Se encontraron diferencias estadísticamente significativas para el par agua-grasa y agua-iodo, con mayor concentración de agua para las metástasis que para los adenomas en ambos pares. Para el par agua-grasa, la curva ROC reveló un ABC de 0,675, por lo que no fue considerado un buen criterio para clasificar las lesiones. Para el par agua-iodo, la curva ROC presentó un ABC de 0,926 (IC95%: 0,807-0,977) y pudo estimarse un punto de corte óptimo de 1009,5 mg/cm3 para diferenciar entre adenomas y metástasis (S: 92%; E: 92%, fig. 5).
ConclusionesEl estudio analiza diferencias entre adenomas y metástasis utilizando IMC y MDM, al no disponer de ISC en nuestro protocolo de adquisición.
En las IMC, el coeficiente de atenuación fue mayor para el grupo de metástasis que para el de adenomas en los tres los niveles energéticos evaluados, tanto en fase arterial como en fase portal. Esto confirma los hallazgos de nuestro estudio piloto29 y es un patrón acorde con la evidencia publicada: Glazer et al.15 y Botsikas et al.24 describen un comportamiento similar en su serie de adenomas. Nuestros valores de atenuación en fase portal a 70 keV para adenomas y metástasis son muy similares a los descritos por Martin et al. en una fase portal convencional a 120 kVp25. Sin embargo, no tenemos conocimiento de otras publicaciones que describan umbrales de corte en IMC con contraste en este tipo de diferenciación con IRKV, y esa es la primera aportación novedosa de nuestro estudio. Las imágenes a 140 keV aportan las mayores cifras de S y E. El potencial de estas imágenes para la diferenciación entre adenomas y metástasis frente a las ISCV o ISC es otro aspecto interesante, aunque son necesarios estudios adicionales para justificarlo. Por otro lado, en nuestra serie parece existir un descenso del coeficiente de atenuación en los dos grupos de lesiones a medida que aumentamos el nivel energético, aunque estos resultados deben ser constatados en otro estudio con un análisis estadístico diferente.
También se han estudiado las IMC obtenidas a partir de ISC en la diferenciación entre adenomas y metástasis: Ju et al.26 describen diferencias significativas de atenuación en todos los niveles energéticos entre 40 y 140 keV, menor para los adenomas que para las metástasis, siendo máxima la diferencia a 40 keV. A este nivel, un umbral de 21,78 UH distingue entre los dos grupos (S: 92,1%, E: 76,6%). Además, encontraron curvas de atenuación espectral diferentes: a bajos niveles energéticos, las metástasis presentan valores de atenuación más altos, y progresivamente descienden a medida que aumenta el kilovoltaje, al contrario que los adenomas. Gupta et al.19 observaron hallazgos similares en cuanto a atenuación, y ambos emplearon IRKV. Shi et al.27, con equipo de DT, describen S: 78,6% y E: 100% en la diferenciación de adenomas y metástasis para un umbral de más 2,42 UH de diferencia entre 80 y 140 keV y un umbral de más de 6,95 UH de diferencia entre 40 y 100 keV. Se ha descrito también un comportamiento similar con equipos de DDC8.
Sin embargo, estas mediciones están sujetas a variabilidad, por lo que hay que ser cautos al universalizar resultados. Se han descrito variaciones de atenuación entre fabricantes dependiendo del nivel energético y el tipo de lesión9,13,30 y diferencias intraindividuo en la atenuación en controles seriados con el mismo tipo de equipo y entre diferentes equipos, con menor variabilidad en fase portal que en arterial31,32.
En nuestros MDM encontramos diferencias significativas en las concentraciones de agua en el mapa agua-iodo (arterial y portal) y agua-grasa portal, aunque el par agua-iodo fue el que aportó las mediciones con niveles de significación estadística mayores y el único que permitió calcular umbrales con curvas ROC. Si revisamos la bibliografía, Morgan et al.18, con IRKV, estudiaron los pares grasa-iodo y agua-iodo en el diagnóstico de adenomas ricos en lípidos. Su adquisición espectral fue únicamente en “la fase parenquimatosa pancreática o arterial tardía hepática”, mientras que la fase basal y portal fueron adquiridas con un haz convencional. Para el mapa agua-iodo, describen un umbral de agua muy similar al nuestro, pero con menor S y E, y además no encontraron diferencias significativas entre adenomas con escaso contenido lipídico y otras lesiones con bajo contenido lipídico (p. ej., metástasis). No tenemos conocimiento de otras referencias al par agua-iodo portal en la diferenciación de adenomas y metástasis, por lo que el umbral de 1009,5 mg/cm3 es la segunda aportación novedosa de nuestro estudio.
Ju et al.26, con IRKV, valoraron mapas grasa-agua en estudios sin contraste. Encontraron diferencias significativas en la concentración de grasa, mayor para adenomas que para metástasis. En nuestra serie, la concentración grasa también fue mayor para los adenomas que para las metástasis en el par grasa-agua, aunque con valor de p no significativo. Creemos que esto estará probablemente relacionado con la contribución del iodo en los MDM.
Mileto et al.28 compararon los pares grasa-iodo, iodo-grasa, grasa-agua y agua-grasa en adenomas y metástasis con IRKV y adquisiciones con contraste, aunque con protocolos de adquisición espectral más heterogéneos que el nuestro. Al igual que nosotros, encontraron mayor concentración de grasa en el par grasa-agua en adenomas que en metástasis, mientras que en el par agua-grasa fueron mayores para las metástasis que para los adenomas, pero fueron capaces de hallar diferencias significativas en todos los pares. Comparativamente, nuestra serie presenta una concentración de agua mayor, probablemente debido a la homogeneidad del protocolo de adquisición espectral.
Glazer et al.15, con DT, encontraron una buena correlación entre ISC y los mapas de iodo-agua en su serie de adenomas.
Martin et al.25, con DT y adquisiciones basales y contrastadas, observaron valores menores de densidad de iodo y mayor fracción de grasa para los adenomas que para las metástasis
Con equipo de DDC se han descrito densidades mayores de iodo en fase portal para los adenomas que para las metástasis23, aunque la combinación de este valor con la atenuación en ISCV es superior al uso de ambos valores por separado (ratio iodo/ISCV).
Con todo, de nuevo existe variabilidad de las mediciones con MDM. Sobre la cuantificación del iodo, con DT se han descrito desviaciones sistemáticas con infraestimación de la concentración de iodo a concentraciones mayores de 10 mg/ml y sobreestimación a 10mg/ml o menos33. Con DDC, las estimaciones en fase portal están sujetas a una menor variabilidad intraindividuo32. Además, los equipos no son capaces de detectar concentraciones de iodo inferiores a 0,8-1 mg/cm3,34 y es necesario definir qué es realce, ya que con DT e IRKV se han descrito diferentes umbrales, de 0,5 mg/cm3 y 1,3-2,0mg/cm3, respectivamente13,35. Adicionalmente, se han descrito diferencias en la concentración absoluta de iodo en vísceras, ganglios y vasos por grupos de edad, sexo e índice de masa corporal en pacientes sanos36. Es más, la atenuación de las lesiones en ISC y su localización influyen en la cuantificación del iodo35. Esto abre las puertas a estudios multicéntricos con amplias muestras que permitan homogeneizar criterios y umbrales.
Nuestro estudio presenta varias limitaciones: es un estudio retrospectivo realizado en un único centro, con un tamaño muestral reducido y sin confirmación histológica en ninguno de nuestros pacientes. Tampoco se ha subdivido en análisis entre adenomas típicos y pobres en lípidos a la hora de comparar con el grupo de las metástasis. El único criterio de emparejamiento de los grupos fue el tamaño similar, pero el impacto de otros factores como el índice de masa corporal no fue analizado (esto podría ser paliado con un cálculo de valores normalizado con la aorta35,36). Adicionalmente, el grupo de las metástasis se nutre sobre todo del cáncer de pulmón, pero la naturaleza hipervascular de otro tipo de primarios pudiera haber sesgado los datos.
En resumen, tanto las IMC como los MDM obtenidos con energía espectral son de utilidad en la diferenciación entre adenomas y metástasis en pacientes oncológicos estudiados con TC con contraste intravenoso. El comportamiento de los adenomas y metástasis en IMC de nuestra serie se ajusta a los patrones ya publicados, pero como novedad se proponen umbrales de corte en este tipo de diferenciación en IMC con contraste con equipos con IRKV. Sobre los MDM, nuestros resultados sugieren que el par agua-iodo es una buena herramienta para discriminar metástasis y adenomas suprarrenales tanto en fase arterial como en fase portal, y se proponen umbrales de corte, sin que tengamos otra referencia previa en la literatura de un umbral en fase portal con contraste con equipos con IRKV.
Autoría- 1.
Responsable de la integridad del estudio: RCA.
- 2.
Concepción del estudio: RCA.
- 3.
Diseño del estudio: CAV, IJTV.
- 4.
Obtención de los datos: RCA, AAV, AFA.
- 5.
Análisis e interpretación de los datos: CAV, IJTV.
- 6.
Tratamiento estadístico: CAV, IJTV.
- 7.
Búsqueda bibliográfica: AAV, AFA, MRR.
- 8.
Redacción del trabajo: RCA.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: CAV, IJTV, MRR.
- 10.
Aprobación de la versión final: VMV, CAV, IJTV.
Los autores declaran no tener ningún conflicto de intereses.