Los gases hiperpolarizados (HP) son una nueva clase de agentes de contraste que permiten obtener imágenes por resonancia magnética (RM) de alta resolución temporal y espacial de los espacios aéreos pulmonares. La RM con gas HP se ha convertido en una importante herramienta de investigación no solo para la evaluación morfológica y funcional pulmonar normal sino también para cuantificar los cambios patológicos regionales que se dan en las enfermedades pulmonares. El propósito de este trabajo es introducir la RM con gases nobles HP, describiendo, para ello, tanto los principios técnicos básicos como la información sobre las enfermedades pulmonares que ofrecen los estudios clínicos realizados. También hacemos una revisión de sus aplicaciones en sujetos normales, en enfermedades pulmonares secundarias al tabaco, el asma y la fibrosis quística.
Hyperpolarized (HP) gases are a new class of contrast agents that permit to obtain high temporal and spatial resolution magnetic resonance images (MRI) of the lung airspaces. HP gas MRI has become important research tool not only for morphological and functional evaluation of normal pulmonary physiology but also for regional quantification of pathologic changes occurring in several lung diseases. The purpose of this work is to provide an introduction to MRI using HP noble gases, describing both the basic principles of the technique and the new information about lung disease provided by clinical studies with this method. The applications of the technique in normal subjects, smoking related lung disease, asthma, and cystic fibrosis are reviewed.
La resonancia magnética (RM) convencional se basa en la señal que emiten los protones de los núcleos de hidrógeno de las moléculas de agua y, en la actualidad, tiene un papel limitado en el pulmón, principalmente por su baja densidad protónica. El efecto de susceptibilidad inducida por sus muchas interfases aire-tejido y el movimiento cardíaco y respiratorio son otras limitaciones añadidas a la hora de intentar obtener imágenes del parénquima pulmonar.
Los gases hiperpolarizados (HP) son una nueva clase de medios de contraste que permiten obtener imágenes de RM de los espacios aéreos pulmonares. Todavía se consideran fármacos en fase de investigación y no han sido aprobados para uso clínico por la Administración para el Control de Alimentos y Fármacos (FDA) de EE. UU. Por eso, el uso de esta técnica está limitado a unos cuantos centros médicos académicos. A pesar de ello, la RM con gas HP se ha convertido en una importante herramienta de investigación, no solo para la evaluación morfológica y funcional del pulmón normal, sino también para cuantificar los cambios patológicos regionales en enfermedades pulmonares1–8. La RM con gas HP aporta información sobre ventilación, intercambio de gases y estructura del alvéolo y la vía aérea distal. Una de las muchas ventajas sobre la TC o la gammagrafía es que no utiliza radiación ionizante, lo cual la hace especialmente útil en los niños y en estudios repetidos o seriados.
El propósito de este trabajo es introducir la RM con gases nobles HP, describiendo tanto los principios básicos de esta técnica como la nueva información que aporta sobre enfermedades pulmonares.
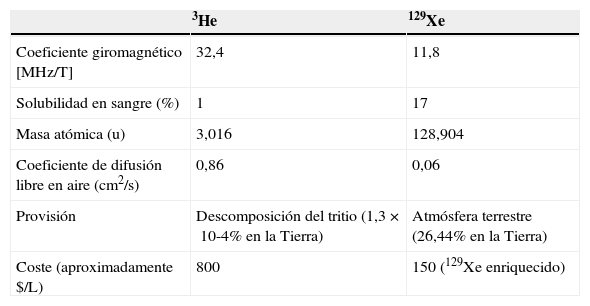
Técnica de la resonancia magnética con gas hiperpolarizadoGases hiperpolarizados: 3He y 129XeLos gases HP, al ser inhalados, permiten obtener imágenes de RM con una alta resolución temporal y espacial de los espacios aéreos pulmonares. Dos isótopos no radiactivos de gas noble, 3He y 129Xe, pueden hiperpolarizarse. A pesar del hecho de que ambos gases pueden hiperpolarizarse, los gases HP 3He y 129Xe tienen distintas propiedades fisiológicas (tabla 1). El 3He es muy poco soluble en sangre o en los tejidos, lo que lo convierte en un gas biológicamente inerte. Una vez inhalado, se mantiene, casi enteramente, dentro de los espacios aéreos. En cambio, la solubilidad del 129Xe en la sangre y los tejidos es relativamente alta, sobre todo en los lípidos, lo que lo convierte en un gas biológicamente activo, con propiedades anestésicas a dosis altas. Es la solubilidad del xenón en los tejidos biológicos lo que hace que sea un medio de contraste tan prometedor para la RM. El 129Xe permite evaluar con RM el intercambio de gases entre los alvéolos y los capilares9–13. Los primeros estudios de RM con gas HP se obtuvieron utilizando el 129Xe HP14. No obstante, debido a la mayor señal del 3He (un nivel más alto de polarización y un coeficiente giromagnético más alto) y a que es más seguro, buena parte del trabajo inicial desarrollado en humanos con RM con gas HP se ha realizado con 3He. Pero en los últimos años ha habido una demanda creciente de 3He para detectores de neutrones, excediendo esta demanda el índice de reabastecimiento de la fuente primaria, la descomposición del tritio. Ahora, el 3He es caro y las reservas mundiales son limitadas. En cambio el 129Xe es muy abundante en la Tierra. Hasta hace poco, las polarizaciones eran más altas con 3He que con 129Xe, pero se ha desarrollado la nueva tecnología que consigue cantidades más grandes de 129Xe altamente polarizado15. Debido a la ilimitada cantidad de este gas en la naturaleza, a sus cada vez menores costes, a los avances hechos en tecnología de polarizadores con xenón así como a la reciente contracción en la demanda de 3He, el 129Xe puede empezar a usarse más generalizadamente.
Gases hiperpolarizados. Propiedades físicas y fisiológicas
| 3He | 129Xe | |
|---|---|---|
| Coeficiente giromagnético [MHz/T] | 32,4 | 11,8 |
| Solubilidad en sangre (%) | 1 | 17 |
| Masa atómica (u) | 3,016 | 128,904 |
| Coeficiente de difusión libre en aire (cm2/s) | 0,86 | 0,06 |
| Provisión | Descomposición del tritio (1,3×10-4% en la Tierra) | Atmósfera terrestre (26,44% en la Tierra) |
| Coste (aproximadamente $/L) | 800 | 150 (129Xe enriquecido) |
He: helio; MHz: megahercios; T: tesla; Xe: xenón.
Empleando un polarizador, los espines nucleares de los átomos del gas se alinean en un pequeño campo fuera de la RM, con lo que se logran polarizaciones de hasta el 50%, lo que es más de 100.000 veces la polarización de los núcleos de hidrógeno en un campo magnético de 1,5T16. El proceso de polarización, llamado bombardeo óptico, se realiza mediante el método de intercambio de espín con vapor de rubidio utilizado como metal alcalino15. Se utiliza nitrógeno de uso médico para conseguir una mezcla de aproximadamente el 30% de gas HP y el 70% de hidrógeno con un volumen total de aproximadamente 1/3 parte de la capacidad vital forzada del sujeto calculada mediante espirometría el mismo día del estudio. Para minimizar la posibilidad de sufrir efectos secundarios derivados del xenón en el sistema nervioso central, nuestro grupo ha ideado una estrategia de dosis de xenón para mantener la concentración alveolar máxima por debajo del 30%.
Tras la polarización, el gas se transfiere al interior de una bolsa de plástico, es transportado a la RM e inhalado por el sujeto por un tubo pequeño de plástico. Se le pide que aguante la respiración durante unos 20 s o menos. Los signos vitales, incluida la saturación de O2 en sangre y la frecuencia cardíaca, se monitorizan en todos los pacientes durante todo el procedimiento.
El alto nivel de polarización obtenido permite ver los espacios aéreos pulmonares con la RM. Obtenemos las imágenes de los propios gases HP directamente con la RM, a diferencia de los medios de contraste basados en gadolinio, que se usan para alterar las propiedades de relajación de los núcleos de hidrógeno cercanos.
Imágenes de resonancia magnéticaAdemás de la polarización del gas, se necesitan varios requisitos técnicos. La RM se modifica con un amplificador de banda ancha que permite operar a las frecuencias de resonancia del gas HP. Se precisan bobinas de radiofrecuencia específicas.
Al utilizar distintas secuencias, podemos obtener información tanto funcional como morfológica del pulmón. La RM con gas HP puede emplearse para estudiar la función pulmonar, utilizando para ello imágenes de densidad de espín estáticas y dinámicas (imagen de ventilación) o imagen sensible al oxígeno. El 129Xe HP permite, además, obtener información sobre el intercambio de gases. Por añadidura, la estructura pulmonar en los alvéolos y la vía aérea distal puede valorarse utilizando imágenes potenciadas en difusión.
- a.
Imagen de ventilación. Se obtiene con imágenes de densidad de espín mientras el sujeto aguanta la respiración tras inhalar el gas HP. Al respirar el gas HP, se llenan los espacios aéreos y, al obtener las imágenes de RM, vemos los cambios en la ventilación regional por la obstrucción del flujo aéreo. A las áreas del pulmón que están bien ventiladas llega mucho gas y se ven hiperintensas en la RM; mientras que las áreas mal ventiladas aparecen hipointensas (fig. 1). Esto es conceptualmente parecido a las imágenes de ventilación pulmonar de la medicina nuclear. La RM de ventilación dinámica se consigue utilizando secuencias ultrarrápidas y se utiliza para mostrar con una resolución temporal de subsegundo la distribución del gas en el parénquima pulmonar con el tiempo. Los procesamientos computacionales modernos permiten automatizar los datos para cuantificar los defectos de ventilación en las RM con gas HP17.
- b.
Medida de la presión de oxígeno (PO2) intrapulmonar. El índice de pérdida de polarización del gas está muy influido por el entorno local. El oxígeno, debido a su efecto paramagnético, acelera la relajación longitudinal del gas HP. Valorando el índice de pérdida de la polarización, es posible calcular indirectamente la concentración local de oxígeno18,19 y, por lo tanto, detectar las áreas de discordancia ventilación/perfusión.
- c.
Intercambio gaseoso alvéolo-capilar. Tras inhalar el 129Xe HP, el gas prosigue la ruta funcional del intercambio gaseoso en el pulmón, difundiéndose desde los espacios alveolares a los septos alveolares (sangre y tejido)20. Como los picos espectrales asociados a la magnetización de 129Xe en los diferentes compartimentos pulmonares tienen desplazamientos químicos diferentes, es posible monitorizar la cinética de la difusión de la magnetización de 129Xe de un compartimento a otro y distinguir la fase gaseosa del 129Xe (xenón dentro del espacio alveolar) de la de disolución (129Xe dentro del epitelio alveolar, intersticio, endotelio capilar y sangre).
Se han desarrollado varios métodos de adquisición de imágenes para obtener información tanto del intercambio como de la captación alvéolo-capilar de gases. En la recuperación de saturación con desplazamiento químico se emplea inicialmente un pulso selectivo de radiofrecuencia para destruir la magnetización de 129Xe en la fase disuelta. Se observa entonces la recuperación de la magnetización 129Xe de la fase disuelta, al difundir el 129Xe HP desde el alvéolo al intersticio alveolar21.
Comparado con la recuperación de saturación con desplazamiento químico, que calcula directamente la magnetización de xenón en la fase disuelta, el método de contraste por transferencia de xenón mide la difusión dentro de la fase disuelta indirectamente, analizando la atenuación de la señal de fase gaseosa tras múltiples oportunidades para la difusión de interfase21. Puede determinarse el coeficiente tejido pulmonar-volumen alveolar, el coeficiente superficie-volumen y el grosor de la barrera sangre-gas20.
- d.
Imágenes de difusión. En la RM convencional, el contraste en las imágenes de difusión depende del movimiento molecular del agua. Esta secuencia es sensible a las variaciones de este movimiento aleatorio de las moléculas, que puede verse alterado en la enfermedad. Este mismo principio se aplica a la RM potenciada en difusión con gas HP, aunque para estudiar el movimiento aleatorio de los átomos de gas que se encuentran dentro de los alvéolos. Los estudios se realizan utilizando secuencias de pulso con gradientes de difusión bipolar basadas en el eco de gradiente Fast Low Angle SHot (FLASH).
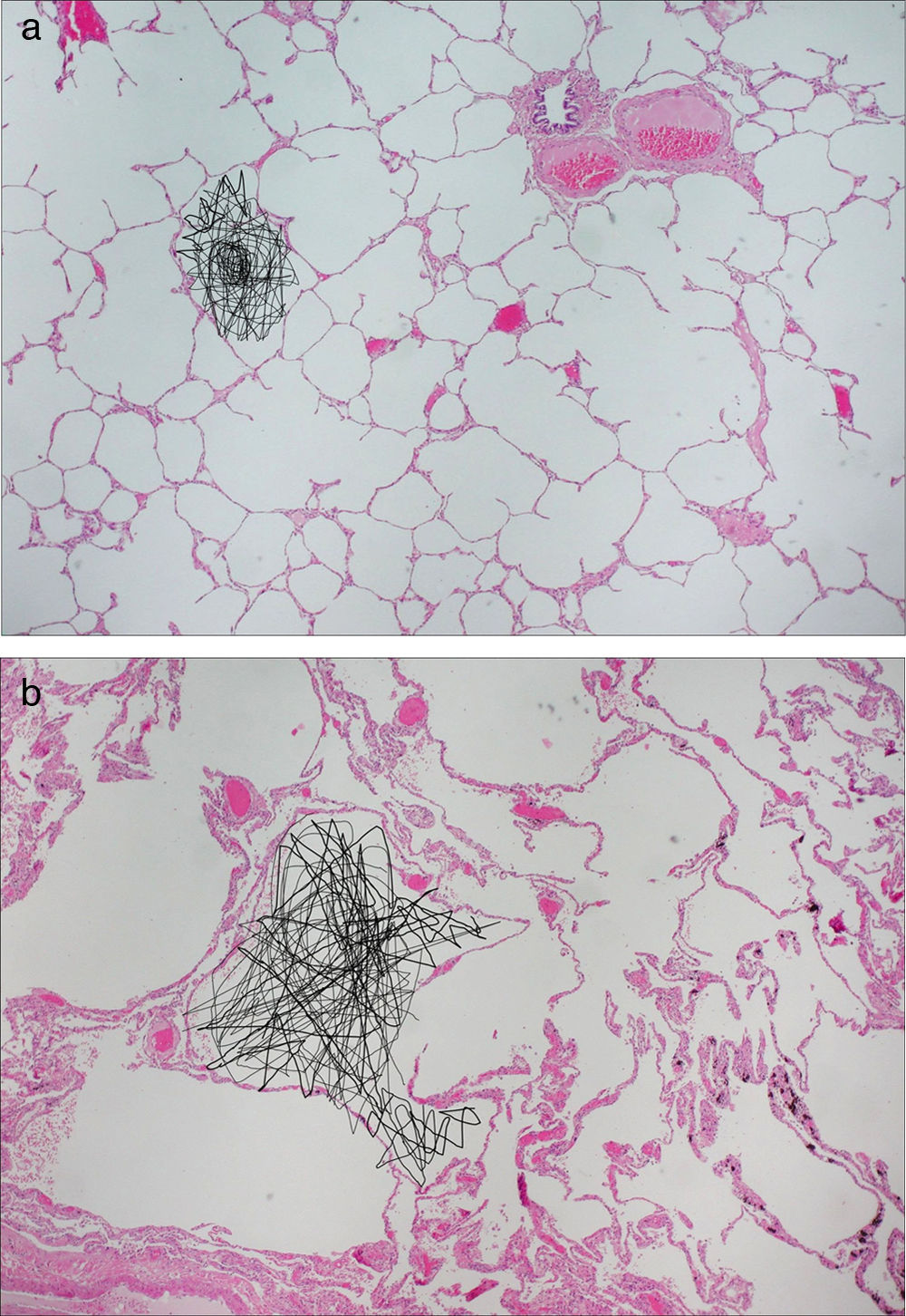
Las imágenes de difusión permiten estudiar la microestructura pulmonar. El movimiento difuso de las moléculas de gas HP dentro del espacio aéreo disminuye la señal de RM. A partir de estos datos puede determinarse un coeficiente de difusión aparente (CDA) y una distancia media asociada a la difusión. La evidencia sugiere que el CDA proporciona una medida cuantitativa no invasiva que se correlaciona con el tamaño y forma de los alvéolos22–27. En pacientes normales, la difusión del gas está restringida por las paredes alveolares, lo cual resulta en valores bajos y homogéneos del CDA. En pacientes con enfermedades que aumentan el tamaño de los alvéolos por la expansión de las vías aéreas acinares o la destrucción tisular, como el enfisema, la restricción de la difusión se reduce y el CDA del gas aumenta notablemente26–30 (fig. 2). Se han publicado correlaciones precisas entre el CDA global y el regional calculados mediante RM con gas HP y el tamaño alveolar medido anatomopatológicamente22,31–33.
Figura 2.RM potenciada en difusión con gas hiperpolarizado. Imagen anatomopatológica pulmonar con representación esquemática del movimiento aleatorio de las moléculas de gas dentro de los alvéolos. a) La difusión del gas está limitada por las paredes alveolares en los sujetos sanos. b) En pacientes con enfisema, las restricciones a la difusión son menores debido a la destrucción de las paredes alveolares.
(0.32MB).La morfometría pulmonar con 3He, que se basa en RM potenciada en difusión con He HP, permite obtener medidas cuantitativas tanto de las vías aéreas acinares como de la microgeometría alveolar. Basándose en el trabajo morfométrico del grupo de Weibel34, los acinos pulmonares se consideran como redes de vías aéreas cilíndricas recubiertas por alvéolos. Las medidas de la difusión de 3He se utilizan para determinar los radios ductales acinares y la profundidad del manguito alveolar. Pueden calcularse parámetros morfométricos estándar como la intercepción lineal media, el coeficiente superficie-volumen y la densidad alveolar35. La morfometría de 3He ha mostrado una excelente correlación con las medidas anatomopatológicas35.
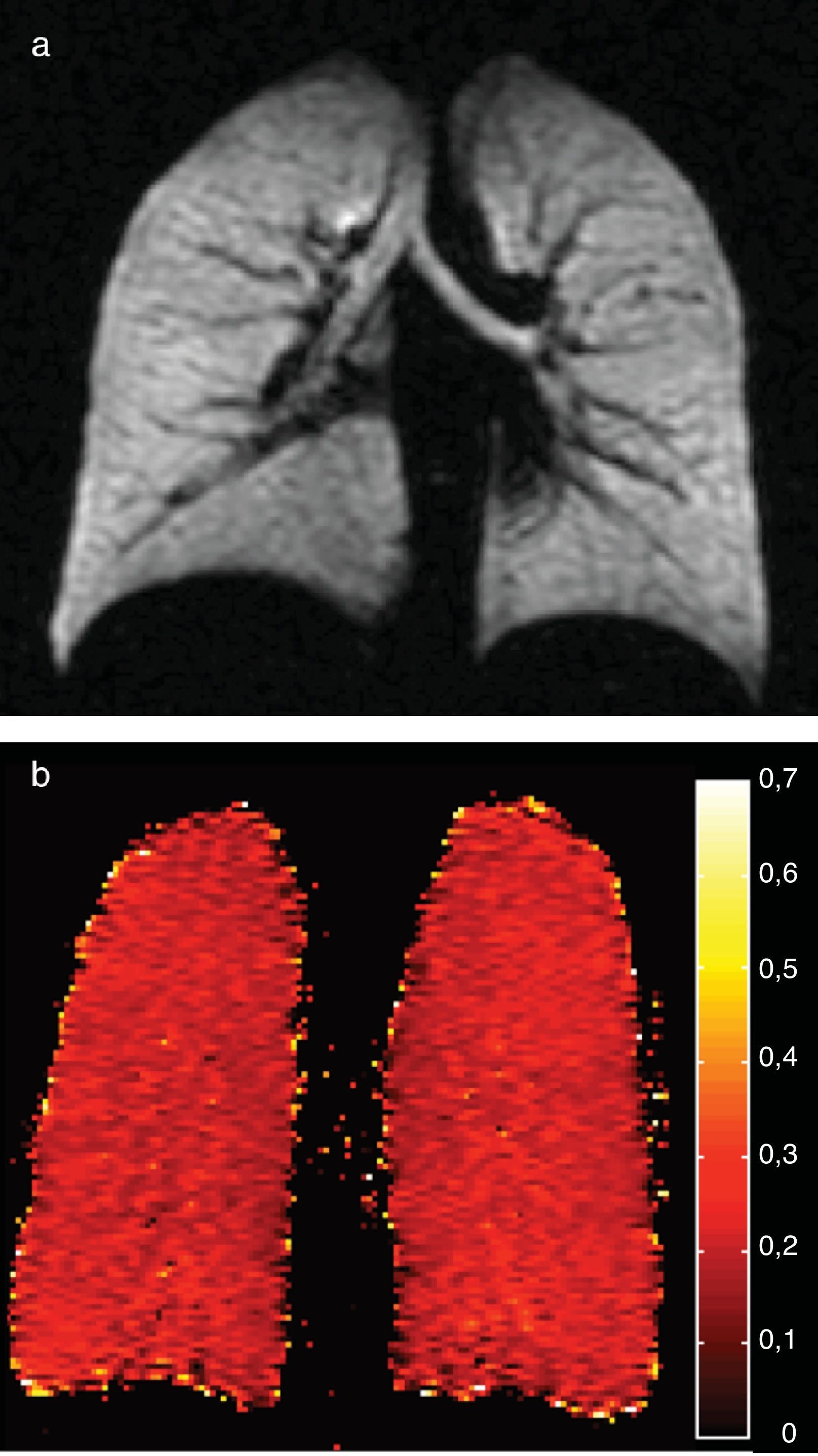
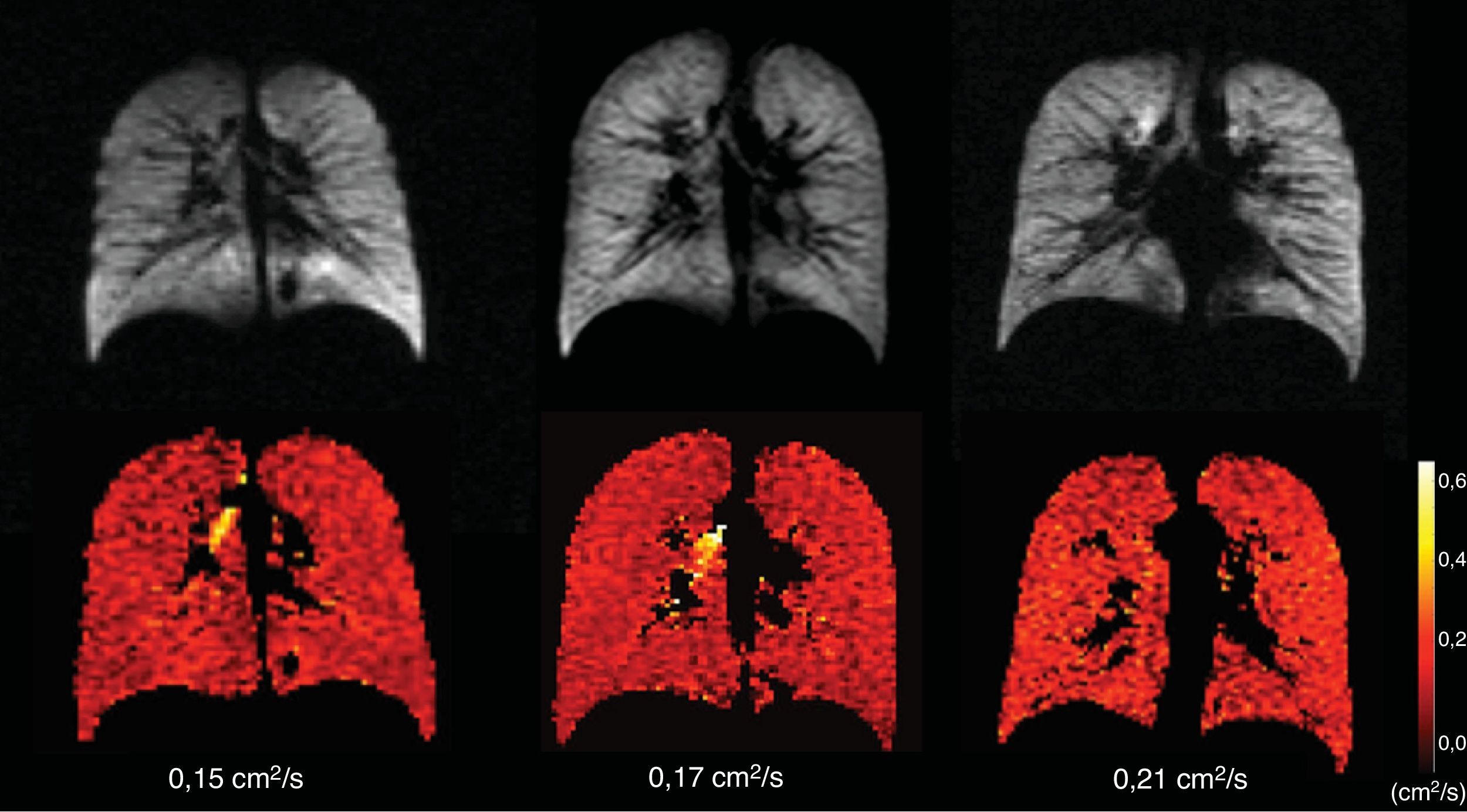
Los adultos jóvenes sanos suele tener una señal homogénea tanto en la ventilación del gas HP como en la RM-difusión, con valores de CDA uniformemente bajos (fig. 3). Un estudio de un grupo de 29 sujetos normales entre 4 y 30 años (media 14 años, desviación estándar 6,7 años) mostró una fuerte tendencia a un CDA mayor en la RM con 3He cuanto mayor era la edad, probablemente debido a un mayor tamaño alveolar a medida que el pulmón va creciendo, lo que indica que la RM con gas HP es capaz de estudiar incruentamente el crecimiento y desarrollo normal del pulmón (fig. 4)36. La alta sensibilidad del CDA para detectar el agrandamiento alveolar también se ha descrito en personas mayores que nunca han sido fumadoras23.
Cambios del CDA con 3He hiperpolarizado asociados a la edad. Imagenes de ventilación (abajo) y sus correspondientes mapas de CDA (arriba) en 3 sujetos sanos; de izquierda a derecha: un niño (10 años), una adolescente (22 años) y un adulto joven (29 años). Los 3 tienen una ventilación homogénea normal, sin defectos, y valores CDA homogéneamente bajos, si bien progresivamente más altos con la edad (0,15; 0,17 y 0,21cm2/s respectivamente). El lector puede ver esta figura en color en la versión electrónica del artículo.
También se han descrito cambios asociados a la edad en el patrón de ventilación. Ha quedado demostrado que los ancianos sanos sin enfermedad respiratoria conocida y con una espirometría normal tienen defectos de la ventilación que se localizan en la periferia del pulmón37. Con la edad, el porcentaje de pulmón ocupado por los defectos de ventilación aumenta, y el volumen de estos defectos no es muy distinto del volumen de defectos de la ventilación de exfumadores de la misma edad que sufren EPOC estadio II38.
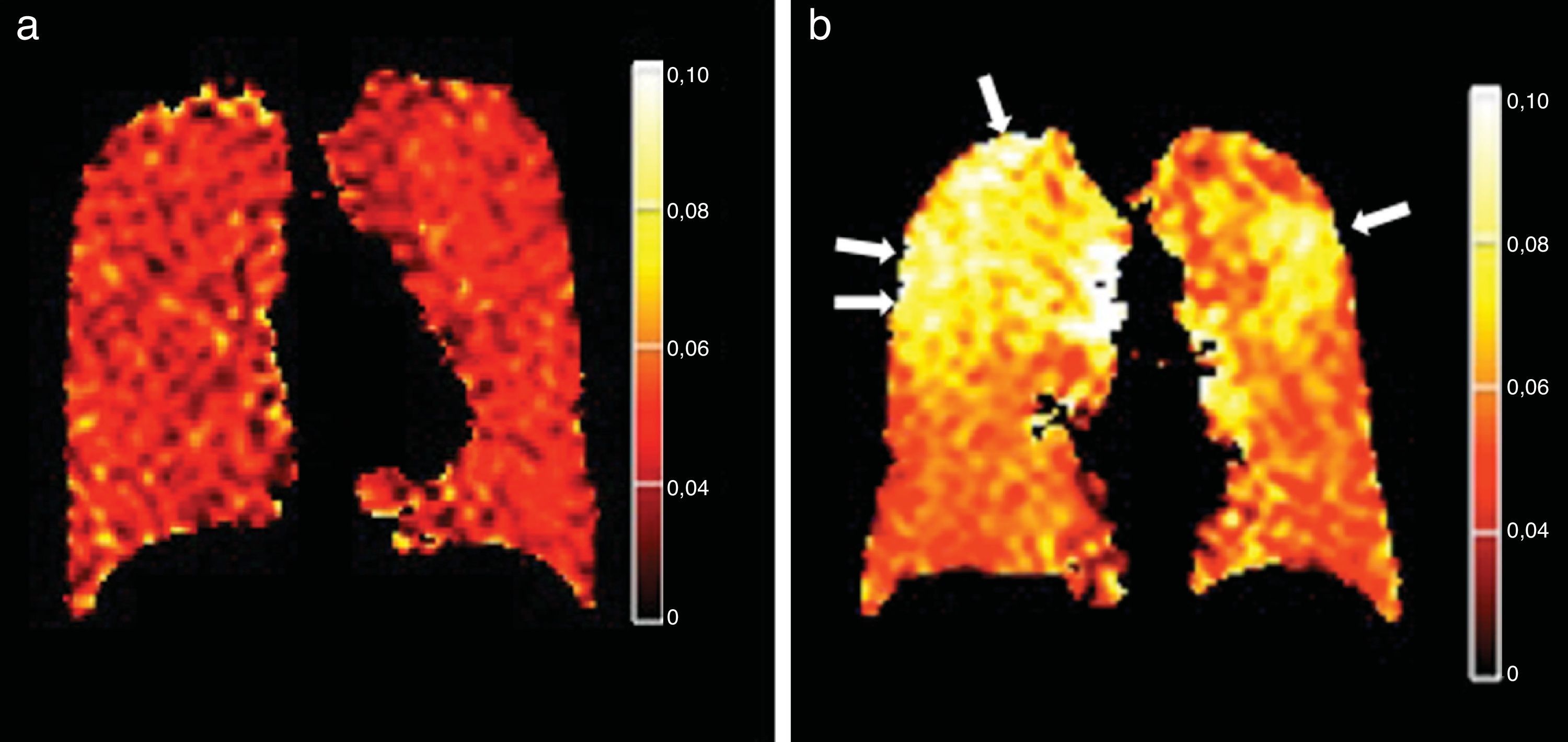
Enfermedades pulmonares secundarias al tabaquismoLa RM potenciada en difusión con gas HP es uno de los métodos con gas HP más desarrollado para estudiar el enfisema26,29,30,32,39. La RM potenciada en difusión con 3He HP ha detectado espacios aéreos agrandados en modelos animales y humanos de enfisema26–32. Las medidas regionales y globales del CDA de 3He se han comparado en pacientes con enfisema y sujetos normales26,30,40, y se ha confirmado una buena correlación con la espirometría23,30,41. Los mapas del CDA obtenidos con RM potenciada en difusión con 129Xe HP son capaces de distinguir entre pacientes con enfisema y sujetos sanos con resultados similares a los de la RM con 3He (fig. 5)42. La RM potenciada en difusión con 129Xe HP puede ser incluso más sensible a las alteraciones estructurales del pulmón que con 3He debido a su coeficiente de difusión más bajo25,43.
Mapas de CDA con gas 129Xe hiperpolarizado. a) Paciente normal. Valores bajos y homogéneos de CDA. b) Paciente con enfisema. Mapas heterogéneos y con valores de CDA más altos, predominantemente en las porciones superiores de los pulmones (flechas). El lector puede ver esta figura en color en la versión electrónica del artículo.
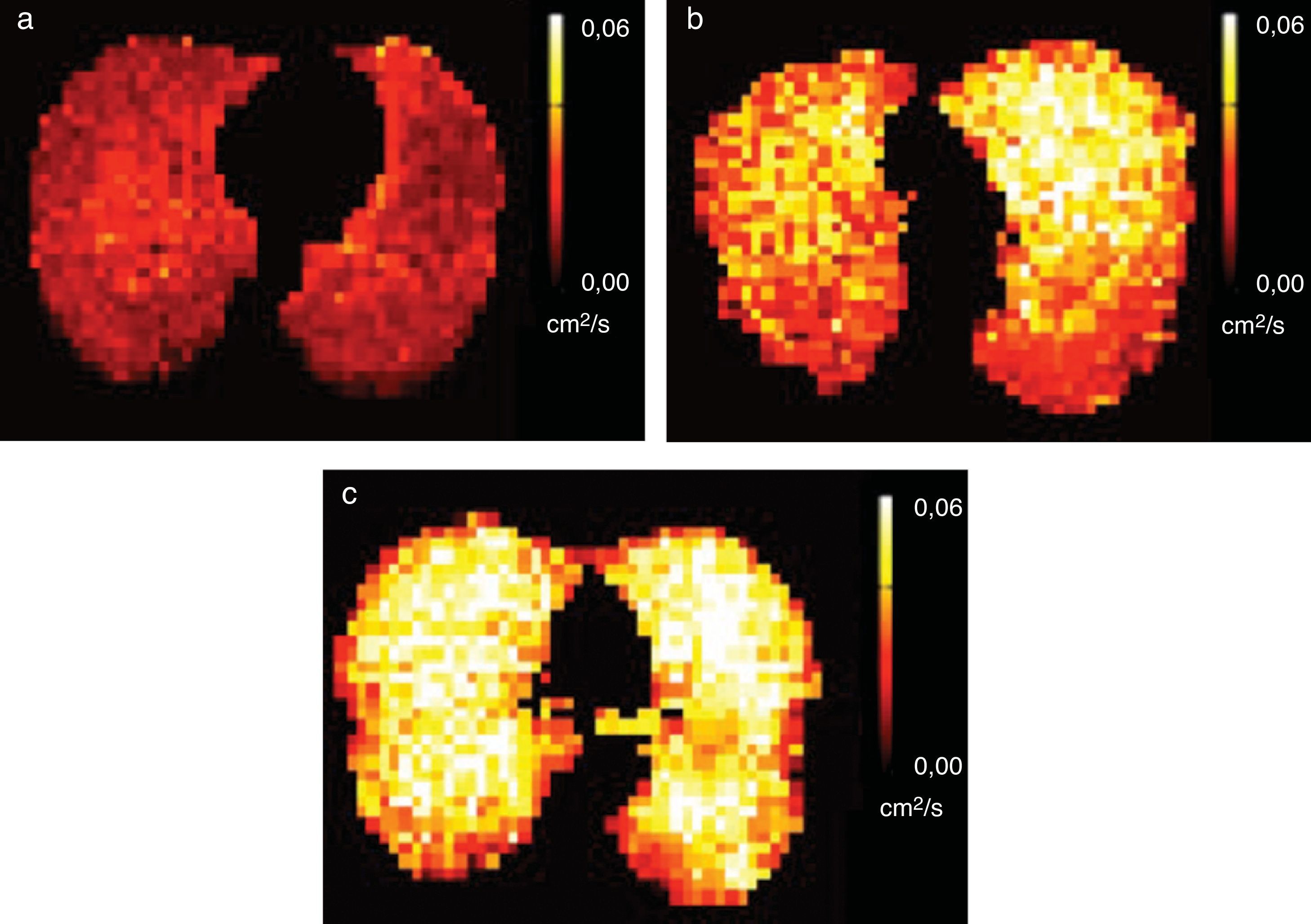
La morfometría pulmonar con 3He es capaz de detectar alteraciones en la estructura acinar de fumadores con cambios enfisematosos con más sensibilidad que las técnicas convencionales (pruebas de función pulmonar y TC)44. En un estudio reciente, la RM potenciada en difusión con 3He detectó la alteración de la función pulmonar en fumadores antes de producir síntomas29. Los autores describieron una correlación estadística importante entre el CDA medio y las pruebas habituales de función pulmonar en fumadores asintomáticos, lo cual refuerza que la técnica es más sensible para detectar precozmente la enfermedad. La sensibilidad del CDA para detectar el aumento alveolar también se ha descrito en fumadores pasivos muy expuestos al humo de tabaco45 (fig. 6).
Agrandamiento alveolar en fumadores pasivos. Los mapas de CDA con gas 129Xe hiperpolarizado de 3 sujetos distintos, a) un no fumador con poca exposición al humo de tabaco, b) un fumador pasivo muy expuesto al humo y c) un fumador, revelan valores de CDA progresivamente mayores y, por lo tanto, un mayor tamaño alveolar. El lector puede ver esta figura en color en la versión electrónica del artículo.
El asma es el trastorno crónico más común de los niños y un problema global que afecta a casi 300 millones de personas de todas las edades, grupos étnicos y países46. La carga económica del asma en España está en torno a los 1.480 millones de euros en la población adulta47.
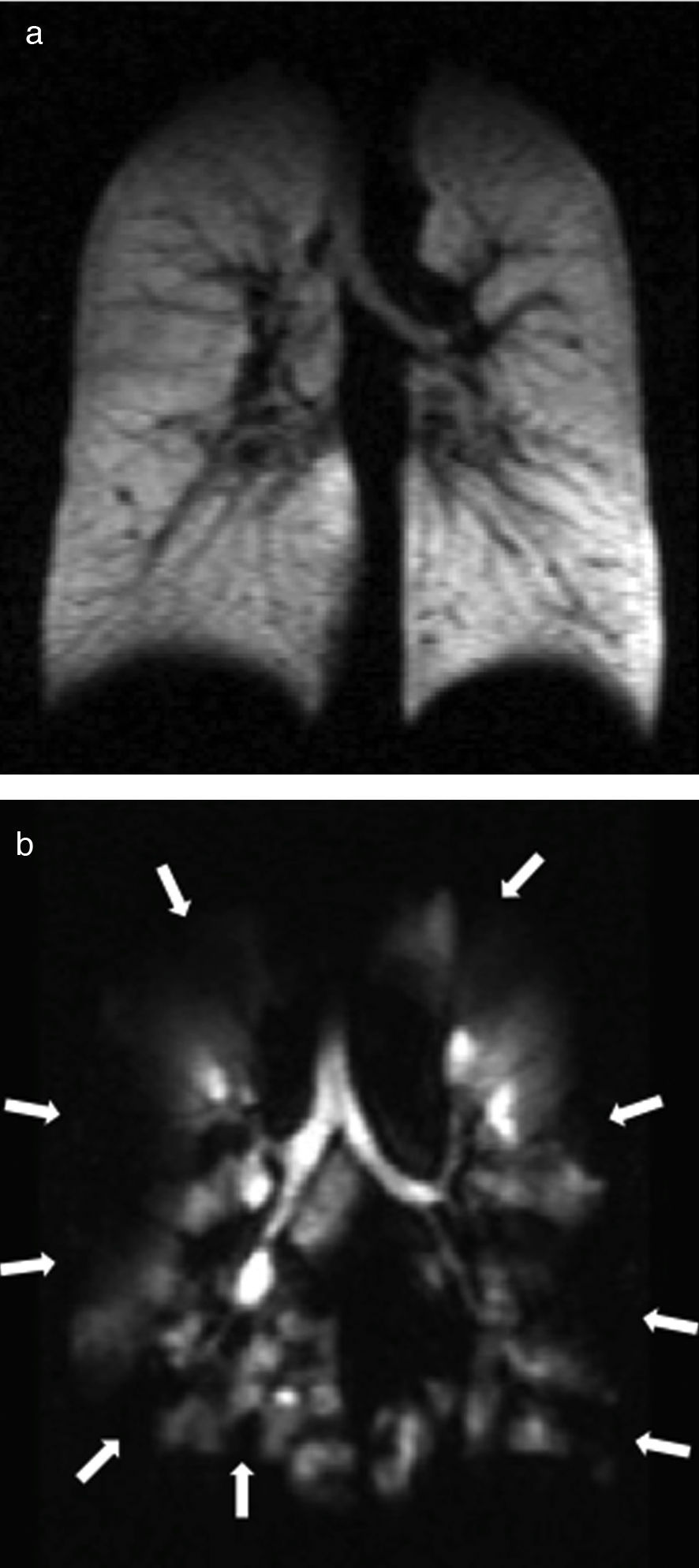
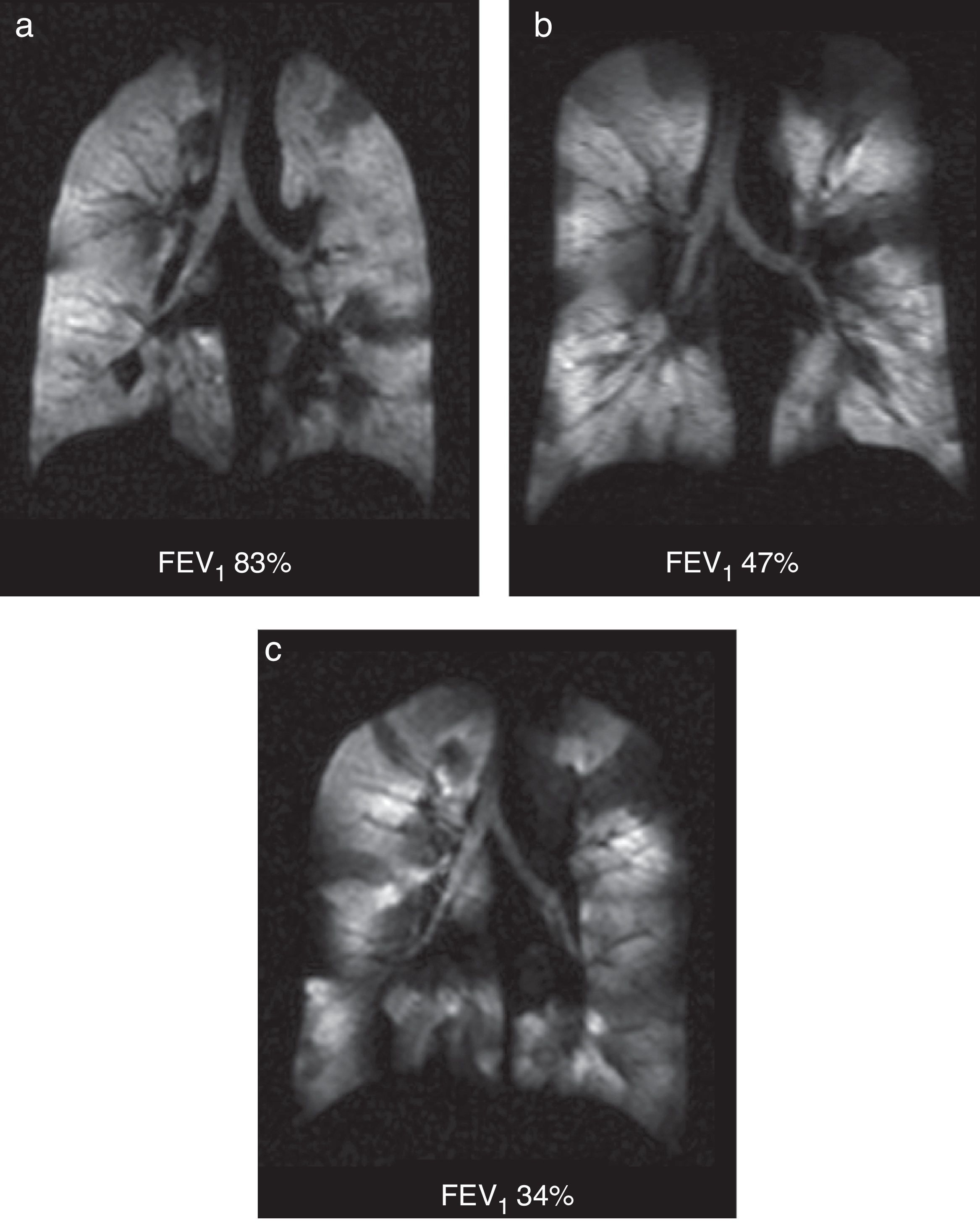
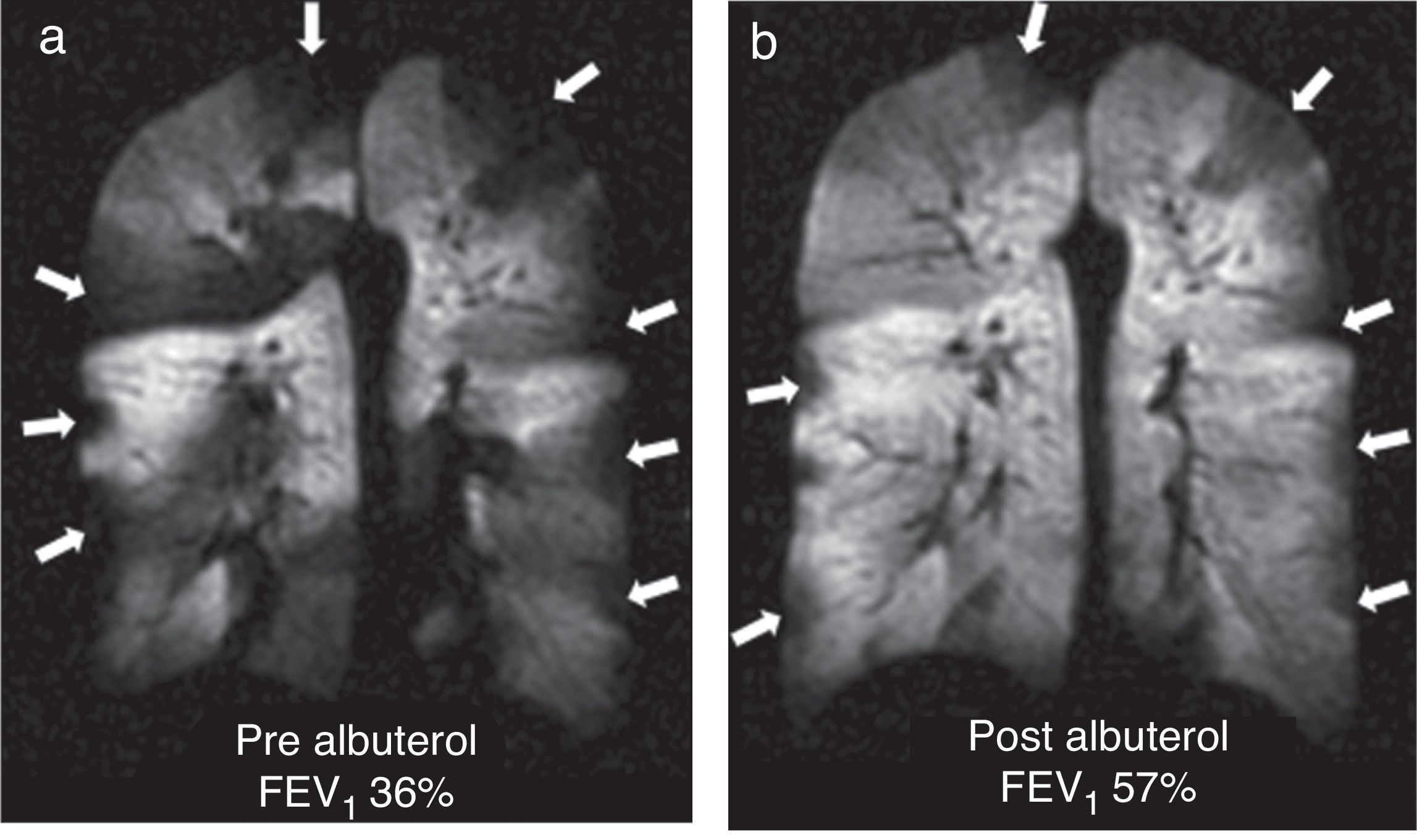
Se trata de un trastorno inflamatorio crónico del pulmón que afecta, predominantemente, a la vía aérea de tamaño medio y pequeño. Los síntomas suelen asociarse a obstrucciones variables de las vías aéreas y pueden estar provocados por broncoconstricción, edema de la pared de las vías aéreas, impacto mucoso y el remodelado de las vías aéreas. Con la TC se pueden ver con detalle las paredes bronquiales y el atrapamiento aéreo. La RM con gas HP puede valorar las alteraciones funcionales del flujo aéreo en el pulmón secundarias a los cambios estructurales en las vías aéreas. Los defectos de ventilación han podido confirmarse mediante RM con gas HP incluso en pacientes asintomáticos y en aquellos con espirometría normal48 (fig. 7). El número de defectos de ventilación detectados mediante RM con 3He HP se ha correlacionado con la gravedad de la enfermedad establecida con espirometría o con la frecuencia de los síntomas3. Por otro lado, los defectos de ventilación son inducidos médicamente con metacolina (un broncoconstrictor directo inhalado)48 y revertidos mediante un broncodilatador inhalado (albuterol) (fig. 8).
Defectos de la ventilación en el asma. Imágenes coronales de ventilación con 3He en 3 pacientes asmáticos con valores porcentuales del volumen espiratorio forzado decrecientes: a) 83%; b) 47% y c) 34%. Se observan múltiples defectos bilaterales de la ventilación en las 3 imágenes, aumentando progresivamente según disminuye el volumen espiratorio forzado, incluso presentes con una espirometría normal (a).
La RM con gas HP ha aportado una nueva perspectiva de la fisiopatología del asma. Nos ha enseñado que la distribución de las anomalías de la ventilación en el pulmón no son aleatorias, como cabría esperar si todo el pulmón estuviese afectado por igual, sino que algunas regiones del pulmón son más propensas a estar alteradas en las imágenes de ventilación, lo que indica que la gravedad de la enfermedad varía regionalmente49,50. Los hallazgos de la RM con gas HP pueden tener importantes implicaciones en tratamientos regionales tales como la termoplastia bronquial (ablación por RF del músculo liso de la pared de la vía aérea durante la broncoscopia) porque es posible obtener mejores resultados con este tratamiento si utilizamos imágenes que nos ayuden a guiar la intervención.
Las imágenes dinámicas de ventilación permiten analizar la cinética del atrapamiento aéreo en pacientes asmáticos, con una buena concordancia entre las áreas de atrapamiento de la RM con gas HP y la TC51. La ausencia de radiación en la RM la convierte en una alternativa atractiva, sobre todo en estudios longitudinales.
Fibrosis quísticaLa fibrosis quística (FQ) es el trastorno genético fatal más frecuente de la población caucásica, con una incidencia estimada de uno por cada 2.500 nacidos vivos52. Esta enfermedad, provocada por la disfunción de la proteína reguladora transmembrana de la FQ, se caracteriza por secreciones exocrinas más viscosas tanto en el pulmón como en el tracto gastrointestinal. En los pulmones obstruye los bronquios con la consecuencia de colonización bacteriana, infección pulmonar crónica, bronquiectasias y fibrosis. La enfermedad pulmonar progresiva se convierte en la primera causa de muerte en la FQ y suele ser necesario monitorizarla mediante imagen.
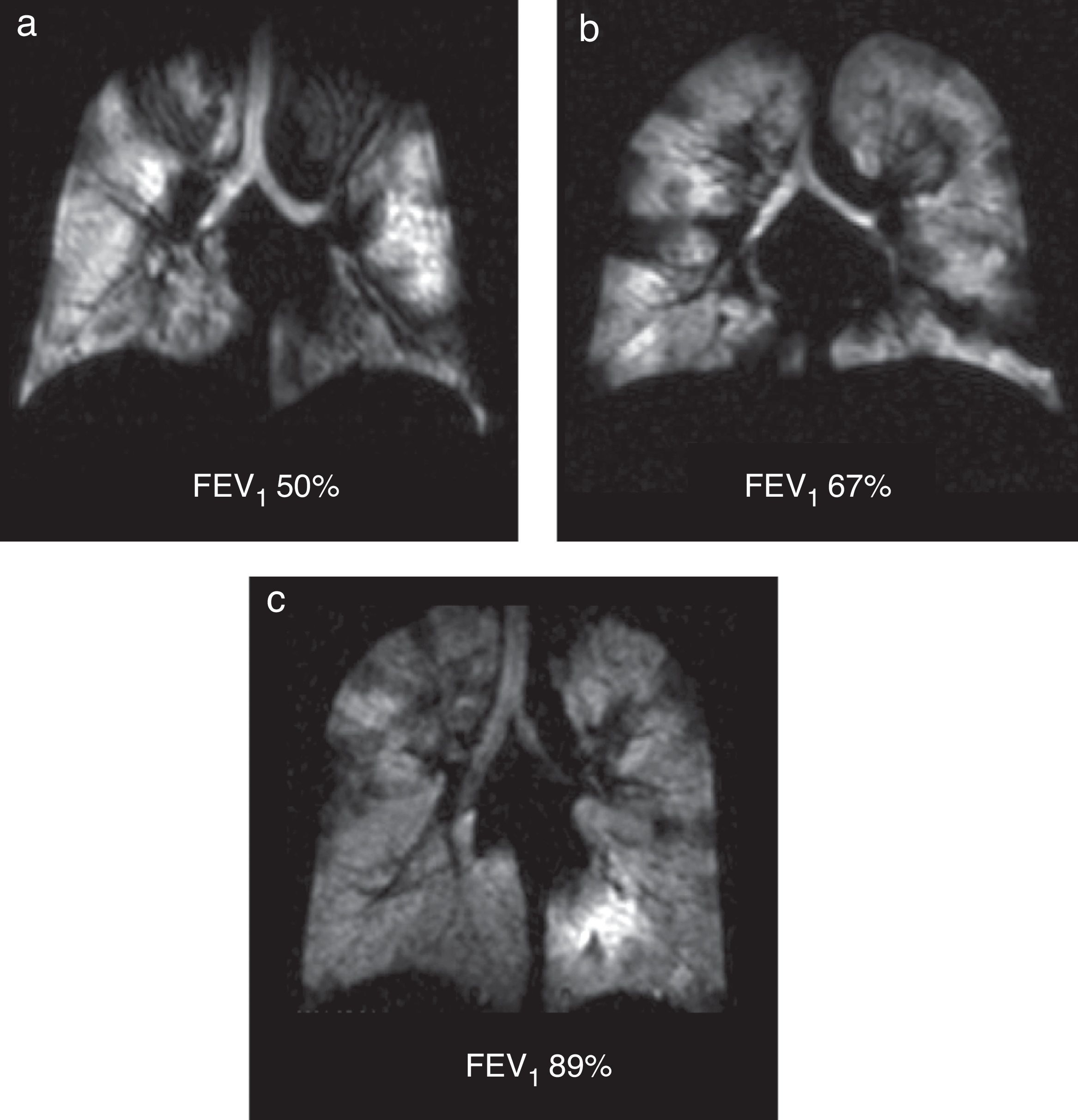
Con la RM con 3He HP se han descrito defectos de ventilación en pacientes con FQ, incluso en aquellos cuyas pruebas de función pulmonar son completamente normales52 (fig. 9). Los defectos de la ventilación cambian con el tratamiento con broncodilatadores y el aclaramiento de la vía aérea mecánica52.
Defectos de la ventilación en la fibrosis quística. Las imágenes coronales de ventilación de 3He en 3 pacientes con valores porcentuales decrecientes del volumen espiratorio forzado: a) del 50%; b) del 67% y c) del 89% revelan defectos bilaterales múltiples de la ventilación con independencia de los resultados de la espirometría.
La RM con gas HP se correlaciona bien con las anomalías estructurales de la TC53 y con la espirometría52,53, pero la correlación con la radiografía torácica es mala54. La correlación con la espirometría es incluso más sólida que la de la TC53. Por todas estas razones, la RM con gas HP se considera una prueba sensible para describir la enfermedad incipiente, y puede convertirse en un biomarcador de la FQ pulmonar porque puede ser útil para monitorizar el estado clínico y la respuesta al tratamiento55.
Direcciones futurasComo no implica el uso de radiación ionizante, la RM con gas HP promete ser una herramienta de investigación útil para investigar la fisiopatología de varias enfermedades pulmonares y valorar la eficacia de los tratamientos. No obstante, todavía hay que desarrollar mucho más la técnica para que pueda convertirse en una herramienta clínica sólida. Los importantes avances técnicos en los polarizadores con xenón y la reciente escasez de 3He indican que el 129Xe puede llegar a usarse de forma más generalizada.
ConclusiónLa RM con gas HP se ha convertido en una importante herramienta de investigación morfológica y funcional del pulmón de la que podemos extraer información sensible y novedosa sobre la fisiopatología de muchas enfermedades pulmonares.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Autoría- 1.
Responsable de la integridad del estudio: LF, TA, JPM, EEDL, GWM, JFM, IR, WFH.
- 2.
Concepción del estudio: LF, TA, JPM, EEDL, GWM, JFM, IR, WFH.
- 3.
Diseño del estudio: LF, TA, JPM, EEDL, GWM, JFM, IR, WFH.
- 4.
Obtención de los datos: LF, TA, JPM, EEDL, GWM, JFM, IR, WFH.
- 5.
Análisis e interpretación de los datos: NA.
- 6.
Tratamiento estadístico: NA.
- 7.
Búsqueda bibliográfica: LF, TA, JPM, WFH.
- 8.
Redacción del trabajo: LF, TA, JPM.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: LF, TA, JPM, EEDL, GWM, JFM, IR, WFH.
- 10.
Aprobación de la versión final: LF, TA, JPM, EEDL, GWM, JFM, IR, WFH
La Dra. Talissa A. Altes ha recibido subvenciones del NIH, University of Virginia Children's Hospital Medical Center, FAMRI, Siemens; honorarios por consultaría en Novartis, Guebert así como por conferencias y presentaciones de Phillips. El Dr. Grady Miller ha recibido una subvención del NIH-NHLBI. El Dr. Eduard de Lange ha recibido una subvención del NIH y royalties por la Oxford University Press. El Dr. F. William Hersman ha percibido una subvención del NHLBI. John Mugler ha recibido una subvención de Siemens Medical Solutions. El resto de autores no tienen conflicto de intereses.