El dolor torácico agudo es una causa frecuente de consulta en los servicios de urgencias. Puede estar ocasionado por una amplia variedad de enfermedades, algunas potencialmente letales, por lo que tienen que diagnosticarse rápidamente. El auge de la tomografía computarizada para estudiar a pacientes con dolor torácico agudo es notable. Sin embargo, se trata de una exploración no exenta de limitaciones. La resonancia magnética cardiovascular es una técnica potencialmente útil en este grupo de pacientes, aunque la disponibilidad y la duración de las exploraciones restringen su uso a determinadas indicaciones.
En este trabajo se ilustran los hallazgos de la resonancia magnética en pacientes con dolor torácico agudo y se describen los protocolos de adquisición. Además, se resaltan los datos semiológicos más característicos de las causas isquémicas y no isquémicas que pueden provocar estos síntomas.
Acute chest pain is a common reason for presentation to the emergency department. It can be caused by a wide variety of diseases, some of which are potentially lethal, so it must be diagnosed quickly. The rise of computed tomography to evaluate patients with acute chest pain is noteworthy. However, computed tomography is not without limitations in this context. Cardiovascular magnetic resonance imaging is a potentially useful technique in this group of patients, although its availability and the time required for examinations restrict its use to specific indications.
In this article, we illustrate the magnetic resonance imaging findings in patients with acute chest pain and describe the protocols for MRI acquisition in this context. Furthermore, we highlight the most characteristic signs of ischemic and nonischemic causes of chest pain.
El dolor torácico agudo (DTA) es uno de los motivos de consulta más frecuentes en los servicios de urgencias1. Puede tener muchas causas: traumática, cardiaca, vascular, pleural, pulmonar, abdominal o psicógena2. La estratificación de riesgo de los pacientes que acuden a los servicios de urgencias por DTA se basa en la historia clínica, el ECG y los marcadores de daño miocárdico1. Los pacientes con estas pruebas alteradas requieren ingreso y tratamiento en unidades especializadas. Sin embargo, en un alto porcentaje de pacientes el ECG es normal o inespecífico y las enzimas cardiacas son negativas. Dado que en esta situación clínica frecuentemente no se puede descartar con certeza un síndrome coronario agudo, la práctica habitual es que los pacientes permanezcan en observación durante un periodo de tiempo variable, habitualmente no inferior a 6-8h, momento en el que se repiten el ECG y el análisis de las enzimas cardiacas1. Además, muchos de ellos permanecen en observación o son hospitalizados de manera innecesaria, lo que supone un importante consumo de recursos1. Por lo tanto, se requieren técnicas que permitan seleccionar a pacientes rápida y eficazmente, como la ecocardiografía y la tomografía computarizada multidetector (TCMD)3. Esta última ha tenido un gran auge en los últimos años. Además de ser la técnica de elección para estudiar la enfermedad aórtica y vascular pulmonar, permite estudiar la vascularización coronaria y se perfila como la prueba de imagen más útil para descartar las entidades de mayor morbimortalidad en urgencias4. Sin embargo, la TCMD posee limitaciones como la utilización de contraste yodado, la necesidad de una frecuencia cardiaca baja, la elevada dosis de radiación y una valoración muy limitada de los órganos involucrados (por ejemplo, el miocardio). En este sentido, la resonancia magnética (RM) cardiovascular ha demostrado ser una técnica de gran utilidad clínica5.
Debe recordarse que: En la práctica rutinaria la RM se emplea en pacientes estables o ambulatorios como técnica de elección para diagnosticar un número cada vez mayor de enfermedades cardiovasculares6.
Los mayores inconvenientes de la RM son su complejidad técnica y el tiempo de estudio, hechos que han limitado su uso en los pacientes con DTA a indicaciones muy concretas.
Los objetivos de este trabajo son revisar la utilidad de la RM para establecer la causa del DTA de origen cardiovascular y familiarizar al radiólogo con los hallazgos característicos de las enfermedades más frecuentes que pueden manifestarse con esos síntomas. Para ello se describen los protocolos de adquisición utilizados así como los hallazgos por RM más característicos de las causas más frecuentes de DTA de etiología cardiovascular.
Protocolo de estudioComo estándar se propone el protocolo de RM mostrado en la tabla 1.
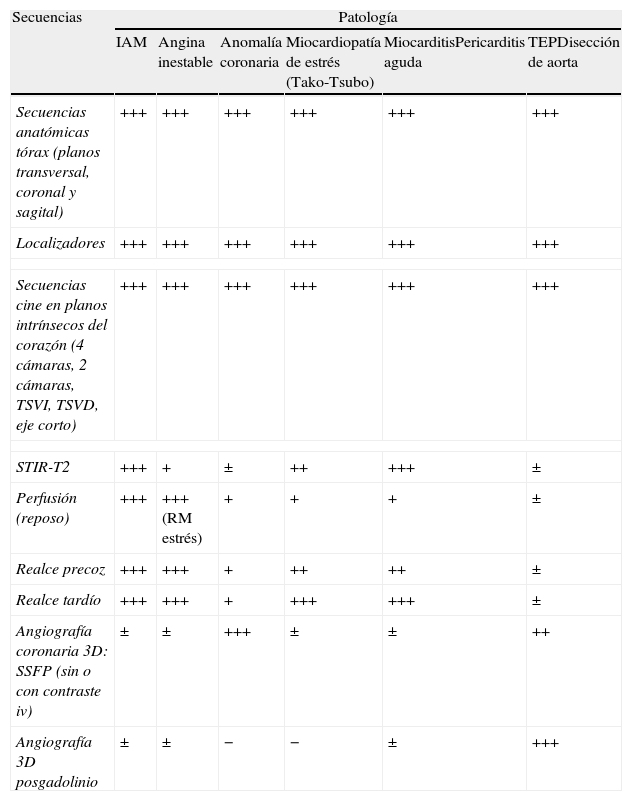
Protocolo estándar de resonancia magnética cardiovascular para estudiar a pacientes con dolor torácico agudo. Utilidad de las distintas secuencias
| Secuencias | Patología | |||||
| IAM | Angina inestable | Anomalía coronaria | Miocardiopatía de estrés (Tako-Tsubo) | MiocarditisPericarditis aguda | TEPDisección de aorta | |
| Secuencias anatómicas tórax (planos transversal, coronal y sagital) | +++ | +++ | +++ | +++ | +++ | +++ |
| Localizadores | +++ | +++ | +++ | +++ | +++ | +++ |
| Secuencias cine en planos intrínsecos del corazón (4 cámaras, 2 cámaras, TSVI, TSVD, eje corto) | +++ | +++ | +++ | +++ | +++ | +++ |
| STIR-T2 | +++ | + | ± | ++ | +++ | ± |
| Perfusión (reposo) | +++ | +++ (RM estrés) | + | + | + | ± |
| Realce precoz | +++ | +++ | + | ++ | ++ | ± |
| Realce tardío | +++ | +++ | + | +++ | +++ | ± |
| Angiografía coronaria 3D: SSFP (sin o con contraste iv) | ± | ± | +++ | ± | ± | ++ |
| Angiografía 3D posgadolinio | ± | ± | − | − | ± | +++ |
GRE-EPI: Gradient Echo-Echo Planar Imaging: HASTE: Half Fourier Acquisition Single Shot Turbo Spin Echo; IAM: infarto agudo de miocardio; iv: intravenoso; RM: resonancia magnética; SSFP: Steady-State Free Precession; STIR-T2: Short Tau Inversion Recovery potenciada en T2; TEP: tromboembolismo pulmonar. TSVI: tracto de salida ventrículo izquierdo. TSVD: tracto de salida ventrículo derecho.
Secuencias: Secuencias anatómicas tórax: HASTE. Secuencias cine: SSFP, T2-STIR. Perfusión: GRE-EPI. Dosis de gadolinio: 0,1-0,2mmol/kg. Realce precoz/tardío: eco de gradiente potenciado en T1 con pulso de inversión recuperación, 1min tras la administración de contraste para el realce precoz, 10min tras la administración de contraste para el realce tardío. Angiografía coronaria 3D: SSFP (sin o con contraste). Angiografía 3D posgadolinio: eco de gradiente 3D.
El DTA de causa cardiovascular puede producirse por enfermedades cardiacas o por enfermedades de origen vascular (tabla 2). La RM ha demostrado ser una exploración de gran utilidad clínica en todas estas entidades, incluso superior a técnicas ya establecidas como la ecocardiografía o las pruebas de medicina nuclear7.
Diagnóstico diferencial del dolor torácico agudo de origen cardiovascular en el servicio de urgencias
| Etiología cardiaca | Etiología no cardiaca | |
| Isquémica | No isquémica | |
| IAM | Miocardiopatía de estrés (Tako-Tsubo) | Síndrome aórtico agudo• Hematoma intramural• Úlcera penetrante• Disección de aorta |
| Angina inestable | Miocarditis aguda | |
| Anomalía coronaria | Pericarditis aguda | TEP agudo |
IAM: infarto agudo de miocardio; TEP: tromboembolismo pulmonar.
Debe recordarse que: Como indicación principal en el infarto agudo de miocardio (IAM), la RM se debe realizar para detectar las áreas de obstrucción microvascular post-IAM, valorar la función global y regional del ventrículo izquierdo, y determinar la localización y extensión del infarto6 (fig. 1).
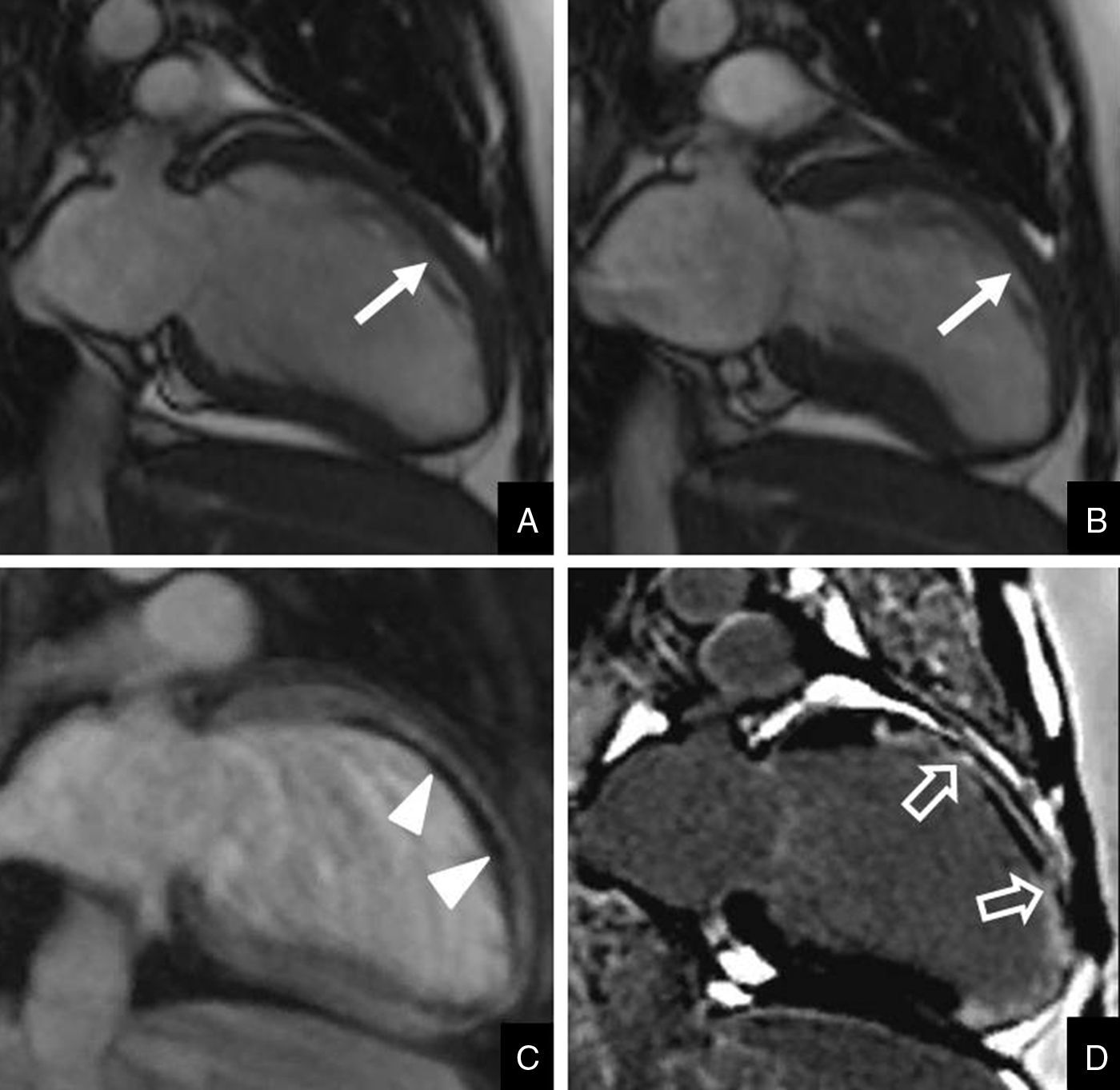
Mujer de 32 años con antecedentes de hipertensión arterial y lupus eritematoso sistémico. Acudió a Urgencias por dolor torácico agudo de características atípicas. El ECG inicial y los biomarcadores cardiacos fueron negativos. Se le realizó una resonancia magnética cardiaca. El estudio con secuencias cine SSFP (Steady-State Free Precession), plano eje largo del ventrículo izquierdo, (A: imagen en diástole, B: en sístole) muestra acinesia de la cara anterior (flecha). Durante el realce precoz (C) se observa hipoperfusión subendocárdica en la cara anterior secundaria a obstrucción microvascular (puntas de flecha). Las secuencias de realce tardío (D) demuestran que se trata de un infarto de miocardio con extensión transmural (flechas abiertas). Nótese el fenómeno «core» (núcleo) por la obstrucción microvascular, manifestado como un área hipointensa rodeada por un halo hiperintenso de captación de contraste. El núcleo del realce indica el área de obstrucción microvascular.
Cada una de las secuencias descritas en el protocolo de estudio propuesto permite obtener información diagnóstica y pronóstica. Las secuencias cine-RM (eco de gradiente, Steady-State Free Precession [SSFP]) se emplean para estudiar la alteración de la contractilidad miocárdica (hipo/acinesia/discinesia) provocada por la isquemia y conocer los volúmenes y función ventricular.
Las secuencias Short Tau Inversion Recovery (STIR) potenciadas en T2 se utilizan para detectar edema miocárdico. En el IAM, el edema miocárdico refleja el área máxima de miocardio que presenta riesgo de necrosis8. Junto a las secuencias de realce tardío, las secuencias STIR permiten determinar la viabilidad miocárdica y discriminar el miocardio isquémico del necrótico.
Las secuencias de perfusión y las de realce precoz con gadolinio permiten detectar áreas de obstrucción microvascular, manifestadas como hipointensidad de señal subendocárdica (nótese el fenómeno «core» [núcleo] mostrado en las figuras 1 y 2). Estas áreas, que también se pueden detectar en las secuencias de realce tardío, representan la característica principal del daño posreperfusión, traducen la gravedad de la agresión miocárdica y se asocian independientemente a la falta de recuperación funcional y el remodelado ventricular adverso, lo que supone peor pronóstico a largo plazo9.
Por último, las secuencias de realce tardío se emplean para medir el tamaño del infarto establecido y determinar su extensión (subendocárdica o transmural). En las fases agudas del infarto parte del realce tardío puede reflejar edema periinfarto correspondiente a un miocardio aturdido potencialmente recuperable (fig. 2).
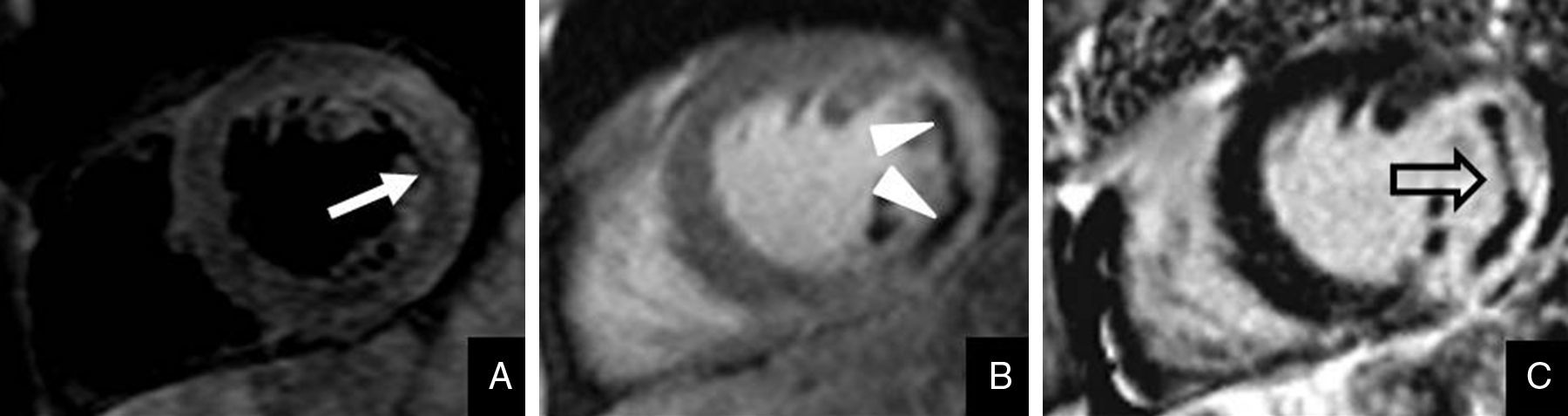
Varón de 70 años que acudió a Urgencias por dolor torácico agudo. Fue diagnosticado de infarto agudo de miocardio y tratado mediante revascularización percutánea. Se realizó una resonancia magnética cardiaca para valorar la extensión del infarto. Las imágenes STIR obtenidas en el eje corto (A) demuestran edema en el segmento anterolateral medio del ventrículo izquierdo (flecha). Durante el realce precoz (B) se demuestra hipoperfusión subendocárdica del segmento afectado por obstrucción microvascular (punta de flecha). Las imágenes de realce tardío (C) demuestran la extensión transmural del infarto con fenómeno «core» (núcleo) secundario a la obstrucción microvascular (flecha abierta).
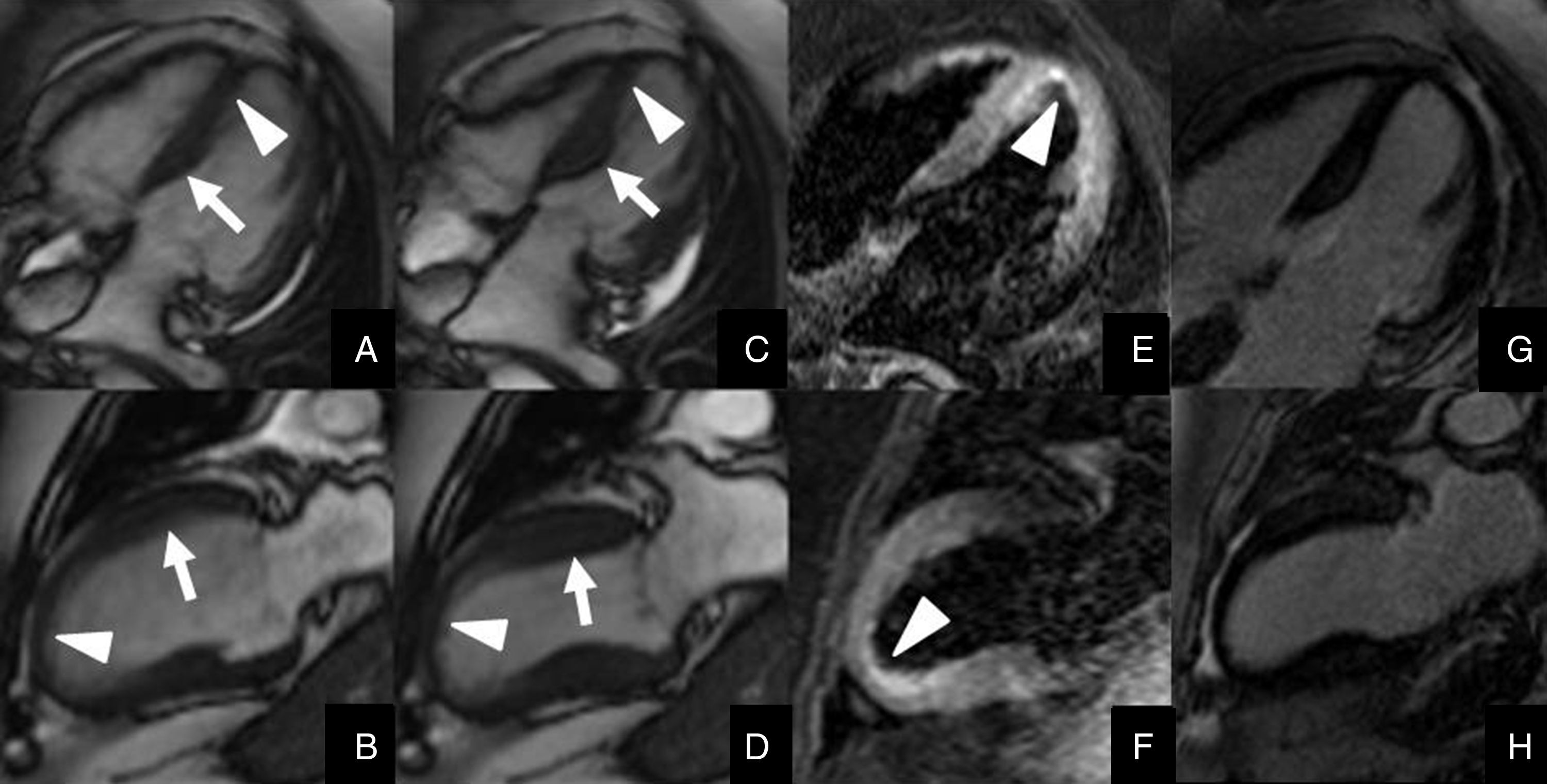
La RM con estrés farmacológico, bien con dobutamina (efecto inotrópico y cronotrópico positivo), bien con fármacos vasodilatadores como la adenosina o el dipiridamol, permite detectar la isquemia miocárdica una vez estabilizado el paciente. Según metaanálisis recientes, el estrés provocado con dobutamina predice con una sensibilidad del 0,83 (IC 95%: 0,78-0,88) y una especificidad del 0,86 (IC 95%: 0,81-0,91) la enfermedad coronaria significativa (estenosis >50% en la coronariografía convencional)10, mientras que la sensibilidad y especificidad de la RM-estrés con vasodilatador es del 0,89 (IC 95%: 0,88-0,91) y del 0,80 (IC 95%: 0,78-0,83), respectivamente11 (fig. 3). Ambas técnicas han demostrado poseer valor pronóstico12.
Debe recordarse que: Una RM-estrés negativa se asocia a un riesgo bajo de volver a padecer un cuadro coronario agudo12.
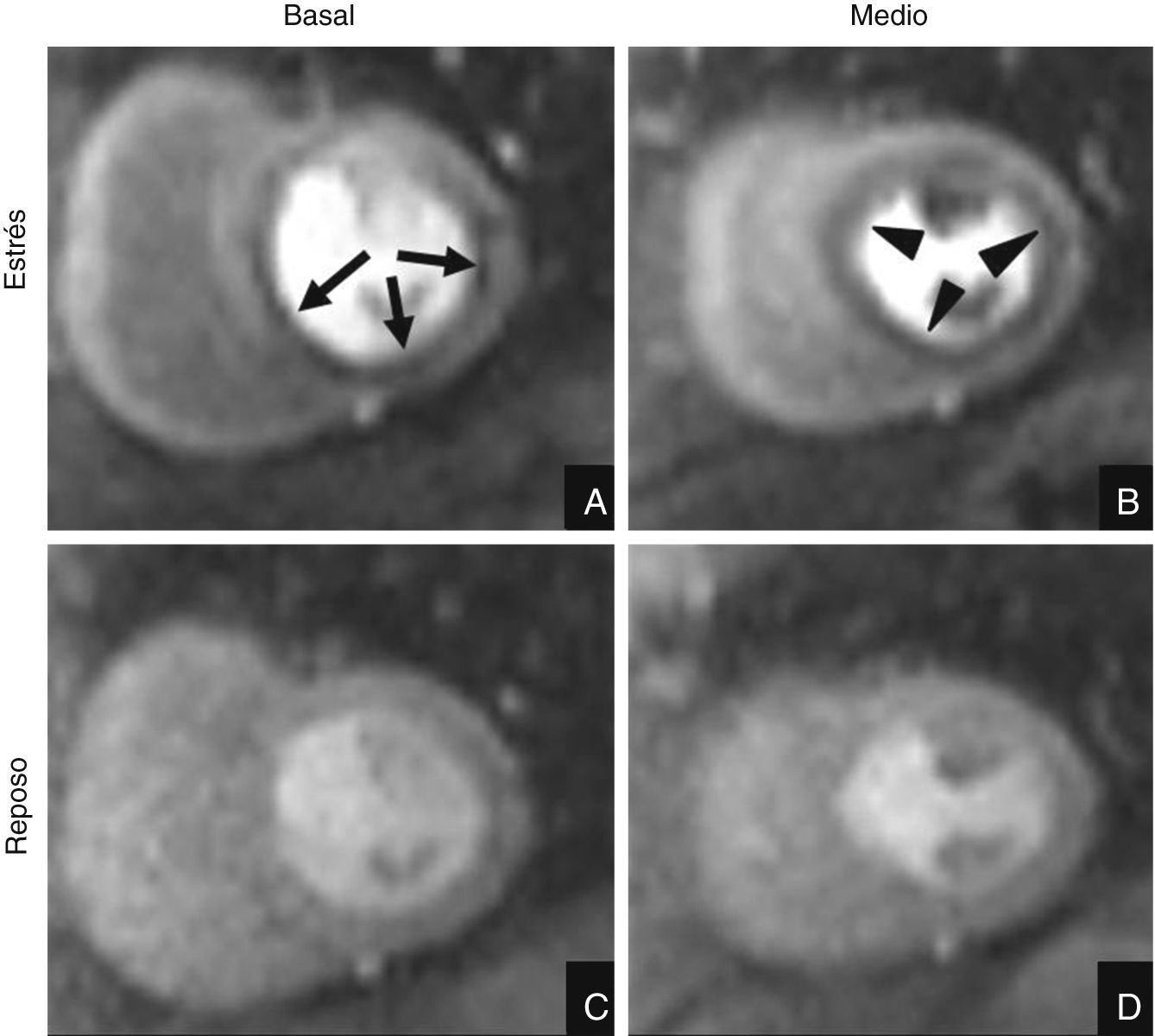
Mujer de 62 años con antecedentes personales de cardiopatía isquémica revascularizada quirúrgicamente que acudió a Urgencias por dolor torácico atípico. El ECG no mostró cambios significativos respecto a su ECG basal y las enzimas cardiacas resultaron negativas. Se le realizó una resonancia magnética cardiaca-estrés con adenosina para descartar una causa isquémica. Las imágenes obtenidas tras estrés farmacológico (fila superior) ponen de manifiesto una hipoperfusión subendocárdica en los segmentos inferoseptal, inferior e inferolateral basales (flechas en A) y prácticamente circunferencial en los segmentos medios del ventrículo izquierdo (puntas de flecha en B). La perfusión en reposo (fila inferior) es normal lo que sugiere que se trata de defectos de perfusión reversibles (isquemia) por enfermedad de 3 vasos, confirmado mediante coronariografía convencional.
La elección del tipo de fármaco a emplear depende de la experiencia propia de cada centro, pero dado el mayor perfil de seguridad y menor número de reacciones adversas, actualmente se prefiere emplear la adenosina para los estudios de RM-estrés13.
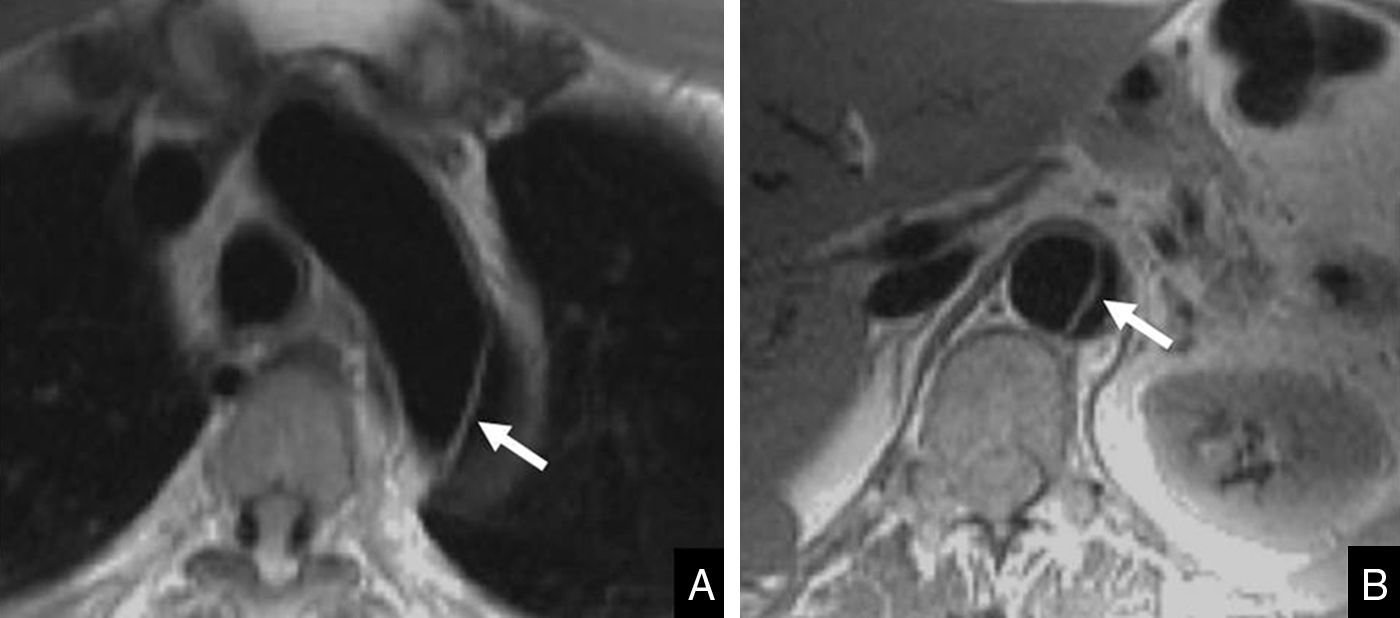
Anomalía coronariaIncluye alteraciones en su origen (tanto de la aorta como de la arteria pulmonar), en su recorrido y las fístulas coronarias. La anomalía de mayor riesgo y la que más parece asociarse con muerte súbita es el origen de la arteria coronaria izquierda en la coronaria derecha o en el seno coronario derecho con recorrido entre la aorta y el tracto de salida del VD14. Aunque la coronariografía convencional es la técnica tradicionalmente empleada, aporta únicamente una visión bidimensional del árbol coronario y en ocasiones no puede definir adecuadamente el trayecto anómalo de estos vasos. Si bien los segmentos proximales de las arterias coronarias pueden verse en secuencias convencionales espín-eco y en cine-RM con secuencias SSFP multicorte, se prefieren secuencias angiográficas tras inyectar contraste o 3D-SSFP sin o con contraste intravenoso, que permiten demostrar con exactitud el origen, trayecto y relación de las arterias coronarias respecto a las estructuras anatómicas adyacentes15 (fig. 4). En general, se emplean secuencias 3D-SSFP en apnea para los casos en los que únicamente se desee valorar el origen de dichas arterias, y secuencias 3D-SSFP con sincronización respiratoria si se desea conocer todo el recorrido de los vasos coronarios.
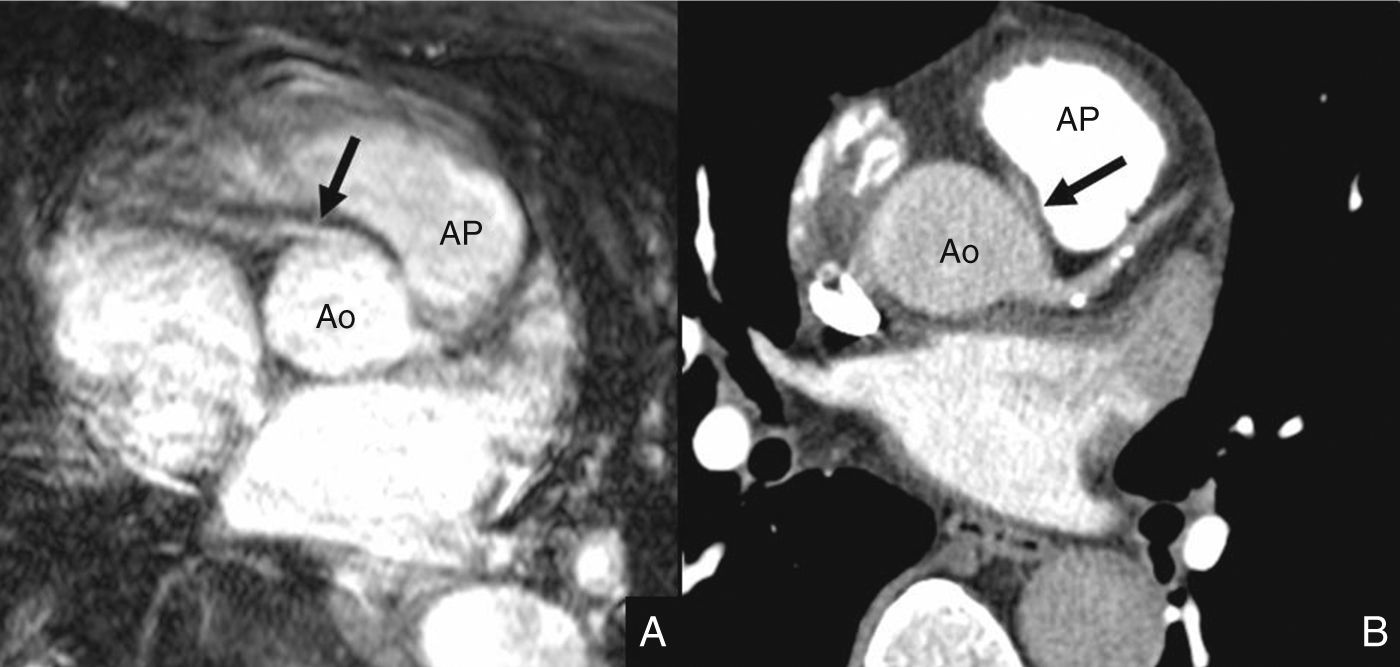
Varón de 54 años, sin factores de riesgo cardiovascular, ingresado en urgencias por dolor torácico atípico. En la resonancia magnética (A) cardiaca se encuentra, de manera incidental, una arteria coronaria derecha con origen anómalo desde el seno coronario izquierdo y trayecto interarterial, entre la arteria pulmonar (AP) y la aorta (Ao). El hallazgo se demuestra mediante tomografía computarizada (B).
Esta miocardiopatía es más frecuente en mujeres posmenopáusicas que han sufrido un episodio reciente de estrés físico o psíquico16. Se manifiesta clínicamente como dolor torácico típico y alteraciones electrocardiográficas sugestivas de isquemia miocárdica sin enfermedad coronaria17.
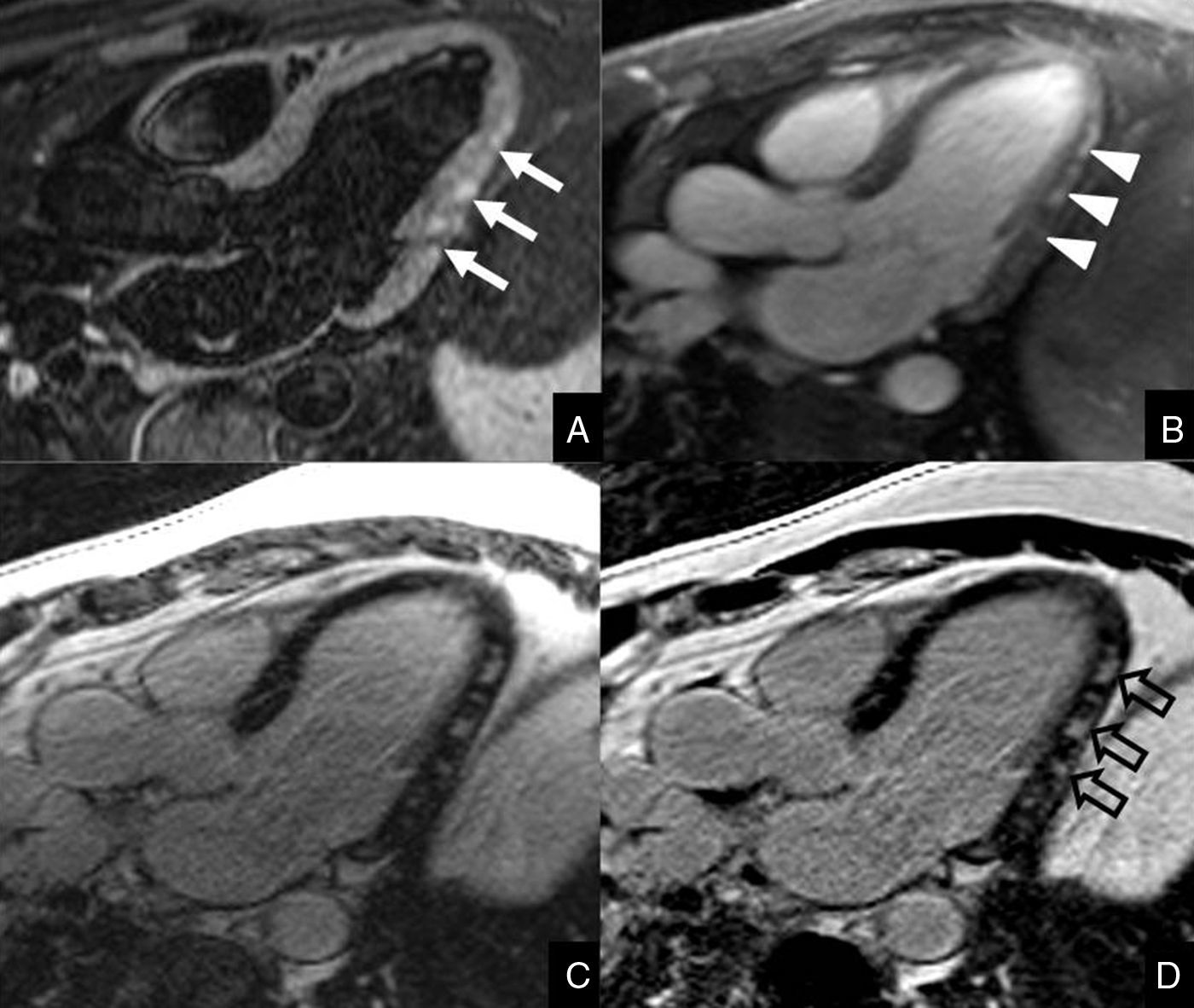
Actualmente la RM es la técnica de elección para diagnosticarla18. Las secuencias cine-SSFP muestran una hipercontractilidad de los segmentos basales y contractilidad disminuida de los segmentos medios y apicales del ventrículo izquierdo. En las secuencias STIR-T2 se puede demostrar edema de los segmentos miocárdicos afectados19. A diferencia de lo que ocurre en el IAM, la miocardiopatía de estrés no presenta el realce tardío subendocárdico característico del infarto, si bien hasta un 20% de los pacientes presentan realce focal y parcheado16 (fig. 5).
Mujer de 76 años, bajo situación de fuerte estrés emocional, acudió a urgencias por dolor torácico agudo. El ECG mostró cambios inespecíficos y los biomarcadores cardiacos resultaron negativos. Se le realizó una resonancia magnética cardiaca para descartar una causa isquémica. Fila superior, plano 4 cámaras. Fila inferior, plano eje largo del ventrículo izquierdo. El estudio con secuencias cine SSFP (Steady-State Free Precession) (A y B: imágenes en diástole, C y D: en sístole) muestra hipercontractilidad basal (flechas) y acinesia de los segmentos medios y apicales (puntas de flecha). Las secuencias STIR (E, F) ponen de manifiesto edema en los segmentos acinéticos (puntas de flecha). En las fases tardías tras la administración de gadolinio (G, H) no se observa realce miocárdico, lo que descarta una causa isquémica, y confirma la sospecha clínica inicial de miocardiopatía de estrés (Tako-Tsubo).
En los países occidentales, la miocarditis aguda se produce más frecuentemente por el virus Coxsackie B y otros virus como el parvovirus B19, el herpesvirus humano 6 y el adenovirus20. Puede ser asintomática o manifestarse como un proceso inflamatorio leve, dolor torácico, insuficiencia cardiaca congestiva o muerte súbita. El ECG y las enzimas cardiacas pueden estar alterados, lo que en ocasiones hace difícil distinguirla del IAM.
La exactitud diagnóstica de la biopsia endomiocárdica es limitada, debido a la afectación miocárdica parcheada y a la gran variabilidad al interpretarla21,22.
Los hallazgos más característicos de la miocarditis aguda en la RM se pueden poner de manifiesto con secuencias específicas: STIR-T2 para demostrar edema miocárdico de distribución multifocal, secuencias tras la inyección en las que se observa captación multifocal de distribución subepicárdica o intramiocárdica, secuencias anatómicas para el derrame pleural o pericárdico y secuencias en modo cine para estudiar la disfunción ventricular segmentaria y/o global23,24 (fig. 6).
Varón de 37 años con dolor torácico atípico y sospecha clínica de pericarditis aguda tras ECG inicial normal y enzimas cardiacas mínimamente alteradas. Se le realizó una resonancia magnética cardiaca para confirmar la sospecha clínica. Imágenes en el plano tracto de salida del ventrículo izquierdo. El estudio con la secuencia STIR potenciada en T2 (A) muestra focos parcheados hiperintensos en la cara posterolateral del ventrículo izquierdo (flechas). Tanto en las imágenes de realce precoz (B) como en las de realce tardío (C: secuencia PSIR - Phase Sensitive Inversion Recovery- imagen de magnitud)) se ve una captación parcheada intramiocárdica (puntas de flecha y flechas abiertas), con preservación del endocardio, sugestiva de miocarditis aguda. El pericardio es normal.
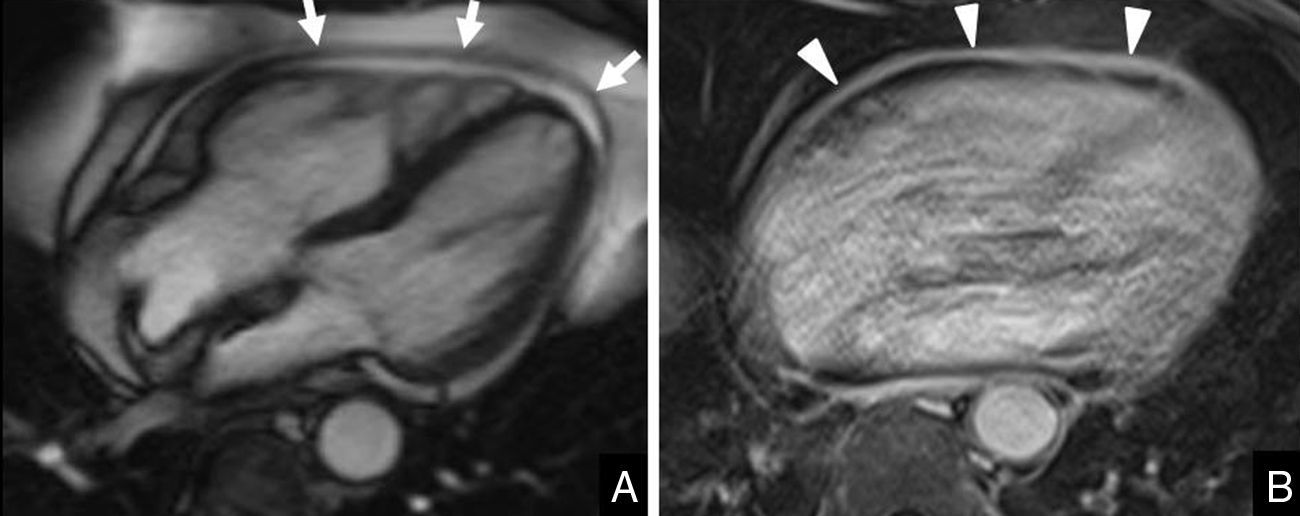
La pericarditis aguda puede ocurrir tanto aisladamente como en el contexto de enfermedades sistémicas. Hallazgos característicos en la RM son el engrosamiento o derrame pericárdico y el realce tardío del pericardio. El realce tardío del pericardio sugiere una inflamación aguda, si bien es un signo poco específico que debe ser valorado en el contexto clínico25 (fig. 7).
Varón de 70 años con dolor torácico atípico. Se realizó una resonancia magnética cardiaca para descartar isquemia miocárdica. Imágenes en el plano de 4 cámaras. El estudio morfológico (A: secuencia cine SSFP - Steady-State Free Precession) muestra un ligero engrosamiento del pericardio y un pequeño derrame (flechas). Tras inyectar el contraste (B: secuencia eco de gradiente potenciada en T1) se observa captación precoz del pericardio (puntas de flecha) por un proceso inflamatorio agudo.
El tromboembolismo pulmonar (TEP) agudo es un motivo de consulta frecuente en los servicios de urgencias. Su presentación clínica puede ser inespecífica con disnea súbita, dolor pleurítico o taquipnea26.
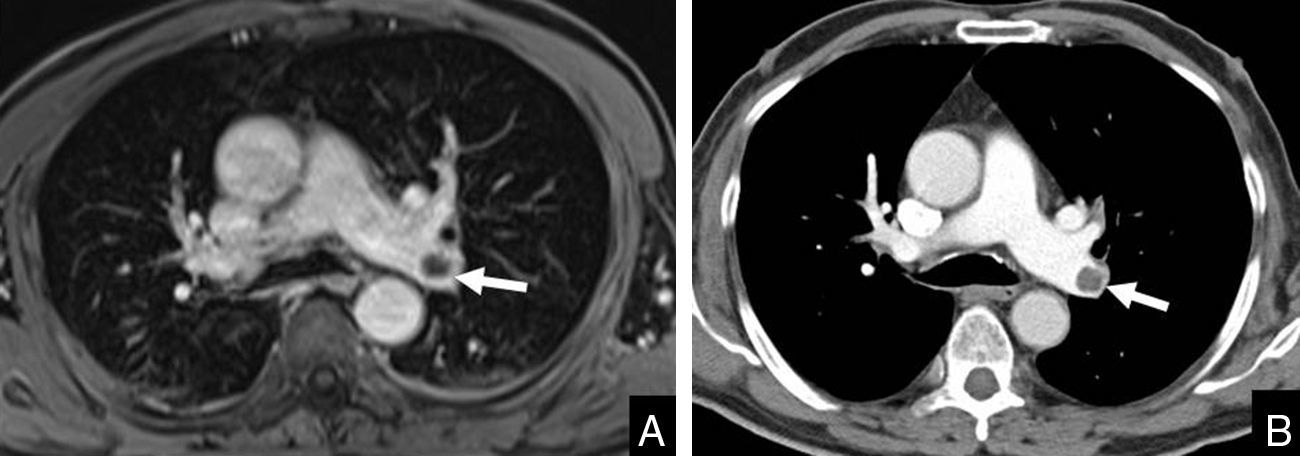
Hoy en día la angio-TCMD es la prueba de elección para descartar la enfermedad27, aunque en pacientes con alergia al contraste yodado, embarazadas o pacientes jóvenes con baja probabilidad pretest de padecer TEP, la RM puede considerarse como alternativa diagnóstica28 (fig. 8). Además de las secuencias angiográficas 3D convencionales se pueden realizar secuencias dinámicas eco de gradiente 3D para detectar los defectos de perfusión dependientes del territorio vascular afectado. Esta técnica concuerda bien con la tomografía computarizada por emisión de fotón único (técnica ampliamente empleada en este contexto clínico) para detectar defectos de perfusión lobares, segmentarios y subsegmentarios29.
Varón de 68 años con dolor torácico agudo, diagnosticado de infarto agudo de miocardio en el servicio de urgencias. Fue revascularizado percutáneamente. Se realizó una resonancia magnética cardiaca (RM) para valorar la extensión del infarto y establecer la causa del dolor torácico y de la disnea referidos por el paciente durante la noche anterior. La RM (A) pone de manifiesto un tromboembolismo pulmonar agudo en la arteria pulmonar izquierda (flecha), no sospechado clínicamente. El hallazgo se confirmó mediante TC (B) (flecha).
Las enfermedades que se agrupan bajo la denominación de síndrome aórtico agudo son la disección aórtica, el hematoma intramural y la úlcera penetrante. La disección de aorta es la causa más frecuente de enfermedad aórtica aguda y se da hasta en un 75% de los pacientes con DTA de causa aórtica30.
Dado que el pronóstico de estos pacientes depende de la rapidez del diagnóstico e instauración del tratamiento, habitualmente la RM no se utiliza en los servicios de urgencias. Generalmente esta técnica queda relegada a pacientes con sospecha clínica alta en los que el resto de las pruebas resultan no concluyentes, o para seguir a pacientes tratados conservadoramente.
Aunque los protocolos varían entre los distintos centros, los estudios de aorta deben incluir secuencias anatómicas (fig. 9) y secuencias de angio-RM 3D que permitan posprocesar las imágenes en el plano deseado. Como alternativa en pacientes poco colaboradores o en los que no se pueda administrar contraste intravenoso se pueden emplear secuencias SSFP-3D.
Varón de 64 años hipertenso, con antecedente de alergia al contraste yodado, fue ingresado en urgencias por dolor centrotorácico. Se realizó una resonancia magnética cardiaca para descartar un síndrome aórtico agudo. Imágenes axiales anatómicas con secuencia HASTE (Half Fourier Acquisition Single Shot Turbo Spin Echo) muestran una disección aórtica aguda que se extiende desde el cayado aórtico (flecha en A) hasta la aorta abdominal (flecha en B). Nótese el desplazamiento de la íntima (flecha).
La RM es una técnica no invasiva que puede ser de gran utilidad clínica para diagnosticar las enfermedades que cursan con DTA. Para obtener el máximo rendimiento de la prueba es importante seleccionar adecuadamente a los pacientes que pueden beneficiarse de esta exploración, conocer los protocolos de adquisición e interpretarla adecuadamente. El radiólogo debe estar familiarizado con los hallazgos de RM característicos de las causas cardiacas y no cardiacas más comunes de DTA descritas en este trabajo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autorías- 1.
Responsable de la integridad del estudio: AFP, AGL, PMA, GB
- 2.
Concepción del estudio: AFP, AGL, PMA, GB
- 3.
Diseño del estudio: AFP, AGL, ISY, PMA, GB
- 4.
Obtención de los datos: AFP, PMA, GB
- 5.
Análisis e interpretación de los datos: AFP, AGL, ISY, GB
- 6.
Tratamiento estadístico: n/a.
- 7.
Búsqueda bibliográfica: AFP, AGL, ISY, PMA, GB
- 8.
Redacción del trabajo: AFP, GB
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: AGL, ISY, PMA
- 10.
Aprobación de la versión final: AFP, AGL, ISY, PMA, GB
El Dr. Bastarrika ha recibido honorarios por conferencias en Siemens, Bayer, Medrad. El resto de los autores manifiesta no tener ningún conflicto de intereses.