En esta última década se han producido avances importantes en el diagnóstico y tratamiento del cáncer de pulmón que han permitido mejorar su pronóstico. Por ello, la Sociedad Española de Radiología Médica (SERAM) y la Sociedad Española de Oncología Médica (SEOM) han elaborado un documento de consenso nacional para hacer recomendaciones sobre el diagnóstico radiológico y la valoración de la respuesta terapéutica en pacientes con cáncer de pulmón. Este grupo de expertos recomienda la tomografía computarizada multidetector (TCMD) como la técnica de elección para estudiar esta enfermedad, y respecto al informe radiológico incluir una valoración completa siguiendo el sistema de estadificación TNM. Por último, cuando el paciente reciba inmunoterapia, además de usar los criterios para evaluar la respuesta en tumores sólidos (Response Evaluation Criteria in Solid Tumors [RECIST 1.1]) también habrá que usar los criterios de respuesta inmunológica (Immune-Related Response Criteria [irRC]).
The last decade has seen substantial progress in the diagnostic and therapeutic approach to lung cancer, thus meaning that its prognosis has improved. The Spanish Society of Medical Radiology (SERAM) and the Spanish Society of Medical Oncology (SEOM) have therefore produced a national consensus statement in order to make recommendations for radiological diagnosis and assessment of treatment response in patients with lung cancer. This expert group recommends multi-detector computed tomography (MDCT) as the technique of choice for investigating this disease. The radiology report should include a full assessment by the TNM staging system. Lastly, when the patient is on immunotherapy, response evaluation should employ not only Response Evaluation Criteria in Solid Tumours (RECIST 1.1) but also Immune-Related Response Criteria (irRC).
En el año 2012 el cáncer de pulmón fue el primero en incidencia y mortalidad en el mundo. En España se diagnosticaron 26.715 nuevos casos (12,4% de todos los cánceres) y fue la neoplasia con mayor mortalidad (21.118 fallecimientos), el 20,6% de todas las muertes por cáncer1. Estos datos indican su relevancia en el ámbito sanitario. En esta última década se han producido avances diagnósticos y terapéuticos importantes que han mejorado el pronóstico, especialmente en determinados subgrupos de pacientes2. Se ha avanzado en la precisión diagnóstica gracias a nuevas tecnologías, tanto en el ámbito anatomopatológico y molecular como de la imagen, de modo que un diagnóstico radiológico adecuado es una herramienta muy importante para atender al paciente con cáncer de pulmón.
Las técnicas radiológicas también tienen un papel clave en el tratamiento, por lo que es necesario optimizar los criterios para valorar la respuesta que permitan medir correctamente la eficacia de las terapias actuales, especialmente de las terapias dirigidas y la inmunoterapia. Las nuevas terapias generan situaciones especiales que hay que saber abordar para tomar las mejores decisiones. Sin embargo, no hay que olvidar otras técnicas de imagen como la tomografía por emisión de positrones (PET), la resonancia magnética (RM) o la gammagrafía. La atención a los pacientes con cáncer requiere la colaboración de los diferentes profesionales implicados, y la coordinación entre ellos en un equipo multidisciplinar que trabaje en una sola dirección en beneficio del paciente. En el caso particular del cáncer de pulmón, el radiólogo desempeña un papel muy importante para diagnosticar, estadificar y valorar la respuesta tumoral a las diferentes terapias y para seguirlo evolutivamente.
Por todo ello, la Sociedad Española de Radiología Médica (SERAM) y la Sociedad Española de Oncología Médica (SEOM) han decidido llevar a cabo por primera vez un documento de consenso nacional, elaborado por 10 expertos, 5 radiólogos y 5 oncólogos médicos, que tiene como objetivo último proponer recomendaciones para el diagnóstico radiológico y la valoración de la respuesta terapéutica en pacientes con cáncer de pulmón basadas en la evidencia científica. En definitiva, la razón de ser de este documento es mejorar la atención al paciente con cáncer de pulmón usando de forma actualizada las mejores técnicas radiológicas para alcanzar el mejor resultado oncológico.
Diagnóstico radiológico del cáncer de pulmónAspectos técnicosLa tomografía computarizada multidetector (TCMD) es una herramienta imprescindible en oncología. Las últimas innovaciones han contribuido a mejorar la calidad de la imagen y a optimizar los exámenes, equilibrando calidad y dosis de radiación. Los equipos de TCMD deben explorar el tórax y el abdomen en apnea con resolución espacial isotrópica para permitir el posproceso. Las reconstrucciones multiplanares (MPR) y de proyección de máxima intensidad (MIP) son siempre aconsejables para valorar la infiltración vascular central y las relaciones del tumor con las estructuras próximas. También pueden ser útiles las reconstrucciones de mínima intensidad (MinIP) y la broncoscopia virtual. Los desarrollos tecnológicos más recientes, como los equipos de doble fuente y 256/320 detectores, con resolución espacial isotrópica submilimétrica y temporal ≤100ms, permiten realizar estudios de perfusión y dinámicos que ayudan a cuantificar y monitorizar la angiogénesis tumoral3,4.
En nuestra opinión, el estudio debe hacerse con contraste intravenoso, inyectando aproximadamente 90ml a 3-4ml/seg. De esta forma, es posible valorar las estructuras vasculares, mediastínicas y el abdomen en fase portal en una sola exploración. El estudio debe extenderse desde la región supraclavicular hasta las crestas iliacas, buscando las metástasis extratorácicas más frecuentes.
La TCMD es la técnica radiológica que más contribuye a la dosis de radiación colectiva. La modulación de la dosis y la reconstrucción iterativa pueden reducir la dosis efectiva hasta en un 70-75%5,6. La nueva Directiva 2013/59 Euratom, publicada el 17 de enero de 2014, insta a los estados miembros a velar por los programas de garantía de calidad y de la evaluación de los rangos de dosis/paciente que deberá reflejarse en la historia clínica7.
Es recomendable utilizar protectores de bismuto, que reducen en un 40-60% la dosis de radiación en la mama sin distorsionar la exploración8,9. En caso de embarazo se reducirá al máximo la dosis, bajando el miliamperaje y el kilovoltaje, se estudiará solo el tórax y se administrará bario oral para minimizar la dosis fetal. Aunque no existen estudios en humanos que demuestren daño fetal por utilizar contraste yodado, se asume el riesgo de disfunción tiroidea y hay que realizar una prueba de cribado tiroideo al nacer. Por otro lado, las guías más recientes recomiendan no suprimir la lactancia materna10,11.
Las reacciones tóxicas asociadas a la técnica son nefrotoxicidad, neurotoxicidad, afectación cardíaca y vasodilatación. Las reacciones de hipersensibilidad pueden ser inmediatas (<1h) o no inmediatas (>1h). El 30% de las no inmediatas y el 43% de las inmediatas ocurren en la primera exposición12. Las no inmediatas pueden aparecer hasta una semana después del procedimiento. En las reacciones inmediatas graves se desaconseja realizar más exploraciones con contraste yodado. En las inmediatas leves y moderadas hay que valorar el riesgo/beneficio, escoger aquellos productos que hayan dado pruebas de alergia negativas y valorar si premedicar. En las no inmediatas debe evitarse el producto que desencadenó la reacción con prueba positiva y valorar si premedicar13.
La RM con gadolinio puede ser útil para complementar la TCMD en caso de alergia al contraste yodado. El gadolinio no debe usarse en el embarazo porque no se ha demostrado la seguridad del feto14. En cuanto a los pacientes con insuficiencia renal, deben clasificarse según su filtrado glomerular15 y, en función del resultado, limitar la dosis de contraste, suspender la administración de fármacos nefrotóxicos, añadir suero salino isotónico (1ml/kg cada 12h) pre y poscontraste, utilizar bicarbonato sódico y valorar la hemofiltración16,17.
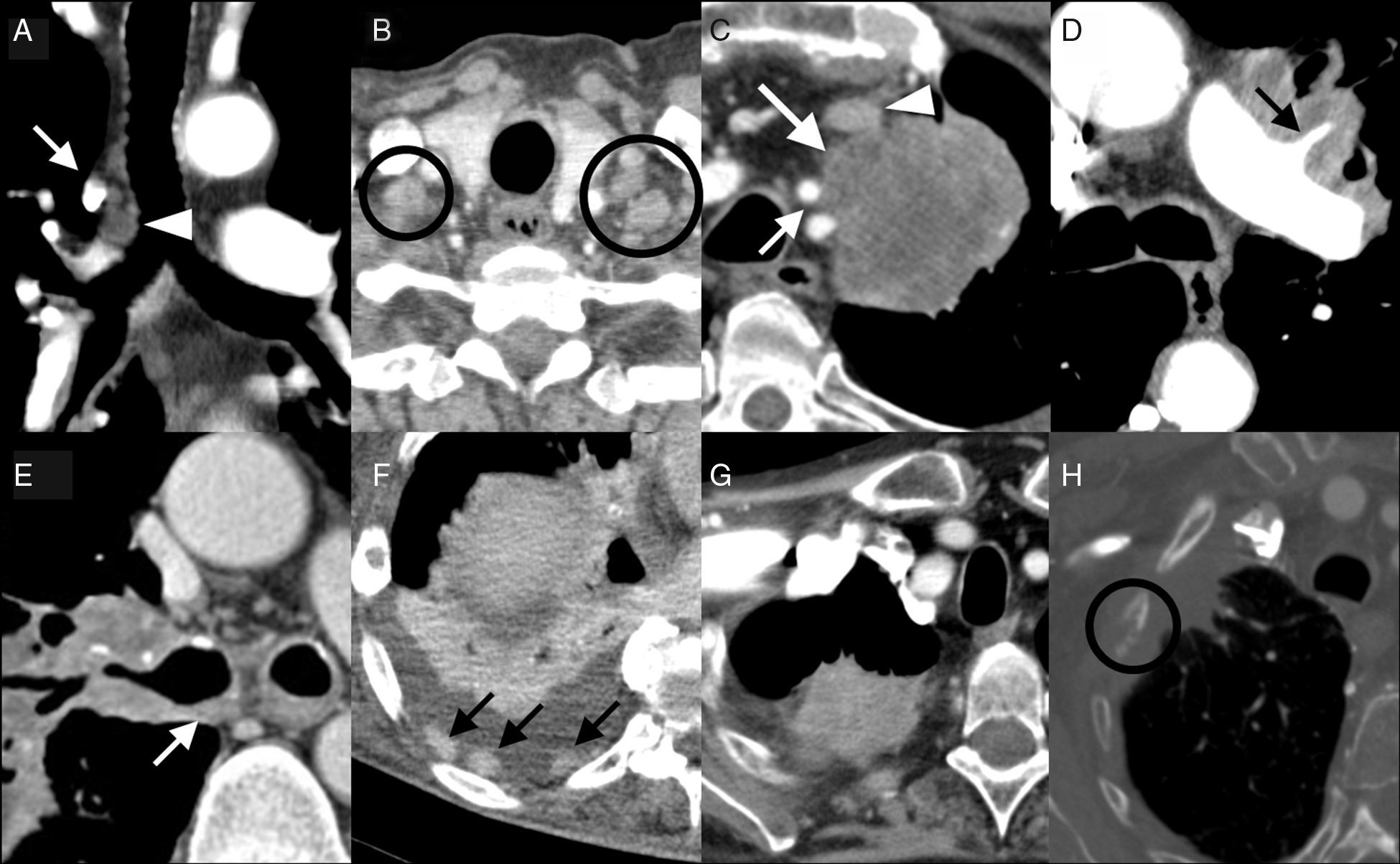
Descripción completa del tumor primarioPara diagnosticar y estadificar el cáncer de pulmón el radiólogo debe basarse en la clasificación TNM, un sistema ideado a mediados del siglo xx por Pierre Denoix y unificado en 1987 por la International Union Against Cancer (UICC) y el American Joint Committee on Cancer (AJCC), cuya versión vigente es la 7.ª, de enero de 201018,19. Esta clasificación se basa en el análisis de 3 descriptores: 1) «T», básicamente para el tumor principal; 2) «N», para la afectación ganglionar (nodal) en los territorios de drenaje del tumor; y 3) «M», para las metástasis. Con esta información se agrupan las categorías de los descriptores según su pronóstico para conformar los estadios tumorales (fig. 1).
Estadificación TNM. A. Adenopatía hiliar (N1) (punta de flecha), caudal al cayado de la vena ácigos (flecha); cranealmente existen otros ganglios, de pequeño tamaño, en territorio 4R. B. Adenopatías supraclaviculares bilaterales (N3). C. Infiltración de la grasa mediastínica (flecha grande) (T4) en contacto con las arterias carótida y subclavia izquierda (flecha pequeña) y la vena innominada homolateral (punta de flecha). D. Probable infiltración de la arteria pulmonar izquierda (T4) englobando la rama lobar superior (flecha). E. Infiltración con estenosis del bronquio lobar superior derecho y engrosamiento de la pared posterior del principal (flecha) hasta menos de 2cm de la carina (probable T3). F. Derrame pleural derecho con engrosamientos nodulares de la pleura parietal (flechas) (M1a). G. Lesión lobar superior derecha con protrusión en la grasa extrapleural (probable T3, aunque en algunos casos puede corresponder a cambios inflamatorios asociados). H. Lesión lobar superior derecha con amplio contacto con la pleura periférica e infiltración con osteólisis costal (T3).
Valora fundamentalmente el tamaño e invasión local del tumor primario. Es importante para determinar el pronóstico y evaluar si el tumor puede resecarse.
Los tumores T1 miden hasta 3cm, están rodeados por pulmón o pleura visceral y el bronquio principal no está invadido en la broncoscopia, salvo cuando, raramente, solo se extienden por la superficie bronquial. En este caso, se consideran T1 aunque afecten al bronquio principal. Si no sobrepasan los 20mm son T1a, y entre 21 y 30mm, T1b.
Los tumores T2 miden entre 31mm y 70mm. Los T2a hasta 50mm y los T2b entre 51mm y 70mm. No deben afectar al bronquio principal a menos de 2cm de la carina. Puesto que el bronquio principal derecho es muy corto, su afectación con frecuencia excede los criterios de T2. La tomografía computarizada (TC) es poco precisa para establecer el T2, que determina si el tumor puede resecarse20, para lo que es mejor la ecografía endobronquial (EBUS). También son T2 los tumores que infiltran la pleura visceral. Aunque este factor no impide que el tumor pueda extirparse, modifica el pronóstico de la enfermedad21. La TC tampoco es sensible para detectarla y la ecografía es una alternativa, aunque pendiente de validar. La infiltración de un lóbulo vecino a través de la cisura está dentro de esta categoría, siempre que no la sobrepase por tamaño22. Asimismo, pertenecen a ella los tumores centrales que infiltran solo la grasa hiliar y los que provocan atelectasia o neumonitis desde el hilio sin afectar todo el pulmón. Puede ser difícil delimitar radiológicamente el tumor y diferenciarlo de los cambios obstructivos pulmonares secundarios.
En los tumores T3 se incluyen los mayores de 70mm, los asociados a un nódulo tumoral en el mismo lóbulo, los de cualquier tamaño que infiltran estructuras potencialmente extirpables (bronquio principal a menos de 2cm de la carina, sin invadirla; pared torácica; diafragma; pleura mediastínica; pericardio parietal o nervio frénico) y los que producen atelectasia o neumonitis de todo el pulmón. La infiltración parietal no impide resecar el tumor, pero afecta al pronóstico y condiciona el abordaje quirúrgico. Aunque se han establecido criterios para valorarla (ángulo obtuso con la pared, contacto con la superficie pleural mayor de 3cm, engrosamiento pleural y desaparición del plano graso)23, el único certero es la infiltración ósea. La ecografía es una técnica prometedora para determinarla24. Por otro lado, se puede sospechar la infiltración del nervio frénico cuando el tumor está en contacto con el trayecto del nervio y su diafragma elevado.
Finalmente, son T4 las neoplasias con un nódulo tumoral situado en otro lóbulo homolateral y los tumores de cualquier tamaño con invasión de estructuras irresecables como el mediastino (extensión del tumor a la grasa mediastínica), el nervio recurrente laríngeo, el corazón, el pericardio visceral, la tráquea o carina, el cuerpo vertebral, el esófago o los grandes vasos (aorta, venas cavas superior e inferior, arteria pulmonar principal y porciones intrapericárdicas de las arterias pulmonares derecha e izquierda y de las venas pulmonares).
En tumores centrales la invasión mediastínica puede ser evidente en la TC o existir solo contacto entre el tumor y el mediastino. Hay signos radiológicos para diferenciar entre contacto e infiltración vascular, como el contacto superior a 3cm, desaparición del plano graso de separación o el contacto con más de 90° o 180° del contorno aórtico, aunque la precisión es muy baja19,25–27. Ser preciso es relevante desde la aparición de los fármacos antiangiogénicos, porque los grandes vasos y los bronquiales englobados o infiltrados son los únicos signos radiológicos relacionados con riesgo de sangrado por estos fármacos28. Por otro lado, aunque la cavitación basal o durante el tratamiento no forma parte del TNM, ni es un factor de riesgo de sangrado claro28, se aconseja mencionarla. Hasta que no se establezcan criterios más definidos es recomendable describir completamente todos estos signos para tomar la mejor decisión terapéutica posible.
Descriptor NSe consideran patológicos los ganglios con un eje corto mayor de 10mm, aunque la precisión diagnóstica es poca29,30. Se incluyen las estaciones ganglionares de drenaje directo del tumor, es decir, los ganglios intratorácicos, escalenos, supraclaviculares y cervicales bajos. La invasión ganglionar directa también se considera N. Los ganglios por encima del borde inferior del cartílago cricoides son M1b, como los de la grasa extrapleural cuando la pared está invadida. Existe un nuevo mapa ganglionar estandarizado que define los límites anatómicos de cada una de las estaciones31. Es importante hacer hincapié en que en las áreas paratraqueales (2 y 4) el límite entre la derecha y la izquierda no es la línea media mediastínica anatómica, sino el margen izquierdo de la tráquea o la línea media mediastínica oncológica.
Son N1 las adenopatías intrapulmonares, peribronquiales e hiliares homolaterales que están por dentro de la pleura visceral (estaciones 10 a 14). Son N2 las mediastínicas homolaterales y las de la línea media, prevasculares, retrotraqueales y subcarinales (estaciones 2 a 9). Son N3 las hiliares o mediastínicas contralaterales y las escalenas, supraclaviculares y cervicales bajas (estación 1), homo o contralaterales.
Descriptor MHace referencia a las metástasis, intra o extratorácicas. Aunque la linfangitis carcinomatosa no se incluye en el TNM es recomendable considerarla porque empeora el pronóstico19.
Son M1a los tumores con nódulos pulmonares contralaterales o afectación pleural o pericárdica maligna no contigua en forma de engrosamientos, nódulos o derrame. La ecografía es útil para estudiarla, permite seleccionar mejor dónde aspirar el líquido y detectar focos sólidos a los que dirigir la punción para estudio cito o anatomopatológico32.
Los tumores M1b tienen metástasis a distancia, incluyendo las adenopatías ubicadas en territorios distintos a los del descriptor N.
Informe radiológicoLa evaluación radiológica es clave para que el oncólogo tome decisiones terapéuticas en el cáncer de pulmón. Por ello, es crucial redactar informes con descripciones correctas y completas. Para conseguirlos es necesaria la colaboración entre el profesional que solicita el estudio y el radiólogo que lo interpreta. En la petición radiológica debe incluirse toda la información que permita al radiólogo interpretar correctamente los signos. Debe constar el motivo de la solicitud (cribado, diagnóstico, valoración de la respuesta al tratamiento) y, en su caso, el tratamiento recibido y su intención (cirugía, quimioterapia, radioterapia, nuevas terapias dirigidas como los inhibidores de la tirosina cinasa [TKI] o antiangiogénicos). Cuando sea posible se incluirá tanto datos de la enfermedad como anatomopatológicos, características moleculares, como el factor de crecimiento epidérmico (EGFR) o la cinasa de linfoma anaplásico (ALK) y TNM al diagnóstico. Cuando se solicita valorar la respuesta terapéutica es importante incluir la fecha de la prueba precedente con la que comparar las imágenes, las lesiones diana seleccionadas y la fecha de la respuesta máxima.
La evaluación radiológica debe ser morfológica (mediante TC) y definir los niveles de afectación tumoral que condicionan el TNM, e incluir los criterios para evaluar la respuesta en tumores sólidos (Response Evaluation Criteria in Solid Tumors [RECIST])33 si fuera necesario. Al diagnosticar el tumor es clave describir sus características radiológicas, que determinan el tratamiento inicial de la enfermedad. Debe incluirse toda la información de los descriptores TNM y otros datos relevantes (tabla 1). En la enfermedad avanzada establecer radiológicamente la infiltración vascular es un criterio para descartar el tratamiento antiangiogénico.
Propuesta de informe radiológico inicial en cáncer de pulmón
| Solicitud de informe | |
|---|---|
| Especialista encargado: oncólogo, radioterapeuta, cirujano o neumólogo | |
| Parámetro descriptor | Características del informe |
| Motivo, tratamiento realizado e intención | 1) Motivo (cribado, diagnóstico, valoración de respuesta)2) Tratamiento realizado (cirugía, quimioterapia, radioterapia, tratamientos moleculares dirigidos)3) Intención del tratamiento (rescate quirúrgico, radical, paliativo) |
| Características del tumor | 1) Histología2) TNM al diagnóstico3) Características moleculares del tumor (EGFR, ALK) |
| Fecha de la imagen comparativa | Incluir en la petición la fecha de la prueba con la que deben compararse las imágenes (basal, previo al tratamiento o, en caso de enfermedad avanzada, la fecha de máxima respuesta RECIST 1.1) |
| Informe de evaluación | |
|---|---|
| Especialista encargado: radiólogo | |
| Parámetro descriptor | Características del informe |
| T | 1) Diámetro mayor en plano axial:a) En caso de nódulo pulmonar con vidrio deslustrado:i) Diámetro sin incluir el vidrio deslustradoii) Diámetro incluyendo el vidrio deslustrado2) Afectación de vía aérea:a) afectación más proximali) Tráqueaii) Bronquio principal a más de 2cm de la carinaiii) Bronquio principal a menos de 2cm de la carinaiv) Bronquio lobarv) Bronquio interlobarvi) Bronquio segmentariovii) Bronquio aferente3) Afectación arterial:a) Troncos arteriales supraaórticosb) Arteria aortac) Arteria pulmonari) Arteria pulmonar principalii) Arteria pulmonar derecha o izquierdaiii) Arteria lobar superior (tronco anterior) o interlobariv) Ramas directas de arteria interlobar (lobar media/lingular o lobar inferior)v) Arterias segmentarias4) Afectación venosa:a) Vena cava superiorb) Vena ácigosc) Vena pulmonar superiord) Vena pulmonar inferiore) Aurícula izquierda5) Infiltración grandes vasos (arteriales y/o venosos): sí/no/indeterminada6) Infiltración periférica:a) Pleuralb) Extrapleural/ pared torácicac) Ósead) Transgresión cisurale) Mediastínicaf) Pericárdica7) Nódulos adicionales:a) En mismo lóbulob) En otro lóbulo homolateral8) Atelectasia/neumonitisa) Parte del pulmónb) Todo el pulmón9) Linfangitisa) cLy0 (no linfangitis)b) cLy1 (alrededor del tumor)c) cLy2 (a distancia en el mismo lóbulo)d) cLy3 (en otro lóbulo homolateral)e) cLy4 (en pulmón contralateral)10) Cavitación: sí/no |
| N | 1) Territorios ganglionares según clasificación TNM 7.a edición con ganglios de características sospechosas de malignidad (tamaño)2) Afectación escalena/supraclavicular |
| M | 1) Nódulo adicional en pulmón contralateral2) Derrame pleural3) Nódulo/engrosamiento pleural4) Derrame pericárdico5) Nódulo/engrosamiento pericárdico6) Extrapulmonar (ganglionar alejada de los territorios N, suprarrenal, ósea, hepática, partes blandas, peritoneal…) |
EGFR: factor de crecimiento epidérmico; RECIST: Response Evaluation Criteria in Solid Tumors.
La última versión RECIST 1.1 es el método universal para valorar radiológicamente la respuesta al tratamiento antitumoral del cáncer de pulmón, ya sea quimioterapia, radioterapia o nuevos tratamientos dirigidos33. Básicamente se enmarca en 3 situaciones terapéuticas posibles: 1) estadios iniciales (i-ii) tratados con quimioterapia de inducción (antes de la intervención quirúrgica) o adyuvante (tras la resección); 2) enfermedad localmente avanzada (N2-N3) tratada con inducción (quimioterapia±radioterapia), donde la respuesta terapéutica es trascendental para determinar el rescate quirúrgico, o tratamiento radical (quimioterapia+radioterapia) en tumores que no pueden intervenirse; y 3) en la enfermedad avanzada (iv), para analizar la eficacia del tratamiento antitumoral con intención paliativa.
No obstante, en los últimos años ha habido cambios trascendentales en el tratamiento del cáncer de pulmón avanzado con la introducción de una nueva generación de fármacos de terapia molecular (TKI: erlotinib, gefitinib, afatinib, crizotinib) o antiangiogénica (bevacizumab), con mecanismos de acción y patrones de respuesta muy distintos a los de la quimioterapia y la radioterapia. A pesar de ello, la nueva versión revisada de los criterios unidimensionales RECIST 1.1 sigue siendo aplicable para estudiar la respuesta a estos nuevos tratamientos dirigidos33, aunque en muchas ocasiones no refleje fielmente la actividad antitumoral. Otro tratamiento para el cáncer de pulmón en fase incipiente de desarrollo es el inmunológico. Al igual que el molecular, la terapia inmunológica tiene un patrón de respuesta específico que sí se refleja en los criterios de respuesta inmunológica bidimensionales (Immune-Related Response Criteria [irRC])34. Estos criterios pretenden ser mejores que RECIST para valorar la respuesta inmunológica y se están aplicando en ensayos clínicos con inmunoterapia34.
Aplicación de los criterios para evaluar la respuesta en tumores sólidos e incorporación al informeEl radiólogo integrado en equipos multidisciplinares dedicados al cáncer de pulmón debe ser capaz de aplicar RECIST para medir la carga tumoral en los estudios de TC y el grado de respuesta al tratamiento, porque son criterios muy utilizados en ensayos clínicos y en la práctica clínica, aunque con limitaciones en el caso de los nuevos fármacos citostáticos. La versión RECIST 1.1 simplifica la 1.0 al reducir el número de lesiones que medir, e incluye otras modificaciones que afectan al informe radiológico del estudio basal y de los estudios control, que deben realizarse con la misma modalidad y parámetros de imagen33,35–42.
Informe radiológico del estudio basalDebe incluir información de:
- •
La selección y diámetro máximo de las lesiones diana. Incluirá un máximo de 5 lesiones y 2 por órgano (en RECIST 1.0 eran un máximo de 10, y 5 por órgano33], eligiendo las mayores y más fácilmente reproducibles. Las lesiones deben ser medibles, es decir, deben tener un diámetro máximo ≥10mm (asumiendo un grosor de corte ≤5mm) en el plano axial. RECIST 1.1 admite medidas sagitales o coronales si las reconstrucciones son isotrópicas33.
- •
Las adenopatías. Se miden en el eje corto y pueden ser lesiones diana cuando miden ≥15mm. También pueden serlo las metástasis óseas líticas o mixtas si tienen un componente de partes blandas medible. Las metástasis quísticas pueden ser diana, pero es preferible utilizar lesiones sólidas.
- •
La descripción del resto de las lesiones (no diana) sin medidas. Incluyen las lesiones medibles y no medibles, es decir, las de diámetro máximo <10mm, adenopatías con eje corto ≥10mm y <15mm, ascitis, derrame pleural y pericárdico, linfangitis carcinomatosa, metástasis leptomeníngeas, metástasis óseas sin masa de partes blandas, lesiones ya radiadas o con tratamiento local.
- •
La suma de los diámetros de las lesiones diana. Sirve de referencia para controles posteriores.
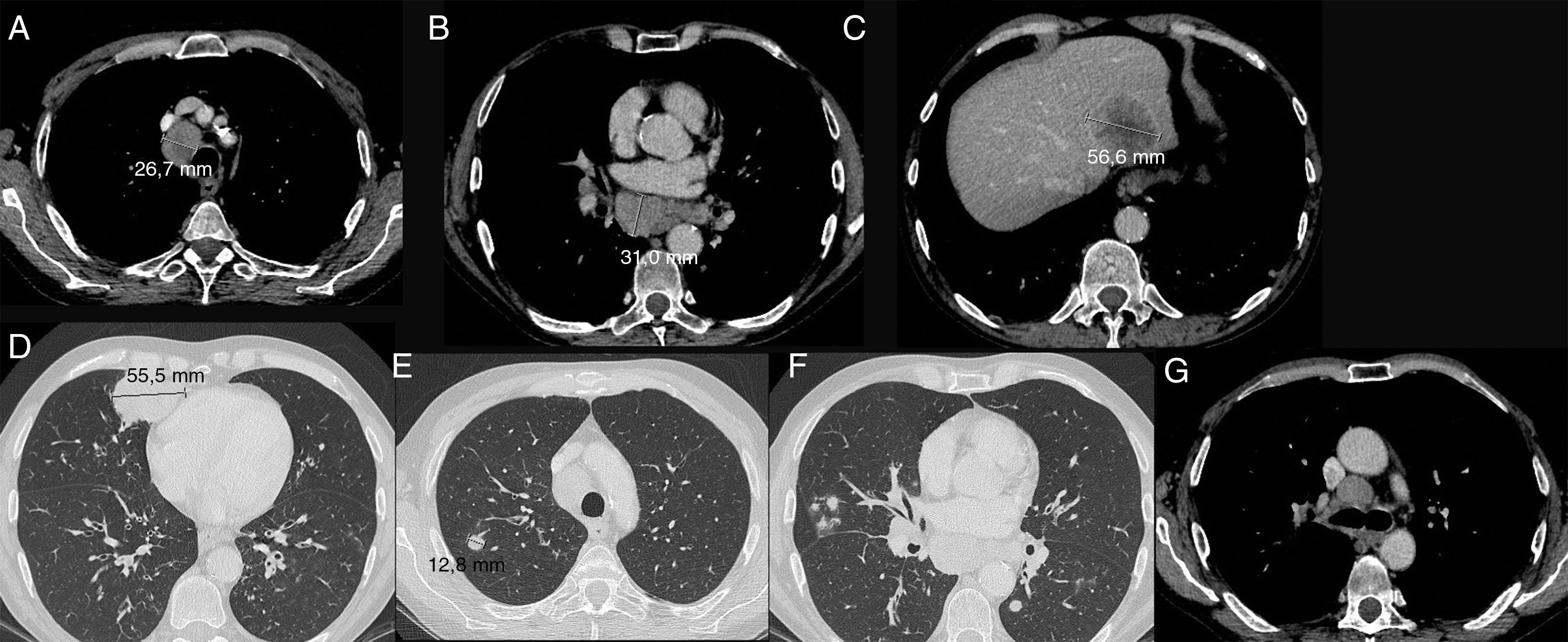
En la figura 2 se pueden observar lesiones diana y no diana en el estudio basal de un adenocarcinoma de pulmón.
Lesiones diana (A-E) y no diana (F y G) en estudio basal de adenocarcinoma de pulmón. A y B. Adenopatías mediastínicas medidas en el eje corto. C. Metástasis hepática. D. Masa en el lóbulo medio. E. Nódulo pulmonar metastásico; F. Múltiples nódulos pulmonares bilaterales. G. Adenopatía mediastínica. La suma de las lesiones diana es de 181mm.
Debe incluir información de:
- •
El diámetro máximo de las lesiones diana. Puede tener una orientación diferente a la del estudio basal. Si confluyen lesiones se medirá el diámetro máximo de la lesión resultante. En caso de fragmentación de la lesión diana se suman los diámetros máximos de las lesiones resultantes. Si una lesión disminuye tanto como para no poder medirse se la considera como de 5mm. En el caso de las adenopatías se mide el eje corto, aunque sea <10mm (tabla 2).
Tabla 2.Propuesta de informe radiológico de seguimiento en cáncer de pulmón
Recoger la medida de todas las lesiones diana, incluidas las adenopatías aunque disminuyan a menos de 10mm de eje corto y su S. Incluir descripción de posible necrosis/cavitación Interpretación radiológica de la respuesta de las lesiones dianaRC: desaparición de todas las lesiones y todos los ganglios con eje corto<10mmRP: reducción de S≥30% respecto al estudio basalEE: ni RP ni PEPE: aumento de S≥20% y ≥5mm respecto a la menor suma obtenida en el seguimiento Interpretación radiológica de la respuesta de lesiones no dianaRC: desaparición de todas las lesiones y todos los ganglios con eje corto <10mmNi RC ni PE: persistencia de lesionesPE: aumento inequívoco de lesiones medibles y/o no medibles Lesiones de nueva apariciónSí→ ProgresiónNoDudosa→ valorar en próximo control Interpretación de respuesta global radiológicaRC: RC de lesiones diana y no dianaRP:RC de lesiones diana; lesiones no diana ni RC, ni PE o NERP de lesiones diana; lesiones no diana ni RC, ni PR o NEEE: EE de lesiones diana; no diana no PE/NEPE: PE lesiones diana y/o PE lesiones no diana y/o nuevas lesionesNE: lesiones diana NE EE: enfermedad estable; NE: no evaluable; PE: progresión de la enfermedad; RC: respuesta completa; RP: respuesta parcial; S: suma.
- •
La necrosis de las lesiones. No se trata de un criterio de respuesta RECIST al tratamiento, pero se sugieren en su Apéndice III33.
- •
La respuesta al tratamiento. Suma de las lesiones diana y valoración cualitativa de las no diana.
- •
La progresión de las lesiones diana. Se parte de la medida menor obtenida durante el estudio (nadir) y RECIST 1.133. Exige un aumento ≥5mm y ≥20%.
- •
La aparición inequívoca de nuevas lesiones malignas. Se considera progresión de la enfermedad. RECIST 1.1 también considera progresión de la enfermedad las lesiones nuevas vistas con PET, no presentes en la TC basal y confirmadas mediante TC33. También se considera progresión la aparición de lesiones en áreas no incluidas en el estudio basal.
- •
La progresión de las lesiones «no diana» con estabilización o respuesta de las lesiones «diana». En este caso se aconseja una valoración cuidadosa por parte del oncólogo, por ejemplo, sobre la aparición de derrame pleural.
Puede presentarse de uno a 6 meses después de la radioterapia torácica externa43–45. Se estima que entre el 13% y el 37% de los pacientes tratados con radioterapia radical desarrollan neumonitis clínicamente significativa que puede requerir tratamiento esteroideo.
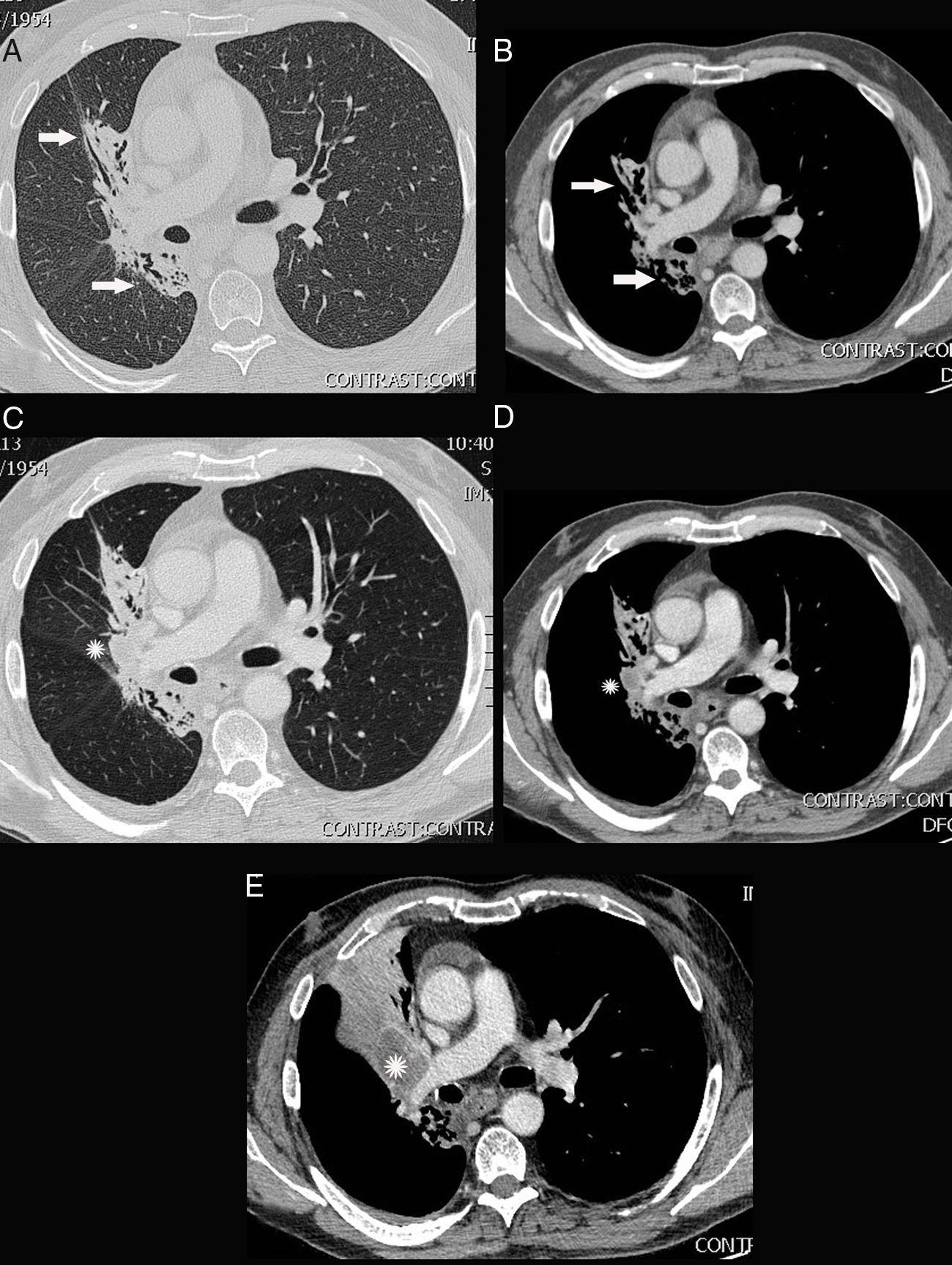
FibrosisSuele observarse en la zona irradiada de 6 a 12 meses después, a menudo sin signos previos de neumonitis rádica43,44. En la TC aparece una atelectasia con bronquiectasias por tracción limitada a la zona irradiada, que puede progresar hasta los 24 meses y desarrollar engrosamiento o derrame pleural. Para interpretarla es importante conocer la técnica de radioterapia empleada (fig. 3).
Fibrosis posradioterapia y posterior recidiva tumoral en un varón de 54 años tratado con quimiorradioterapia por carcinoma microcítico de pulmón. Estudios de tomografía computarizada (TC) multidetector con contraste intravenoso. A y B. Ventanas de pulmón (A) y de mediastino (B) de TC realizada 2 años tras la quimiorradioterapia. El paciente estaba en remisión completa. Se observa fibrosis posradioterapia con atelectasia y bronquiectasias por tracción delimitadas al campo irradiado (flechas). C y D. Ventanas de pulmón (C) y de mediastino (D) de TC realizada 3 años y 6 meses tras la quimiorradioterapia. Se observa una opacidad redondeada de densidad de tejidos blandos parahiliar derecha no visible en las TC previas seriadas, compatible con recidiva tumoral (asteriscos). No había otros hallazgos en la TC. E. Ventana de mediastino de estudio de TC realizado 3 años y 10 meses tras la quimiorradioterapia, donde se observa un marcado crecimiento de la masa hiliar derecha (asterisco) y atelectasia obstructiva asociada. También había metástasis hepáticas múltiples (no mostradas).
Valorar mediante TC la evolución del tumor tras la radioterapia es difícil por la neumonitis o fibrosis circundantes. Es importante disponer de estudios anteriores técnicamente similares con contraste yodado. En los primeros meses la PET-TC no es útil porque puede haber falsos positivos por la neumonitis46. Cuando se consigue la remisión completa de la enfermedad es difícil detectar precozmente con TC una recidiva del tumor en las zonas irradiadas. Es importante comparar los estudios sucesivos porque la recidiva tumoral se caracteriza por la aparición o crecimiento de una opacidad de tejidos blandos dentro de la zona de fibrosis. En los casos dudosos se puede realizar una PET-TC. La recidiva se manifiesta ahora como una hipercaptación de fluorodesoxiglucosa (FDG) en la zona irradiada.
Situaciones especialesLas terapias tumorales dirigidas son un gran avance para tratar el cáncer. Las terapias moleculares con medicamentos no citotóxicos pretenden interferir específicamente con las vías biológicas aberrantes implicadas en la génesis tumoral, al contrario que el efecto citotóxico generalizado de la quimioterapia convencional. A pesar de algunas limitaciones, los criterios RECIST, basados en el tamaño tumoral, se aplican ampliamente y son bien aceptados para evaluar la respuesta de tumores sólidos tratados con quimioterapia citotóxica convencional47, pero no tienen en cuenta respuestas tumorales discretas de larga duración o estabilizaciones prolongadas de la enfermedad producidas por agentes como gefitinib, erlotinib y bevacizumab48. Los efectos de nuevos fármacos como los inhibidores de la angiogénesis y los antivasculares son más complejos que el simple cambio de tamaño. Estos fármacos producen frecuentemente necrosis y cavitación en el tumor sin un cambio significativo de tamaño, por lo que RECIST subestima a menudo su efecto. Por ello, se han planteado alternativas para medir la respuesta tumoral utilizando nuevas técnicas como la imagen funcional y molecular.
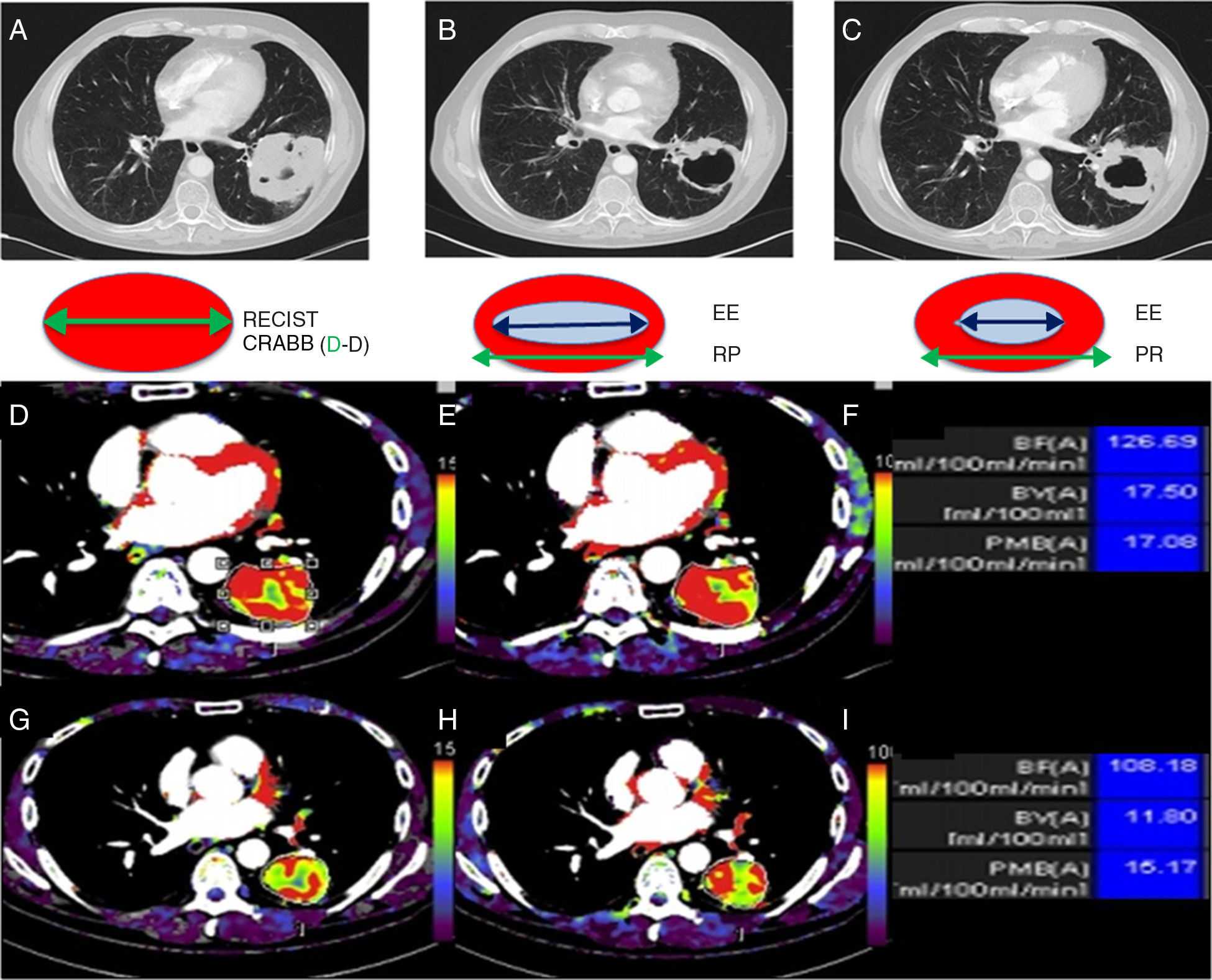
CavitaciónPuede aparecer inicialmente en el cáncer de pulmón, especialmente en carcinomas escamosos, pero también en adenocarcinomas y es frecuente en tumores pulmonares tratados con fármacos antiangiogénicos. Un estudio que observó cavitación en el 24% de los pacientes tratados con fármacos antiangiogénicos y en ninguno de los tratados con quimioterapia clásica propuso utilizar el diámetro de Crabb como diámetro alternativo al del RECIST49. Consiste en restarle al del RECIST el diámetro máximo de la cavitación, lo que permite determinar mejor la respuesta de las lesiones diana al tratamiento49 (fig. 4).
Diámetro RECIST y de Crabb y tomografía computarizada (TC) perfusión de masa pulmonar en LII. A. Masa pulmonar en LII con mínima cavitación en el que coinciden el diámetro medido con RECIST y mediante el método de Crabb. B. Tras el tratamiento se observa una importante cavitación de la masa pulmonar, que con RECIST (solo el tamaño tumoral) es enfermedad estable, mientras que mediante Crabb (diámetro RECIST menos el diámetro de la cavitación) es respuesta parcial. C. En un control posterior observamos que aumenta el componente sólido de la lesión, que corresponde a enfermedad estable con RECIST y progresión mediante Crabb.
TC perfusión de otra neoplasia pulmonar en LII antes de empezar el tratamiento. D. Imagen de volumen sanguíneo. E. Imagen de flujo sanguíneo. F. Valores numéricos de volumen sanguíneo, flujo sanguíneo y permeabilidad. TC perfusión a los 10 días de iniciado el tratamiento antiangiogénico. G. Mapa de volumen sanguíneo. H. Flujo sanguíneo. I. Valores numéricos de volumen sanguíneo, flujo sanguíneo y permeabilidad. Se observa una disminución de todos los parámetros de perfusión sin cambios en el tamaño de la lesión según RECIST.
EE: enfermedad estable; PR: progresión; RECIST: Response Evaluation Criteria in Solid Tumors; RP: respuesta parcial.
En las lesiones puede también cambiar la atenuación por necrosis y hemorragia. Un estudio de tumores del estroma gastrointestinal (GIST) con TC con contraste valoró la necrosis midiendo las unidades Hounsfield antes y después del tratamiento50. Con los resultados de este estudio se han propuesto unos criterios de respuesta (criterios de Choi) que incluyen la atenuación tumoral y se han incorporado en algunos estudios que valoran la respuesta pulmonar a los fármacos antiangiogénicos51.
PerfusiónExisten múltiples técnicas de imagen funcional por TC, RM, PET o ultrasonidos47. En el cáncer pulmonar la técnica de imagen funcional más utilizada actualmente es la TC perfusión. Permite evaluar la vascularización tumoral analizando temporalmente los cambios de atenuación en los vasos sanguíneos y los tejidos, adquiriendo rápidamente series de imágenes con contraste intravenoso52. Los parámetros más utilizados son el flujo sanguíneo, el volumen sanguíneo y la permeabilidad, que se han relacionado patológicamente con la angiogénesis, la vascularización tumoral y la necrosis53–56 y son útiles para valorar la respuesta tumoral en pacientes tratados con fármacos antiangiogénicos57–59. Los últimos estudios coinciden en que la TC perfusión no es solo adecuada para valorar la respuesta al tratamiento, sino que puede predecir la respuesta terapéutica por su sensibilidad para detectar cambios precoces en la vascularización tumoral57–59 (fig. 4). La limitación principal para extender su uso en ensayos clínicos es la heterogeneidad de los protocolos existentes y las diferencias entre las marcas comerciales. Recientemente se han publicado las primeras guías clínicas para unificar conceptos y establecer protocolos de TC perfusión en ensayos clínicos52.
Periodicidad del seguimiento del paciente con cáncer de pulmónSe trata de una cuestión controvertida que debe ser individualizada. En los pacientes intervenidos quirúrgicamente se recomienda seguirlos con TC cada 6-12 meses durante los 2 primeros años, y después anualmente60.
En el tratamiento de primera línea se recomienda evaluar la respuesta tumoral a las 9 o 12 semanas desde el inicio del tratamiento. Según el criterio clínico individualizado puede hacerse un control tras 6 semanas, pero esto suele hacerse cuando se sospecha la progresión precoz de la enfermedad, toxicidad o cuando se quiere evaluar la respuesta antes de lo habitual por cualquier motivo.
No está muy claro cuál es el mejor seguimiento clínico y radiológico una vez finalizado el tratamiento antineoplásico del cáncer de pulmón no microcítico (CPNM) avanzado, porque los datos publicados son limitados. El seguimiento debe basarse fundamentalmente en la decisión terapéutica planificada cuando progresa la enfermedad61. Los pacientes no subsidiarios de tratamiento oncológico activo en líneas sucesivas de tratamiento no se seguirán con pruebas radiológicas adicionales. Dada la mejora de la supervivencia en los pacientes tratados con quimioterapia en segunda línea, y que solo un 60-65% de pacientes llegan a ser tratados con ella por la naturaleza agresiva de este tumor, es necesario seguirlos estrechamente tras finalizar el tratamiento quimioterápico de primera línea. Se recomienda realizar una evaluación clínica y/o radiológica 6 semanas después de haber finalizado el tratamiento y posteriormente cada 6-12 semanas para empezar precozmente la terapia de segunda línea.
ConclusionesLa TCMD es la técnica de elección para estudiar el cáncer de pulmón. Debe hacerse con contraste intravenoso para valorar las estructuras vasculares, mediastínicas y el abdomen en fase portal. El informe radiológico debe incluir una valoración completa de los descriptores TNM. Se debe describir exhaustivamente la localización, medida, afectación de estructuras adyacentes y potencial invasión vascular por el tumor primario. La TC también es el método de elección para evaluar la respuesta terapéutica aplicando la última versión RECIST 1.1. Es preciso evaluar la respuesta en las lesiones diana y no diana, describir si hay nuevas lesiones y hacer una interpretación global. Por ello, los oncólogos deben aportar la información necesaria del paciente, del tipo de enfermedad y de los tratamientos recibidos. Por otro lado, en pacientes con inmunoterapia deben aplicarse también los criterios de respuesta inmunológica bidimensionales irRC. Finalmente, aunque la periodicidad del seguimiento de la respuesta tumoral es un tema controvertido, se recomienda hacer una primera valoración 6-12 semanas después de iniciar el tratamiento y luego cada 6-12 semanas después de haber finalizado el tratamiento. En cualquier caso, el tipo de seguimiento se basará fundamentalmente en la decisión terapéutica planificada cuando la enfermedad progrese.
FinanciaciónLa SEOM y la SERAM agradecen el apoyo financiero de este proyecto mediante becas sin restricción de AstraZeneca, Novartis y Roche.
Conflicto de interesesLos autores declaran que, en el momento de la redacción y revisión del texto, desconocían el nombre de los laboratorios que han apoyado económicamente este proyecto, por lo que este apoyo no ha influido en el contenido de este artículo.
Los autores agradecen la asistencia editorial de Ana Martín de HealthCo (Madrid, España) en el desarrollo de este manuscrito.
De acuerdo con los autores y los editores, este artículo se publica simultáneamente y de forma íntegra en inglés en la revista Clinical and Translational Oncology. DOI: 10.1007/s12094-014-1231-5.