Mediante las imágenes biomédicas podemos diagnosticar, estadificar, controlar y valorar la efectividad de los procedimientos terapéuticos a los que son sometidos los pacientes oncológicos. RECIST (Response Evaluation Criteria In Solid Tumors) es el método para monitorizar el tratamiento mediante medidas unidimensionales de los tumores, obtenidas con técnicas de imagen reproducibles como son la TC, la RM y la PET. Los cambios metabólicos inducidos por los nuevos tratamientos modifican la biología y comportamiento del tumor, con discordancia ocasional entre el estado clínico del paciente y la respuesta medida con RECIST, lo que apunta a la necesidad de incluir pruebas funcionales en la valoración de la respuesta al tratamiento.
El objetivo es revisar los criterios RECIST conociendo la aportación de la imagen funcional para valorar correctamente la eficacia y la repercusión del tratamiento en los pacientes con tumores sólidos.
Biomedical imaging makes it possible not only to diagnose and stage cancer, but also to follow up patients and evaluate the response to treatment. RECIST (Response Evaluation Criteria In Solid Tumors) provides a method to monitor the response to treatment based on one dimensional measurements of tumors obtained with reproducible imaging techniques like CT, MRI, and PET. The metabolic changes induced by new treatments modify the biology and behavior of the tumor; occasionally, there is a discrepancy between the patient's clinical condition and the response measured by RECIST, which indicates that functional tests need to be included in the evaluation of the response to treatment.
The objective is to review the RECIST criteria to include the contribution of functional imaging to enable the efficacy and effects of the treatment in patients with solid tumors.
La RAE define «respuesta» como «efecto que se pretende conseguir con una acción»1. En el ámbito de la oncología y la radiología, se trata de medir la respuesta a los tratamientos con biomarcadores de imagen y, así, mantener un tratamiento o suspenderlo para evitar posibles toxicidades y gastos innecesarios. La respuesta al tratamiento de los tumores sólidos clásicamente se basa en los cambios de tamaño, elemento base de los criterios RECIST (Response Evaluation Criteria In Solid Tumors)2. Estos cambios intentan representar el comportamiento biológico de los tumores, lo que ocasionalmente crea controversia porque, en los pacientes tratados con nuevos fármacos, no siempre un aumento del tamaño significa progresión3.
En ensayos clínicos se han usado diferentes criterios con el objetivo de normalizar la valoración de la respuesta al tratamiento, elemento fundamental para poder comparar los efectos de los tratamientos. Más aún cuando se desarrollan nuevos fármacos y terapias costosas para mejorar la supervivencia, y cuyos objetivos son 1) la mejoría clínica, por la reducción de la carga tumoral, o 2) la curación, por la desaparición completa del tumor. El propósito de esta revisión es repasar los criterios RECIST 1.1 e introducir los métodos de valoración con imagen funcional en los tratamientos con los nuevos quimioterápicos.
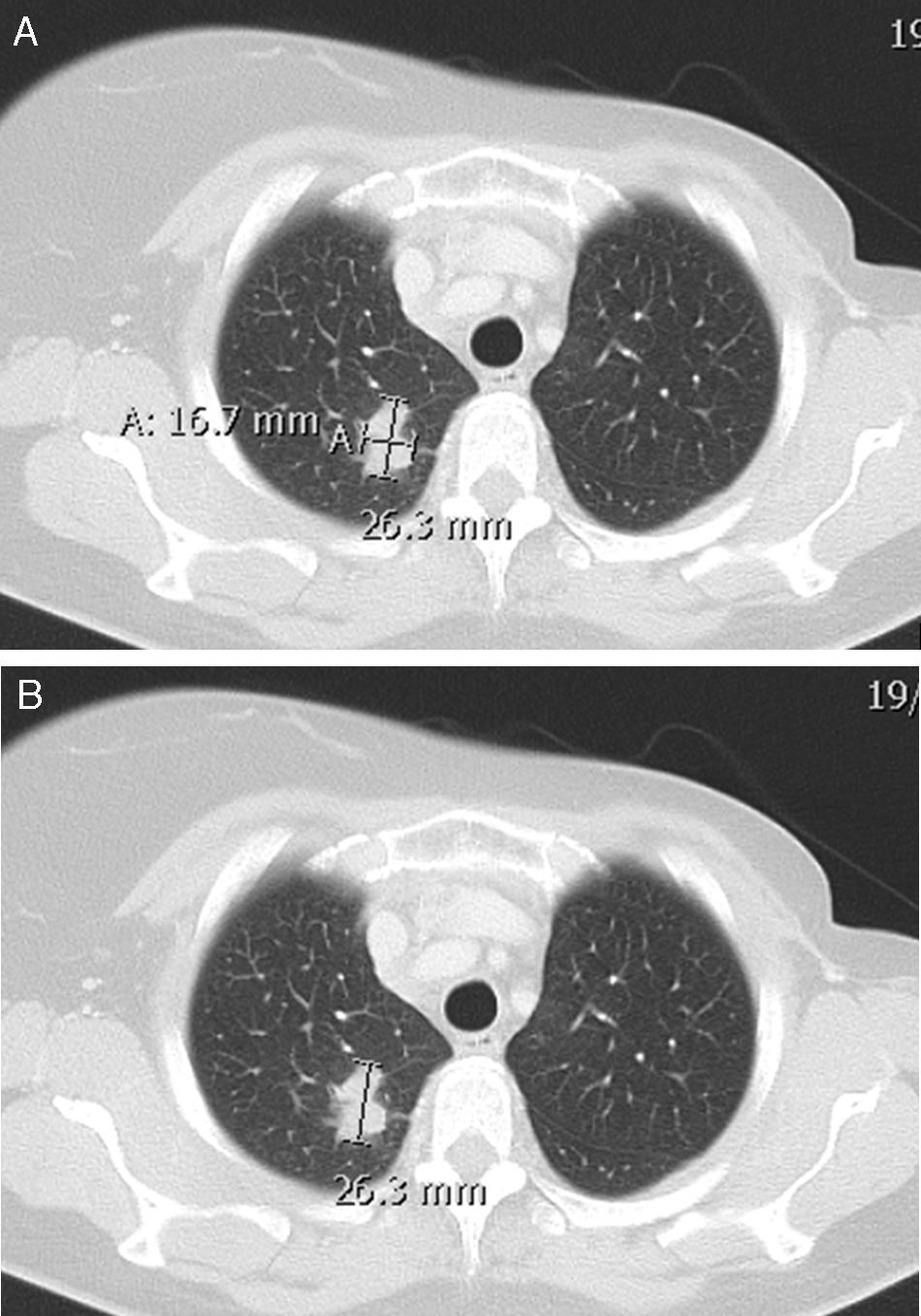
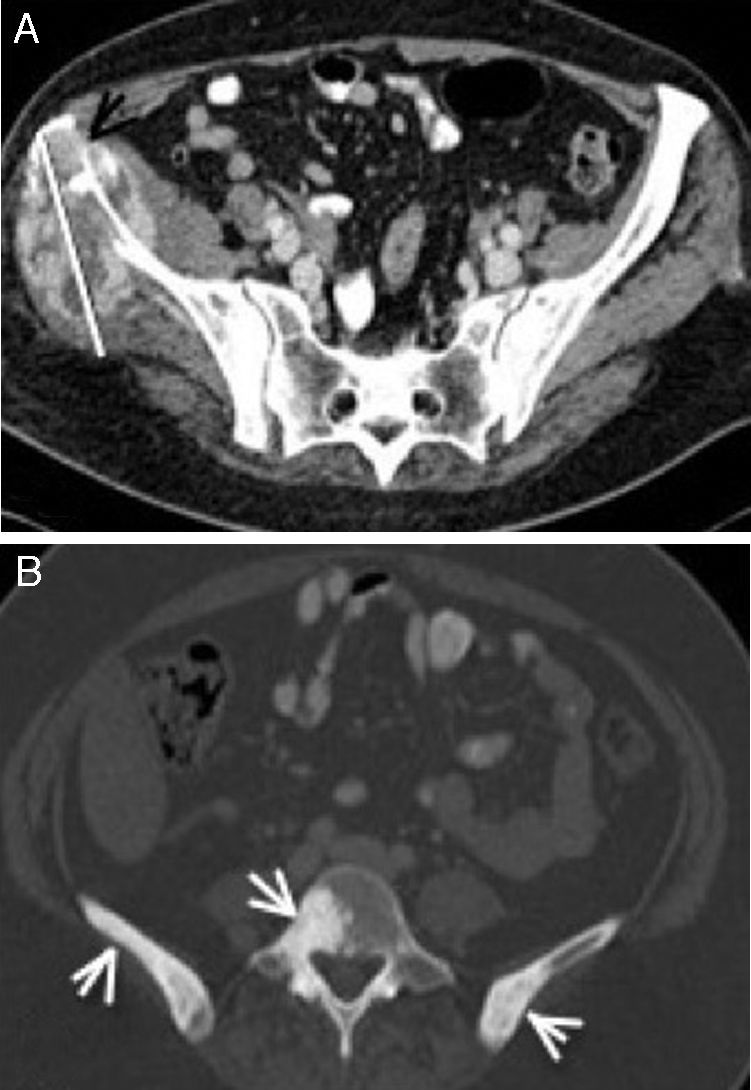
Criterios RECIST 1.1A finales de los 90, la OMS4 unifica la valoración de la respuesta y de la recidiva, el intervalo libre de enfermedad, y establece una graduación de la toxicidad del tratamiento. En el año 2000 aparecen los criterios RECIST2 como modificación de los criterios de la OMS, actualizados en 2009 a la versión 1.1 (http://www.recist.com) (fig. 1)5, que incluye la resonancia magnética (RM) y la PET con 18F-FDG como modalidades de imagen aceptadas para valorar la respuesta6 (tabla 1). Modificaciones importantes que la actualización 1.1 aporta son la reducción del número de lesiones diana (máximo de 5, solo 2 por órgano); el límite de 5mm, por debajo del cual las lesiones no se consideran medibles; la inclusión de las adenopatías como lesiones diana cuando su eje corto sea mayor de 15mm7; y la mención especial a las lesiones óseas, a las lesiones quísticas y a las lesiones previamente irradiadas. El rastreo óseo, la PET o las radiografías no son adecuados para medir las lesiones óseas, aunque pueden ser útiles para confirmarlas o determinar su desaparición. Las metástasis líticas o mixtas líticas-blásticas son medibles cuando el componente de partes blandas cumpla criterios de lesión medible. Las blásticas no son medibles (fig. 2). Las lesiones quísticas con criterios radiológicos de quiste simple no son medibles porque no se consideran malignas. Las que correspondan a metástasis quísticas pueden considerarse medibles si cumplen los criterios de lesión medible. No obstante, cuando existan otras lesiones no quísticas serán estas las seleccionadas como lesiones diana. RECIST no contempla los cambios de densidad (TC) o de intensidad de señal (RM) durante el seguimiento. Las lesiones localizadas en áreas previamente irradiadas o sometidas a cualquier terapia locorregional, deben considerarse lesiones no medibles, a menos que se demuestre su progresión.
Imagen axial de TC sin contraste endovenoso. Adenocarcinoma de pulmón. (A) Medida de los diámetros perpendiculares máximos, OMS. (B) Medida unidimensional máxima, RECIST. La suma de los diámetros máximos de hasta 5 lesiones y solo 2 por órgano (RECIST 1.1) define la carga tumoral del paciente.
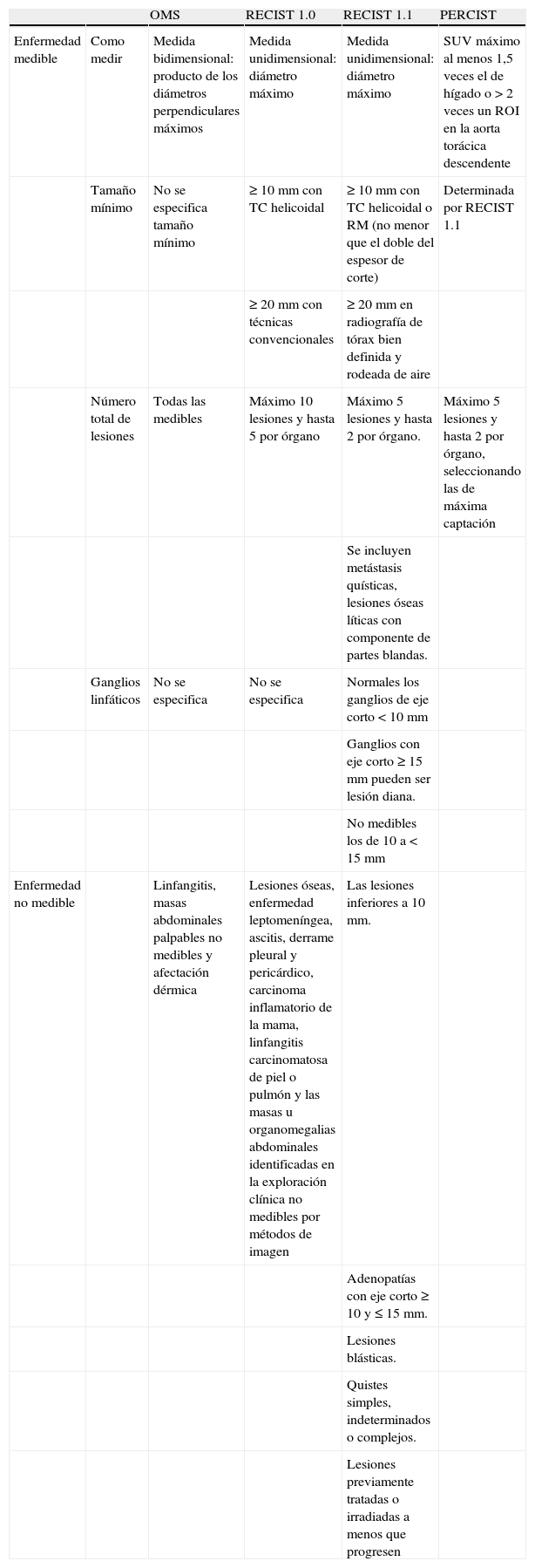
Resumen comparativo de los parámetros de evaluación según OMS, RECIST 1.0, RECIST 1.1 y PERCIST
| OMS | RECIST 1.0 | RECIST 1.1 | PERCIST | ||
| Enfermedad medible | Como medir | Medida bidimensional: producto de los diámetros perpendiculares máximos | Medida unidimensional: diámetro máximo | Medida unidimensional: diámetro máximo | SUV máximo al menos 1,5 veces el de hígado o >2 veces un ROI en la aorta torácica descendente |
| Tamaño mínimo | No se especifica tamaño mínimo | ≥10mm con TC helicoidal | ≥10mm con TC helicoidal o RM (no menor que el doble del espesor de corte) | Determinada por RECIST 1.1 | |
| ≥20mm con técnicas convencionales | ≥20mm en radiografía de tórax bien definida y rodeada de aire | ||||
| Número total de lesiones | Todas las medibles | Máximo 10 lesiones y hasta 5 por órgano | Máximo 5 lesiones y hasta 2 por órgano. | Máximo 5 lesiones y hasta 2 por órgano, seleccionando las de máxima captación | |
| Se incluyen metástasis quísticas, lesiones óseas líticas con componente de partes blandas. | |||||
| Ganglios linfáticos | No se especifica | No se especifica | Normales los ganglios de eje corto <10mm | ||
| Ganglios con eje corto ≥15mm pueden ser lesión diana. | |||||
| No medibles los de 10 a <15mm | |||||
| Enfermedad no medible | Linfangitis, masas abdominales palpables no medibles y afectación dérmica | Lesiones óseas, enfermedad leptomeníngea, ascitis, derrame pleural y pericárdico, carcinoma inflamatorio de la mama, linfangitis carcinomatosa de piel o pulmón y las masas u organomegalias abdominales identificadas en la exploración clínica no medibles por métodos de imagen | Las lesiones inferiores a 10mm. | ||
| Adenopatías con eje corto ≥10 y ≤15mm. | |||||
| Lesiones blásticas. | |||||
| Quistes simples, indeterminados o complejos. | |||||
| Lesiones previamente tratadas o irradiadas a menos que progresen |
Carcinoma de células renales con lesión lítica (flecha negra) en el hueso ilíaco derecho y con línea de medida incluyendo el componente de partes blandas en la imagen axial de TC con contraste intravenoso y ventana de partes blandas (A). Lesiones blásticas en ambos huesos ilíacos y L4 por adenocarcinoma de próstata en la imagen axial de la pelvis con ventana ósea (B).
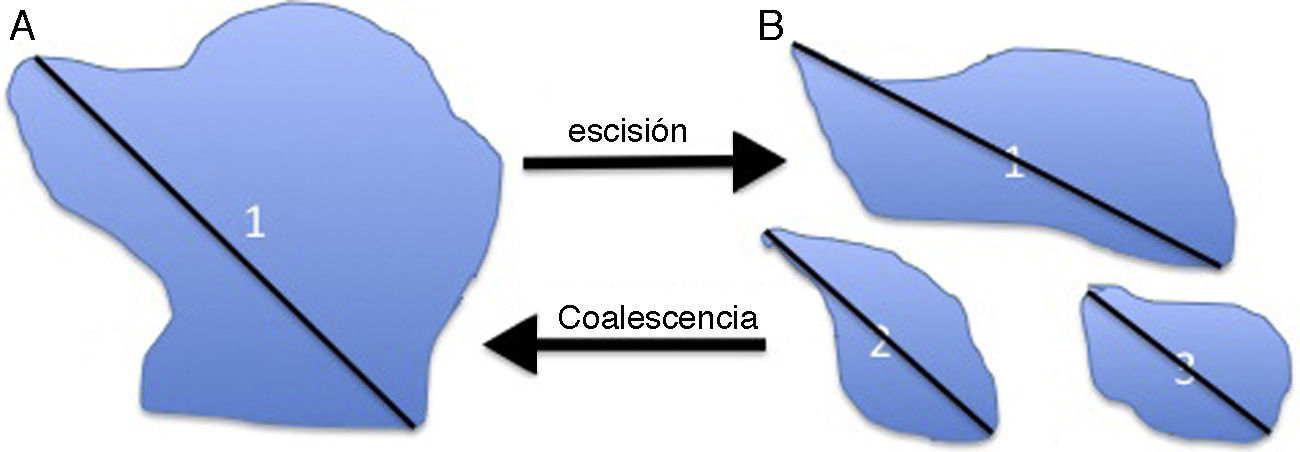
Para aplicar los criterios RECIST, primero hay que definir en el estudio inicial las lesiones diana representativas y reproducibles durante el seguimiento, teniendo en cuenta que su gran variabilidad (confluencia, fragmentación, mala definición, técnica de imagen, apreciación), y la dificultad para medirlas, como ocurre en los órganos móviles (ovario, tracto gastrointestinal), originan discrepancias intraobservador e interobservador8. La valoración de la respuesta se realizará con la misma técnica empleada en el estudio inicial, constatando la duración de la respuesta. La suma de las lesiones diana del estudio basal se usará para seguir y valorar objetivamente la respuesta. Cuando una lesión diana se fragmente durante el tratamiento se medirán sus partes, se sumarán, y se considerarán como una única lesión (fig. 3).
Medida del diámetro máximo (1) en una lesión diana (A) que tras el tratamiento se fragmenta (B). Para su valoración debe sumarse el diámetro máximo de cada uno de las partes escindidas (en B, 1+2+3). En el caso contrario, de producirse coalescencia se mide el máximo de la lesión resultante (1 en A).
Aun con sus limitaciones y excepciones, RECIST es el método radiológico sencillo, rápido y fiable más usado8, para valorar el tamaño tumoral, aunque en ocasiones no se correlacione bien con la situación clínica del paciente.
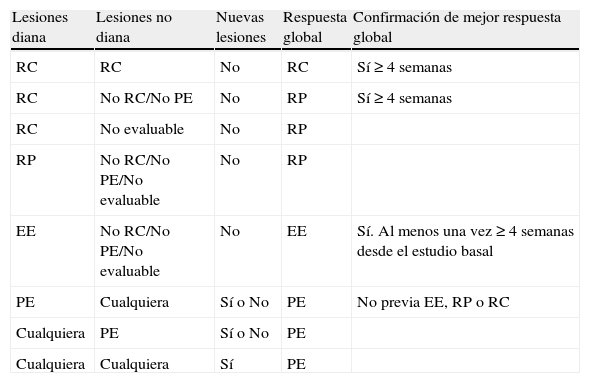
Tipos de respuestaSe considera respuesta completa (RC) cuando desaparecen la enfermedad medible y la evaluable, sin que aparezcan nuevas lesiones, con ausencia de síntomas y normalización de marcadores, durante al menos 4 semanas. Hablamos de respuesta parcial (RP) cuando se reduce al menos un 30% la suma de los diámetros de las lesiones diana. Hay progresión de la enfermedad (PE) cuando aumenta el 20%, se produce un incremento absoluto de al menos 5mm en la suma de los diámetros de las lesiones diana, o aparecen nuevas metástasis o progresan las lesiones no diana. La enfermedad estable (EE) significa que no hay suficiente reducción o suficiente incremento para considerarla RP o PE, respectivamente. Se define como respuesta global (RG) a la mejor respuesta después de iniciado el tratamiento antes de que recidive o progrese la enfermedad (tablas 2–4).
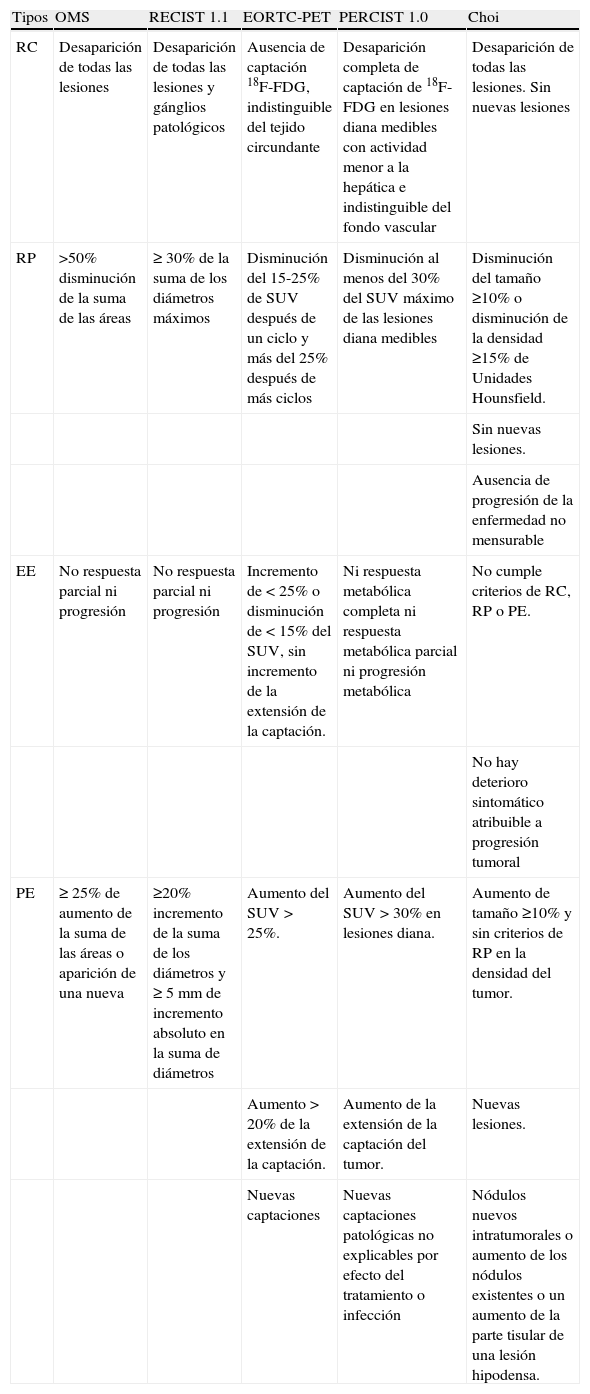
Criterios de respuesta OMS, RECIST, EORTC-PET, PERCIST 1.0
| Tipos | OMS | RECIST 1.1 | EORTC-PET | PERCIST 1.0 | Choi |
| RC | Desaparición de todas las lesiones | Desaparición de todas las lesiones y gánglios patológicos | Ausencia de captación 18F-FDG, indistinguible del tejido circundante | Desaparición completa de captación de 18F-FDG en lesiones diana medibles con actividad menor a la hepática e indistinguible del fondo vascular | Desaparición de todas las lesiones. Sin nuevas lesiones |
| RP | >50% disminución de la suma de las áreas | ≥30% de la suma de los diámetros máximos | Disminución del 15-25% de SUV después de un ciclo y más del 25% después de más ciclos | Disminución al menos del 30% del SUV máximo de las lesiones diana medibles | Disminución del tamaño ≥10% o disminución de la densidad ≥15% de Unidades Hounsfield. |
| Sin nuevas lesiones. | |||||
| Ausencia de progresión de la enfermedad no mensurable | |||||
| EE | No respuesta parcial ni progresión | No respuesta parcial ni progresión | Incremento de <25% o disminución de <15% del SUV, sin incremento de la extensión de la captación. | Ni respuesta metabólica completa ni respuesta metabólica parcial ni progresión metabólica | No cumple criterios de RC, RP o PE. |
| No hay deterioro sintomático atribuible a progresión tumoral | |||||
| PE | ≥25% de aumento de la suma de las áreas o aparición de una nueva | ≥20% incremento de la suma de los diámetros y ≥5mm de incremento absoluto en la suma de diámetros | Aumento del SUV >25%. | Aumento del SUV >30% en lesiones diana. | Aumento de tamaño ≥10% y sin criterios de RP en la densidad del tumor. |
| Aumento >20% de la extensión de la captación. | Aumento de la extensión de la captación del tumor. | Nuevas lesiones. | |||
| Nuevas captaciones | Nuevas captaciones patológicas no explicables por efecto del tratamiento o infección | Nódulos nuevos intratumorales o aumento de los nódulos existentes o un aumento de la parte tisular de una lesión hipodensa. |
Combinación de las posibles respuestas en pacientes con lesiones medibles y su mejor respuesta global
| Lesiones diana | Lesiones no diana | Nuevas lesiones | Respuesta global | Confirmación de mejor respuesta global |
| RC | RC | No | RC | Sí ≥4 semanas |
| RC | No RC/No PE | No | RP | Sí ≥4 semanas |
| RC | No evaluable | No | RP | |
| RP | No RC/No PE/No evaluable | No | RP | |
| EE | No RC/No PE/No evaluable | No | EE | Sí. Al menos una vez ≥4 semanas desde el estudio basal |
| PE | Cualquiera | Sí o No | PE | No previa EE, RP o RC |
| Cualquiera | PE | Sí o No | PE | |
| Cualquiera | Cualquiera | Sí | PE |
Fuente: adaptada de Van Persijn van Meerten8.
EE: enfermedad estable; PE: progresión enfermedad; RC: respuesta completa; RP: respuesta parcial.
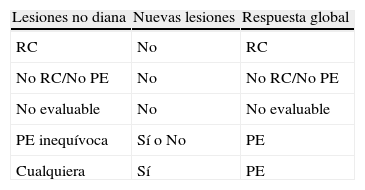
Combinación de las posibles respuestas en pacientes con lesiones no medibles y su mejor respuesta global
| Lesiones no diana | Nuevas lesiones | Respuesta global |
| RC | No | RC |
| No RC/No PE | No | No RC/No PE |
| No evaluable | No | No evaluable |
| PE inequívoca | Sí o No | PE |
| Cualquiera | Sí | PE |
Fuente: adaptada de Van Persijn van Meerten8.
EE: enfermedad estable; PE: progresión enfermedad; RC: respuesta completa; RP: respuesta parcial.
Es importante tener presente el criterio de aumento absoluto de 5mm en la medida de una lesión para considerar progresión. Así, si, por ejemplo, en el estudio basal una lesión diana mide 30mm y en el primer control se reduce a 10mm (reducción del 67%) se considera RP. Si en el siguiente control mide 13mm se consideraría EE, ya que además de aumentar el 20% se requiere el aumento absoluto de 5mm. Si en el seguimiento posterior aumenta a 16mm se consideraría PE por incrementar su tamaño más de 5mm y más del 20% respecto al menor de los tamaños registrados (10mm)9.
Volumen tumoralSe ha propuesto utilizar el volumen tumoral10,11 para evaluar la respuesta, ya que bastantes neoplasias no son esféricas, y crecen o se reducen de modo irregular12, y porque el volumen proporciona una información de la carga tumoral más fiable13, con una predicción de la respuesta más exacta, temprana14 y fácilmente reproducible15,16. Aunque en RECIST no se ha incluido la valoración volumétrica de los tumores, sí contempla las medidas coronales de imágenes isotrópicas5.
Valoración funcionalLos cambios metabólicos que inducen en los tumores los nuevos tratamientos (antiangiogénicos, antivasculares, anti-EGFR [epithelial growth factor receptor], anti Her2, inhibidores de la vía PI3k/Akt/mTOR, cKIT, terapia hormonal) no se reflejan directamente en la forma y, por tanto, no se pueden valorar adecuadamente con los criterios RECIST17. Existe una amplia variedad de técnicas de imágenes funcionales que permiten medir los cambios fisiopatológicos, metabólicos o bioquímicos18 mediante biomarcadores de imagen médica12,19, los cuales proporcionan información, tanto para el diagnóstico como para evaluar la respuesta20.
Difusión con resonancia magnéticaLas técnicas de difusión con RM, basadas en el movimiento browniano del agua, han demostrado ser un buen indicador temprano de la respuesta tumoral21. Generalmente los cambios en el coeficiente de difusión aparente (ADC) se correlacionan inversamente con la celularidad. Las imágenes potenciadas en difusión mejoran la detección y caracterización de los tumores malignos, ya que estos son hipercelulares y, por tanto, la difusión está restringida20. Un incremento del ADC puede reflejar un incremento en la movilidad del agua, bien por la pérdida de la integridad de la membrana, o bien por un incremento en la proporción total de líquido extracelular, con la correspondiente disminución del tamaño o número de células, como ocurre en la apoptosis o necrosis. Por el contrario, una disminución del ADC refleja una disminución del agua extracelular por un incremento del número o del tamaño de las células, como ocurre en la fibrosis, en el edema o en la progresión del tumor, lo que la hace una herramienta muy útil para valorar precozmente los efectos moleculares y, celulares de los tratamientos17,22 (fig. 4).
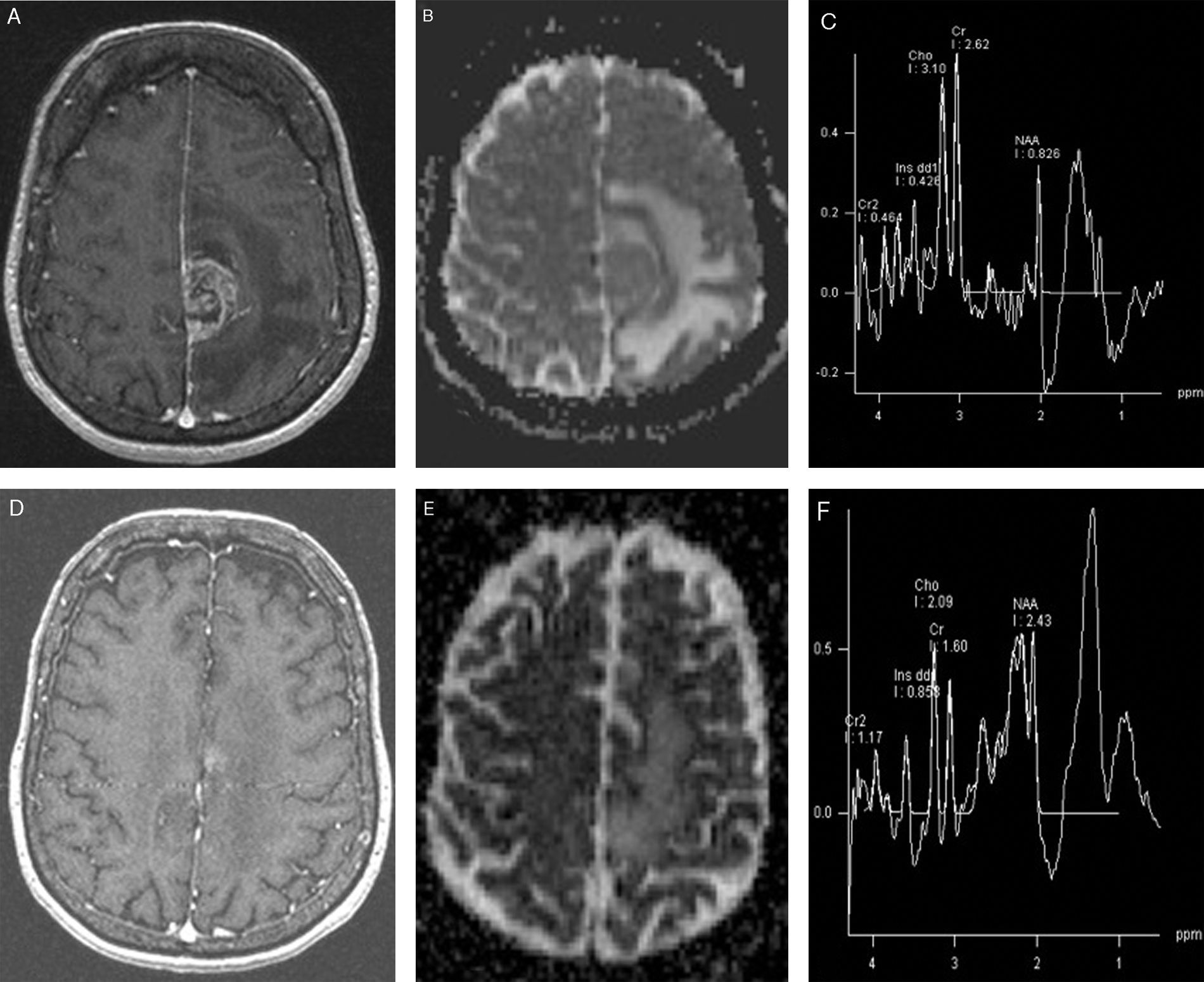
Glioblastoma multiforme, estudio basal y tras quimioterapia con fármaco antiangiogénico (bevacizumab) y radioterapia esteroatáxica fraccionada. En el estudio basal se aprecia la tumoración parafalciana en la imagen axial potenciada en T1 con contraste intravenoso (A). En la imagen del coeficiente de difusión aparente (B) se aprecia una restricción de la difusión en la parte sólida, y en el estudio de espectroscopia por RM 1H muestra un cociente colina/N-acetil aspartato (Cho/NAA) de 3,7 (C), propio de una tumoración glial de alto grado. El estudio axial T1 con contraste tras el tratamiento muestra una reducción de la tumoración (D), aumento del ADC respecto al estudio basal (E) —nótese las áreas de desmielinización debidas a la radioterapia— y el cociente Cho/NAA es 0,86 (F). Todo ello sugiere respuesta al tratamiento con disminución del metabolismo y el aumento de producción de membranas celulares (principal responsable del metabolito Cho en el estudio de espectroscopia).
La perfusión tumoral19 permite observar cómo el contraste inyectado se difunde al espacio extravascular extracelular, lo que aporta información de la permeabilidad endotelial y, del volumen del espacio intersticial intercambiable, y permite valorar la fisiología tisular y microvascular. Con esta técnica se evalúa la respuesta basada en la neoangiogénesis (fig. 5), considerando como respuesta la reducción de los valores relativos de volumen (rCBV) y flujo tumoral (rCBF). Así, por ejemplo, para diferenciar una radionecrosis de la persistencia tumoral en las metástasis cerebrales, se estima que un rCBV>2 respecto a la sustancia blanca cerebral sugiere permanencia tumoral.
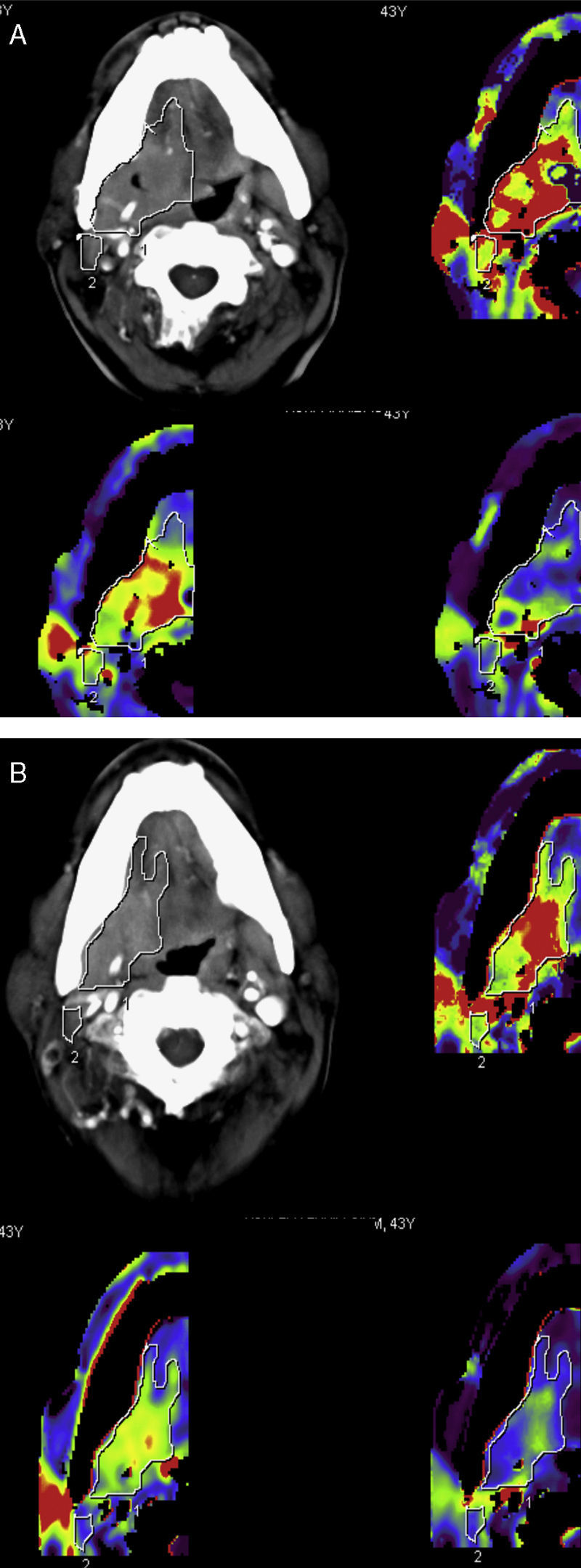
Estudio de perfusión de un tumor de la base de lengua en el plano axial, antes (A) y después (B) de ser tratado con cetuximab. Existe una disminución del producto del área de permeabilidad tumoral de 38ml/100ml/min a 33ml/100ml/min, y del flujo sanguíneo de 86,8ml/100ml/min a 77ml/100ml/min, considerados como enfermedad estable, por descenso de solo el 11,29%.
La espectroscopia con resonancia magnética (eRM) de protón 1H es una técnica robusta, para uso clínico en el cerebro, la mama y la próstata17. Se basa en detectar los metabolitos presentes o aumentados en el tumor y, su disminución o desaparición durante el seguimiento. Los metabolitos con importancia biológica son el ATP, la colina (Ch), la creatina (Cr), el lactato, el citrato (Ci) y el N-acetil-aspartato (NAA).
En el cerebro, la combinación de RM y eRM puede ayudar a evaluar el tipo de tumor cerebral y el grado, así como a diferenciar el realce tumoral de otras causas de realce. El criterio metabólico de la eRM de 1H se basa en que en las neoplasias malignas cerebrales hay un aumento de Ch y descenso de NAA, con aumento del cociente Cho/NAA. Cuando el tumor responde, disminuye este cociente metabólico, tanto en los tumores cerebrales primarios como en las metástasis.
En la mama, la disminución precoz de Ch es un buen indicador de respuesta. En la próstata, la Ch, Cr y Ci pueden predecir la existencia de cáncer en la zona periférica, así como de recidiva tras la prostatectomía radical, radioterapia o crioterapia.
Tomografía por emisión de positronesLa 18F-FDG es un excelente biomarcador metabólico de la actividad tumoral23. El aumento de captación de 18F-FDG se relaciona con el aumento de actividad glicolítica cuantificable de la mayoría de los tumores malignos, lo que posibilita evaluar la respuesta (fig. 6) e identificar precozmente a los pacientes que responderán o no24. Además de los criterios de respuesta con 18F-FDG de la European Organisation for Research and Treatment of Cancer (EORTC)25, hay que destacar a los criterios de respuesta con la PET (PERCIST 1.0), para valorar semicuantitativamente la actividad glicolítica tumoral mediante el valor estandarizado de captación (SUV) de 18F-FDG26.
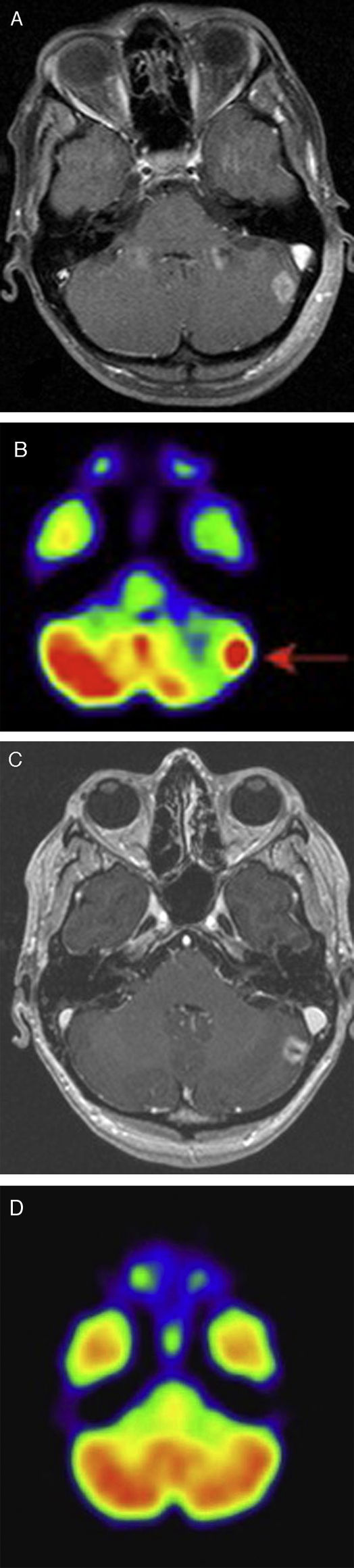
(A) Imagen axial potenciada en T1 con contraste y saturación grasa donde se aprecia una metástasis cerebelosa izquierda; (B) estudio PET- F18FDG donde se muestra la actividad metabólica en esta localización. Tras la radiocirugía se aprecia un tamaño similar de la lesión en RM, aunque con cambios internos (C) y desaparición de la actividad metabólica en el estudio de PET (D).
Clásicamente, se ha considerado que una reducción de tamaño tumoral representaba un signo precoz de mejoría clínica, aun con los errores subjetivos de medida condicionados por la irregularidad del margen tumoral27, los realces heterogéneos y, los diferentes protocolos de imagen. Algunos autores28 consideran que la reducción del tamaño tumoral no representa siempre respuesta y, no predice la supervivencia global de la enfermedad, por lo que proponen emplear la no progresión como predictor de respuesta. Así, el carcinoma de pulmón no microcítico, responde ocasionalmente cambiando la densidad del tumor sin modificar sustancialmente el tamaño, lo que en RECIST no se consideraría como respuesta29.
Las nuevos quimioterápicos y los procedimientos intervencionistas de las lesiones focales30 se dirigen a detener el crecimiento. En ocasiones, estos tratamientos provocan que los tumores puedan aumentar de volumen y, en cambio, tener una excelente respuesta clínica31. Así, por ejemplo, las metástasis del tumor del estroma gastrointestinal tratado con imatinib pueden aumentar de tamaño y disminuir la densidad (fig. 7), lo que es un criterio de respuesta aceptado, descrito por Choi32 (tabla 2). Criterios similares se aplican en metástasis hepáticas tratadas con radioembolización33,34, a sarcomas de partes blandas tratados con quimioterapia y radioterapia preoperatoria, y al carcinoma de células renales tratado con inhibidores de la tirosin-cinasa35,36.
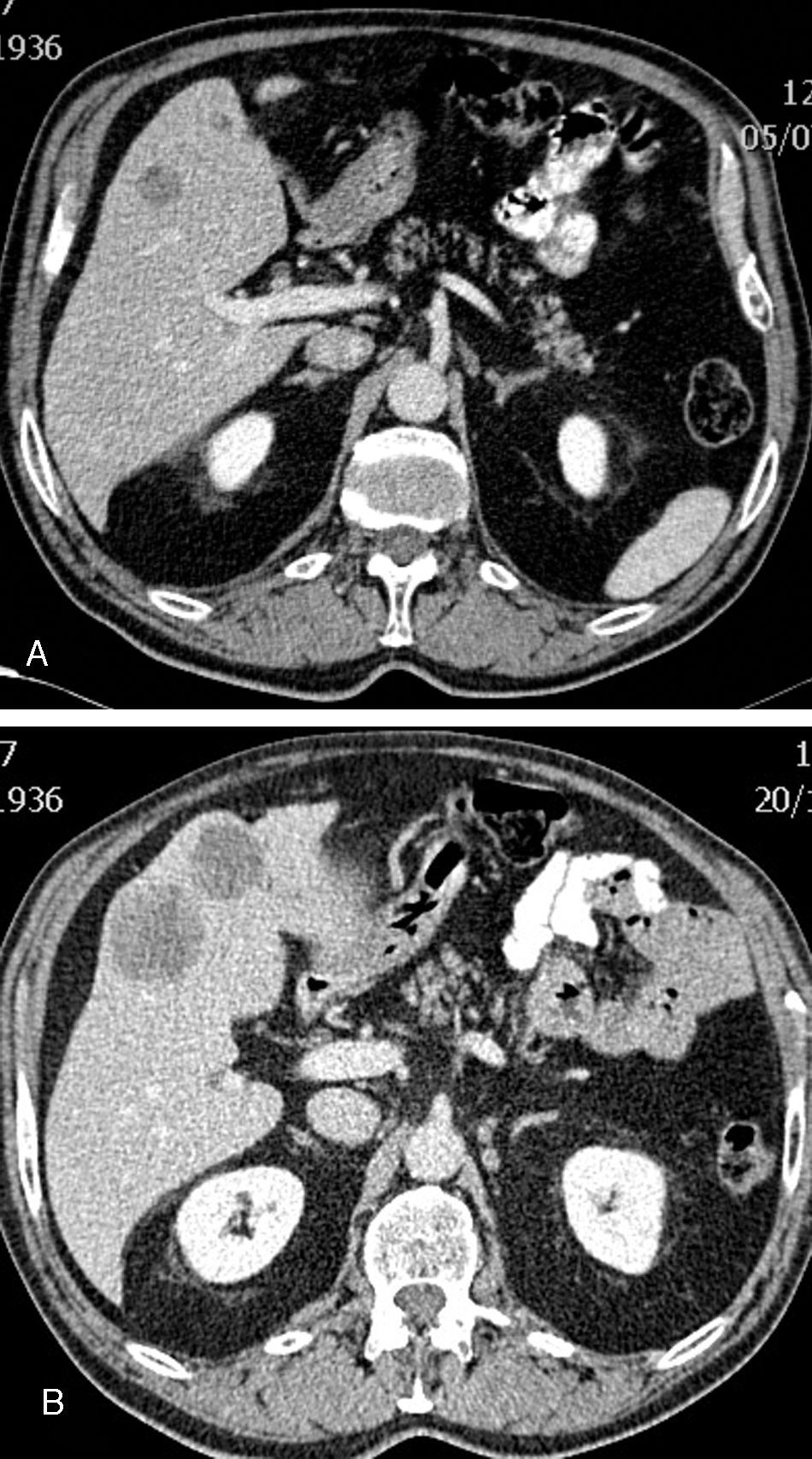
GIST rectal que en el estudio basal presenta 2 metástasis, la mayor de ellas con 49 UH de densidad (A), que en un control 6 meses después (B) presenta aumento de tamaño y disminución de densidad a 29 UH, considerándose como criterio de respuesta propuesto por Choi32 ya que disminuye más del 15%.
En el cáncer de esófago, la PET tiene un papel importante en el diagnóstico y la estadificación, y, además, puede predecir qué tumor responderá al tratamiento. De este modo, las guías de la National Comprehensive Cancer Network, aunque recogen que el estudio de TC con contraste es la primera indicación para valorar la respuesta, este no es necesario si al paciente se le ha hecho antes un estudio de PET37.
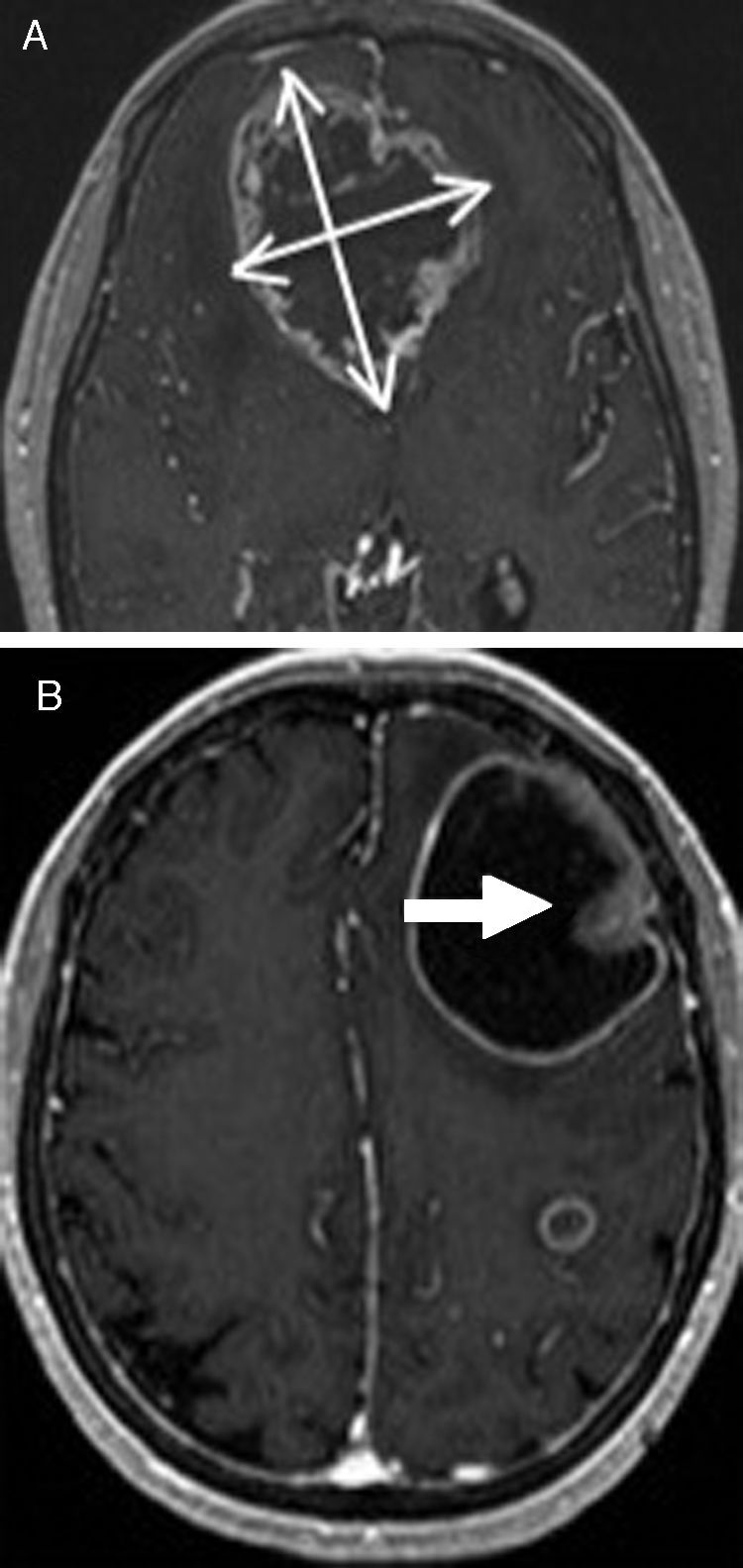
Para el glioma cerebral se aplicaban los criterios de respuesta de MacDonald et al.38 en 1990 (tabla 5), los cuales presentaban numerosas limitaciones39,40 en los pacientes tratados con radioterapia y temozolamida, o con antiangiogénicos que afectan la permeabilidad vascular del tumor, especialmente los de mecanismo de acción sobre el factor de crecimiento del endotelio vascular (VEGF: bevacizumab) y en el receptor VEGF (cediranib). Estos tratamientos pueden producir una marcada disminución de la captación de contraste en la fase temprana del tratamiento (1 o 2 días), sin que esto signifique respuesta radiológica-farmacológica. Los cambios deben permanecer al menos 4 semanas para considerarlos como verdadera respuesta. Con el fin de soslayar estas limitaciones y estandarizar la valoración de la respuesta en ensayos clínicos, se ha propuesto una actualización por parte de un amplio grupo de expertos de los criterios de respuesta conocidos como «Response Assessment in Neuro-Oncology Working Group» (Criterios RANO)39. Su aportación es definir las lesiones medibles como imágenes cuantificables y bien delimitadas, con diámetros perpendiculares máximos de al menos 10mm de diámetro en 2 o más imágenes (espesor de corte: 5mm); y como lesiones no medibles, a las mal definidas o predominantemente quísticas, visibles solo en un eje, o menor de 10mm (fig. 8) y, a las cavidades posquirúrgicas.
Criterios de respuesta en gliomas
| RECIST 1,1 | Macdonald (2D) | RANO | |
| RC | Desaparición de todos los realces tumorales. Confirmado a las 4 semanas | Desaparición de todos los realces tumorales. Confirmado a las 4 semanas. No nuevas lesiones. No corticoides y estabilidad o mejoría clínica. | Desaparición completa de todas las lesiones que captan contraste, sean medibles o no, mantenidas al menos 4 semanas. No nuevas lesiones. Estabilidad o reducción de las lesiones hiperintensas en T2/FLAIR que no captan contraste. Ausencia de corticoides y mejoría clínica* |
| RP | ≥30% disminución de la suma de los diámetros máximos. Confirmado a las 4 semanas | ≥50% disminución en la suma de los productos de los diámetros máximos perpendiculares de todas las lesiones que realzan. Confirmado a las 4 semanas. No nuevas lesiones. Reducción o estabilidad de dosis de corticoides y estabilidad o mejoría clínica. | ≥50% disminución de la suma de productos de los diámetros transversos de las lesiones medibles que capten contraste, mantenido al menos 4 semanas. |
| No hay nuevas lesiones. Estabilidad o reducción de las lesiones hiperintensas en T2/FLAIR que no captan contraste. | |||
| Mejoría o estabilidad clínica con menor dosis de corticoides. | |||
| No hay progresión de lesiones no medibles | |||
| EE | Ausencia de RC, RP, PE | Ausencia de RC, RP, PE y estabilidad clínica | No cumple los criterios de RC, RP o PE. Estabilidad o reducción de las lesiones hiperintensas en T2/FLAIR que no captan contraste. |
| Dosis de esteroides igual o inferior a la del estudio basal. | |||
| PE | ≥20% incremento en la suma de los diámetros máximos. Confirmado a las 4 semanas | ≥25% incremento en la suma de los productos de diámetros perpendiculares de lesiones que realzan, o nuevas lesiones o deterioro clínico | Aumento ≥25% de tamaño de la suma de productos de los diámetros perpendiculares de las lesiones que captan contraste. Aumento de las lesiones no medibles |
| Dosis de esteroides igual o superior a la que tomaba al realizar la RM basal. | |||
| Aumento significativo de las lesiones no captantes | |||
| Aparición de alguna lesión nueva. | |||
| Deterioro clínico no atribuible a otras causas que no sea directamente al tumor o a cambios en la dosis de esteroides | |||
| Fallecimiento o deterioro clínico severo | |||
| *Pacientes sin lesiones medibles la mejor respuesta es EE |
Fuente: adaptado de Wen39.
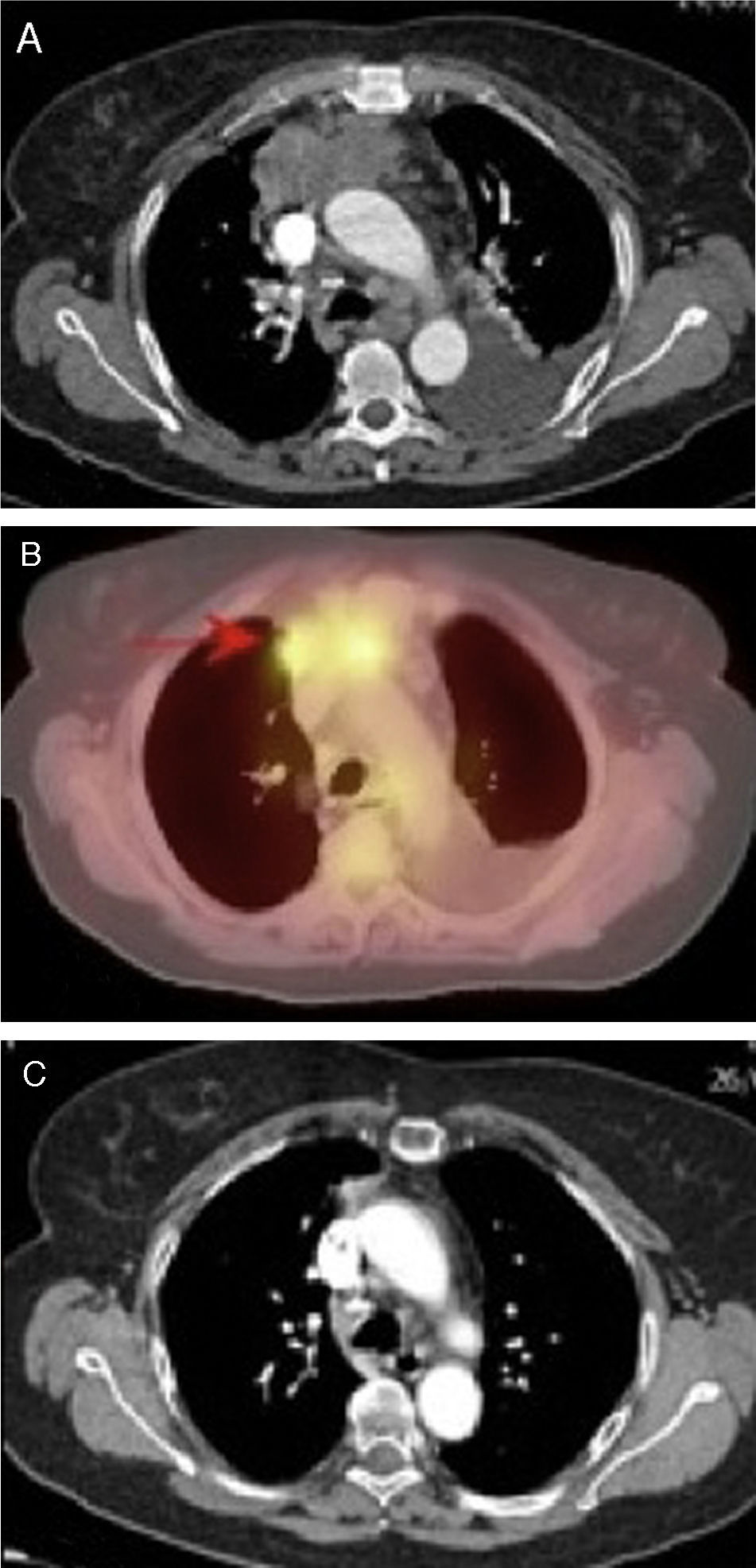
En el seguimiento de linfomas se recomienda la PET por discriminar mejor que la TC a los pacientes que puedan recaer y a los que tienen posibilidades de remisión41 (fig. 9). El estudio de PET debe realizarse de 8 a 12 semanas después de la radioterapia o quimioterapia, ya que procesos inflamatorios pueden observarse hasta 2 semanas después de la quimioterapia.
En el carcinoma hepatocelular los criterios de medida anatómicos pueden ser erróneos cuando se aplican terapias moleculares, tales como el sorafenib o tratamientos locorregionales, por lo que se propuso una modificación de los criterios RECIST (mRECIST)42,43. En ella se define una lesión como evaluable si mide al menos 1cm en una dimensión, demostrable en la fase arterial del estudio dinámico de TC o RM. Recientemente se ha propuesto un criterio de valoración de respuesta (Response Evaluation Criteria in Cancer of the Liver [RECICL]) (tabla 6), que cuantifica la combinación de las medidas en 2 dimensiones de las lesiones diana44. Además, incluyen marcadores tumorales y un protocolo de valoración en los casos tratados con quimioembolización arterial, así como recomendaciones de seguimiento según el tipo de tratamiento.
Criterios mRECIST y RECICL para valoración del hepatocarcinoma
| mRECIST | RECICL | |
| Lesión evaluable | Lesiones clasificadas como medibles con criterio RECIST (1cm o más en una dimensión) | Lesiones diana (un máximo de 5) |
| Método de evaluación | Medida unidimensional del tumor viable (lesión realzada en fase arterial) y que sea posible su medida en el seguimiento | Suma de todas las lesiones diana. Medida bidimensional (las lesiones no realzadas en TC dinámico o con depósito de lipiodol son medidas como necrosis) |
| Respuesta completa | Desaparición de cualquier realce arterial en lesiones diana | Necrosis del 100% del tumor o 100% de reducción del tamaño |
| Respuesta parcial | Al menos 30% de disminución de la suma de los diámetros de las lesiones diana viables (realzadas en fase arterial), tomando como referencia la suma basal de los diámetros de las lesiones diana | Efecto necrótico o reducción del tamaño del 50% a<100% |
| Enfermedad estable | No respuesta parcial ni progresión | No respuesta parcial ni progresión |
| Progresión enfermedad | ≥20% suma de diámetros de lesiones diana viables, tomando como referencia la suma más pequeña de los diámetros de lesiones viables recogidas desde el inicio del tratamiento. Desarrollo de una nueva lesión | ≥25 de aumento del tumor respecto al efecto necrotizante o aparición de una nueva lesión (categorizada en 3 grupos: lesión solitaria intrahepática, lesiones intrahepáticas múltiples, invasión vascular o diseminación extrahepática) |
Aunque el parámetro más usado para valorar la respuesta al tratamiento es la reducción tumoral, no siempre una reducción del volumen tumoral se acompaña de una mejora de la supervivencia. Las discrepancias entre los criterios anatómicos y metabólicos de respuesta, los fallos de predicción, la variabilidad interobservador y la utilidad de valoraciones volumétricas, hacen que quizás deban revisarse los criterios RECIST. Probablemente, la combinación de biomarcadores de imagen anatómica y funcional refleje mejor la respuesta tumoral a los tratamientos. La utilización clínica de biomarcadores funcionales requiere una estandarización, una vez hayan podido ser validados en ensayos multicéntricos.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.