Identificar la incidencia de reacciones adversas inmunomediadas (irAE, immune related adverse events), con y sin manifestaciones radiológicas, y correlacionarla con la respuesta al tratamiento inmunoterápico.
Material y métodosSe reclutaron retrospectivamente 79 pacientes con carcinomas de pulmón (n=24), renal (n=11) y melanoma (n=44) en estadio IV que fueron tratados con fármacos inmunoterápicos. Se valoró la aparición de irAE, sus manifestaciones radiológicas y el tipo de patrón de respuesta de acuerdo con los criterios de respuesta a la inmunoterapia (irRC). Se relacionó la presencia de irAE con el patrón de respuesta al tratamiento.
ResultadosEl 27,8% de los pacientes sufrieron irAE. Estas reacciones fueron más frecuentes en pacientes con melanoma (40,9% de los pacientes). Más de la mitad de las reacciones (59,1%) presentaron manifestaciones radiológicas a modo de neumonitis, colitis, hipofisitis, tiroiditis y miocarditis. La neumonitis fue la irAE con expresión radiológica más frecuente, incluso en pacientes asintomáticos. En la población estudiada, la tasa de respuesta a la inmunoterapia fue significativamente mejor en pacientes que desarrollaron irAE (68,2% frente a 38,6%, χ2=5,58; p=0,018). La tasa de respuesta favorable en los pacientes con y sin manifestaciones radiológicas de las irAE fue de 84,6% y 44,4%, respectivamente (p=0,023).
ConclusionesLa presencia de reacciones adversas inmunomediadas se asocia, de forma significativa, con una mejor respuesta a la inmunoterapia. La asociación con respuesta favorable es incluso mayor en pacientes con manifestaciones radiológicas de las irAE.
To determine the incidence of immune-mediated adverse reactions with and without radiologic manifestations and to correlate them with the response to immunotherapy.
Material And MethodsWe retrospectively included 79 patients with stage IV lung carcinomas (n=24), renal carcinomas (n=11), or melanoma (n=44) treated with immunotherapy. We evaluated the occurrence of immune-mediated adverse reactions, their radiologic manifestations, and the response pattern according to the immune-related response criteria (irRC). We correlated the presence of immune-mediated adverse reactions with the response pattern.
ResultsImmune-mediated adverse reactions occurred in 27.8%, being most common in patients with melanoma (40.9%). In 59.1% of patients with adverse reactions, there were radiologic manifestations such as pneumonitis, colitis, hypophysitis, thyroiditis, or myocarditis. Pneumonitis was the most common radiologic manifestation of immune-mediated adverse reactions, even in asymptomatic patients. The rate of response to immunotherapy was higher among patients who developed immune-mediated adverse reactions than in those who did not (68.2% vs. 38.6%, respectively, χ2 5.58; p=0.018). The rate of favorable responses was higher in patients with radiologic manifestations of immune-mediated adverse reactions than in those without radiologic manifestations (84.6% vs. 44.4%, respectively; p=0.023).
ConclusionsThe presence of immune-mediated adverse reactions is associated with a better response to immunotherapy. The association with a favorable response is even stronger in patients with radiologic manifestations of the immune-mediated adverse reactions.
En la última década, la inmunoterapia ha revolucionado el manejo de los pacientes con tumores avanzados y se ha postulado como el nuevo paradigma en el tratamiento de tumores metastásicos resistentes a las primeras líneas terapéuticas.
La revista Science declaró la inmunoterapia como el mayor avance del año 2013, basándose en los alentadores resultados observados en pacientes con melanoma metastásico tratados con ipilimumab1. Este agente, el ipilimumab, actúa inhibiendo la CTLA-4, molécula expresada en la superficie de los linfocitos T (LT) citotóxicos2,3. En condiciones normales, la CTLA-4 impide la segunda señal coestimuladora del LT, bloqueando su activación.
Desde su aprobación en 2011, el éxito del ipilimumab en el tratamiento del melanoma metastásico y su buen perfil de seguridad llevaron al desarrollo de otros agentes inmunoterápicos, como los inhibidores del receptor celular de muerte programada PD-1 y su ligando, PD-L13–5. La unión de PD-1, molécula expresada en los LT, con su ligando PD-L1, conduce a la regulación negativa de la respuesta inmunitaria, impidiendo la activación de los LT citotóxicos. El empleo de fármacos anti-PD1, como nivolumab y pembrolizumab, evita la inactivación de los LT, de modo que puedan llevar a cabo su acción citotóxica5.
La experiencia clínica ha demostrado que la respuesta a estos agentes se puede producir de manera retardada, de manera que los criterios tradicionales para evaluar la respuesta de los tumores sólidos (RECIST 1.1) no son suficientes para determinar la actividad inmunoterápica6. Surgieron así los criterios de respuesta a la inmunoterapia (irRC), según los cuales la aparición de nuevas lesiones o el aumento inicial del tamaño de las existentes no implica necesariamente un fracaso terapéutico7.
Por otro lado, la activación del sistema inmunitario para hacer frente al tumor puede provocar la aparición de reacciones adversas inmunomediadas (irAE)8,9. Varios estudios sugieren que la presencia de irAE predice una mejor respuesta a la inmunoterapia, si bien existen publicaciones con datos contradictorios10,11. Muchas irAE, asintomáticas al inicio, se pueden detectar de forma precoz por técnicas de imagen, lo que permite el inicio de la terapia correspondiente y evita la progresión a grados más severos de toxicidad.
El objetivo del presente estudio es identificar la incidencia de irAE, con y sin manifestaciones radiológicas, y correlacionarla con la respuesta al tratamiento inmunoterápico.
Material y métodosEstudio retrospectivo en el que se incluyeron 79 pacientes con carcinomas de pulmón (n=24), renal (n=11) y melanoma (n=44) metastásicos que estuvieran recibiendo tratamiento con fármacos inmunoterápicos (tabla 1). Se eligieron estos tumores por su alta prevalencia y por disponer de gran experiencia con el empleo de fármacos inmunoterápicos.
Algunos de los fármacos aprobados por la Food and Drug Administration de Estados Unidos, incluidos en el estudio, con sus indicaciones para los tumores incluidos en el presente trabajo
| Fármaco (diana) | Indicación |
|---|---|
| Ipilimumab (CTLA4) | Melanoma |
| Nivolumab (PD-1) | Melanoma, cáncer no microcítico de pulmón, carcinoma renal |
| Pembrolizumab (PD-1) | Melanoma, cáncer no microcítico de pulmón |
Modificado de: Postow MA et al9.
Pacientes consecutivos con al menos un control por imagen de su enfermedad de base realizado entre los meses de enero y mayo de 2017.
Disponer de al menos dos reevaluaciones de su enfermedad por pruebas de imagen, espaciadas por 4 semanas.
Se excluyeron los pacientes con tumores sincrónicos o aquellos que hubieran recibido tratamiento dentro de ensayo clínico con fármacos aún no aprobados para esos tipos de tumores. De los pacientes reclutados, se recogieron el sexo, la edad, la histología tumoral y los fármacos inmunoterápicos. No hubo pérdidas en el reclutamiento.
Al ser un estudio retrospectivo, aprobado por el comité de ética del centro, de acuerdo con la normativa vigente, no se precisó de consentimiento informado de los sujetos, al no llevar a cabo entrevistas personales ni recogida de muestras biológicas.
Técnicas de imagenLa tomografía computarizada (TC) con contraste intravenoso fue la prueba de imagen más empleada para detectar irAE. Todos los estudios fueron realizados en equipos multidetector (SOMATOM Definition y Sensation, Siemens Healthineers, Alemania). Para valorar irAE concretas, sospechadas por la sintomatología y/o por la analítica, se realizaron pruebas de imagen más específicas como resonancia magnética (RM) cerebral o ecografía tiroidea.
Evaluación de la respuesta y registro de irAELa respuesta a la inmunoterapia fue evaluada por dos radiólogos (con 20 y 3 años de experiencia) en estudios de TC toraco-abdominopélvicos midiendo las lesiones diana de cada órgano en el último estudio realizado respecto al basal, de acuerdo con los criterios irRC (tabla 2). La respuesta se categorizó en favorable o desfavorable, considerando como favorable la estabilidad de las lesiones, la respuesta parcial y la respuesta completa.
Criterios de respuesta a la inmunoterapia
| Immune-Related Response Criteria (irRC) | |
|---|---|
| Medidas lesiones | Bidimensionales |
| Lesión diana basal | 5×5 mm |
| Número de lesiones diana | 10 lesiones en total, hasta 5 por órgano |
| Nuevas lesiones | Se incorporan a la carga tumoral |
| Respuesta | Respuesta completa (irCR): desaparición de todas las lesiones, medibles y no mediblesRespuesta parcial (irPR): disminución≥50% de la carga basalEstabilidad (irSD): ni RP ni PProgresión (irPD):≥25% de aumento del nadir de la carga tumoral |
| Confirmación de la respuesta tras la primera reevaluación | Sí; requiere confirmación de la respuesta |
Modificado de: Wolchock et al7.
irCR: immune-related complete response; irPD: immune-related progressive disease; irPR: immune-related partial response; irSD: immune-related stable disease.
Para determinar la incidencia de irAE se revisaron estudios de imagen y la historia clínica desde el inicio del tratamiento. Entre las irAE se incluyen dermatitis, enterocolitis, neumonitis, tiroiditis, hipofisitis, transaminasitis, insuficiencia suprarrenal, pancreatitis, miositis, etc. Se determinó cuáles de estas reacciones presentaban manifestaciones radiológicas.
Se consideraron manifestaciones de neumonitis inmunomediada los siguientes patrones radiológicos:
- ∘
Opacidades en vidrio deslustrado, frecuentemente periféricas.
- ∘
Neumonía organizada criptogénica, manifestada como infiltrados de predominio periférico, que van cambiando de localización y pueden presentar el signo del “halo reverso”.
- ∘
Neumonitis por hipersensibilidad, especialmente subaguda, con áreas centrolobulillares en vidrio deslustrado y zonas de atrapamiento aéreo.
- ∘
Neumopatía intersticial no específica, con líneas subpleurales, afectación periférica en vidrio deslustrado, tractos cicatriciales, etc.
- ∘
Neumopatía intersticial aguda. Al igual que otros fármacos, los inmunoterápicos pueden producir toxicidad pulmonar directa, con riesgo de fallo pulmonar agudo y alta tasa de mortalidad.
Las tiroiditis y enterocolitis inmunomediadas presentaron hallazgos radiológicos inespecíficos y comunes a otras etiologías.
Análisis estadísticoSe realizó un análisis descriptivo del tipo de respuesta que presentaron los pacientes de acuerdo con los irRC. Se calcularon la frecuencia absoluta y relativa de las irAE en los tres grupos de pacientes durante el tiempo que estuvieron en tratamiento con agentes inmunoterápicos. Se estudió la relación entre el tipo de respuesta (favorable o desfavorable) y la aparición de irAE en la población total mediante la prueba de la χ2 de Pearson (SPSS 20.0). Se consideró estadísticamente significativo un valor de p <0,05.
ResultadosLos resultados se encuentran resumidos en la tabla 3.
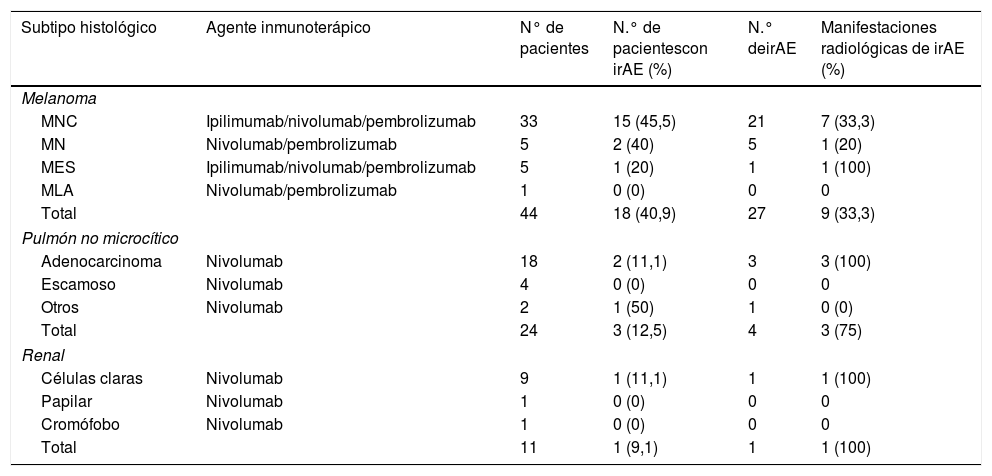
Número de pacientes con reacciones adversas inmunomediadas en los distintos grupos tumorales, en función del tipo histológico. Se detalla cuáles se acompañaron de expresión radiológica
| Subtipo histológico | Agente inmunoterápico | N° de pacientes | N.° de pacientescon irAE (%) | N.° deirAE | Manifestaciones radiológicas de irAE (%) |
|---|---|---|---|---|---|
| Melanoma | |||||
| MNC | Ipilimumab/nivolumab/pembrolizumab | 33 | 15 (45,5) | 21 | 7 (33,3) |
| MN | Nivolumab/pembrolizumab | 5 | 2 (40) | 5 | 1 (20) |
| MES | Ipilimumab/nivolumab/pembrolizumab | 5 | 1 (20) | 1 | 1 (100) |
| MLA | Nivolumab/pembrolizumab | 1 | 0 (0) | 0 | 0 |
| Total | 44 | 18 (40,9) | 27 | 9 (33,3) | |
| Pulmón no microcítico | |||||
| Adenocarcinoma | Nivolumab | 18 | 2 (11,1) | 3 | 3 (100) |
| Escamoso | Nivolumab | 4 | 0 (0) | 0 | 0 |
| Otros | Nivolumab | 2 | 1 (50) | 1 | 0 (0) |
| Total | 24 | 3 (12,5) | 4 | 3 (75) | |
| Renal | |||||
| Células claras | Nivolumab | 9 | 1 (11,1) | 1 | 1 (100) |
| Papilar | Nivolumab | 1 | 0 (0) | 0 | 0 |
| Cromófobo | Nivolumab | 1 | 0 (0) | 0 | 0 |
| Total | 11 | 1 (9,1) | 1 | 1 (100) | |
irAE: reacciones adversas inmunomediadas; irCR: immune-related complete response; irPD: immune-related progressive disease; irSD: immune-related stable disease; irPR: immune-related partial response; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral MN: melanoma nodular; MNC: melanoma no clasificable.
En el grupo de pacientes con melanoma se incluyen los distintos fármacos recibidos según el tipo histológico (no indican tratamientos combinados o consecutivos).
Se incluyeron 44 pacientes con melanoma, 27 hombres y 17 mujeres (60,92±12,67 años), que recibieron ipilimumab (n=20), nivolumab (n=12), terapia combinada de ipilimumab+nivolumab (n=7) y pembrolizumab (n=5). El tiempo medio de seguimiento de la muestra estudiada fue de 314,6±385,26 días.
De los 18 (40,9%) pacientes con melanoma que sufrieron irAE, 12 (66,67%) presentaron respuesta favorable (3 irCR, 4 irPR [immune-related partial response] y 5 irSD [immune-related stable disease]). Se registraron un total de 27 irAE, de las cuales 9 (33,3%) fueron detectadas en pruebas de imagen: neumonitis (n=5), tiroiditis (n=2), hipofisitis (n=1) y colitis (n=1).
La neumonitis se presentó radiológicamente como infiltrados en vidrio deslustrado y consolidaciones parcheadas periféricas, algunas de ellas con centro de menor atenuación (“halo reverso”). Las tiroiditis fueron confirmadas ecográficamente, si bien el diagnóstico fue clínico y bioquímico.
Cáncer de pulmónEn el caso de los pacientes con cáncer de pulmón (n=24), se incluyeron 15 hombres y 9 mujeres (60,12±11,33 años) que recibían tratamiento con nivolumab (tiempo medio de seguimiento de 144,7±122,8 días). Tres (12,5%) pacientes presentaron 4 irAE (nefritis, miocarditis y dos neumonitis), de las cuales el 75% tuvo expresión radiológica. Dos de los pacientes (66,67%) que sufrieron irAE se encontraban en respuesta favorable (irSD e irPR).
Cáncer renalEl grupo de pacientes con carcinoma renal (n=11) incluyó 8 hombres y 3 mujeres (61,9±10,3 años) y recibieron nivolumab (media de seguimiento de 216,36±216,9 días). Uno de los pacientes (9%) sufrió miocarditis, que fue detectada mediante tomografía por emisión de fotón único (SPECT) (se evitó realizar RM cardíaca con gadolinio por insuficiencia renal grave). El paciente se encontraba en irSD.
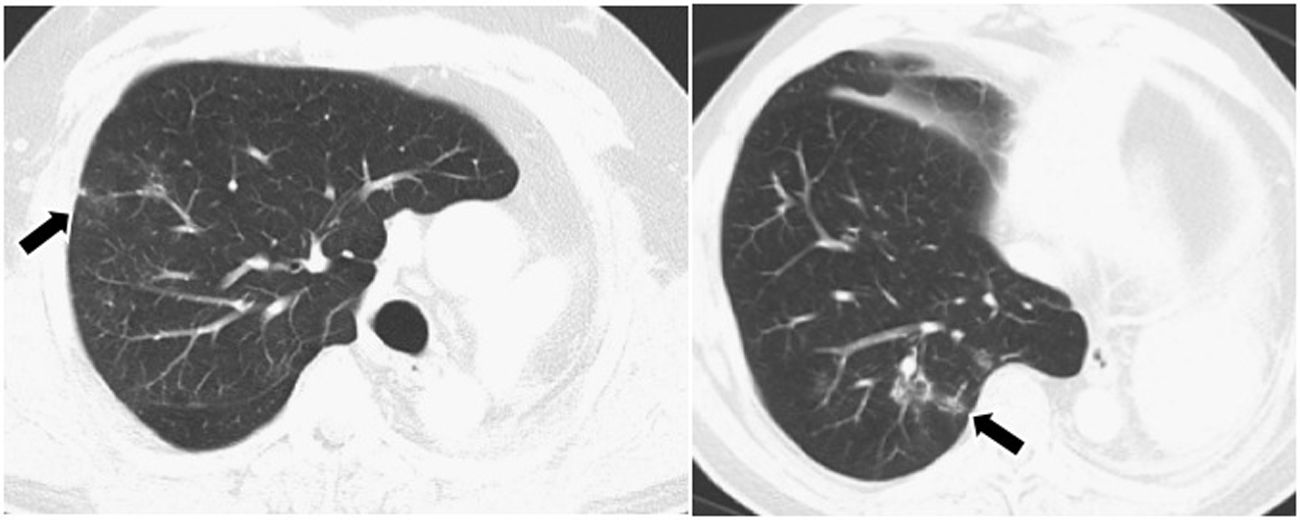
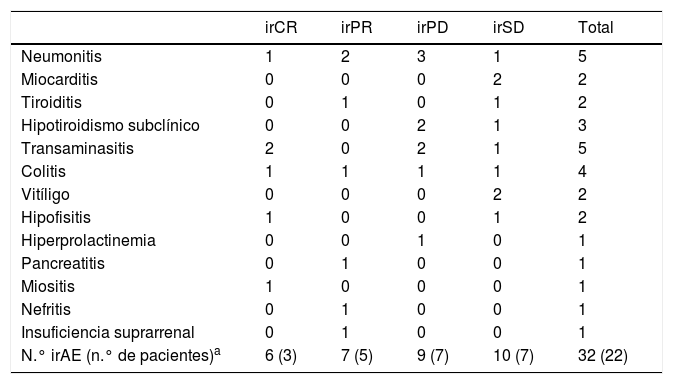
Resultados globalesDe manera global, de los 79 pacientes, 22 (27,8%) sufrieron un total de 32 irAE (tabla 4). Un 59,1% de estas reacciones presentaron expresión radiológica, documentada fundamentalmente mediante TC, a modo de neumonitis, colitis, hipofisitis, tiroiditis y miocarditis (figs. 1-4). La neumonitis fue la irAE que presentó con mayor frecuencia expresión radiológica, incluso en pacientes asintomáticos. Los patrones radiológicos de neumonitis fueron opacidades periféricas en vidrio deslustrado e infiltrados o consolidaciones propias del patrón de neumonía organizada.
Número de reacciones adversas inmunomediadas observadas en todos los grupos de pacientes en función de la respuesta
| irCR | irPR | irPD | irSD | Total | |
|---|---|---|---|---|---|
| Neumonitis | 1 | 2 | 3 | 1 | 5 |
| Miocarditis | 0 | 0 | 0 | 2 | 2 |
| Tiroiditis | 0 | 1 | 0 | 1 | 2 |
| Hipotiroidismo subclínico | 0 | 0 | 2 | 1 | 3 |
| Transaminasitis | 2 | 0 | 2 | 1 | 5 |
| Colitis | 1 | 1 | 1 | 1 | 4 |
| Vitíligo | 0 | 0 | 0 | 2 | 2 |
| Hipofisitis | 1 | 0 | 0 | 1 | 2 |
| Hiperprolactinemia | 0 | 0 | 1 | 0 | 1 |
| Pancreatitis | 0 | 1 | 0 | 0 | 1 |
| Miositis | 1 | 0 | 0 | 0 | 1 |
| Nefritis | 0 | 1 | 0 | 0 | 1 |
| Insuficiencia suprarrenal | 0 | 1 | 0 | 0 | 1 |
| N.° irAE (n.° de pacientes)a | 6 (3) | 7 (5) | 9 (7) | 10 (7) | 32 (22) |
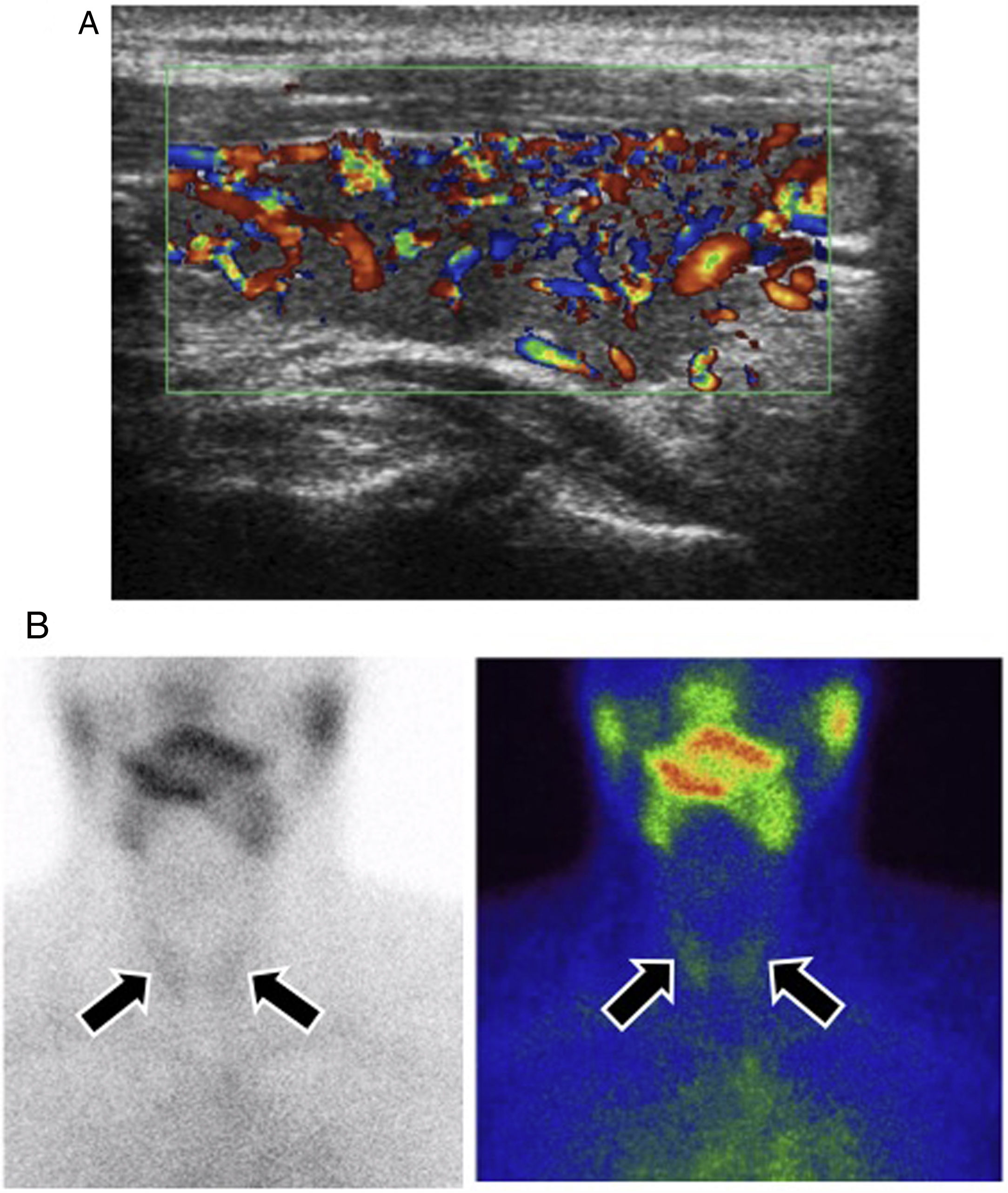
Tiroiditis en un paciente con melanoma metastásico en tratamiento con Ipilimumab+nivolumab. A) Ecografía Doppler color en el plano sagital del lóbulo tiroideo derecho. Signos ecográficos de tiroiditis, con un aumento difuso de la vascularización del lóbulo tiroideo. B) Gammagrafía tiroidea convencional en proyección anterior con pertecnetato de tecnecio (Tc-99m). Se confirma la hipocaptación del radiotrazador por ambos lóbulos tiroideos, propia de procesos inflamatorios (flechas).
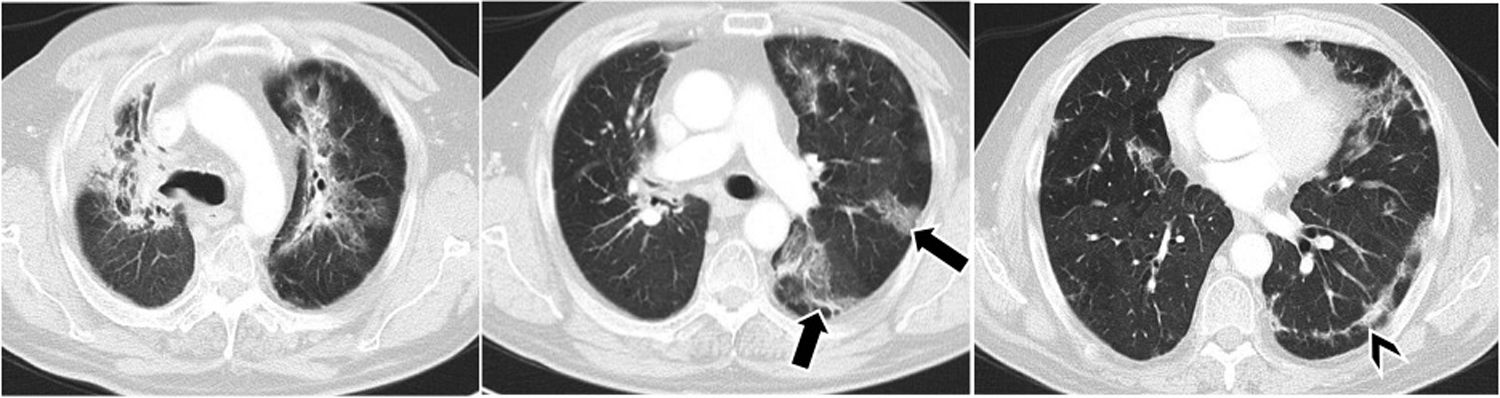
Tomografía computarizada de tórax, cortes axiales, ventana de parénquima. Infiltrados pulmonares migratorios, de predominio periférico (flechas), en paciente con adenocarcinoma de pulmón en tratamiento con nivolumab. En cortes basales se aprecian también líneas subpleurales (punta de flecha). Posible neumonitis por inmunoterapia, compatible con neumonía organizada.
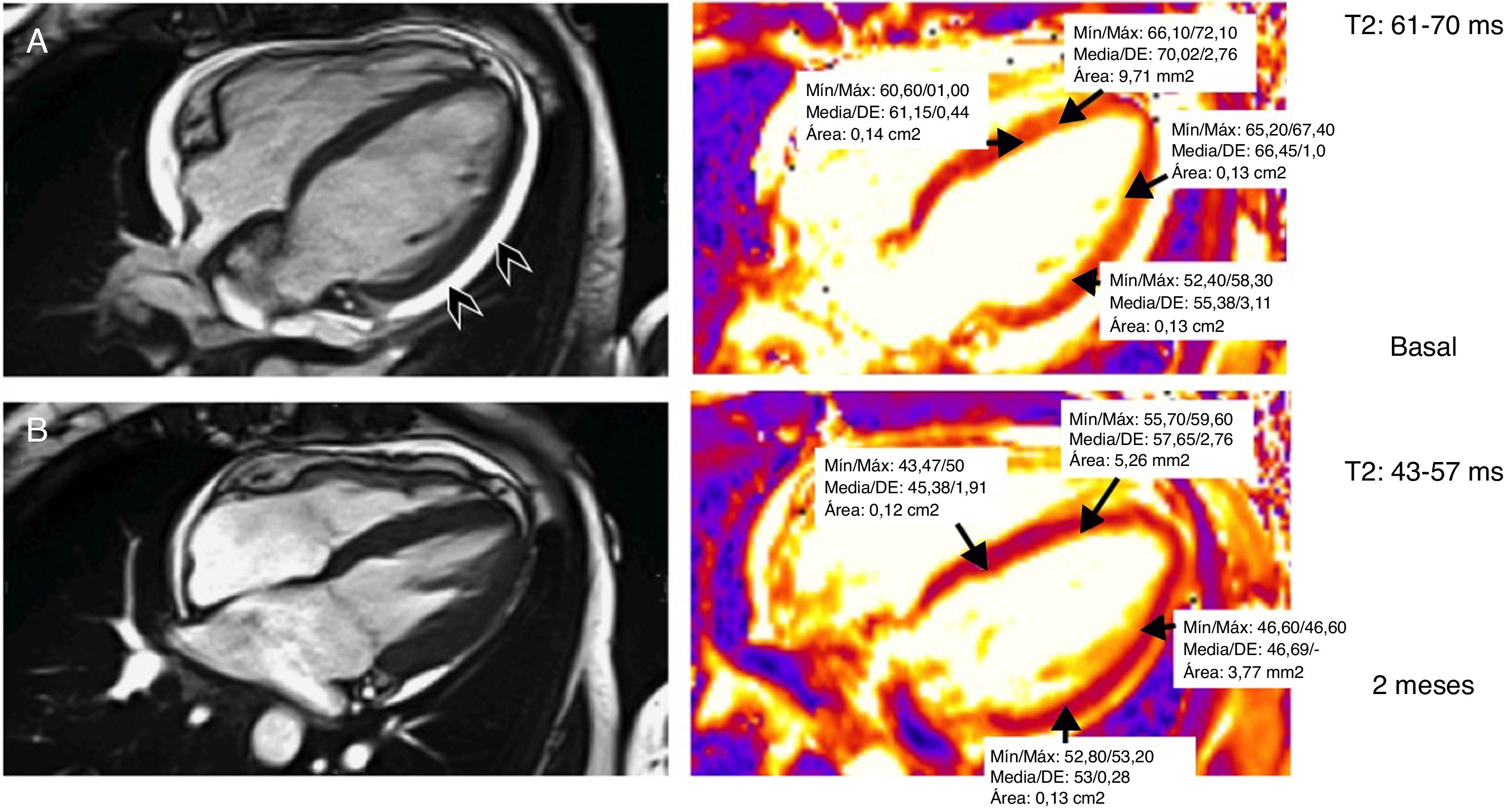
Resonancia magnética cardíaca. Secuencias eco de gradiente SSFP 4 cámaras para valoración anatómica y funcional. Mapas T2 para cuantificación del edema miocárdico en un paciente con miocarditis inducida por nivolumab. Estudio basal con incremento de los valores T2 por edema miocárdico y con presencia de ligero derrame pericárdico (puntas de flecha) (T2=61-70ms). Control realizado a los 2 meses del episodio de miocarditis: resolución del derrame pericárdico y normalización de los valores medios T2 (43-57ms).
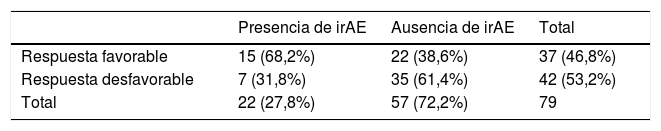
Más de dos tercios de los pacientes que sufrieron irAE presentaron respuesta favorable al tratamiento, encontrándose una asociación significativa entre ambas variables (68,2% frente a 38,6%, χ2=5,58; p=0,018) (tabla 5). La tasa de respuesta favorable en los pacientes con y sin manifestaciones radiológicas de irAE fue de 84,6% y 44,4%, respectivamente (χ2=5,2; p=0,023).
Pacientes de todos los grupos tumorales que tuvieron reacciones adversas inmunomediadas, categorizados en dos grupos de respuesta al tratamiento inmunoterápico
| Presencia de irAE | Ausencia de irAE | Total | |
|---|---|---|---|
| Respuesta favorable | 15 (68,2%) | 22 (38,6%) | 37 (46,8%) |
| Respuesta desfavorable | 7 (31,8%) | 35 (61,4%) | 42 (53,2%) |
| Total | 22 (27,8%) | 57 (72,2%) | 79 |
irAE: reacciones adversas inmunomediadas.
En la muestra estudiada, el 27,8% de los pacientes tuvieron irAE. De ellos, más de la mitad presentaron manifestaciones radiológicas de irAE, especialmente neumonitis. Se encontró una asociación significativa entre la aparición de irAE y la respuesta favorable al tratamiento; así como entre la expresión radiológica de irAE y la respuesta favorable.
Las irAE constituyen un espectro único de efectos secundarios provocados por la interrupción en la homeostasis inmunitaria10,12. El mecanismo por el que se producen todavía es incierto4. Se han postulado varias teorías para explicar su aparición, como el aumento de la actividad de los LT frente a antígenos de los tejidos tumorales y sanos o el aumento de los niveles de citoquinas proinflamatorias y de autoanticuerpos circulantes. Las irAE comienzan las primeras semanas (3-12) tras el inicio del tratamiento, si bien pueden suceder en cualquier momento, incluso tras finalizar la terapia.
Las irAE pueden ocurrir independientemente del tipo de tumor, por lo que parece que dependen más de la activación del sistema inmunitario que de la propia histología tumoral. La incidencia de irAE sí parece depender del tipo agente inmunoterápico empleado, y se han notificado incidencias en torno al 60% con ipilimumab y del 40% con fármacos anti-PD110,13,14.
Las irAE incluyen colitis, dermatitis, neumonitis e, incluso, reacciones tipo sarcoidosis-like. Según estudios publicados, las irAE más frecuentes son la toxicidad cutánea (5-16%), la gastrointestinal (8-12%) y la neumonitis (3-6%)10,15–17. Resulta crucial la valoración de pequeñas alteraciones bioquímicas para detectar endocrinopatías como la tiroiditis o hipofisitis, la elevación de enzimas hepáticas o transaminasitis y la nefrotoxicidad.
En nuestro estudio, los resultados obtenidos son similares a los descritos en publicaciones previas; aunque, a diferencia de otras cohortes en las que prevalece la toxicidad cutánea o gastrointestinal, la irAE más frecuente fue la neumonitis (n=7). La segunda toxicidad más frecuente fue la gastrointestinal (n=4), en forma de diarrea y colitis. En un metaanálisis que reúne estudios de pacientes en tratamiento con fármacos anti-PD-1, la incidencia de neumonitis era superior en pacientes con cáncer renal y pulmonar, frente al melanoma18. En nuestro estudio, a pesar del número reducido de pacientes, la incidencia de neumonitis fue ligeramente superior en pacientes con melanoma (11,3%) que en pacientes con cáncer de pulmón (8,3%).
Existe controversia sobre la asociación entre la aparición de irAE y la respuesta favorable al tratamiento18,19. Un estudio retrospectivo reciente no mostró diferencias en la respuesta en pacientes con y sin irAE tratados con ipilimumab11. Por su parte, Bronstein et al. publicaron una serie de 119 pacientes con melanoma avanzado tratados con ipilimumab, de los cuales 20 (16,8%) sufrieron irAE con expresión radiológica2. Los autores observaron que la enfermedad se encontraba controlada en el 55% de los pacientes con manifestaciones radiológicas de irAE, frente al 10% de tasa de control de la enfermedad en el grupo sin irAE. En nuestro estudio observamos el mismo fenómeno: existe una asociación significativa entre la aparición de manifestaciones radiológicas de irAE y el control de la enfermedad frente a los irAE sin expresión radiológica (84,6% frente a 44,4% de respuesta favorable, p=0,023).
Asimismo, la tasa de respuesta favorable fue significativamente mayor en pacientes con irAE, independientemente de que tuvieran o no expresión radiológica (68,2% frente a 38,6%; p=0,018). Por tanto, la aparición de irAE puede indicar que la respuesta inmunitaria se ha puesto en marcha y constituir un marcador indirecto de respuesta a la inmunoterapia.
Nuestro trabajo presenta varias limitaciones. Se trata de un estudio retrospectivo, con un número reducido y heterogéneo de pacientes y realizado en un solo centro, por lo que los resultados se deben interpretar con cautela. Únicamente se realiza un análisis descriptivo analizando la incidencia de irAE. Sería interesante realizar estudios con muestras más amplias de pacientes, en seguimiento prospectivo, para poder calcular el tiempo libre de progresión.
Como conclusión, en la muestra estudiada, la presencia de irAE así como su expresión radiológica se asocian de forma significativa con una respuesta favorable al tratamiento inmunoterápico.
Autoría1. Responsables de la integridad del estudio: AE, MC; JPDT, AGB, EC, DC, IV y GB.
2. Concepción del estudio: AE y GB.
3. Diseño del estudio: AE, AGB, IV y GB.
4. Obtención de los datos: AE, MC, JPDT, AGB, EC, DC y IV.
5. Análisis e interpretación de los datos: AE, JPDT, AGB, EC, DC, IV y GB.
6. Tratamiento estadístico: AE y AGB.
7. Búsqueda bibliográfica: AE, JPDT, AGB, EC y GB.
8. Redacción del trabajo: AE, AGB y GB.
9. Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: AE, JPDT, EC, DC, IV y GB.
10. Aprobación de la versión final: AE, MC, JPDT, AGB, EC, DC, IV y GB.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.