La presencia de una tumoración palpable en un niño es un motivo de consulta frecuente en Radiología. El diagnóstico diferencial es extenso y considerablemente diferente al del adulto. Algunas de las etiologías son poco conocidas fuera del ámbito pediátrico.
La prueba de imagen más utilizada es la ecografía, porque además de inocua y coste-efectiva, es concluyente en la mayoría de los casos.
La mayor parte de las lesiones son de naturaleza benigna. Se estima que solo el 1% terminan en un diagnóstico de neoplasia maligna. Conocerlas permite hacer un diagnóstico correcto, sin tener que recurrir a pruebas innecesarias y a veces invasivas, así como evitar retrasos en el proceso asistencial cuando nos encontremos ante una enfermedad de mayor gravedad.
El objetivo de este artículo es repasar las características clínico-radiológicas de las tumoraciones palpables más frecuentes en el paciente pediátrico, explicando los datos clave que permitan hacer un diagnóstico preciso.
Palpable tumors in children are a common reason for consulting a radiologist. The differential diagnosis is extensive and considerably different from that used in adults. Some of the etiologies of palpable tumors are little known outside of pediatrics.
The most commonly used imaging test is ultrasonography, because in addition to being harmless and cost-effective, it is conclusive in most cases.
Most palpable lesions in children are benign; it is estimated that only 1% are malignant. Knowing these lesions enables the correct diagnosis without the need to resort to unnecessary, sometimes invasive tests, thus avoiding delays in treatment when more severe disease is present.
This article aims to review the clinical and radiological characteristics of the palpable lesions that are most common in pediatric patients, explaining the key features that enable accurate diagnosis.
La presencia de una tumoración palpable en un niño es un motivo de consulta frecuente tanto para radiólogos pediátricos como generales. Las etiologías difieren considerablemente de las que encontramos en el paciente adulto, siendo algunas poco conocidas fuera del ámbito infantil. Aunque generan mucha ansiedad, la inmensa mayoría son lesiones benignas o incluso autolimitadas. Se estima que solo el 1% terminan en un diagnóstico de neoplasia maligna1.
La prueba de imagen inicial (y muchas veces final) suele ser la ecografía. Además de sus ventajas sobradamente conocidas, nos permite examinar clínicamente al paciente. Numerosas lesiones tienen un aspecto y una localización característicos, y con frecuencia podemos sospechar el diagnóstico incluso antes de hacer la ecografía. Como norma general se deben utilizar transductores lineales con la frecuencia más alta disponible, por su mayor resolución espacial. Ocasionalmente, es necesario recurrir a sondas con frecuencias más bajas si existe tanta extensión en profundidad que queda fuera del alcance de las sondas de alta frecuencia. El estudio eco-Doppler permite la valoración del flujo sanguíneo de la lesión. Son especialmente útiles las nuevas técnicas microvasculares, capaces de detectar sin artefactos por movimiento flujos de muy baja velocidad, que no resultan visibles con Doppler-color ni power-Doppler2. La sonoelastografía cuantitativa es una técnica novedosa y prometedora para caracterizar con más precisión las tumoraciones de partes blandas3,4.
Se suele recurrir a la RM cuando la ecografía no da un diagnóstico concluyente o la extensión en profundidad impide una valoración completa. Destaca por su excelente resolución de contraste, así como por dar información topográfica y de la composición química, vascularización y celularidad5. Aparte de una menor disponibilidad y mayor coste, la necesidad de sedación en pacientes no colaboradores limita su uso en el ámbito pediátrico.
La TC no se utiliza en este contexto asistencial por emplear radiaciones ionizantes y no aportar tanta información como la RM. La miositis osificante sería la excepción.
La radiografía es la prueba que en menos ocasiones da información concluyente sobre una lesión palpable, pero su gran disponibilidad hace que, con frecuencia, ya esté hecha antes de que el paciente acuda al servicio de Radiodiagnóstico.
Cuando una lesión de partes blandas no se corresponda claramente con una entidad autolimitada o benigna, debería ser seguida estrechamente para detectar crecimiento o cambios en su morfología o consistencia, y la mayor parte de las veces resecada o al menos biopsiada. Las pruebas de imagen también son útiles para guiar la toma de biopsias y planificar la cirugía.
El objetivo de este artículo es repasar las principales tumoraciones palpables en Pediatría explicando los datos clave que permitan un diagnóstico preciso. Por la extensión del tema, ha tenido que ser dividido en 2 partes, para así poder incluir la mayor parte de las entidades que podemos encontrar.
Ganglios y adenopatíasLos ganglios linfáticos son agrupaciones encapsuladas y altamente organizadas de linfocitos y otras células del sistema inmunitario localizadas a lo largo de los conductos linfáticos de todo el cuerpo6.
Los ganglios linfáticos palpables son muy frecuentes en los pacientes pediátricos7. Hasta el 90% de los niños de 4 a 8 años presentan ganglios cervicales palpables en la exploración clínica8.
Si la exploración o la evolución son atípicas, se suele recurrir a la ecografía como prueba inicial para clasificar la lesión como ganglio reactivo («benigno») o adenopatía patológica (tumoral, necrótica o supurativa).
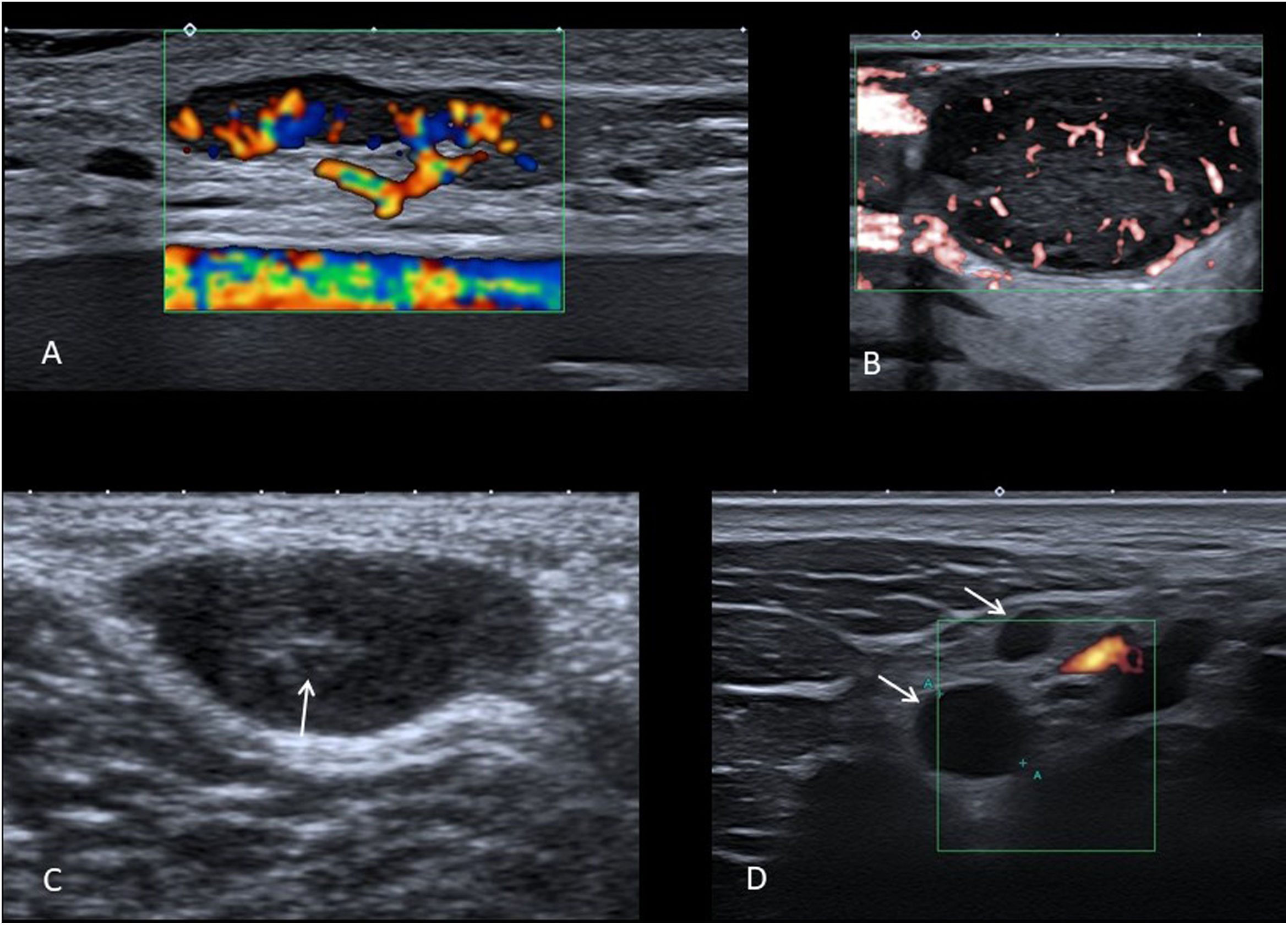
Los criterios ecográficos que indican un origen reactivo o patológico del ganglio deben ser tomados en conjunto, no basar el diagnóstico exclusivamente en uno. Un ganglio normal es ovalado e hipoecoico, con un hilio central ecogénico con vascularización central9 (fig. 1A).
A) Imagen de ecografía eco-Doppler color donde se observa un ganglio benigno ovalado, con hilio graso y flujo de distribución normal. B) Imagen eco-Doppler microvascular que muestra un ganglio patológico, con morfología redondeada, sin hilio graso y con flujo desordenado de predominio periférico. C) Ecografía en escala de grises de sarcoma sinovial en hueco poplíteo de niño de 9 años, que presenta morfología ovalada y un centro hiperecogénico (flecha), que debe evitarse confundir con un hilio. D) Imagen de ecografía power-Doppler donde se identifican adenopatías supraclaviculares de aspecto “seudoquístico” (flechas) en niña de 14 años con linfoma de Hodgkin.
El tamaño del ganglio no es muy útil por sí solo para establecer su benignidad o no. En niños encontramos muchos ganglios reactivos mayores del clásico límite de 1cm de eje menor, aumentados de tamaño por estimulación fisiológica del sistema inmunitario, mientras que algunos patológicos están por debajo de este tamaño.
Los ganglios patológicos suelen ser esféricos (fig. 1B). La excepción son los ganglios reactivos intraparotídeos y submentonianos, que con frecuencia son esféricos.
La presencia de un hilio graso central hiperecogénico también sugiere ganglio reactivo, mientras que su ausencia debe hacer sospechar adenopatía patológica. Hay que asegurarse de que es un verdadero hilio y no un centro hiperecogénico que implicaría otro diagnóstico diferencial como un sarcoma de partes blandas (fig. 1C) o un tumor neurogénico. Además de la presencia de hilio, es necesario confirmar un patrón ecográfico normal del ganglio con un grosor homogéneo de la cortical y ausencia de calcificaciones o zonas anecoicas.
En el estudio Doppler-color, el flujo normal de un ganglio consiste en vasos que se ramifican desde el hilio (fig. 1A), mientras que el flujo desordenado de distribución periférica es típico de adenopatías patológicas (fig. 1B). En ganglios benignos pequeños o en adenopatías muy necróticas es frecuente no detectar flujo con eco-Doppler color o power-Doppler, siendo las técnicas microvasculares considerablemente más sensibles en estas situaciones.
Se debe tener especial precaución para no confundir un ganglio anecoico con una lesión quística. Este aspecto «seudoquístico» es frecuente en linfomas (fig. 1D), especialmente si se utilizan sondas de una frecuencia no lo suficientemente alta10. También se puede ver apariencia quística en ganglios metastásicos con necrosis extensa, así como en adenopatías supurativas o con necrosis caseosa.
Si un ganglio cumple criterios típicos de benignidad, habitualmente se tiene una actitud expectante, salvo que existan datos clínicos de infección bacteriana, en cuyo caso se trata con antibióticos. Si, por el contrario, parece tener un origen patológico, o no responde al tratamiento antibiótico, es necesario realizar estudio histológico y microbiológico. Se suele hacer PAAF o, especialmente si se sospecha linfoma, extirpación del ganglio para así determinar el curso asistencial a seguir.
La adenitis cervical por micobacterias no tuberculosas es una enfermedad relativamente frecuente y casi exclusiva de niños de entre 1 y 5 años. Es poco conocida por los radiólogos no pediátricos, lo que suele acarrear retrasos en el diagnóstico. El motivo de consulta es normalmente la presencia de un nódulo laterocervical o submandibular, con color violáceo de la piel (fig. 2A). En casos más avanzados, la lesión se fistuliza a la superficie cutánea («escrófula»). En Europa el 80% son causadas por Mycobacterium avium.
En la ecografía puede haber uno o varios ganglios afectados. Son redondeados, hipoecogénicos y normalmente con áreas necróticas de aspecto quístico. Si la lesión se ha abierto a piel se ve el trayecto fistuloso (fig. 2B). El diagnóstico se confirma con PAAF y el tratamiento es la resección de la lesión, que es curativa y evita cambios cicatriciales estéticamente indeseables. Raramente precisa tratamiento antibiótico.
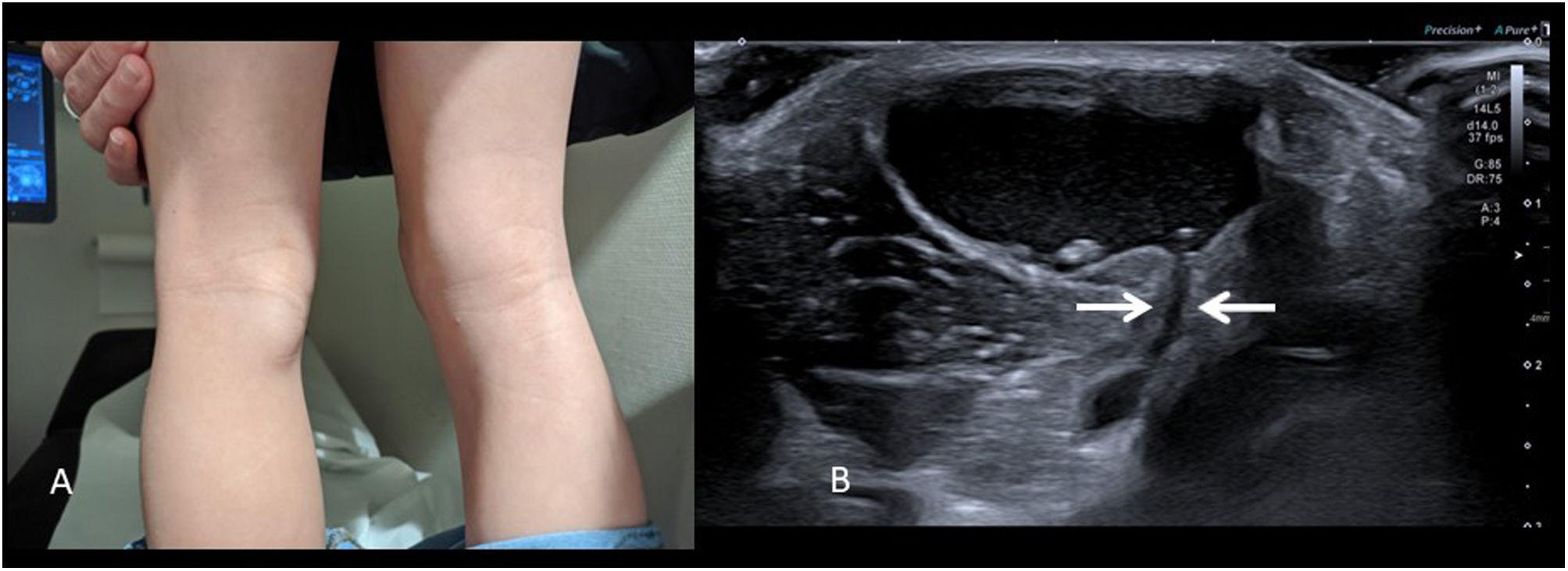
Quiste de BakerEl quiste poplíteo o de Baker es frecuente en adultos, pero muchas veces no se piensa en esta entidad en el paciente pediátrico, pese a ser la masa en hueco poplíteo más frecuente en niños. A diferencia del adulto, en niños casi nunca están asociados a enfermedad reumática o degenerativa.
Consiste en una «hernia» de la cápsula articular llena de líquido a través del espacio entre el tendón de origen del gemelo interno y el tendón del semimembranoso.
No suele ser doloroso y se manifiesta como una masa firme pero compresible en la parte medial y caudal del hueco poplíteo (fig. 3A). El diagnóstico es directo con ecografía, identificándose una estructura quística bien definida que se comunica con la articulación de la rodilla a través del espacio semimembranoso-gemelar (fig. 3B). En la misma exploración podemos descartar la presencia de derrame articular. Ocasionalmente se rompen, adoptando un aspecto radiológico muy atípico con presencia de contenido ecogénico, engrosamiento capsular y líquido, y cambios inflamatorios en los tejidos circundantes11, lo que complica el diagnóstico.
En el paciente pediátrico sin enfermedad articular asociada, se resuelven espontáneamente, recomendándose una actitud expectante12.
GangliónEl ganglión sinovial es otra acumulación de líquido sinovial, pero en este caso es por una rotura en la cápsula articular y extravasación del líquido a los tejidos circundantes. El término «quiste sinovial» no es correcto, al no tener estas lesiones una pared propia. Es también una lesión frecuente en niños, especialmente en la superficie palmar de la muñeca (en adultos suele ser en la superficie dorsal) a partir de la articulación escafolunar. Los gangliones no son dolorosos, y si hay dolor se debe buscar la causa y no atribuirlo al ganglión.
Aunque el diagnóstico clínico es fácil, muchas veces se prescribe la ecografía para tranquilizar a los padres. La ecografía permite explorar al paciente en la posición en la que el bulto sea más evidente (p. ej., extendiendo o flexionando la muñeca) y confirmar que se corresponde con un quiste. Al igual que en el quiste de Baker, es necesario definir una comunicación clara con el espacio articular o una vaina tendinosa y ausencia de componente sólido, porque si no podemos etiquetar como ganglión otro tipo de lesiones quísticas o incluso un tumor de partes blandas hipoecogénico13.
La tasa de resolución espontánea en niños es alta, de aproximadamente el 80%14. Si persisten, se pueden tratar quirúrgicamente, pero normalmente no se hace en lesiones asintomáticas15.
Quistes epidermoides y dermoidesSe originan durante el desarrollo embriológico debido a un fallo en la separación entre el ectodermo superficial y las estructuras adyacentes. Algunos elementos ectodérmicos quedan atrapados en profundidad formando un quiste de inclusión.
Los quistes epidermoides únicamente están revestidos por epitelio escamoso y están rellenos de queratina laminada, mientras que los quistes dermoides además contienen otros elementos cutáneos (pelo, glándulas sebáceas, glándulas sudoríparas, etc.)16. Son una causa frecuente de tumoración palpable en niños y la lesión más frecuentemente resecada en este grupo de edad.
Su localización más frecuente es en zonas de fusión embriológica, como puntos de cierre de suturas craneales o del tubo neural17, apareciendo principalmente en cabeza-cuello, escotadura supraesternal, tronco y región anogenital, aunque pueden aparecer en cualquier parte del cuerpo. En la cabeza y el cuello se sitúan mayoritariamente en relación con las suturas craneales o en la línea media. La sutura frontocigomática, en la «cola» de la ceja, es el sitio más característico. En línea media son más frecuentes en el suelo de la boca, la región nasal, la glabela (entrecejo) y la fontanela anterior. Pueden situarse superficiales o profundos al periostio, incluyendo la localización intracraneal18,19.
Suelen presentarse como masas palpables indoloras de consistencia variable. Pueden ser bien definidas y móviles o estar adheridas a planos profundos. Normalmente, se descubren de forma accidental por lo que, aunque la mayoría están presentes al nacer, suelen detectarse en niños más mayores. La piel que los recubre puede ser normal o mostrar una coloración ligeramente azulada, rojiza o blanquecina. Habitualmente son menores de 3cm y solitarios (la presencia de lesiones múltiples se asocia a algunas poliposis intestinales como el síndrome de Gardner). Son de crecimiento lento, debido al acúmulo progresivo de productos derivados de la piel. A veces se infectan o se rompen, desencadenando una reacción inflamatoria en tejidos circundantes, engrosamiento y peor definición de su pared, lo que les puede dar un aspecto agresivo en pruebas de imagen20.
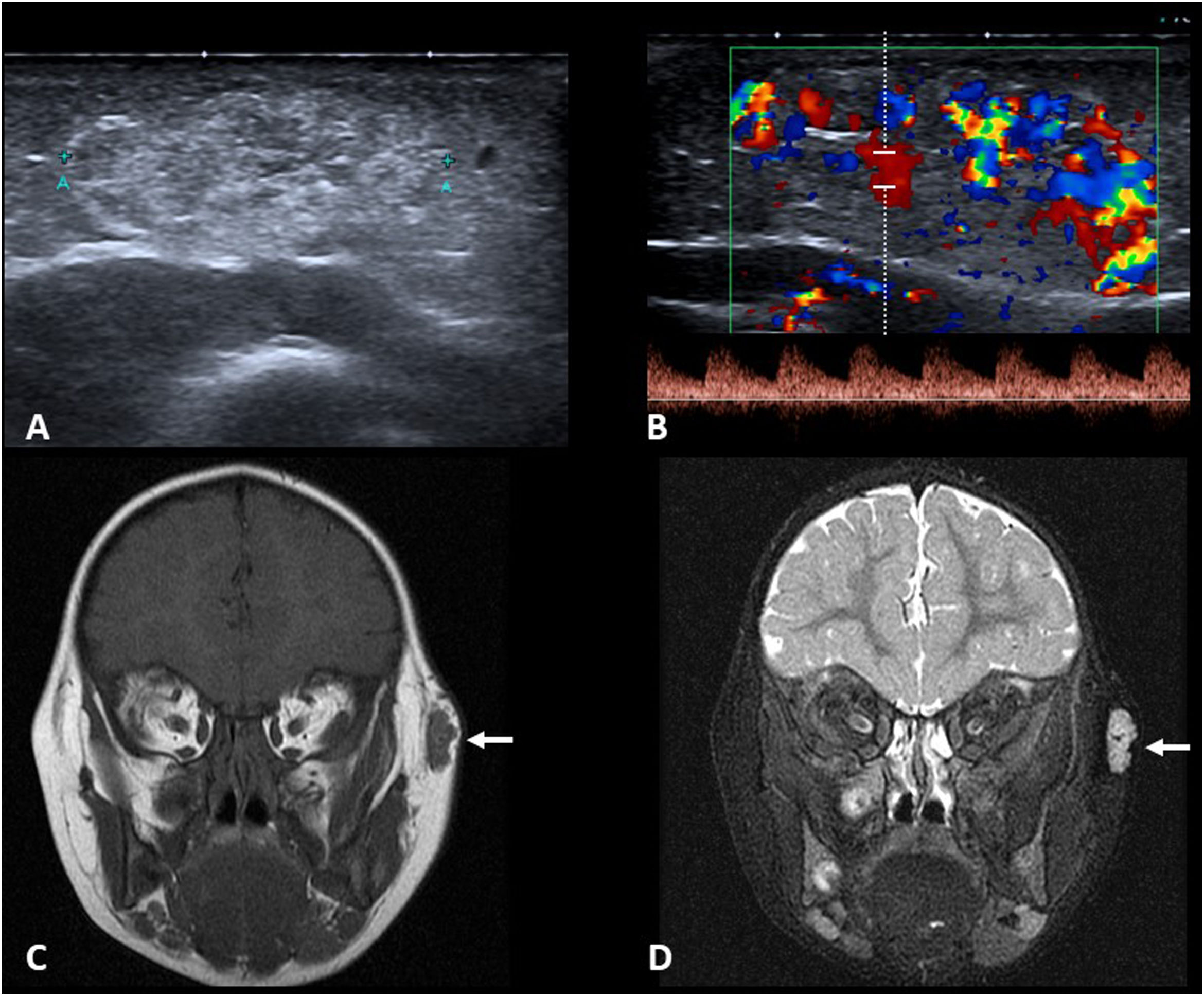
El estudio de imagen suele comenzar con la ecografía (fig. 4A y C), para confirmar el diagnóstico y valorar la extensión. Ambos tipos de quistes son normalmente indistinguibles, mostrándose como nódulos bien definidos, redondos u ovales. Presentan ecogenicidad variable según su contenido, desde anecoico hasta ecogénico de forma difusa, con buena transmisión del sonido y sin flujo en el estudio Doppler. Cuando se sitúan adyacentes a una superficie ósea, es característico que produzcan remodelación de la misma.
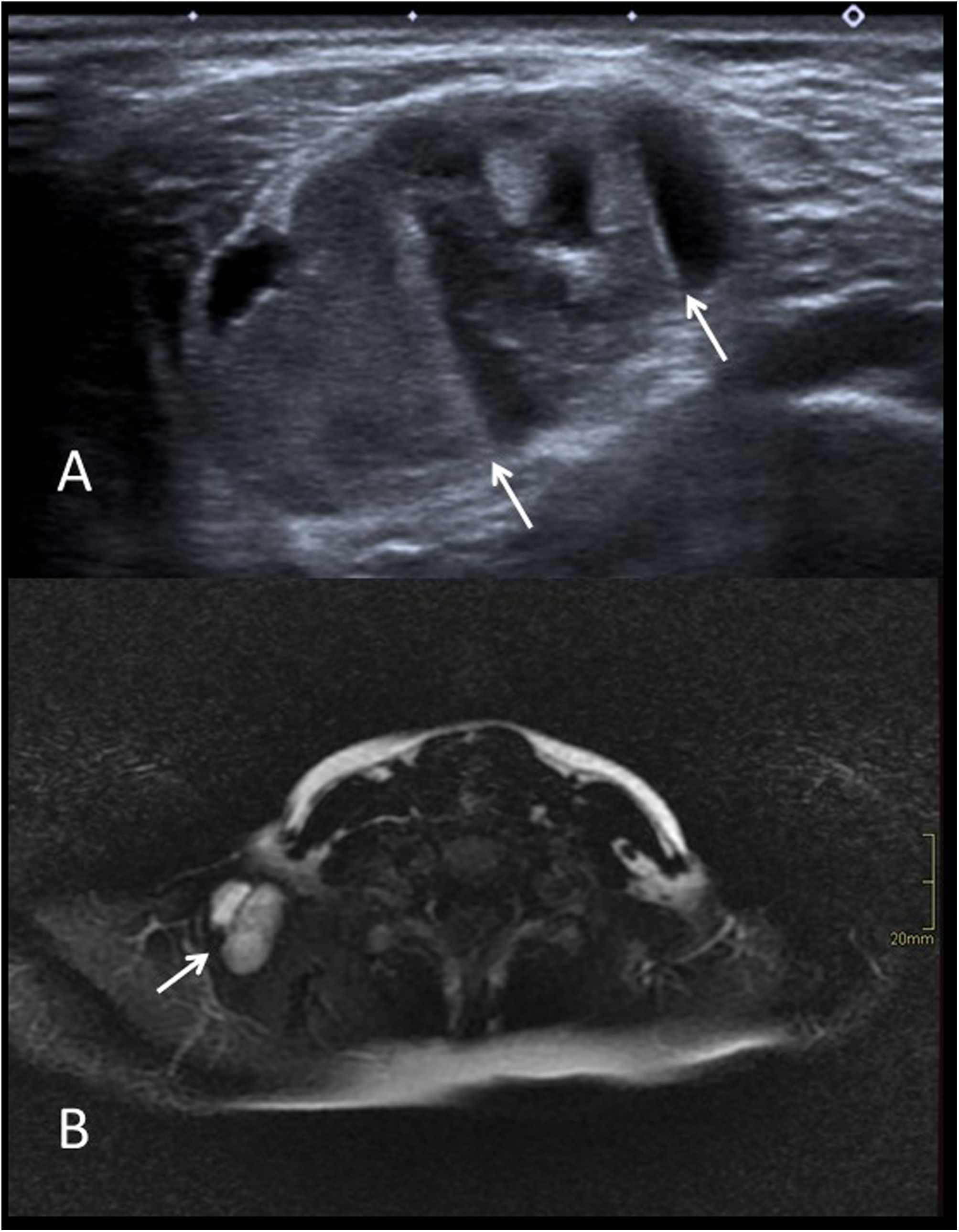
A) Imagen axial de ecografía en escala de grises mostrando un quiste epidermoide en «cola» de ceja izquierda (flechas) en niño de un año (* globo ocular). B) Imagen axial de RM potenciada en difusión de otro paciente (3 años). Se puede observar la restricción de la difusión característica del quiste epidermoide (flecha). C) Imagen de ecografía en escala de grises en el plano coronal sobre la fontanela anterior de un lactante de 7 meses. Se observa un quiste dermoide con contenido ecogénico (flechas). D) Imagen de RM potenciada en T2 con saturación de la grasa en el plano sagital del paciente anterior. La lesión es hipointensa (flecha) al haberse suprimido la señal del contenido lipídico.
Si la localización y los hallazgos ecográficos son típicos, no es necesaria la realización de otras pruebas de imagen. En caso de dudas diagnósticas o si hay sospecha de afectación en profundidad, hay que completar el estudio con otras pruebas de imagen, habitualmente RM.
La RM sí permite con frecuencia diferenciar ambos tipos de quistes. Los epidermoides presentan normalmente una intensidad de señal igual a la del líquido en todas las secuencias y tienen como aspecto más característico la restricción de la difusión debido a la queratina que contienen (fig. 4B). Los dermoides suelen presentar contenido lipídico en diferentes proporciones, por ello muestran una intensidad de señal variable, frecuentemente alta en T1 y baja en secuencias T2 con saturación de la grasa (fig. 4D). A diferencia de los epidermoides, no muestran restricción de la difusión y en ocasiones se identifican niveles líquido-líquido en su interior.
Aunque la TC puede ser de utilidad, se usa casi exclusivamente en casos de afectación de la calota craneal.
Son lesiones benignas, pero debido a su potencial crecimiento, suelen resecarse.
HemangiomasLos hemangiomas son auténticos tumores vasculares con proliferación e hiperplasia de células endoteliales. Debe evitarse utilizar el término para referirse a malformaciones vasculares21.
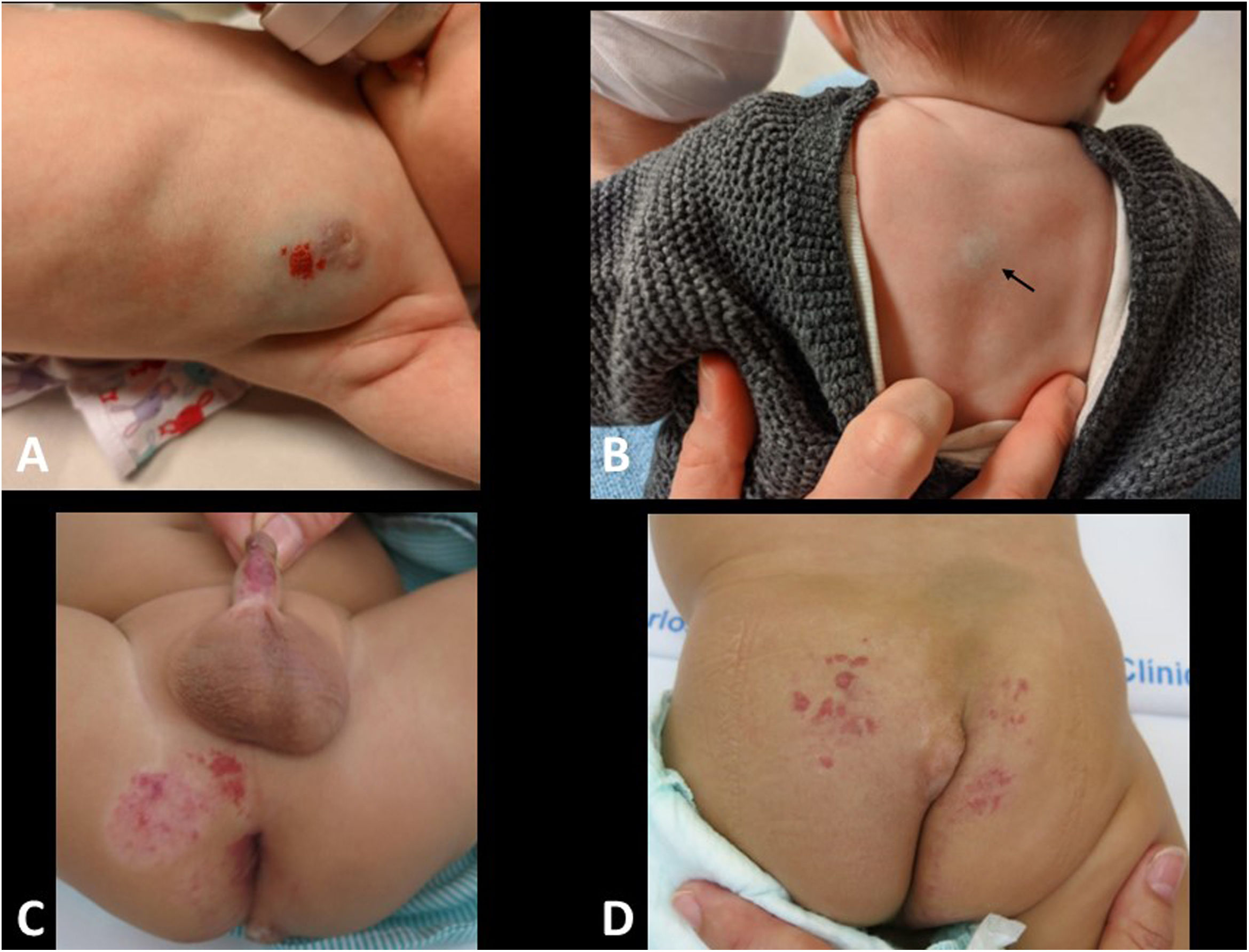
El hemangioma infantil (HI) es la tumoración de partes blandas más frecuente en lactantes, apareciendo hasta en el 5%. El diagnóstico es habitualmente clínico, siendo su aspecto y coloración rojo frambuesa muy característicos22. En HI profundos el color de la piel suele ser azulado o incluso normal, complicando el diagnóstico clínico (fig. 5A y B).
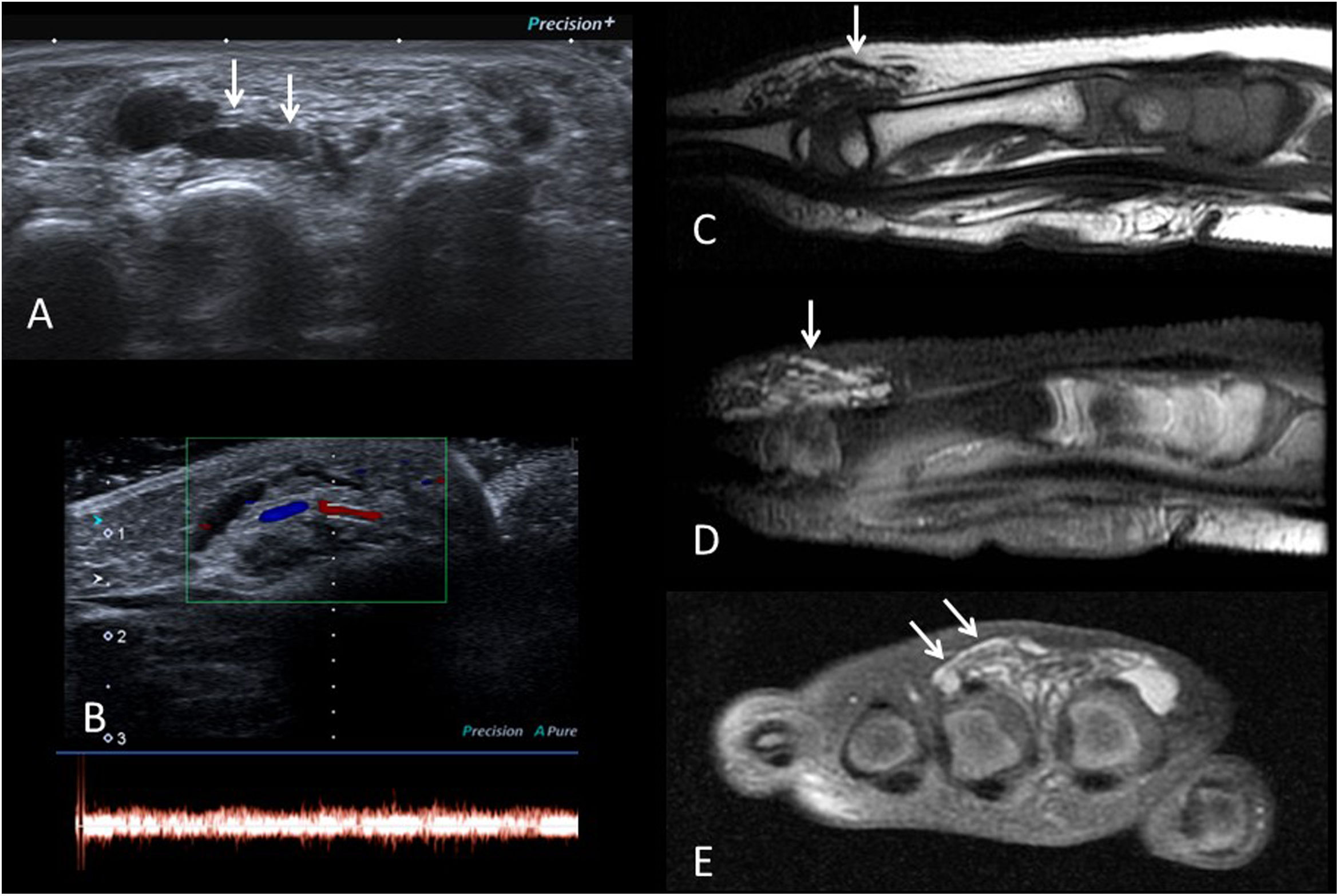
A) Lactante de 5 meses con hemangioma infantil en la región mamaria, con componente profundo (violáceo) y superficial (rojo frambuesa). B) Lactante de 3 meses con hemangioma infantil profundo en la espalda (flecha). C y D) Asociación LUMBAR (Lower body hemangioma, Urogenital anomalies, Ulceration, Myelopathy, Bony deformities, Anorectal malformations, Arterial anomalies, and Renal anomalies). Lactante de 6 meses con hemangioma infantil perineal y sacro, junto con lipoma sacro. En la RM (no mostrada) se observaba médula anclada asociada a lipoma intradural.
Pueden estar presentes al nacer, pero lo habitual es que se hagan aparentes en las 2 primeras semanas de vida, crezcan rápidamente durante los primeros meses (fase proliferativa) y después involucionen lentamente tras una fase de estabilización. Aunque la media de edad para su desaparición es en torno a los 5 años de edad, algunos pueden persistir hasta los 10 años. No es raro que queden zonas cicatriciales, lipomatosas o teleangiectásicas residuales.
Las lesiones grandes (> 5cm de diámetro) faciales o lumbares pueden ser la primera manifestación de un cuadro clínico más complejo, como las asociaciones PHACES (Posterior fossa brain malformations, large facial Hemangiomas, anatomical anomalies of the cerebral Arteries, aortic coarctation, Cardiac anomalies, Eye abnormalities and Sternal anomalies) y LUMBAR (Lower body hemangioma, Urogenital anomalies, Ulceration, Myelopathy, Bony deformities, Anorectal malformations, Arterial anomalies, and Renal anomalies) (fig. 5C y D)23,24. Ante lesiones múltiples (más de 5), conviene descartar afectación visceral, siendo la hepática la más frecuente. Las lesiones cercanas a la vía aérea, como en el cuello o en la nariz, deben estudiarse cuidadosamente para descartar compromiso de la misma.
La ecografía es la prueba radiológica más utilizada para el estudio del HI (fig. 6A y B). Permite confirmar el diagnóstico en lesiones profundas, siendo especialmente importante diferenciarlo de una malformación vascular, porque su manejo y pronóstico son totalmente diferentes. En las fases proliferativa y de estabilización, el HI es una lesión bien delimitada de bordes lobulados, ecogenicidad variable pero bastante homogénea que habitualmente no invade compartimentos anatómicos adyacentes. Muestra abundante flujo arterial de baja resistencia en el estudio Doppler. Cuando se estudia la lesión en fase involutiva, los hallazgos ecográficos pueden ser menos específicos, apareciendo como nódulos o masas de aspecto lipomatoso y sin hiperemia en eco-Doppler.
A y B) Ecografías en escala de grises y eco-Doppler color y pulsado de hemangioma infantil en la pared torácica de un lactante de 8 meses. Se observa un nódulo subcutáneo hiperecogénico y con contorno lobulado bien definido, con abundante flujo arterial de baja resistencia. C y D) Imágenes de RM en el plano coronal potenciadas en T1 y T2 con saturación de la grasa en niño de 26 meses con hemangioma infantil facial. La lesión (flechas) es hipointensa en T1 e hiperintensa en T2 con saturación de la grasa, donde se observan vacíos de señal arteriales en su región central.
La RM se utiliza para valorar posibles alteraciones asociadas (LUMBAR/PHACES) o en lesiones con un aspecto ecográfico atípico o poco accesibles al estudio con ultrasonidos por su localización. Los HI son lesiones con bordes lobulados bien definidos, hipointensas en T1 e hiperintensas en T2, con algunos vacíos de señal arteriales y un realce intenso si se administra contraste paramagnético (fig. 6C y D).
Los hemangiomas congénitos (HC) son lesiones mucho menos frecuentes que los HI, pero tienen una apariencia radiológica similar. Es su evolución y el aspecto clínico lo que permite diferenciarlos. El HC está completamente desarrollado al nacimiento, siendo su evolución posterior impredecible. Algunos involucionan rápidamente (Rapidly Involuting Congenital Hemangioma [RICH]), mientras que otros solo involucionan parcialmente (Partially Involuting [PICH]) o no involucionan (Non Involuting [NICH]).
El granuloma piógeno, el hemangioma en penacho y su forma más agresiva, el hemangioendotelioma kaposiforme, que puede causar fenómeno de Kasabach-Merritt, son otros hemangiomas con una incidencia muy baja. El cuadro clínico y la edad del niño en el momento de aparición ayudan a sospechar su presencia.
Aunque es poco habitual, si los hallazgos clínicos y radiológicos son atípicos, se recurre a la biopsia. Existe un marcador inmunohistoquímico exclusivo del HI, independientemente de su estadio evolutivo, denominado GLUT-1. Es una proteína transportadora de glucosa que el resto de los hemangiomas mencionados no expresan25.
En la mayor parte de las ocasiones los HI no requieren tratamiento alguno, realizándose solamente seguimiento para confirmar su involución natural. Un 10-15% de los HI sí requiere tratamiento, fundamentalmente cuando comprometen la visión (p. ej., hemangiomas grandes en un párpado), la vía aérea, se ulceran, están en áreas húmedas y «sucias» (bajo el pañal) o son muy desfigurantes. Estos casos responden espectacularmente al tratamiento con propranolol por vía oral26 y solo muy raramente es necesaria cirugía27.
La ecografía permite evaluar la eficacia del tratamiento médico en las lesiones no superficiales. La disminución del flujo sanguíneo en el estudio eco-Doppler precede a la disminución del tamaño de la lesión.
Malformaciones vascularesLas malformaciones vasculares (MV) son lesiones presentes al nacimiento que crecen paralelamente al crecimiento del niño.
La clasificación más aceptada es la de la International Society for the Study of Vascular Anomalies (ISSVA)28,29. Las divide en malformaciones simples (capilares, linfáticas, venosas o arteriovenosas) o combinadas (cualquier combinación de 2 o más de las anteriores). De cara a su manejo, se suelen dividir en MV de alto flujo (todas las que tengan componente arterial) y de bajo flujo (el resto), ya que este es el criterio para la elección del tratamiento30.
Las MV pueden aparecer en cualquier lugar del cuerpo y, a diferencia de los HI, con frecuencia se extienden por diferentes compartimentos anatómicos. Por este motivo la ecografía puede resultar insuficiente y frecuentemente hay que recurrir a la RM para valorar la afectación profunda.
Las malformaciones capilares (también denominadas «manchas en vino de Oporto») suelen ser superficiales y no requieren prueba de imagen para el diagnóstico, que se basa en su presencia al nacimiento, apariencia y distribución. Las pruebas de imagen a veces sí son necesarias para descartar anomalías asociadas (p. ej., síndrome de Sturge-Weber).
Las MV linfáticas son masas quísticas con septos finos en ecografía. Puede haber niveles líquido-líquido, especialmente si se complican con hemorragia o infección. No es raro que algunas desparezcan o disminuyan después de una infección. En la RM con contraste las paredes de los quistes y los septos suelen realzar (fig. 7).
A) Imagen de ecografía en escala de grises de una malformación vascular linfática infectada en la región supraclavicular derecha de una niña de 11 años. Se observan múltiples septos y niveles líquido-líquido (flechas). B) Imagen en el plano axial de RM potenciada en T2 con saturación de la grasa de la misma paciente. También son visibles los septos y niveles líquido-líquido de la lesión (flecha).
Las MV venosas a la exploración son lesiones azuladas, a veces difíciles de distinguir clínicamente de los hemangiomas profundos si los trayectos vasculares no son evidentes. En la ecografía y la RM se detectan trayectos vasculares, con alta señal en las secuencias potenciadas en T231 (fig. 8). A veces aparecen flebolitos. Pueden complicarse con trombosis o hemorragia.
Malformación vascular tipo venoso en el dorso del pie de un niño de 10 años. A) Ecografía en escala de grises que muestra trayectos vasculares anecoicos (flechas). B) Imágenes eco-Doppler color y pulsado donde se objetiva flujo venoso. C) Imagen de RM potenciada en T1 en el plano sagital, donde se observan estructuras vasculares hipointensas (flecha). D y E) Imágenes de RM potenciadas en T2 con saturación de la grasa en los planos sagital y coronal, donde se observa hiperintensidad de señal de los trayectos vasculares (flechas), compatible con malformación vascular de bajo flujo.
Las MV arteriovenosas son menos frecuentes que las anteriores. También se identifican trayectos vasculares, pero se detecta flujo arterial en el estudio eco-Doppler y vacío de señal en las secuencias spin-echo de RM. Pueden complicarse con trombosis y hemorragias y causar problemas hemodinámicos por fenómenos de robo.
Si la MV no causa problemas médicos ni estéticos, una actitud conservadora puede ser razonable. En las capilares superficiales, el láser es el tratamiento habitual. El resto pueden tratarse quirúrgicamente o con más frecuencia con técnicas de radiología vascular intervencionista. Las de bajo flujo se tratan con escleroterapia32,33 y las de alto flujo con embolización. En MV de bajo flujo que, por su complejidad, no sean candidatas a cirugía o escleroterapia, existe la alternativa de tratamiento farmacológico con sirolimús34.
Tejido mamario axilarSe presenta en niñas peripuberales como una masa axilar, a veces dolorosa. Hay que cuestionarse este diagnóstico antes de la telarquia. Tanto en la ecografía como en la RM se observa un área con límites mal definidos con ecogenicidad y patrón ecográfico idénticos a la del tejido mamario35 (fig. 9).
Niña de 14 años con tejido mamario axilar izquierdo. A) Ecografía en escala de grises donde se observa el tejido glandular mamario hiperecogénico en la grasa axilar (flechas). B y C) Imágenes de RM en el plano axial potenciadas en T1 y STIR, donde se observa que la intensidad de señal del tejido ectópico axilar (flechas) es idéntica a la del tejido glandular mamario.
Aunque muchas veces no es necesario tratamiento alguno, una vez aclarado el origen de la «masa» se puede resecar quirúrgicamente si causa molestias.
Granuloma anular subcutáneoEl granuloma anular es una dermatosis no infecciosa frecuente, que afecta a niños y jóvenes sanos. Puede aparecer en cualquier parte del cuerpo, respetando mucosas. La localización más habitual es el dorso de manos y pies.
Son lesiones autolimitadas, aunque bastante persistentes, durando hasta varios años. Cuando se biopsian, se observa un granuloma inespecífico con una zona central de fibras de colágeno necróticas y un infiltrado periférico en empalizada con histiocitos, linfocitos y células gigantes. Su etiología es desconocida.
Las lesiones superficiales las suele diagnosticar el dermatólogo36 y no llegan a los servicios de Radiología, pero existe una forma subcutánea prácticamente exclusiva del paciente pediátrico en la que aparecen nódulos indoloros firmes al tacto, con un aspecto normal de la piel (fig. 10A). Su conocimiento por el radiólogo evita biopsias e intervenciones innecesarias.
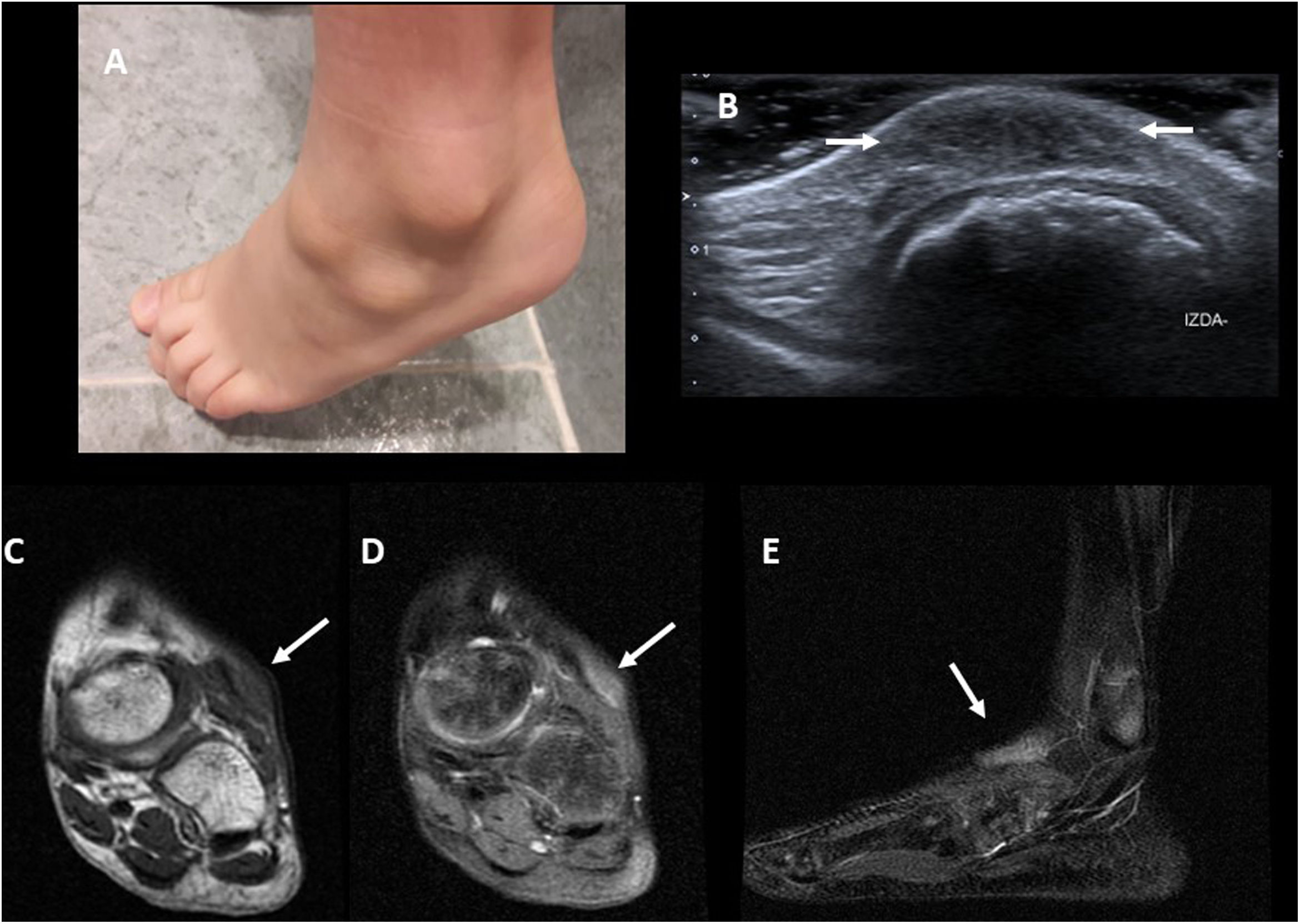
A) Imagen clínica de niño de 6 años con 2 granulomas anulares subcutáneos en el dorso del pie. B) Imagen de ecografía del mismo paciente, donde se ve un engrosamiento hipoecogénico con bordes mal definidos del tejido celular subcutáneo (flechas). C) Imagen de RM potenciada en T1 en el plano coronal, de otro paciente. La lesión (flecha) es hipointensa y con bordes mal definidos. D y E) Imágenes de RM potenciadas en T2 con saturación de la grasa del paciente anterior. La lesión es hiperintensa y con bordes mal definidos (flechas).
La ecografía es la prueba más utilizada por su disponibilidad. El aspecto es bastante típico, identificándose áreas hipoecogénicas de bordes imprecisos en la grasa subcutánea, a veces difíciles de ver (fig. 10B), normalmente sin flujo detectable en estudio Doppler color37.
En RM se observan lesiones de bordes mal definidos en el tejido celular subcutáneo, isointensas con el músculo en T1 y heterogéneamente hiperintensas en las secuencias potenciadas en T2 con supresión grasa38 (fig. 10C y D). La presencia de realce es muy variable. Habitualmente, no se hace biopsia si es una lesión asintomática con hallazgos de imagen típicos. Solo se hace si el curso clínico no es el esperable (p. ej., crecimiento, ulceración o aparición de síntomas locales).
Necrosis grasa postraumáticaLa necrosis grasa postraumática es una causa frecuente de nódulos subcutáneos en niños. Es el resultado de edema, hemorragia, necrosis y fibrosis en distintas proporciones según el tiempo de evolución39. Muchas veces la consulta es bastante después del traumatismo y este no se recuerda.
Los sitios de aparición frecuentes son los más expuestos a traumatismos, como zona pretibial, nalgas, hombros, mejillas y frente. A veces ocurren tras inyecciones (p. ej., vacunas) o por traumatismo del parto en neonatos.
Son lesiones autolimitadas y habitualmente sin importancia médica, quedando a veces como secuela cosmética una depresión residual por la pérdida de tejido celular subcutáneo. La importancia para el radiólogo es reconocerlas para evitar iatrogenia.
En ecografía su aspecto varía con el tiempo de evolución. Normalmente, son áreas hiperecogénicas de bordes imprecisos en el tejido celular subcutáneo (fig. 11A). El diagnóstico diferencial es con el granuloma anular subcutáneo (que es hipoecogénico), y con el hemangioma profundo, que suele estar mejor definido y presenta flujo abundante en el Doppler color. Menos frecuentemente la liponecrosis aparece como una lesión nodular isoecogénica en el tejido adiposo, con un halo hipoecoico40.
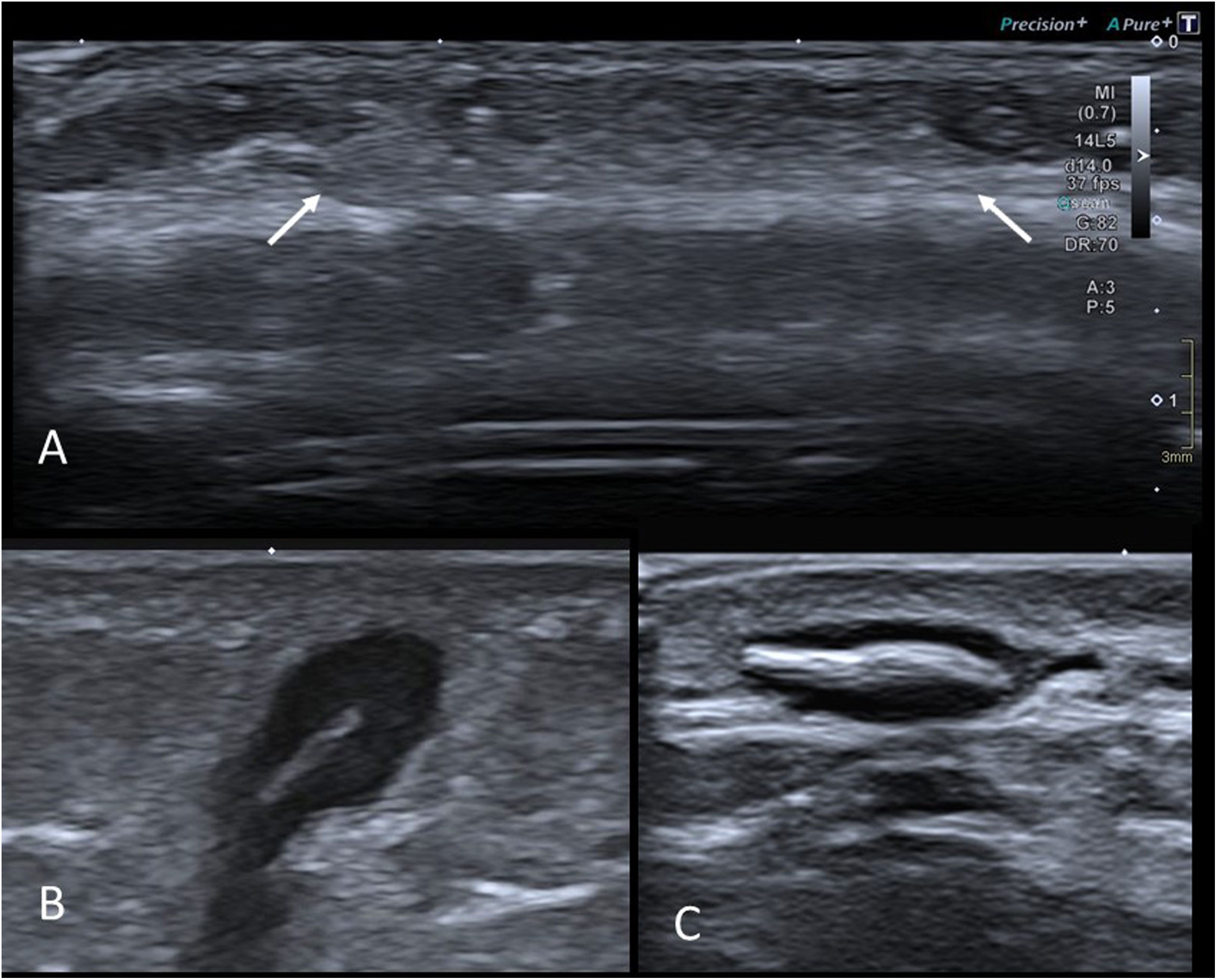
A) Ecografía de la región frontal de una niña de 18 meses con nódulo palpable. Antecedente de traumatismo en la zona 2 meses antes. Área hiperecogénica de bordes imprecisos en el tejido celular subcutáneo (flechas) compatible con liponecrosis. B) Imagen de ecografía en escala de grises de granuloma por cuerpo extraño en glúteo izquierdo de niña de 3 años. Lesión subcutánea con una imagen lineal hiperecogénica central (resultó ser una pequeña espina de origen vegetal) y un área circundante hipoecogénica que corresponde a la reacción granulomatosa. C) Imagen de ecografía en escala de grises de granuloma por cuerpo extraño en el dorso de la mano de un niño de 11 años con el antecedente de haberse clavado una astilla. Los hallazgos son similares a los de la figura anterior.
Con cierta frecuencia, la causa de un nódulo en partes blandas en el niño es la presencia de una reacción granulomatosa a cuerpo extraño. Los sitios más expuestos a este tipo de lesiones son pies, rodillas y nalgas. Muchas veces no se recuerda ningún antecedente.
La mayor parte de las ocasiones el cuerpo extraño es de origen vegetal (espinas, astillas, etc.) y, por tanto, radiotransparente41. La ecografía es la prueba de elección42 y el aspecto es muy típico, observándose el cuerpo extraño como una imagen lineal hiperecogénica subcutánea rodeada por un área nodular hipoecogénica, que es la reacción granulomatosa circundante (fig. 11 B y C). La ecografía también puede ser útil para guiar la extracción quirúrgica43.
ConclusiónLas tumoraciones palpables son frecuentes en niños y engloban un grupo muy heterogéneo de enfermedades. La inmensa mayoría de las lesiones tienen una naturaleza benigna.
La prueba de imagen de elección casi siempre es la ecografía, que aparte de rápida y coste-efectiva, es inocua y no requiere sedación.
En este artículo se describen las características clínico-radiológicas de las lesiones más frecuentes, si bien habrá una segunda parte que describirá más entidades. Conocerlas permite hacer un diagnóstico correcto, sin recurrir a pruebas más invasivas cuando son innecesarias, así como evitar retrasos en el proceso asistencial cuando nos hallemos ante enfermedad de mayor gravedad.
Autoría- 1.
Responsable de la integridad del estudio: DL e IP.
- 2.
Concepción del estudio: DL e IP.
- 3.
Diseño del estudio: DL e IP.
- 4.
Obtención de los datos: DL e IP.
- 5.
Análisis e interpretación de los datos: DL e IP.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: DL e IP.
- 8.
Redacción del trabajo: DL, IP, LC y LA.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: DL, IP, LC, JA y LA.
- 10.
Aprobación de la versión final: DL, IP, LC, JA y LA.
Los autores declaran no tener ningún conflicto de intereses.