Suplemento:Actualización y buenas prácticas en los usos de los medios de contraste
Más datosLa administración de contraste yodado en una tomografía computarizada (TC) persigue delimitar estructuras anatómicas y detectar patología. Los protocolos de administración del contraste en las exploraciones de TC son muy variables e incluyen principalmente estudios vasculares, viscerales, multifásicos y con técnica de inyección bifásica, cada uno de ellos con unas indicaciones y particularidades que se deben conocer para optimizar el empleo del medio de contraste en cada situación. Existen numerosos factores que influyen en el grado de realce que se obtiene, entre los que se incluyen el peso del paciente, el gasto cardiaco, el retraso del estudio, las características técnicas empleadas para la adquisición, principalmente el kilovoltaje, y variables relacionadas con la administración y dosificación del medio de contraste, como el flujo y la carga de yodo. En este artículo se discutirá cómo afecta cada uno de ellos al realce obtenido y los parámetros que se pueden modificar para optimizar el resultado de los diferentes tipos de exploraciones realizadas con contraste.
Iodinated contrast is administered when carrying out computed tomography (CT) scans to define anatomical structures and detect pathologies. The contrast is administered according to different protocols which vary significantly and include vascular, visceral, multiphasic and split-bolus injection studies. Each protocol has its own indications and particularities to optimise the use of the contrast medium in each situation. There are numerous factors that influence the degree of contrast enhancement obtained, including the patient's weight, cardiac output, study delay, the technical characteristics used for acquisition—mainly kilovoltage—, and variables related to the administration and dosage of the contrast medium, such as iodine delivery rate and load. This article will discuss how each of these variables affects the level of enhancement achieved and the parameters that can be modified in order to optimise the results of the different types of scans performed with iodinated contrast.
La administración de contraste yodado en una tomografía computarizada (TC) persigue delimitar estructuras anatómicas y detectar patología gracias a las diferencias de atenuación que se consiguen con la diferente distribución del medio de contraste1.
El objetivo de las TC realizadas con contraste intravenoso se puede dividir en dos grandes grupos: las que persiguen un realce vascular, como los diferentes tipos de angio-TC que se realizan rutinariamente, y las que buscan un realce predominantemente visceral, habitualmente en una fase portal, que es lo que se pretende en la mayoría de los estudios que incluyen el abdomen. En algunas situaciones puede ser preciso obtener información tanto vascular como visceral en la misma exploración, o bien valorar el realce visceral en diferentes etapas, empleando en estos casos diferentes fases o modificaciones en los protocolos de administración de los medios de contraste yodado (MCI).
En este artículo se revisarán los diferentes factores que influyen en el realce en los estudios de TC vasculares y viscerales y analizaremos aquellos parámetros que deben ser tenidos en cuenta para optimizar el resultado de un estudio con contraste. Además, analizaremos los estudios dinámicos o multifásicos y la técnica de doble inyección, bifásica o split-bolus.
Optimización del realce en los estudios de TC vascularesLos avances tecnológicos en los equipos de TC, las bombas de inyección y la manipulación de las imágenes han permitido el desarrollo de diferentes tipos de angio-TC como técnica diagnóstica de primera línea en múltiples ámbitos. La variabilidad de estudios y equipos posibles hace que el radiólogo deba conocer las opciones que tiene para optimizar el realce. Además, por razones de calidad, seguridad y costes, e incluso para hacer frente a eventuales condiciones de escasez de MCI, se debe usar la mínima cantidad de contraste posible para cada situación2-4, de forma similar a como se debe hacer con el uso de la radiación, especialmente en pacientes con factores de riesgo de nefrotoxicidad. Por otro lado, un uso inadecuado puede llevarnos a situaciones absurdas, como que se siga inyectando contraste cuando la adquisición ha finalizado. Por tanto, debemos buscar una individualización de protocolos adaptados a la exploración, al paciente y a la máquina empleada3-7.
Vamos a discutir las posibilidades de optimización del MCI detallando los diversos puntos que se pueden modificar para conseguir un estudio de calidad. Para ello, comenzaremos por analizar la curva teórica del contraste en el vaso de interés, que se muestra en la figura 1. Una inyección típica, con un alto flujo de yodo, da lugar a un ascenso rápido de la atenuación en el vaso, que en el caso de una inyección de corta duración se sigue de un descenso también rápido1. El objetivo primordial de una angio-TC es que la adquisición coincida con el momento de mayor atenuación en el vaso deseado; para ello debemos conseguir que el estudio se inicie lo más cerca del pico posible, y que ese nivel de atenuación vascular se mantenga en todo el recorrido del estudio y durante todo el tiempo que dure la adquisición. El cálculo de la dosis de MCI sería el resultado de multiplicar la velocidad de inyección por el tiempo que dure la exploración, a lo que habría que añadir una cantidad de contraste «de seguridad», que variará de acuerdo a la dirección del flujo en el área estudiada, la extensión y la duración de la exploración, y el retraso desde que se alcanza el umbral que hayamos establecido hasta el inicio del estudio.
Representación teórica de la curva de atenuación en un vaso durante una inyección estándar de medio de contraste corta a alta velocidad en una angio-TC (A), y ajustando la dosis de contraste (B). A)En una inyección habitual, la primera fase corresponde a los cortes de seguimiento del bolo en el área de interés determinada (sombreado rojo). Cuando se alcanza el umbral prefijado (línea verde discontinua) comienza la cuenta atrás del tiempo de retraso para el inicio de la adquisición (sombreado amarillo). Finalizado ese tiempo comienza la adquisición de la exploración (sombreado verde), que debe coincidir con los valores de mayor atenuación en el vaso de interés. B)Para optimizar el uso del bolo de contraste se puede reducir el umbral para el inicio del estudio, u opcionalmente iniciarlo manualmente cuando el explorador identifique visualmente la llegada del contraste a la región de interés. El siguiente paso es reducir al máximo que nos permita el equipo el tiempo de retraso desde que se llega al umbral o se inicia la exploración por el operador y comienza la adquisición (sombreado amarillo). Por último, como se explica en el texto, en ocasiones hay posibilidades técnicas para reducir el tiempo de adquisición (sombreado verde). Como se puede ver, la diferencia entre ambas curvas es el tiempo que dura la meseta del pico de contraste, siendo en la inyección estándar más amplia, mientras que en el ajuste de dosis se llega al mismo pico, pero menos tiempo, obligando a ajustar el inicio del estudio, la duración del mismo, o ambos factores.
Así, para la definición de un protocolo de administración intravenosa de MCI en un estudio vascular y un óptimo aprovechamiento del mismo se deben tener en cuenta varios aspectos, que discutimos a continuación:
Objetivo del estudioNo existe una definición de cuándo una angio-TC es adecuada y, de hecho, no todas las exploraciones exigen el mismo nivel de atenuación. Por tanto, se debe adaptar la dosis a estas necesidades y a las características del paciente. Estudios como la angio-TC de arterias pulmonares o una angio-TC de aorta requerirían un nivel de atenuación mínimo en torno a 200UH8,9; en cambio, las angio-TC de arterias coronarias deberían alcanzar valores de 325-400UH10,11.
Conocer nuestro equipoLa amplia gama de equipos de TC existentes y sus posibilidades técnicas hace que una buena parte de las posibilidades de reducir dosis de contraste y optimizar las imágenes vasculares obtenidas vengan determinadas por las características del aparato que usemos. Por ese motivo, el radiólogo debe conocer sus capacidades tecnológicas y adaptar los protocolos de inyección del contraste a ellas. En cada equipo puede variar significativamente el tiempo de exploración, y también dependen de cada máquina, y son de utilidad para reducir la dosis de contraste, el rango de valores de kilovoltaje que se puede seleccionar, el retraso desde que se alcanza el umbral hasta que comienza el estudio, las diferentes técnicas de reconstrucción de imágenes, que permiten mejorar su calidad con menor dosis12-14, o la posibilidad de adquisición de imagen espectral en sus diferentes variedades15.
Factores que condicionan el realceAunque son muchos, los principales factores que influyen en el realce vascular son el peso del paciente, el gasto cardiaco, las características técnicas empleadas para el estudio y el flujo de yodo administrado1,2,16.
El peso es determinante del realce en los estudios de TC, aunque su impacto es más importante en la valoración visceral. En las exploraciones vasculares, la influencia de pequeñas variaciones de peso es relativamente menor, por lo que es habitual usar velocidades de inyección estándar. Sin embargo, sería necesario adaptar la velocidad de inyección al peso cuando este se encuentre en valores extremos, por existir una relación inversa del peso con la atenuación17-20. Existen softwares disponibles que tienen en cuenta el peso para adecuar el flujo de administración de yodo. En ausencia de ellos, la forma de adaptar la velocidad de inyección al peso en la práctica diaria dependerá de muchos de los factores que estamos comentando en este apartado. Por ejemplo, en la experiencia de algunos de los autores de este artículo, y de acuerdo a lo que encuentran algunos estudios17, para una angio-TC de arterias pulmonares el empleo de 4ml/s con una concentración de 350mgI/ml proporciona atenuaciones válidas en la inmensa mayoría de los pacientes entre 50 y 80kg. Sin embargo, como veremos más adelante, los pacientes con menor peso se benefician de reducir el kilovoltaje y la velocidad de inyección. En pacientes con peso elevado algunos estudios encuentran una menor influencia de esa variable en la atenuación20, lo que en la práctica supone exploraciones aceptables con esa velocidad de inyección en casi todos los pacientes de hasta alrededor de 90kg17. Por encima de ese peso podría ser aconsejable aumentar la velocidad a 4,5-5ml/s.
El gasto cardiaco determina de forma significativa el realce arterial, siendo el factor fisiológico que más influye en el mismo en un paciente dado1,21. Sin embargo, habitualmente este parámetro se desconoce antes del estudio y solo es controlable si realizamos las exploraciones con la técnica de seguimiento del bolo. Un gasto cardiaco disminuido determina un pico de realce más tardío, pero también más elevado1,3,22, y un tiempo de tránsito del contraste de la arteria pulmonar a la aorta aumentado2, lo que se debe tener en cuenta en las exploraciones que requieren realce de ambos vasos. En esos casos, si el estudio se realiza con la técnica de seguimiento del bolo, se debe tomar como referencia la aorta y administrar suficiente contraste para que el bolo cubra el árbol arterial pulmonar en el momento de la adquisición. Si no se tiene en cuenta este factor, es probable que el estudio solo sea adecuado para una parte de la circulación (pulmonar o arterial sistémica), y que por tanto sea necesario repetir la exploración para valorar el sector que no haya quedado suficientemente contrastado.
La reducción del kilovoltaje con el que se adquiere el estudio es una herramienta muy útil para disminuir las necesidades de contraste. Empleando bajo kilovoltaje (80-100kV) o, en los equipos con capacidades de análisis espectral, mediante las imágenes monoenergéticas de baja energía (40keV), obtenemos una mayor atenuación vascular, reduciendo de esa forma las necesidades de MCI6,9,22,23. A pesar de que estas imágenes pueden presentar mayor ruido, se ha descrito que la calidad es aceptable22 incluso en pacientes no necesariamente delgados23, permitiendo lo que se denomina en inglés the double low, con estudios de buena calidad en los que la radiación y la dosis de contraste son bajas24,25. Cada tipo de estudio, de paciente y de equipo pueden admitir diferentes combinaciones de reducción de kilovoltaje y, consecuentemente, de las velocidades de inyección. Por ejemplo, en nuestra experiencia, usando métodos de reconstrucción iterativa se pueden realizar estudios de angio-TC de calidad diagnóstica con 80kV y velocidades de inyección de 2,5-3ml/s en la mayoría de los pacientes25,26.
Por último, el factor individual que más condiciona el realce vascular es el flujo de yodo o tasa de administración de yodo (iodine delivery rate)24-28, que viene expresada en gramos de yodo por segundo, y está determinada por la concentración del MCI y la velocidad de inyección según la fórmula:
A flujos elevados se consigue un pico máximo más elevado y al que se llega antes, comparado con flujos menores7. La elección del flujo de yodo de una exploración se determina principalmente por el objetivo de la misma, siendo máxima para el estudio de las arterias coronarias (1,6-2,0gI/ml) y algo menores para la valoración de la aorta o las arterias pulmonares (1,4-1,6gI/ml). Estos valores pueden reducirse cuando se emplea un menor kilovoltaje 6,7,26,28.
En los casos en los que la calidad del acceso venoso limite la velocidad de inyección, un medio de contraste con mayor concentración de yodo nos permite una velocidad de inyección menor, manteniendo constante el flujo de yodo7,29,30. En estas situaciones, una opción es reducir el kilovoltaje, lo que, como hemos visto antes, nos permite obtener una mayor atenuación con menores velocidades de inyección. Además, el uso de un bolo de suero salino tras el de contraste permite empujar al torrente sanguíneo y compactar todo el contraste, evitando que quede remansado en el territorio venoso31.
Factores que permiten reducir el tiempo de exploración o el inicio de la mismaDado que el tiempo de adquisición es, junto con la velocidad de inyección, un determinante de la dosis de MCI que debemos administrar, reducir dicha duración y modificar otros factores del protocolo son una herramienta para disminuir la dosis. Entre las posibles modificaciones, algunas de las cuales se representan en la figura 1B, se encuentran:
- a.
Reducir el tiempo de adquisición, lo que se puede conseguir por un lado ajustando el estudio al máximo a la zona de interés, o por otro modificando parámetros para que la cobertura en un tiempo determinado sea más amplia (aumentando la velocidad de la mesa, con una mayor velocidad de rotación del tubo o modificando la colimación).
- b.
Ajustar la adquisición al inicio del pico de atenuación. Para ello, empleando la técnica de seguimiento del bolo, se puede conseguir este ajuste de varias formas: disminuyendo el umbral al que se inicia el estudio para que se alcance antes, incluso iniciando de forma manual cuando se detecte visualmente la llegada del bolo; reduciendo al mínimo el tiempo desde que se alcanza el umbral hasta el inicio del estudio; o colocando el área de interés en una localización más próxima de la llegada del contraste (por ejemplo, en la vena cava superior en lugar de en la arteria pulmonar para realizar una angio-TC pulmonar). Hay que tener en cuenta la dirección y la velocidad del flujo de la sangre y, por tanto, del contraste, ya que en estudios relativamente largos puede ser una ventaja la adquisición a favor de la corriente sanguínea (fig. 2). No obstante, con equipos muy rápidos se debe considerar la posibilidad de que la adquisición se adelante a la llegada del contraste (por ejemplo, en una angio-TC de miembros inferiores), lo que debe evitarse aumentando la cantidad de contraste y el retraso en el inicio de la exploración, o modificando el protocolo para garantizar el contraste al final del estudio32.
Figura 2.Angio-TC toracoabdominopélvica para planificación de colocación de una endoprótesis de válvula aórtica transfemoral. En un paciente de 82kg de peso y 169cm de altura, la adquisición del estudio presentaba una duración de 10,1segundos. Se administraron 40ml de contraste yodado a una velocidad de inyección de 4ml/s, seguida de 40ml de suero salino a la misma velocidad. La región de interés se colocó en la aorta ascendente a un umbral de 100UH, pero se inició el estudio manualmente cuando el operador visualizó la llegada del contraste a ese punto. El retraso del inicio de la exploración estaba en 5,6segundos (el mínimo establecido por la máquina). Como se puede ver, la atenuación se mostró similar, por encima de 300UH, en aorta ascendente, descendente y arterias femorales. Nótese que en el momento de la adquisición el bolo de contraste ya ha pasado completamente por el ventrículo derecho (asterisco enB), que no muestra ningún realce. El uso de esta dosis es posible gracias a que se ha ajustado el inicio de la exploración a la llegada del contraste a la aorta ascendente y a que se adquiere a favor del flujo de la aorta.
En la figura 1B y en la figura 3 se resumen algunos de los pasos que se pueden seguir para adecuar el protocolo de contraste en un estudio vascular. Los protocolos de administración de contraste usados rutinariamente deben tener en cuenta el paciente estándar y unos parámetros que permitan su reproducibilidad por todo el personal con buenos resultados. Sin embargo, en circunstancias especiales, cuando es necesario reducir la dosis de contraste, por ejemplo, en pacientes con alteraciones importantes de la función renal, se pueden realizar variaciones de esos protocolos para disminuir la cantidad de contraste administrada. En la tabla 1 se muestra un ejemplo de cómo se puede adaptar el protocolo en un escáner concreto. En esa misma circunstancia una alternativa, si el peso del paciente lo permite, sería reducir el kilovoltaje y, paralelamente, la velocidad de inyección y el volumen administrado, como se discute anteriormente.
Ejemplo de adaptación de un protocolo de angio-TC pulmonar estándar a uno para reducir dosis de contraste en un escáner de 16 filas de detectores
| Parámetro | Protocolo estándar | Protocolo con reducción de dosis |
|---|---|---|
| Inicio de los cortes de prueba del seguimiento del bolo | 8 s | 4 s |
| Umbral para el inicio de la adquisición | 120 UH | 100 UH (inicio manual por el operador cuando identifique la llegada del bolo) |
| Retraso del inicio de la adquisición tras el umbral | 6 s | 4 s |
| Colimación | 16×0,6 mm | 16×1,2 mm |
| Duración aproximada del estudio | 12 s | 6 s |
| Grosor mínimo de reconstruccióna | 1 mm | 1,5 mm |
| Velocidad de inyección del medio de contraste | 4 ml/s | 4 ml/s |
| Cantidad de medio de contraste | 60 ml | 30-35 ml |
| Cantidad de suero salinob | 30 ml | 45 ml |
Cuando una TC se realiza en fase portal, lo que en la práctica diaria constituye la gran mayoría de exploraciones que incluyen el abdomen, la calidad del estudio se puede definir por el realce que alcanza el parénquima hepático con la administración intravenosa del MCI. En la bibliografía clásicamente se toma como referencia un incremento de atenuación del hígado de al menos 50UH sobre su valor basal33,34 o alcanzar una atenuación mínima de 100-110UH como valor absoluto (120UH en el bazo si hay esteatosis hepática)35,36.
Para conseguir estos valores de atenuación es imprescindible administrar una dosis adecuada de MCI, que en los estudios viscerales podemos definirla con el concepto de carga de yodo, el cual relaciona los gramos de yodo administrados respecto a una unidad que haga referencia al tamaño corporal del paciente, como el peso o el área de superficie corporal33,37. De esta forma la cantidad de yodo a administrar se relaciona con una característica propia del paciente, lo que permite un ajuste de la dosis de forma individualizada.
Por tanto, para calcular la carga de yodo en un paciente dado se tiene en cuenta la cantidad de yodo administrada en relación, por ejemplo, al peso del mismo, según la fórmula:
Este ajuste va a tener mayor utilidad en estudios viscerales, ya que el realce hepático depende sobre todo del aporte venoso portal38.
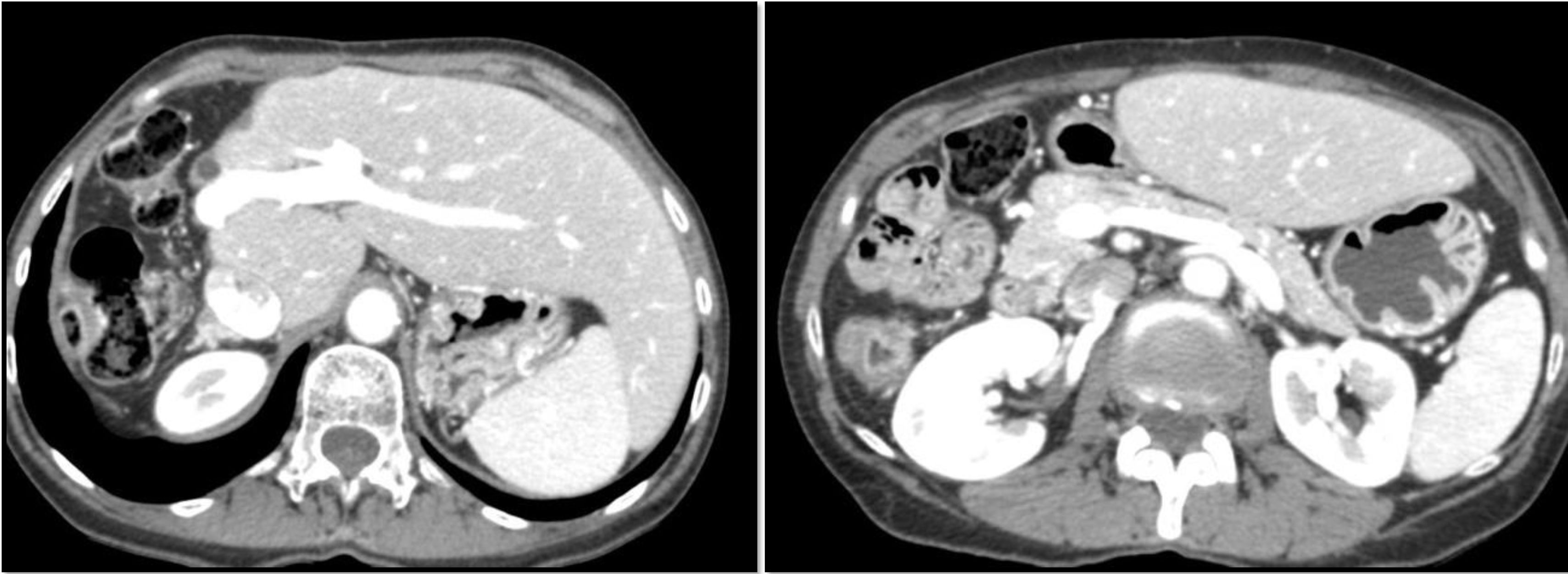
El uso de la carga de yodo como referencia permite, a diferencia de los protocolos que utilizan un volumen fijo de MCI, obtener estudios con unos valores de atenuación visceral más homogéneos. En el caso de protocolos de TC abdominal donde, por ejemplo, se pautan 100ml de MCI para todos los pacientes, podemos encontrar algunas limitaciones: por un lado, no se considera la concentración de yodo en ese volumen, de manera que la dosis puede ser muy variable (por ejemplo, 100ml con una concentración de 300mg/ml aportan 30g de yodo, mientras que si la concentración fuera de 400mg/ml, serían 40g de yodo, es decir, un 33% más); por otra parte, un volumen fijo no adaptado a las características del paciente puede condicionar realces viscerales muy variables, que en muchos casos pueden ser inadecuados, por exceso o por defecto (fig. 4).
Para intentar optimizar el realce en los estudios viscerales es imprescindible conocer las variables más importantes que van a condicionar el realce y cómo influyen en el mismo, lo que se resume en la tabla 2 y se discute a continuación.
Mayor volumen o mayor concentración van a implicar lógicamente una mayor dosis de yodo, lo que producirá un incremento en el realce visceral, de forma proporcional1 (fig. 5A y 5B).
Curvas simuladas de realce hepático a lo largo del tiempo. A)Tras la inyección en el mismo paciente de tres volúmenes diferentes de medio de contraste con la misma concentración. B)Tras la inyección del mismo volumen de contraste con tres concentraciones diferentes. C)En pacientes de diferentes pesos y misma altura, manteniendo fijos todos los parámetros relacionados con el contraste (caudal, volumen y concentración).
Un mayor peso se relaciona en general con un mayor volumen sanguíneo, de manera que el contraste queda más diluido, especialmente si la opacificación va a depender del retorno venoso. Así, con una misma dosis de MCI, un mayor peso conlleva menor realce visceral (1) (fig. 5C).
No obstante, aunque el peso es la variable más utilizada para ajustar la dosis del MCI, tiene la limitación de que puede no representar adecuadamente el volumen corporal en el que se va a distribuir ese contraste. En un paciente obeso, la grasa tiene una vascularización escasa, con lo que también lo será su influencia en el volumen sanguíneo y retorno venoso (1). De esta forma, en pacientes en los que gran parte del peso se deba a tejido graso, adaptar la dosis del MCI a los kilogramos sobreestimaría la necesidad de contraste39.
Así, como se aprecia en la figura 5C, en el rango de pacientes entre 50 y 100kg parece que sí se mantiene una proporcionalidad entre peso y realce. En estos casos pueden utilizarse las cargas de yodo recomendadas por la bibliografía para alcanzar los objetivos de realce hepático comentados anteriormente, con valores de entre 0,52 y 0,60g/kg33,34,37. De esta forma, si tomamos como referencia un valor de carga de yodo, por ejemplo de 0,60g/kg, modificando la fórmula se puede calcular el volumen necesario a administrar, si conocemos el resto de parámetros: concentración del contraste y peso del paciente.
En cambio, por encima de los 100kg, donde existe más probabilidad de que un mayor peso se deba a obesidad, y por tanto más proporción de tejido graso corporal, es llamativa la menor influencia del peso sobre el realce. Ante esto habría que plantearse si el volumen de distribución en este grupo de pacientes requiere una dosis de yodo menor que la que correspondería por peso, puesto que en la mayor parte de la población esos pesos altos se van a deber a obesidad.
Por este motivo, en pacientes obesos se plantea la utilización de otras variables antropométricas diferentes al peso, como la masa magra corporal o la superficie corporal, que podrían permitir un mejor ajuste de la dosis de yodo, por mantener una mayor correlación con el realce esperable37,39-44.
Otras variablesOtras variables que condicionan el realce visceral, como el caudal de inyección, el gasto cardiaco o el kilovoltaje, ya han sido comentadas en el apartado de los estudios de TC vasculares. No obstante, su influencia tiene algunas diferencias entre ambos tipos de estudios, que se deben comentar.
Respecto al caudal de inyección, si bien en los estudios viscerales no es un factor tan importante como la carga de yodo, es fundamental recordar que caudales muy bajos pueden condicionar un realce inadecuado con cargas de yodo apropiadas.
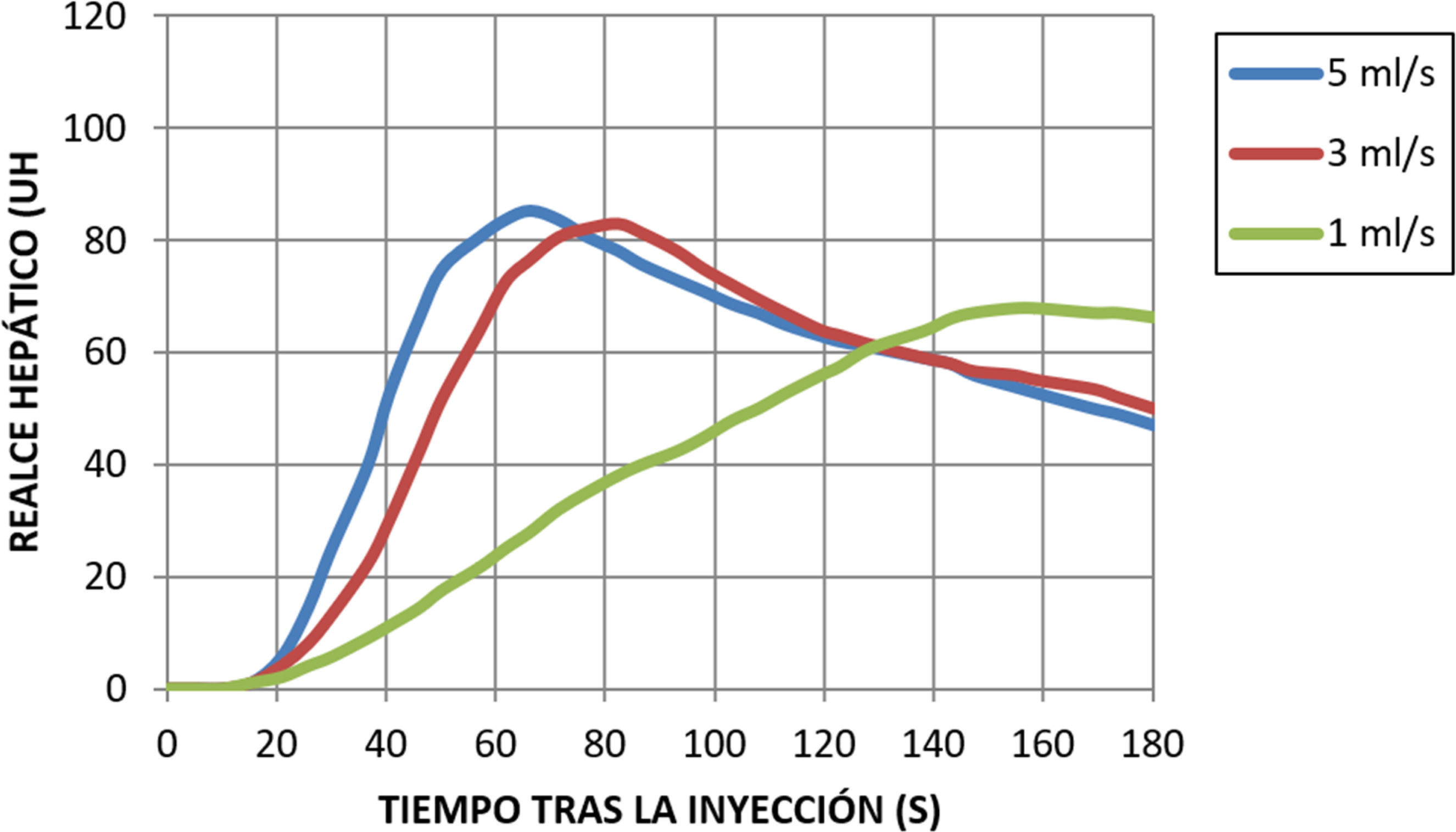
Con caudales de 3 a 5ml/s, el máximo realce hepático se alcanza en los tiempos de la fase portal, alrededor de los 70s. En cambio, con caudales muy bajos ese pico de realce puede llegar a ser muy tardío, dado que la inyección va a tener mayor duración, y la máxima atenuación hepática solo se alcanzará con toda la dosis de yodo distribuida en el organismo. Además, ese retraso también condicionará una mayor dilución del contraste, con lo que tampoco se alcanzará el mismo realce máximo que con inyecciones más rápidas (fig. 6)1.
Del mismo modo, con volúmenes muy altos de MCI, aunque el pico de realce hepático será mayor, el momento en que se alcanzará ese pico será más tardío que en una fase portal habitual, cuando todo el contraste se haya distribuido y retornado por la circulación venosa (fig. 5A)1.
Así, de las figuras 5A y 6 se puede extrapolar que se necesitan al menos 25-30s desde el final de la inyección para que toda la dosis de yodo administrada logre la máxima atenuación del parénquima hepático. Por tanto, para una adquisición de imágenes en teórica fase portal, por ejemplo a los 70s, inyecciones que duren más de 40s (ya sea por caudal bajo o volúmenes muy altos) supondrán un estudio de atenuación subóptima. Puede darse la situación de que aún se esté inyectando contraste cuando se inicie la adquisición, o incluso tras haber finalizado. Para evitar estas circunstancias, en las que parte del contraste administrado no va a ser útil en la opacificación visceral, hay que intentar adaptar la velocidad de administración del MCI para que la duración de la inyección no supere los 40s; si esto no fuera posible, es imprescindible realizar un ajuste adecuado en el retraso de la adquisición.
En cuanto al gasto cardiaco, puesto que va a influir en la velocidad de distribución del yodo, su disminución condicionará realces más tardíos (1). Suele ser un factor no controlable antes de realizar el estudio y que determina realce inadecuado en un pequeño número de pacientes. Para evitarlo, como se muestra en la tabla 3, en lugar de un retraso fijo, una alternativa es emplear la detección automática del bolo en los estudios viscerales, que en parte puede compensar el retraso en la llegada del bolo debido al bajo gasto cardiaco.
Características y utilidades de diversas fases en TC con contraste
| Fases | Características técnicas | Utilidad |
|---|---|---|
| Sin contraste | Antes de la administración del contraste | Diferenciar tejidos como calcio, grasa o sangre |
| Arterial precoz | 15-20 segundos tras el inicio de la inyección del contraste o inmediatamente tras DAB | Mapeo arterial anatómico, búsqueda de sangrado activo |
| Arterial tardía | 35-40 segundos tras el inicio de la inyección del contraste o 15 segundos tras DAB | Detección de lesiones hipervasculares hepáticas |
| Portal | 70-75 segundos tras el inicio de la inyección del contraste o 50-55 segundos tras DAB | Detección de lesiones hipovasculares hepáticas |
| Pancreatográfica | 20 segundos tras DAB | Detección de lesiones pancreáticas |
| Enterográfica | 20-25 segundos tras DAB | Valoración del intestino delgado |
| Nefrográfica | 90-100 segundos tras el inicio de la inyección del contraste u 80 segundos tras DAB | Detección de lesiones del parénquima renal |
| Tardía hepática o de equilibrio | 3 a 5 minutos tras el inicio de la inyección del contraste | Detección de tumores fibrosos como el colangiocarcinoma que retienen contraste en esta fase o valorar el lavado en lesiones hipervasculares malignas (hepatocarcinoma, metástasis) |
| Excretora o urográfica | 7-12 minutos tras el inicio de la inyección del contraste | Detección de tumoraciones uroteliales y de extravasación en lesiones traumáticas de la vía excretora |
DAB: detección automática del bolo.
En lo que respecta al kilovoltaje, su reducción en las exploraciones viscerales supone mayores limitaciones que en TC vascular, dado que el aumento en el ruido en muchos casos puede limitar la capacidad diagnóstica, a pesar de otras medidas que puedan compensar ese ruido, como el aumento del miliamperaje o la reconstrucción iterativa45,46.
De todas maneras, existen varios trabajos que sugieren unas cargas de yodo mínimas para lograr un realce hepático adecuado para kV por debajo de los 120kV, de hasta 0,4g/kg y 0,3g/kg usando 100 y 80kV, respectivamente35,47,48. Del mismo modo, la tecnología espectral también abre la posibilidad de manejar cargas de yodo mucho más bajas de las habituales, con valores de realce hepáticos adecuados para el diagnóstico49.
Otros factoresOtros factores que pueden ayudar a una mejor distribución del contraste en TC visceral son la administración de 30-40ml de solución salina tras el contraste por el mejor aprovechamiento de toda la dosis administrada, y en contrastes de alta concentración, las bombas que aumentan su temperatura hasta la corporal pueden facilitar la inyección a caudales más altos al reducir su viscosidad35.
Una vez conocidas las variables más importantes que afectan al realce visceral, podemos plantearnos cómo ajustar en lo posible la dosis de contraste intravenoso en estas exploraciones. El procedimiento para ajustar dosis de contraste en TC visceral puede resumirse en los pasos explicados en la figura 7.
Estudios dinámicos o multifásicosLos estudios de TC multifásica tienen como objetivo estudiar el comportamiento de órganos y lesiones en diferentes fases50. Los medios de contraste son marcadores del fluido extracelular, ya que una vez inyectados se distribuyen rápidamente entre los espacios vascular e intersticial extracelular51. Aprovechando esta característica, hay diferentes protocolos que combinan ambas fases en función de la indicación del estudio. De esta forma, un estudio multifásico puede constar de una serie basal o sin contraste (que es opcional), una fase arterial, una fase visceral o parenquimatosa y, en ocasiones, otra fase más retardada (fig. 8). Como se ha dicho anteriormente, la fase arterial vendrá determinada por el flujo de yodo, mientras que la fase visceral dependerá principalmente de la carga de yodo51. Por tanto, en este tipo de estudios el flujo de inyección de yodo debe ser alto, similar a un estudio vascular, mientras que la dosis total de yodo debe ajustarse a la fase visceral y, por tanto, al volumen corporal.
Las fases más ampliamente utilizadas en la práctica clínica, sus características y utilidades aparecen reflejadas en la tabla 350-53.
Como en los otros tipos de estudios, en los estudios multifásicos se debe tener en cuenta el efecto de la disminución del gasto cardíaco. Su disminución en la fase arterial va a producir un realce más tardío, pero más intenso y prolongado, mientras que en la fase visceral va a causar un realce mucho más tardío1. Como consecuencia de esto, puede ocurrir que en la fase visceral no haya un buen realce, ya que el tiempo programado entre las fases arterial y visceral es fijo. Debido a que esta situación no se suele poder prever, es posible que sea necesaria una nueva adquisición para obtener un estudio en el momento de máximo realce visceral. Si la persona responsable de la realización del estudio detecta esta circunstancia, puede resultar factible la repetición inmediata de la fase visceral para aprovechar el contraste administrado.
Técnica de inyección bifásicaLa técnica de bolo único es la más habitualmente utilizada en los estudios de TC. En contraposición, la doble inyección, inyección bifásica, inyección dividida o split-bolus es una técnica de administración del contraste yodado que permite estudiar simultáneamente diferentes estructuras que realzan con distintos tiempos de retardo, como por ejemplo arterias y venas o el sistema excretor y el parénquima renal. Esto permite realizar una única adquisición helicoidal en sustitución de varias adquisiciones multifásicas. El protocolo de doble inyección ha demostrado reducir significativamente la dosis de radiación ionizante recibida y el número de imágenes de los estudios, en comparación con las exploraciones multifásicas54. Para ello puede ser necesario aumentar la cantidad del medio de contraste administrado.
Técnicamente se consigue al dividir la inyección del contraste en dos o más bolos separados por inyección de suero salino y una pausa, con un bolo inicial que proporciona el realce de la estructura que tendría más retardo y un segundo bolo que es el responsable del realce de las estructuras con menor retardo. Por ejemplo, en el caso de una TC de abdomen y pelvis, el bolo inicial proporciona el realce visceral y el segundo bolo a mayor flujo es el responsable del realce vascular55 (figs. 9 y 10).
Curvas de realce arterial (roja) y hepático (verde) tras la administración de contraste yodado con protocolo monofásico (A) y bifásico (B). El rectángulo gris representa el momento de adquisición de las imágenes. En la parte superior de la figura se muestran los bolos de inyección de contraste y de suero salino. En la inyección bifásica de contraste (B) el segundo bolo es el responsable del mayor realce arterial.
TC de abdomen a nivel del hígado y los riñones tras la administración de contraste yodado con protocolo monofásico (A) y bifásico (B). En ambos estudios se observa igual realce de las venas suprahepáticas (flechas), pero el realce de la aorta abdominal (cabezas de flecha) es mayor en la inyección bifásica.
Una forma de realizar el cálculo en una TC de tórax, abdomen y pelvis con la técnica de doble bolo sería la siguiente:
- •
El retardo para obtener un estudio en fase visceral es de 70segundos y para realzar la aorta sería de 20segundos.
- •
El inicio de la inyección sería el segundo «0» y el estudio tendrá que iniciarse a los 70segundos.
- •
El primer bolo podría ser de 80ml con un flujo de 2,5ml/s, luego duraría 32segundos.
- •
A continuación se inyectan 30ml de suero salino a 3ml/s, que duraría 10segundos.
- •
El segundo bolo de realce arterial tendría que empezar 20segundos antes de iniciar la adquisición, luego tiene que haber una pausa entre el final de la inyección del suero salino y el inicio del segundo bolo de 8segundos (70−32−10=28 segundos, retraso global menos duración del primer bolo de MCI y del suero salino, luego quedan 28 segundos al inicio del estudio; 28−20=8, la pausa es de 8segundos porque los últimos 20segundos se emplean en inyectar los segundos bolos, de contraste y de suero).
- •
El volumen del segundo bolo podría ser de 35ml, que a un flujo de 3,8ml/s duraría 9segundos.
- •
Finalmente, se lavaría con 40ml de suero salino a un flujo de 4ml/s.
Hay muchas aplicaciones de la inyección bifásica de contraste, pero destaca su uso en los estudios de cabeza y cuello, del politraumatizado estable y la urografía-TC55-57. En la tabla 4 se reflejan varias propuestas de inyección bifásica de contraste.
Propuesta de protocolos de inyección bifásica de contraste
| TC de tórax-abdomen-pelvis |
| 1. Retardo total: 70 s o DAB+50-55s |
| 2. Primer bolo: 80ml, 2,5ml/s, duración 32s |
| 3. Suero salino: 30ml, 3ml/s, duración 10s |
| 4. Pausa: 8s |
| 5. Segundo bolo: 35ml, 3,8ml/s, duración 9s |
| 6. Suero salino: 40ml, 4ml/s |
| TC de cabeza y cuello |
| 1. Retardo total: 80s o DAB+60-65s |
| 2. Primer bolo: 80ml, 2,5ml/s, duración 32s |
| 3. Suero salino: 30ml, 3ml/s, duración 10s |
| 4. Pausa: 13s |
| 5. Segundo bolo: 30ml, 3ml/s, duración 10s |
| 6. Suero salino: 30ml, 3ml/s |
| TC urografía |
| 1. Primer bolo: 1/3 del total del MCI, 2,5ml/s |
| 2. Suero salino: 40ml, 2,5ml/s |
| 3. Pausa: 8min |
| 4. Segundo bolo 2/3 del total del MCI, 2,5ml/s |
| 5. Suero salino: 40ml, 2,5ml/s |
DAB: detección automática del bolo.
Los protocolos de administración de contraste en las exploraciones de TC son muy variables e incluyen principalmente estudios vasculares, viscerales, multifásicos y con técnica de inyección bifásica, cada uno de ellos con unas indicaciones y particularidades que deben conocerse para optimizar el empleo del contraste en cada situación. El conocimiento por parte del radiólogo de los parámetros técnicos de los equipos, de los factores que condicionan el realce y de la distribución del medio de contraste en el organismo le permitirá poder adaptar los protocolos de administración a cada tipo de estudio obteniendo los mejores resultados.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Contribución de los autores- 1.
Responsable de la integridad del estudio: Juan José Arenas-Jiménez.
- 2.
Concepción del estudio: Juan José Arenas-Jiménez, Juan Matías Bernabé García, Gemma Fernández Suárez, Juan Calvo Blanco.
- 3.
Diseño del estudio: Juan José Arenas-Jiménez, Juan Matías Bernabé García, Gemma Fernández Suárez, Juan Calvo Blanco.
- 4.
Obtención de los datos: Juan José Arenas-Jiménez, Juan Matías Bernabé García, Gemma Fernández Suárez, Juan Calvo Blanco.
- 5.
Análisis e interpretación de los datos: Juan José Arenas-Jiménez, Juan Matías Bernabé García, Gemma Fernández Suárez, Juan Calvo Blanco.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: Juan José Arenas-Jiménez, Juan Matías Bernabé García, Gemma Fernández Suárez, Juan Calvo Blanco.
- 8.
Redacción del trabajo: Juan José Arenas-Jiménez, Juan Matías Bernabé García, Gemma Fernández Suárez, Juan Calvo Blanco.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: Juan José Arenas-Jiménez, Juan Matías Bernabé García, Gemma Fernández Suárez, Juan Calvo Blanco.
- 10.
Aprobación de la versión final: Juan José Arenas-Jiménez, Juan Matías Bernabé García, Gemma Fernández Suárez, Juan Calvo Blanco.
Los autores declaran no tener ningún conflicto de intereses.