En pacientes pediátricos con sarcomas, hepatoblastomas u otros tipos de tumores primarios es frecuente encontrar metástasis pulmonares en el inicio o durante el seguimiento. El manejo y seguimiento es un reto dada la gran diversidad de tumores primarios y situaciones clínicas. La tomografía computarizada de tórax es la mejor forma de detectar la diseminación pulmonar. Muchos nódulos pulmonares son inespecíficos y pueden no tener significado patológico. Otros pueden tener características que los hagan sospechosos. Hay algunos criterios generales para considerar a un nódulo pulmonar probablemente metástasis, pero a veces depende del tumor primario. Además, las metástasis se pueden desarrollar a lo largo del curso de la enfermedad, siendo los protocolos de seguimiento distintos según el tumor primario. Revisamos los diferentes protocolos utilizados en nuestro hospital para los tumores primarios que más frecuentemente metastatizan en el pulmón, incluidos los criterios de metástasis pulmonar y el seguimiento para cada tumor primario.
In pediatric patients with sarcomas, hepatoblastomas, or other types of primary tumors, lung metastases are often found at diagnosis or during follow-up. The wide variety of primary tumors and clinical situations makes management and follow-up of these patients challenging. Chest CT is the best way to detect the dissemination of disease to the lungs. Many pulmonary nodules are nonspecific, and many might not be pathological. Others have characteristics that make them suspicious. Although there are some general features that indicate that a pulmonary nodule is likely to be a metastasis, sometimes the meaning of these features depends on the primary tumor. Furthermore, metastases can develop during the course of the disease, and the protocols for follow-up are different for different primary tumors. We review the different protocols used at our hospital for the primary tumors that most often metastasize to the lungs, including the criteria for lung metastases and the follow-up for each primary tumor.
Los pulmones son el órgano metastásico más comúnmente afectado en la mayoría de los tumores sólidos pediátricos. El osteosarcoma, el tumor de Wilms (nefroblastoma), tumores de la familia del sarcoma de Ewing, el rabdomiosarcoma y el hepatoblastoma son los tumores primarios más frecuentes que se presentan con metástasis pulmonares o las desarrollan a lo largo de la enfermedad1,2.
En el seguimiento y detección de nódulos pulmonares en el paciente oncológico pediátrico disponemos de dos herramientas radiológicas: La radiografía y la tomografía computarizada (TC) de tórax. La radiografía de tórax se obtiene en proyección anteroposterior (AP, una sola proyección) en pacientes menores de 4-5 años, dependiendo del grado de colaboración, y en posteroanterior (PA) para radioprotección de la glándula mamaria en pacientes colaboradores. Respecto a la TC de tórax, existen muchos parámetros que pueden modificar la imagen y diagnóstico y cuya descripción se sale de los objetivos de este estudio, pero que se pueden resumir en: parámetros de adquisición de la imagen para adecuación en función de la edad, peso y grado de colaboración del paciente (sedación, anestesia general, corriente del tubo, espesor de corte, pitch, etc.) y parámetros de posprocesado (detección en proyección de máxima intensidad (MIP) y medición en reconstrucción multiplanar entre otros), que pueden incidir en la exactitud y reproducibilidad del informe radiológico. Con respecto a la técnica, la TC de tórax para detección de nódulos pulmonares se suele realizar sin contraste salvo en el rabdomiosarcoma de miembros y abdomen que se realiza con contraste3.
La TC de tórax ha demostrado tener una mayor sensibilidad para la detección de nódulos pulmonares que la radiografía de tórax. En la TC, las metástasis pulmonares se ven normalmente como nódulos redondos y bien circunscritos. Pero no todos los nódulos pulmonares son metástasis. Existe una amplia variedad de procesos benignos que pueden expresarse como un nódulo pulmonar, como granulomas, infección, inflamación, ganglios linfáticos intrapulmonares, malformaciones vasculares, hamartomas y atelectasias4. Hasta la fecha, existen muchos desafíos en torno a considerar un nódulo pulmonar como metastásico en un niño con cáncer:
- •
La alta prevalencia de nódulos pulmonares en niños no oncológicos.
- •
Las dificultades para determinar si un solo nódulo es benigno o maligno según las imágenes radiológicas. Se han realizado algunos esfuerzos en la literatura radiológica para aclarar qué nódulos deben considerarse benignos: por ejemplo, los nódulos calcificados en pacientes sin osteosarcoma deben considerarse granulomas calcificados, y los nódulos perifisurales triangulares en todos los casos deben considerarse ganglios linfáticos pulmonares benignos5. Pero aparte de eso, no hay características fiables en la TC para poder diferenciar un nódulo pulmonar benigno de una metástasis pulmonar5,6.
- •
Las diferencias en la adquisición de TC de pulmón entre las diferentes instalaciones que incluyen no solo parámetros de adquisición (tales como el espesor de corte y el pitch o la corriente del tubo), sino también los grados de inspiración, sedación/anestesia general para pacientes pequeños o adquisición durante la respiración suave.
- •
Una variabilidad sustancial entre observadores en la detección de pequeños nódulos pulmonares y en la interpretación individual de los nódulos.
Aunque la TC pulmonar puede ser “sensible” para la detección de nódulos pulmonares, su especificidad es baja para el diagnóstico de metástasis pulmonares, con biopsias probadas con tasas de falsos positivos del 32-65% en niños con cáncer con sospecha de metástasis pulmonares5,6. Además, las guías de Fleischner, desarrolladas para la población adulta, no se aplican a los niños6,7.
Los protocolos de las guías de seguimiento pueden ser un reto tanto para los oncólogos como para los radiólogos pediátricos debido, por un lado, a los diferentes criterios de metástasis pulmonar según el tumor primario, y por otro, a las diferentes indicaciones para la obtención de muestras histológicas de dichos nódulos pulmonares en función del tumor primario, la estadificación oncológica y la situación clínica del paciente.
RevisiónRevisamos las guías de los ensayos clínicos más importantes para el diagnóstico y el seguimiento de los tumores sólidos pediátricos más frecuentes que metastatizan al pulmón: osteosarcoma, tumores de la familia del sarcoma de Ewing, hepatoblastoma, rabdomiosarcoma y tumor de Wilms.
Dividimos nuestra atención en dos aspectos diferentes:
- •
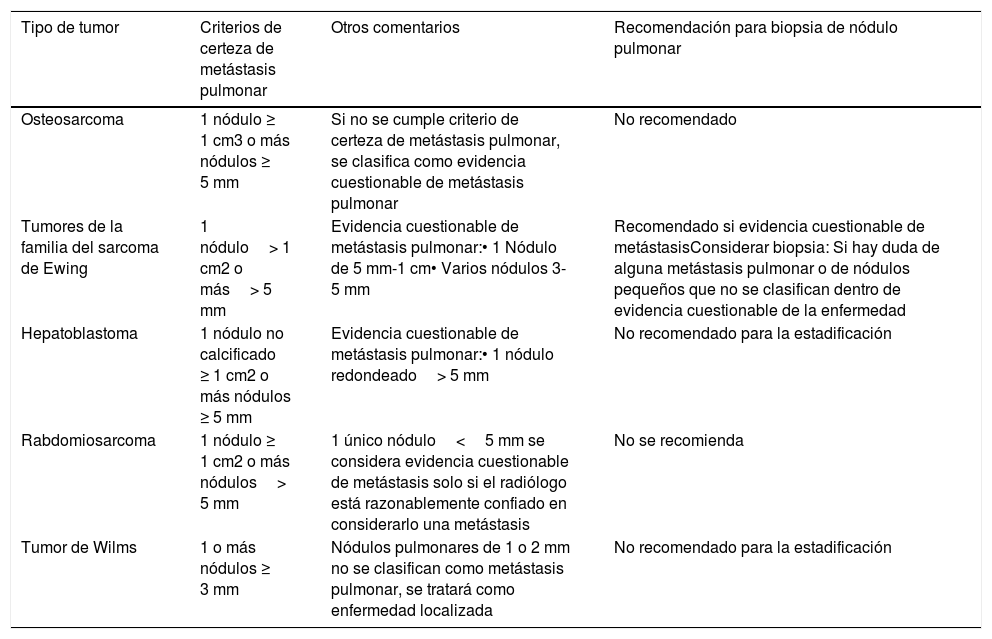
Criterios utilizados para considerar a un nódulo pulmonar como metástasis según el tumor (tabla 1).
Tabla 1.Resumen de los criterios de metástasis pulmonar según el tumor primario
Tipo de tumor Criterios de certeza de metástasis pulmonar Otros comentarios Recomendación para biopsia de nódulo pulmonar Osteosarcoma 1 nódulo ≥ 1 cm3 o más nódulos ≥ 5 mm Si no se cumple criterio de certeza de metástasis pulmonar, se clasifica como evidencia cuestionable de metástasis pulmonar No recomendado Tumores de la familia del sarcoma de Ewing 1 nódulo> 1 cm2 o más> 5 mm Evidencia cuestionable de metástasis pulmonar:• 1 Nódulo de 5 mm-1 cm• Varios nódulos 3-5 mm Recomendado si evidencia cuestionable de metástasisConsiderar biopsia: Si hay duda de alguna metástasis pulmonar o de nódulos pequeños que no se clasifican dentro de evidencia cuestionable de la enfermedad Hepatoblastoma 1 nódulo no calcificado ≥ 1 cm2 o más nódulos ≥ 5 mm Evidencia cuestionable de metástasis pulmonar:• 1 nódulo redondeado> 5 mm No recomendado para la estadificación Rabdomiosarcoma 1 nódulo ≥ 1 cm2 o más nódulos> 5 mm 1 único nódulo<5 mm se considera evidencia cuestionable de metástasis solo si el radiólogo está razonablemente confiado en considerarlo una metástasis No se recomienda Tumor de Wilms 1 o más nódulos ≥ 3 mm Nódulos pulmonares de 1 o 2 mm no se clasifican como metástasis pulmonar, se tratará como enfermedad localizada No recomendado para la estadificación - •
El manejo radiológico que se debe realizar para el diagnóstico inicial y el seguimiento durante y después del tratamiento.
Al no estar nuestro centro oficialmente incluido en los ensayos clínicos del osteosarcoma8 y tumores de la familia del sarcoma de Ewing9, en estas dos neoplasias utilizamos las recomendaciones de la SEHOP (Sociedad Española de Hematología y Oncología Pediátrica) y la SIOP (Sociedad Internacional de Oncología Pediátrica). En el resto de los tumores se revisaron los siguientes protocolos y ensayos clínicos:
- •
Hepatoblastoma: PHITT. Versión 1.0b. 201710.
- •
Tumor de Wilms: SIOP-RTSG 2016. Versión 1.211.
- •
Rabdomiosarcoma: RMS 2005. Versión 2.03.
Estos protocolos fueron revisados junto con el departamento de oncología pediátrica para adaptarlos a la práctica clínica de un hospital terciario.
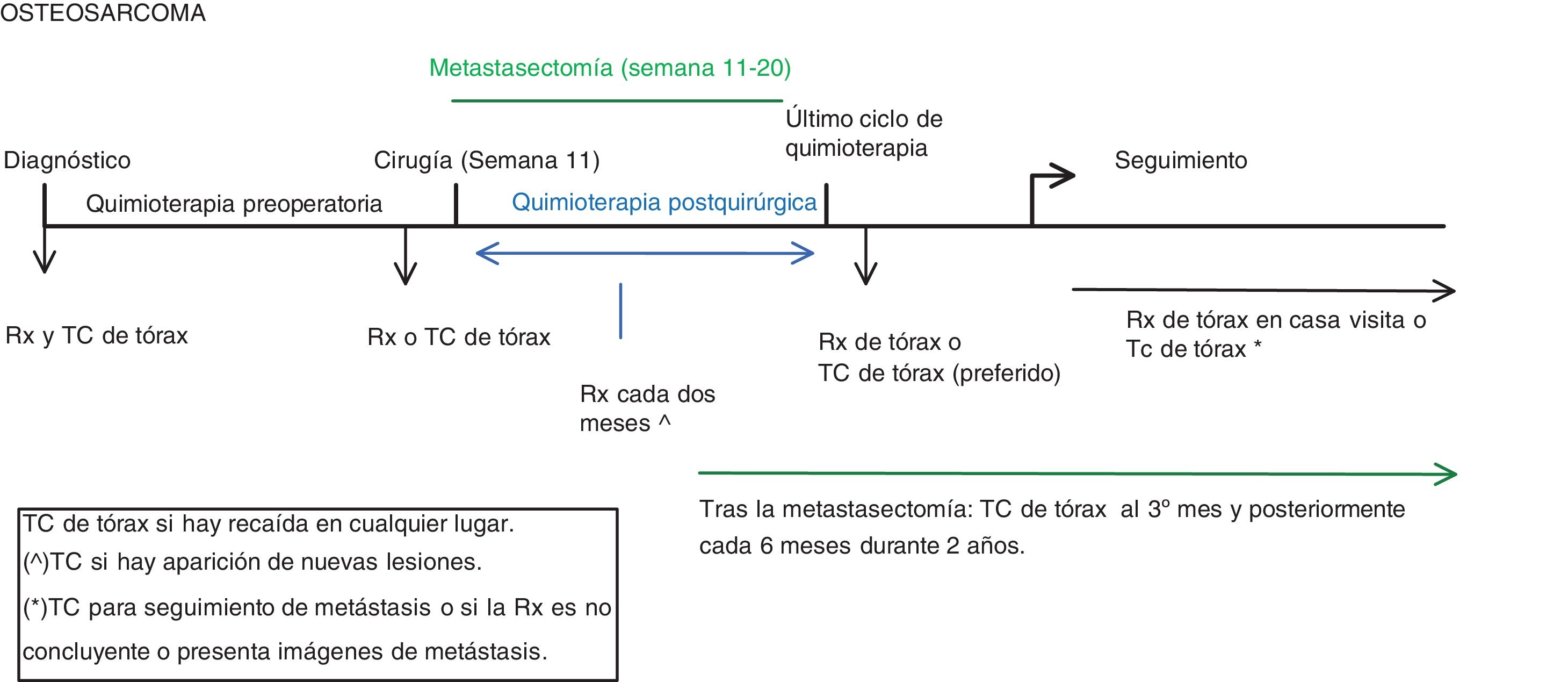
OsteosarcomaA continuación, mostramos una adaptación del protocolo EURAMOS-1, versión 3.0 de 20118 junto a la práctica clínica y a las guías de la SEHOP/SIOP.
Las pruebas diagnósticas torácicas que se realizan son la TC de tórax y la radiografía simple de tórax durante el diagnóstico, tratamiento y seguimiento (fig. 1)8:
- •
Al diagnóstico: radiografía de tórax y TC de tórax. Se realiza la radiografía de tórax para poder comparar con las futuras radiografías que se hacen durante el seguimiento.
- •
Antes de la cirugía: radiografía o TC de tórax. En nuestro centro se realiza radiografía de tórax excepto si hubiera metástasis pulmonar conocida o hallazgos de la TC al diagnóstico que requiriesen control con TC.
- •
Durante la quimioterapia posquirúrgica: radiografía de tórax cada 2 meses.
- •
Tras el último ciclo de quimioterapia: se prefiere realizar TC torácica.
- •
En seguimiento: radiografía o TC:
- –
La radiografía de tórax se realiza en cada visita clínica, que suele ser:
- •
1.er y 2.° año: cada 6 semanas-3 meses.
- •
3.er y 4.° año: cada 2-4 meses.
- •
5.°-10.° año: cada 6 meses.
- •
>10 años: cada 6-12 meses.
- –
La realización de TC depende de la situación clínica; es necesaria si la radiografía es no concluyente o aparece alguna lesión nueva. También se realiza en pacientes a los que se quiere realizar seguimiento de alguna lesión por TC, generalmente alternando radiografía y TC en cada revisión.
Los criterios de certeza de metástasis pulmonar en TC son (tabla 1):
- •
1 nódulo> 1 cm.
- •
3 o más nódulos> 5 mm.
Si no se cumplen los criterios (1 nódulo de menos de 1 cm o varios nódulos menores de 5 mm) se caracterizan como posible enfermedad metastásica.
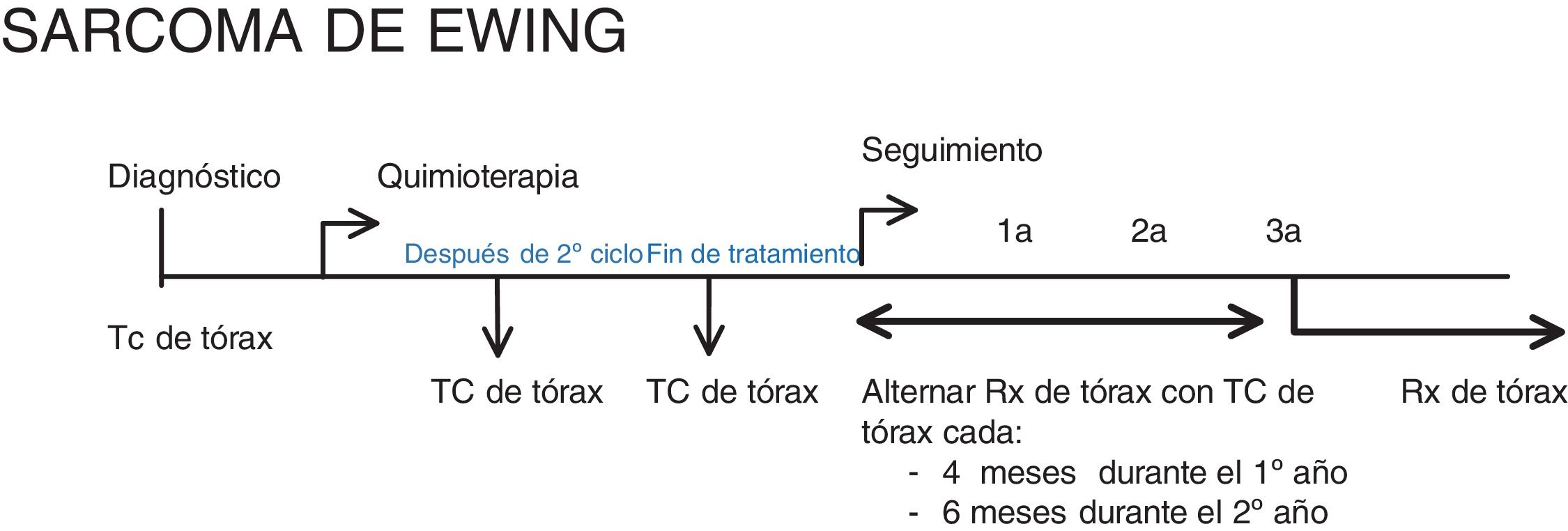
Tumores de la familia del sarcoma de EwingA continuación, mostramos una adaptación al protocolo del EURO EWING 20129, según la práctica clínica y las guías SEHOP/SIOP. En nuestro centro solo se utiliza el tratamiento estándar (rama A), por lo que mostramos el seguimiento tras ese manejo terapéutico, modificado para un control más estrecho.
Las pruebas de imagen de tórax a realizar son (fig. 2):
- •
Al diagnóstico: TC de tórax.
- •
Tras el segundo ciclo de quimioterapia: TC de tórax.
- •
Al final del tratamiento: TC de tórax.
- •
Para el seguimiento: en nuestro centro se realiza radiografía de tórax alternando con TC de tórax cada 4 meses durante el primer año, cada 6 meses en el segundo y únicamente radiografía desde el tercer año de seguimiento.
Los criterios para considerar que un nódulo pulmonar es una metástasis se dividen en (tabla 1):
- •
Evidencia de metástasis pulmonares: un nódulo mayor de 1 cm o más de un nódulo de más de 5 mm.
- •
Evidencia cuestionable de metástasis pulmonar: un nódulo de 5-9 mm o más de un nódulo de 3-5 mm. En estos casos se recomienda la biopsia.
- •
No clara evidencia de metástasis pulmonar: un nódulo de menos de 5 mm o más de un nódulo de menos de 3 mm. Estos nódulos deberían de valorarse de manera individualizada.
En pacientes con tumor primario localizado en la pared torácica, el derrame pleural con o sin nódulos pleurales se considera enfermedad locorregional9.
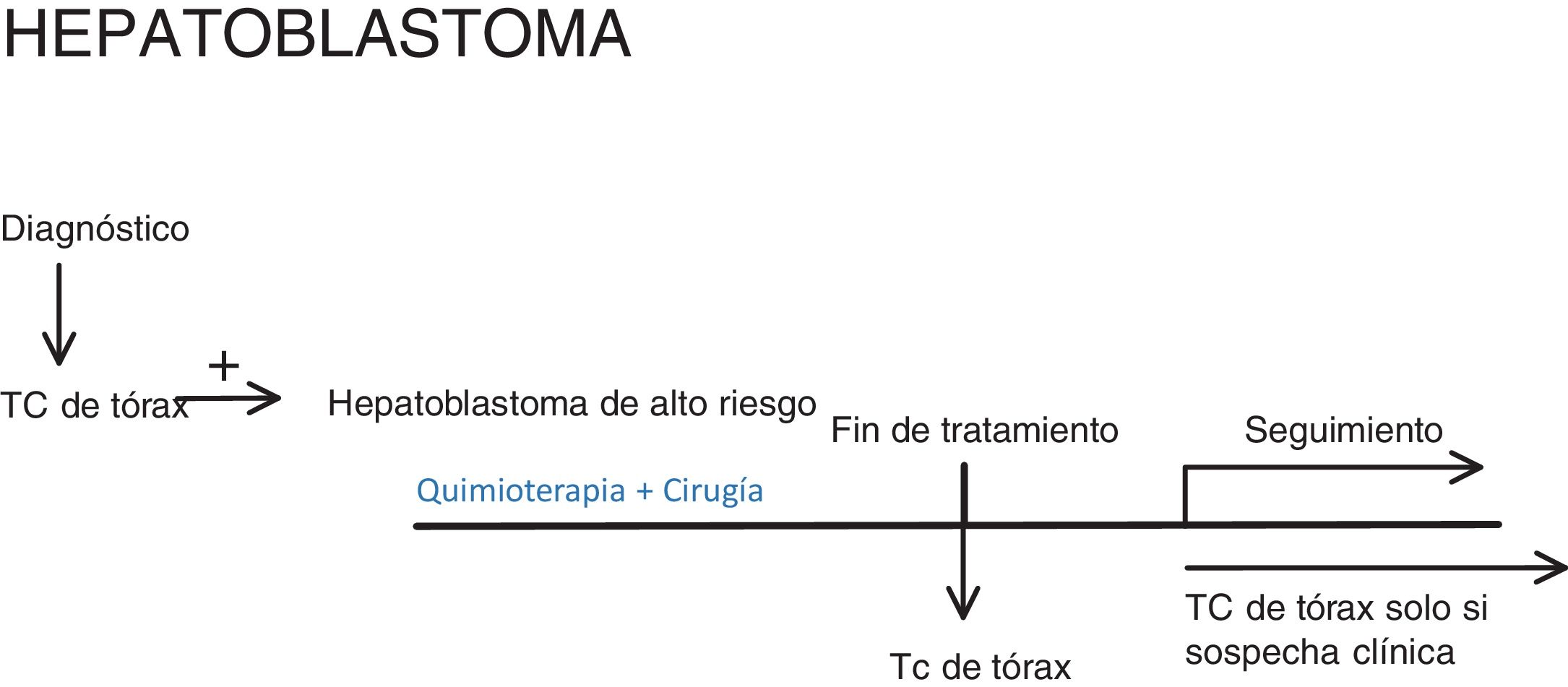
HepatoblastomaA continuación, mostramos el protocolo PHITT de 2017, versión 1.0b10.
Las pruebas de imagen torácicas que se deberían realizar son (fig. 3):
- •
Al diagnóstico: TC de tórax, para estratificar el riesgo del paciente.
- •
Al final del tratamiento: TC de tórax en pacientes con alto riesgo metastásico (tabla 2).
Tabla 2.Criterios de alto riesgo y muy alto riesgo metastásico en pacientes con hepatoblastoma
PRETEXTa Alto riesgo Muy alto riesgo Estadio I Edad <8 años y VPERFb Edad> 8 años y VPERFb Estadio II Edad 3 a 7 años y/o VPERFb AFPc <100 ng/ml y edad ≥ 8 años Estadio III Edad 3 a 7 años y/o VPERFb y/o AFPc 100-1000 ng/ml AFPc <100 ng/ml y edad ≥ 8 años Estadio IV AFPc> 100 ng/ml AFPc <100 ng/ml y edad ≥ 8 años Cualquier M M+ - •
Durante el seguimiento: TC de tórax solo a los M+(los pacientes que ya tenían metástasis al diagnóstico o las desarrollan a lo largo de la enfermedad).
Las características definitorias de metástasis pulmonar no han sido estudiadas específicamente, pero para calificarse de metástasis pulmonar debería ser (tabla 1):
- •
Un nódulo no calcificado ≥ 1 cm.
- •
Dos o más nódulos ≥ 5 mm.
- •
Cualquier nódulo confirmado por biopsia o metastasectomía.
La biopsia no es necesaria para la estadificación, dada la baja probabilidad de que otras lesiones imiten a la metástasis en este contexto clínico10.
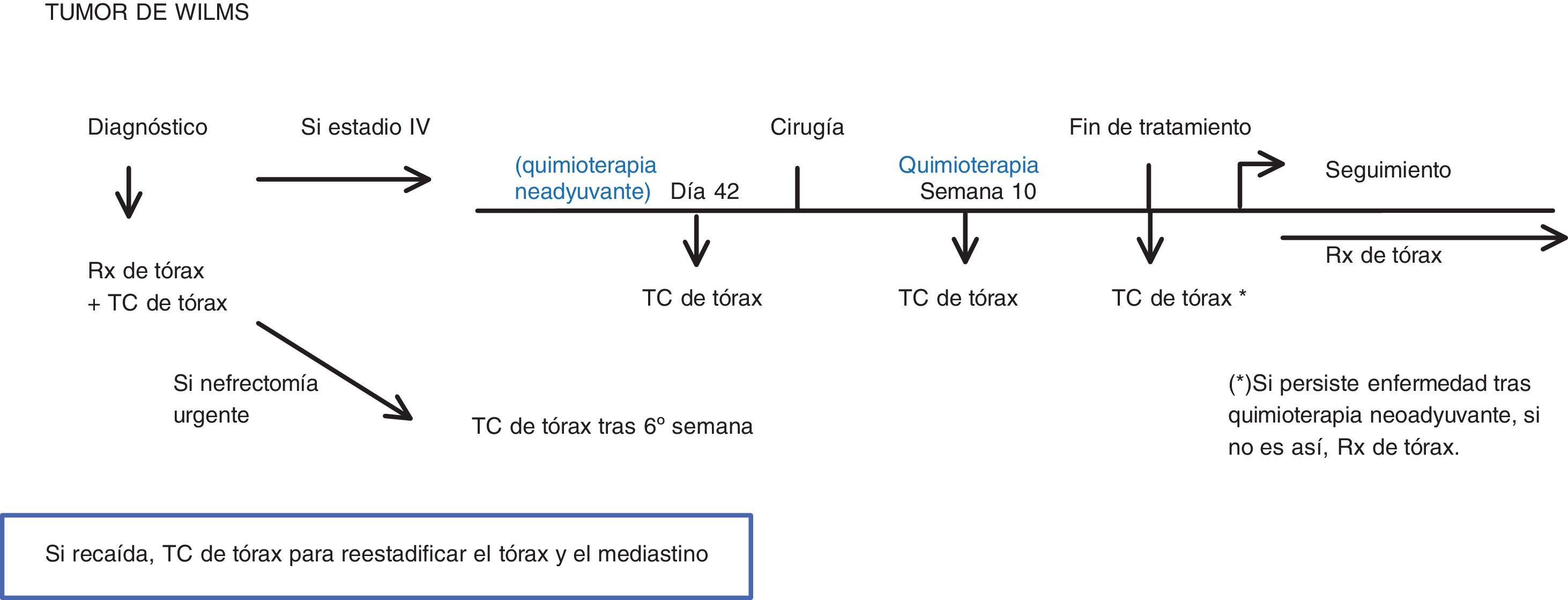
Tumor de WilmsA continuación, mostramos el protocolo SIOP-RTSG de 2016, versión 1.211. En nuestro centro se emplea el protocolo europeo de tratamiento (quimioterapia neoadyuvante y cirugía posterior).
La TC de tórax se debería realizar (fig. 4):
- •
Al diagnóstico.
- •
Si se encuentran metástasis (estadio IV), realizar TC:
- –
Previo a la cirugía.
- –
En la 10.ª semana de tratamiento quimioterápico.
- –
Al finalizar el tratamiento quimioterápico: solo si hay enfermedad residual. En caso contrario con una radiografía simple de tórax sería suficiente.
- •
Cuando hay sospecha de recurrencia.
- •
Si se tuvo que realizar una nefrectomía urgente sin evidencia de metástasis: TC de tórax a las 6 semanas después de la cirugía11.
La prueba de imagen durante el seguimiento es la radiografía de tórax, siguiendo el protocolo europeo.
El criterio de metástasis pulmonar es un nódulo no calcificado, de márgenes bien definidos, mayor de 3 mm. Cualquier nódulo pulmonar, no importa el tamaño, debería de informarse11 (tabla 1).
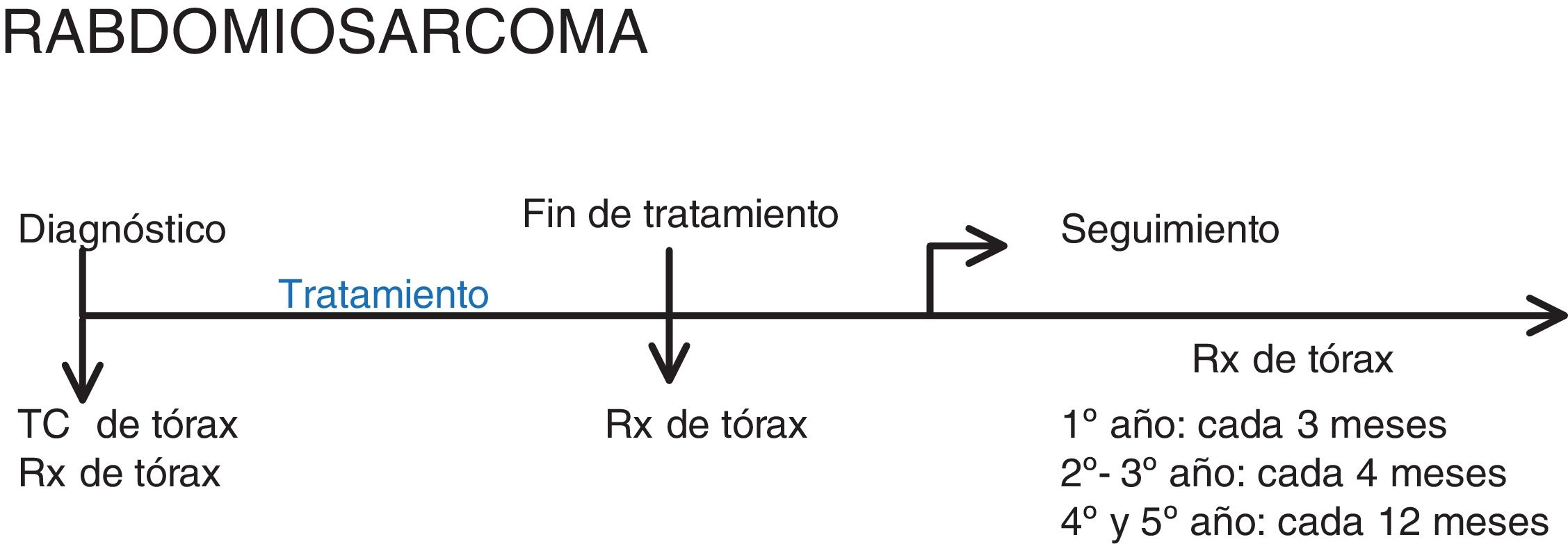
RabdomiosarcomaA continuación, mostramos el protocolo RMS de 2005, versión 2.03.
Se debería de realizar prueba de imagen torácica (fig. 5):
- •
Al diagnóstico: radiografía y TC de tórax. Al igual que en el osteosarcoma, se realizan ambos ya que el seguimiento es con radiografía de tórax, para poder comparar.
- •
Después de tratamiento: radiografía de tórax.
- •
Seguimiento: radiografía de tórax.
Cuando el tumor proviene del abdomen o de los miembros, es necesario realizar el estudio con contraste intravenoso, mientras que si proviene de otras localizaciones solo se recomienda.
Aunque no hay criterios 100% específicos de metástasis pulmonar, se considera (tabla 1)3:
- •
Evidencia clara de metástasis: un nódulo de 1cm o más o varios nódulos de más de 5 mm.
- •
Evidencia cuestionable de metástasis: nódulos menores de 5 mm solo si el radiólogo está razonablemente confiado en considerarlas metástasis. La biopsia en estos casos no se recomienda, ya que se considerarían micrometástasis, que ya están probablemente presentes en todos los rabdomiosarcomas locales.
Las metástasis pulmonares en un paciente pediátrico oncológico no son una forma infrecuente de diseminación tumoral. Los criterios de metástasis y los protocolos de seguimiento dependen del tipo de tumor. Para aclarar los pasos a seguir en el curso de los tumores pediátricos más comunes que metastatizan a los pulmones, hemos desarrollado algunos algoritmos basados en las diferentes situaciones clínicas y los protocolos utilizados en nuestro hospital.
Autoría- 1.
Responsable de la integridad del estudio:
- 2.
Concepción del estudio: CGH.
- 3.
Diseño del estudio: CGH.
- 4.
Obtención de los datos: MCCC, JAS.
- 5.
Análisis e interpretación de los datos: MCCC, JAS.
- 6.
Tratamiento estadístico:
- 7.
Búsqueda bibliográfica:
- 8.
Redacción del trabajo: MRP.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: CGH, MRP, VPA.
- 10.
Aprobación de la versión final: CGH.
Los autores declaran no tener ningún conflicto de intereses.
Responsabilidades éticasNone