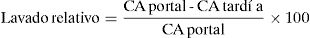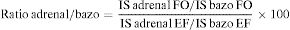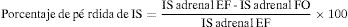La creciente demanda de pruebas radiológicas y el envejecimiento progresivo de la población ha llevado al aumento progresivo en la detección de lesiones suprarrenales indeterminadas. Una vez detectado el incidentaloma suprarrenal, disponemos actualmente de pruebas clínicas y hormonales y de una batería de técnicas de imagen (TC, RM, PET/TC…) que hacen posible el diagnóstico etiológico de la mayoría de estos incidentalomas. En este artículo presentamos las ventajas y limitaciones de cada técnica, las características por imagen de las lesiones suprarrenales más frecuentes y proponemos un algoritmo diagnóstico que permita el diagnóstico de las mismas.
The growing demand for imaging tests and the progressive aging of the population have led to a progressive increase in the detection of indeterminate adrenal lesions. Once an adrenal incidentaloma is detected, clinical and hormone tests together with a battery of imaging techniques (CT, MRI, PET/CT…) make it possible to determine the cause in most cases. In this article, we discuss the advantages and limitations of each technique. We show the imaging characteristics of the most common adrenal lesions and propose a diagnostic algorithm to enable their diagnosis.
Los incidentalomas adrenales son masas suprarrenales clínicamente silentes descubiertas durante el estudio, tratamiento o seguimiento de otras condiciones clínicas. La definición excluye a los pacientes sometidos a pruebas de imagen como parte de la estadificación o seguimiento de un cáncer1,2.
La prevalencia media de incidentalomas suprarrenales en las series de autopsias es de aproximadamente el 2,3%, sin diferencias significativas entre hombres y mujeres, y con valores más elevados en la población mayor3. En el contexto actual de creciente demanda y realización de pruebas diagnósticas de alta resolución, se observa un aumento significativo en la detección de estas lesiones. En la actualidad se identifican lesiones suprarrenales en un 4-5% de las tomografías computarizadas (TC) realizadas por otros motivos3–7.
De todas las lesiones incidentales, el 70% corresponden a adenomas no funcionantes, un 5-16% a adenomas funcionantes, un 6% a feocromocitomas, un 5% a carcinomas adrenocorticales, un 2% a metástasis, y el resto, a otros tipos de lesiones (mielolipomas, hematomas, quistes o linfoma)3,8,9.
Ante un incidentaloma suprarrenal detectado por pruebas de imagen, resulta clave determinar si la lesión es hormonalmente funcionante o no funcionante, y si es benigna o maligna. Los resultados serán determinantes en la decisión de resecar la lesión o realizar un manejo conservador.
Aunque la gran mayoría de los incidentalomas adrenales son no funcionantes, un número apreciable de estos pacientes presentan una forma subclínica de disfunción hormonal y suelen representar una población con alto riesgo de alteraciones metabólicas y enfermedades cardiovasculares. Por ello, ante la aparición de un incidentaloma suprarrenal son necesarias una historia clínica completa incluyendo exploración física, valoración bioquímica hormonal, y en ocasiones, estudios radiológicos adicionales. Todos los pacientes deben ser sometidos a pruebas de despistaje para feocromocitoma, hipercortisolismo e hiperaldosteronismo primario si presentan hipertensión arterial, excepto aquellos cuyas lesiones muestren características inequívocas de mielolipoma, hemorragia o quiste adrenal1,10,11.
El radiólogo dispone de una batería de técnicas de imagen para caracterizar los incidentalomas suprarrenales, desde la TC y la resonancia magnética (RM), que permiten diagnosticar la mayoría de las lesiones adrenales, hasta otras pruebas más sofisticadas como la tomografía por emisión de positrones/tomografía computarizada (PET/TC) y la espectroscopia-RM, esta última en fase experimental. Sin embargo, un pequeño porcentaje de las lesiones adrenales persisten indeterminadas, planteando un reto diagnóstico y terapéutico, dado que no hay consenso en la literatura sobre cuándo debe indicarse una punción aspirativa con aguja fina (PAAF), cirugía o el seguimiento (clínico, bioquímico y radiológico).
El objetivo de este artículo consiste en exponer las ventajas y limitaciones de las diferentes técnicas de imagen para la caracterización de los incidentalomas y proponer un algoritmo diagnóstico que incluya aspectos clínicos, bioquímicos y sobre todo, de imagen.Aunque la definición de incidentaloma excluye las masas adrenales encontradas durante el estudio de extensión o el seguimiento de una neoplasia1,2, hemos incluido información sobre el diagnóstico y manejo de las lesiones adrenales en el contexto de pacientes oncológicos, dado que aproximadamente el 50% de ellas son metástasis12 y que su caracterización es importante para la estadificación no invasiva del tumor, el planteamiento de la conducta terapéutica y la determinación del pronóstico8.
Pruebas de imagenTomografía computarizadaMediante la TC, un tamaño mayor de 6cm, crecimiento rápido, bordes irregulares o nodulares y densidad heterogénea son parámetros que pueden sugerir la naturaleza maligna de un incidentaloma suprarrenal, aunque estas características son poco específicas13,14. No obstante, la medición de los valores de atenuación en la TC sin contraste, análisis del histograma y los valores de lavado del contraste (washout en inglés) permiten la caracterización de las lesiones adrenales en un alto porcentaje de los casos6,15,16.
La técnica adecuada para la valoración de un nódulo suprarrenal requiere un estudio sin contraste endovenoso (EV) (estudio basal) en todos los casos y, si es necesario, estudio después de la administración de contraste endovenoso (fase portal a los 60 segundos y fase tardía a los 15 minutos). Se requieren cortes finos (2-3mm) y medidas de densidad mediante regiones de interés, que abarquen una porción significativa del área de la lesión (1/2 a 2/3 de su área), evitando las áreas periféricas a fin de evitar artefactos por volumen parcial14,17.
La cuantificación del valor medio de atenuación de una lesión en el estudio basal es una tarea de fácil ejecución y altamente sensible para detectar la grasa intratumoral, lo que la convierte en el parámetro de mayor utilidad en la valoración inicial de las lesiones suprarrenales18,19.
Otra herramienta que puede ser útil en la caracterización de las lesiones suprarrenales es el análisis del histograma, una representación gráfica de un análisis individualizado de los valores de densidad de cada pixel en una determinada área, siendo más sensible para la detección de grasa, representada como pixeles con valores de atenuación negativos8,17,20,21.
Los parámetros más utilizados en la TC con contraste son:
Lavado absoluto: consiste en la cuantificación del lavado en fase tardía respecto a la captación de la fase portal.
*CA=coeficiente de atenuación (UH)
Lavado relativo: consiste en el cálculo aproximado del lavado absoluto en los casos en los cuales se identifica una lesión suprarrenal en una TC con contraste (fase portal y tardía) sin haber adquirido imágenes en condiciones basales.
Los cálculos de lavado no tienen utilidad en la caracterización de masas con focos de baja atenuación no homogénea (necrosis o áreas quísticas).
La reciente aparición de la tecnología de TC de doble energía permite, mediante un algoritmo de postprocesado, suprimir el contraste yodado de las imágenes en estudios abdominales adquiridos tras la administración de contraste, simulando un estudio sin contraste en el que se puede estimar los valores de atenuación basales de una lesión suprarrenal22.
Resonancia magnéticaPor RM, la piedra angular para la caracterización de las lesiones adrenales sólidas es la técnica del desplazamiento químico (Chemical shift en inglés), basada en la adquisición de imágenes con eco de gradiente ponderadas en T1 en fase y fase opuesta, que permite detectar la presencia de lípidos intracitoplasmáticos23–26. Los protones de las moléculas de lípidos y agua tienen diferentes frecuencias de resonancia. En las secuencias en fase opuesta la señal de los lípidos se opone a la del agua, condicionando una caída de señal en los vóxeles que contienen los dos elementos, lo que se correlaciona microscópicamente con la presencia de lípidos intracelulares27.
El fenómeno del desplazamiento químico se puede valorar cualitativamente, comparándose visualmente la intensidad de la lesión adrenal con respecto a la intensidad esplénica; o cuantitativamente, a través de una de las siguientes fórmulas28,29:
*IS=intensidad de señal; EF = En fase; FO = Fase opuesta
Además, los protocolos pueden incluir secuencias potenciadas en T1, T2 y T1 con saturación grasa antes y después de la administración de contraste, que aportan datos sobre la morfología y comportamiento de lesiones suprarrenales equiparables a la TC.
Los estudios dinámicos mediante RM consisten en administrar contrastes de gadolinio endovenoso y realizar secuencias rápidas consecutivas, con intervalos de tiempo variables según el protocolo de cada institución, de forma que se obtiene una curva que representa la variación absoluta o relativa de la señal de la lesión en un determinado espacio de tiempo30,31.
La espectrocopia-RM se ha mostrado potencialmente útil en el diagnóstico diferencial de las lesiones suprarrenales basándose en la relación de metabolitos, fundamentalmente para caracterizar los feocromocitomas32 y para diferenciar adenomas y feocromocitomas de carcinomas y metástasis33,34.
Hasta el momento, el análisis de difusión-RM no ha demostrado utilidad para diferenciar entre lesiones benignas y malignas31.
EcografíaLa ecografía no permite caracterizar la mayoría de incidentalomas suprarrenales. Recientemente se ha descrito que la administración de contraste ecográfico puede mejorar el rendimiento diagnóstico, pues las lesiones malignas suelen presentar hipervascularización más frecuentemente, lo que se traduce como un realce arterial precoz con lavado rápido35.
No obstante, la dificultad para visualizar las glándulas suprarrenales mediante esta técnica es un factor limitante para su empleo de forma sistemática.
Tomografía por emisión de positrones/tomografía computarizadaEl protocolo de los estudios PET/TC con 18F-fluorodesoxiglucosa (18F-FDG PET/TC) varía según las instituciones. Esta técnica tiene una alta sensibilidad para diferenciar entre lesiones adrenales benignas y malignas28,36. Su principal utilidad reside en la identificación de masas adrenales metastásicas en el estudio de pacientes oncológicos37.
La actividad metabólica se puede valorar mediante un análisis cualitativo, comparándose visualmente la captación de la lesión adrenal con respecto a la captación hepática o cuantitativamente, a través de la determinación de los SUVs (Standardized uptake values) medios y máximos y de los SURs (Standardized uptake ratios), obtenidos mediante la ratio adrenal/hígado.
Se está validando la utilidad del PET/TC con 11C-metomidato (METO) para la detección de tumores adrenales primarios no necróticos38, y de la 11C-hidroxiefedrina, y la 18F-dihidroxifenilalanina para la detección de feocromocitomas8.
La gammagrafía con MIBG, un radiotrazador que es captado selectivamente por las células cromafines, permite la localización de feocromocitomas en un porcentaje significativo de casos28,36.
Punción aspiración con aguja finaEn los algoritmos de manejo del incidentaloma suprarrenal, la PAAF está indicada en la caracterización de lesiones que crecen, ante hallazgos radiológicos equívocos en función del contexto clínico y cuando hay alta sospecha de metástasis27 (sobre todo en pacientes con neoplasia conocida), siempre que el diagnóstico definitivo pueda cambiar la conducta terapéutica.
Su utilidad principal consiste en diferenciar entre tejido adrenal y no adrenal (metástasis o infecciones). No obstante, la citología tiene escaso o nulo rendimiento diagnóstico para diferenciar adenomas de carcinomas adrenales. Se puede realizar guiada por TC, RM o ecografía y su exactitud diagnóstica varía del 83 al 93%, con una tasa de complicaciones de aproximadamente el 3% (las más frecuentes son el dolor, la hemorragia y el neumotórax)39,40. Antes de realizar una PAAF deben practicarse pruebas hormonales para descartar un feocromocitoma, ya que su punción podría desencadenar una crisis hipertensiva grave.
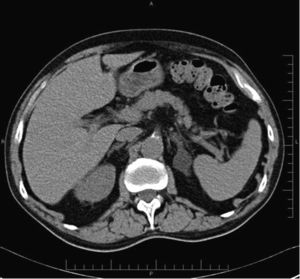
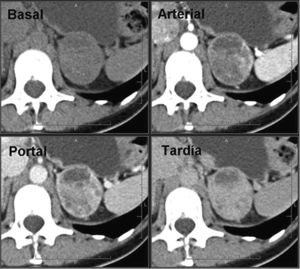
Lesiones suprarrenales incidentales más frecuentesAdenomasUno de los puntos clave en el diagnóstico de los adenomas es la presencia de una proporción variable de lípidos intracelulares, cuya detección permite establecer su diagnóstico con elevada confianza. Se ha establecido un límite máximo de 10 UH en la TC sin contraste para la caracterización de los adenomas (figs. 1 y 2), con una sensibilidad del 71% y una especificidad del 98%. Estos parámetros se aproximan al 100% si se añaden los criterios de tamaño, crecimiento y forma16,18,19.
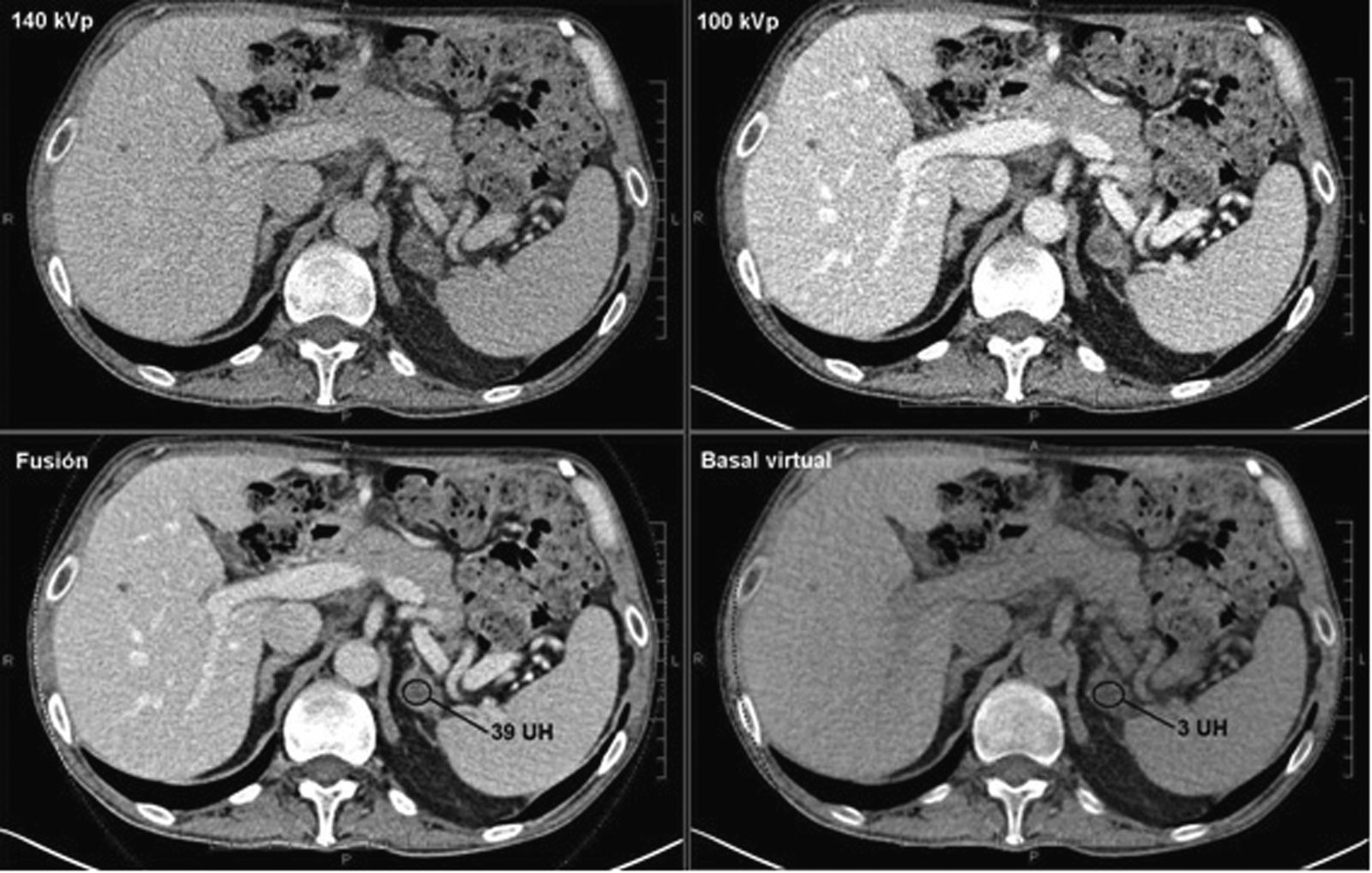
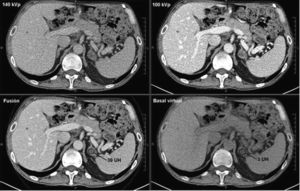
Adenoma suprarrenal. TC de abdomen adquirido con doble energía en paciente de 63 años diagnosticado de un carcinoma colorrectal, en el que no se realizó un estudio sin contraste, En estudio con contraste en fase portal (fusión 140 kVp+100 kVp) se identifica una lesión nodular en suprarrenal izquierda de 39 UH. La técnica de doble energía permitió realizar un estudio basal virtual, en el que la lesión de la suprarrenal tenía 3 UH, compatible con un adenoma.
Se supone que la mayoría de los adenomas, incluyendo aquellos pobres en lípidos, contienen suficientes lípidos intracitoplasmáticos para permitir su caracterización20. El análisis del histograma puede tener utilidad en la caracterización de los adenomas pobres en lípidos. En la TC sin contraste, el análisis del histograma con un punto de corte de 10% de pixeles negativos proporciona una especificidad del 100% y una sensibilidad del 46 al 91%17,20,21,41. Ante lesiones con valores de atenuación basal entre 10-20 UH, el hallazgo de más del 10% de los pixeles con valores de atenuación negativos tiene una sensibilidad del 92% para el diagnóstico de adenoma. Ante lesiones con valores de atenuación basal entre 20-30 UH y > 30 UH, la sensibilidad baja al 10 y al 0%, respectivamente21. La combinación de valores ≤ 10 UH o > 10% de pixeles negativos tiene una sensibilidad de hasta el 91% para la detección de los adenomas comparada a la del 68% cuando se utilizan solamente los valores de atenuación, manteniéndose una especificidad de 100%20.
Por lo tanto, el análisis del histograma en la TC sin contraste es una modalidad que aumenta la sensibilidad global para detectar adenomas, sobre todo en lesiones con valores de atenuación basal entre 10-20 UH.
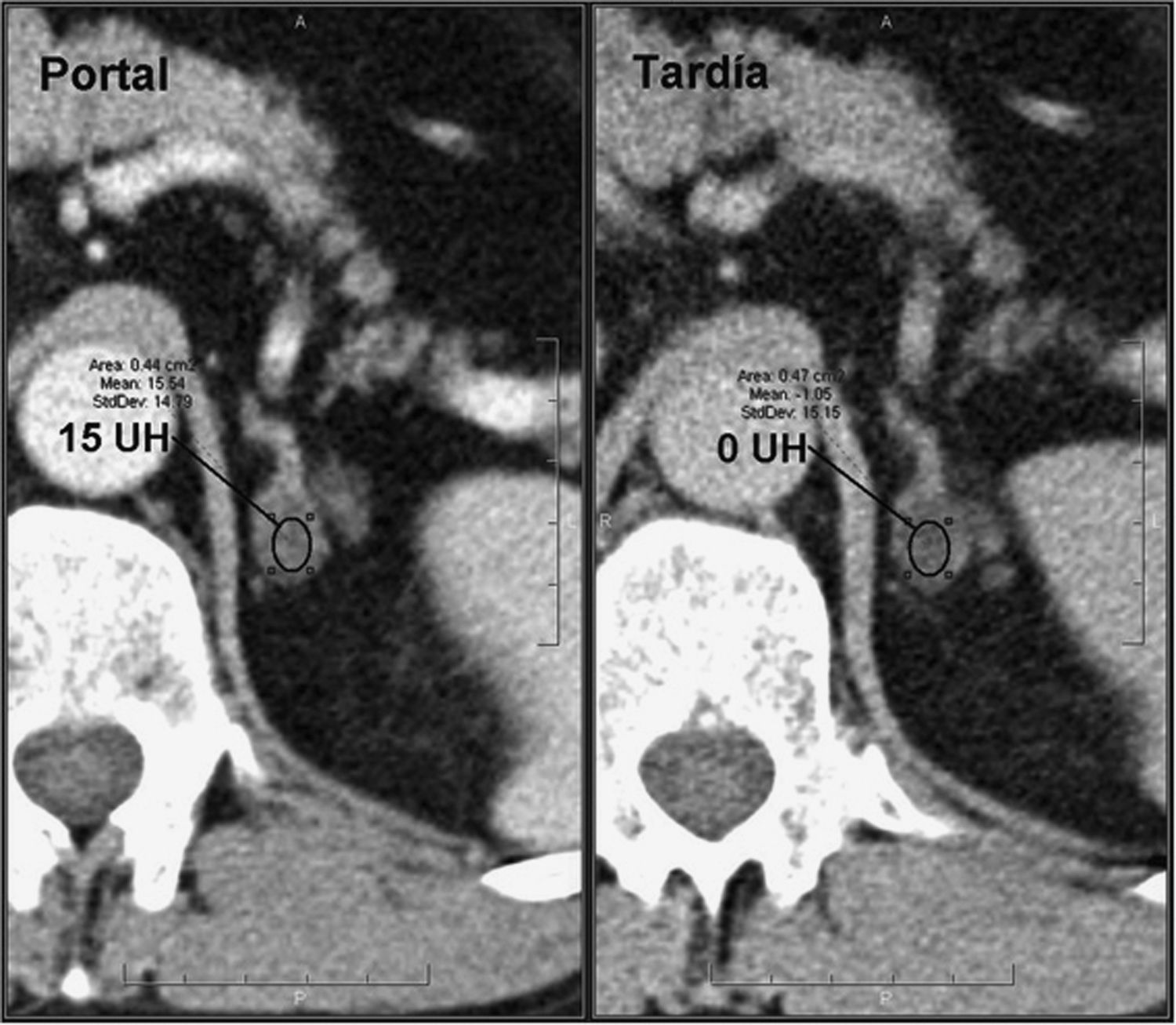
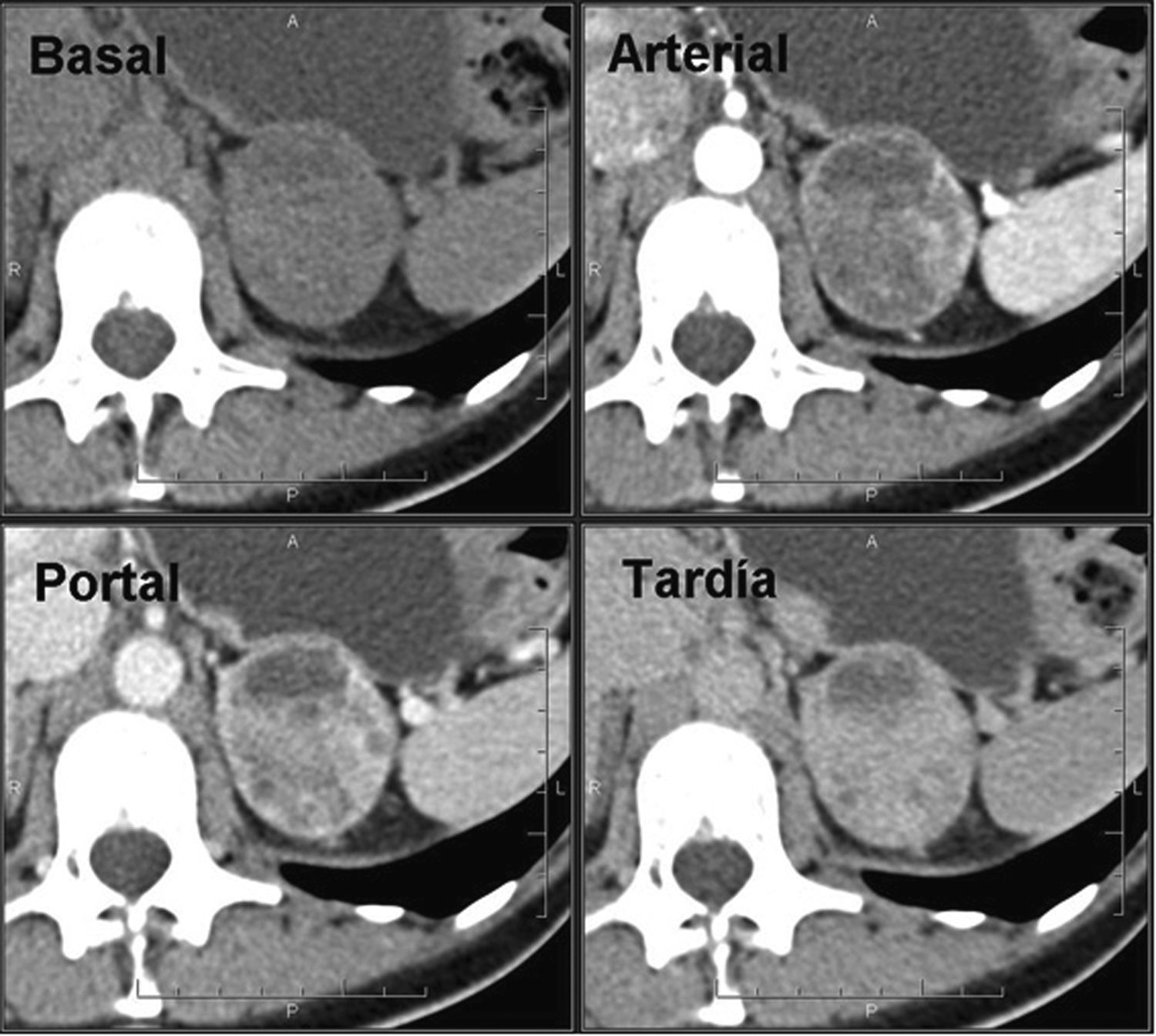
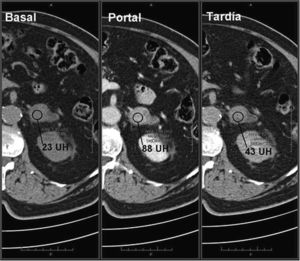
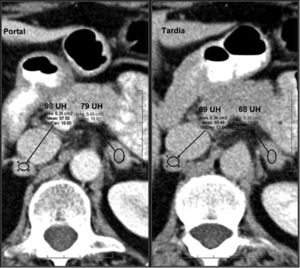
Un 70% de los adenomas son ricos en lípidos42–44 y un 30% pobres en grasa. Ambos tipos tienen un lavado del contraste más rápido que los tumores malignos, por lo que es de utilidad su cálculo6,15,16,42,43,45,46. Un lavado absoluto ≥ 60% (sensibilidad del 88% y especificidad del 96%) o relativo ≥ 40% (sensibilidad del 96% y especificidad del 100%) sugiere adenoma16,42,43,45–47 (figs. 3 y 4). Es importante resaltar que estos valores están establecidos para fases tardías realizadas a los 15 minutos de la administración del contraste. Park et al.48 analizaron los valores de lavado relativo del contraste a los tres minutos en lesiones suprarrenales y determinaron que valores > 25% eran diagnósticos para adenomas y valores ≤ 5% compatibles con lesiones no adenomatosas. Aquellas con valores comprendidos entre 5 y 25% eran inespecíficas. Sin embargo, el estudio presentaba algunas limitaciones metodológicas, por lo que se requieren estudios más amplios para validar estos resultados.
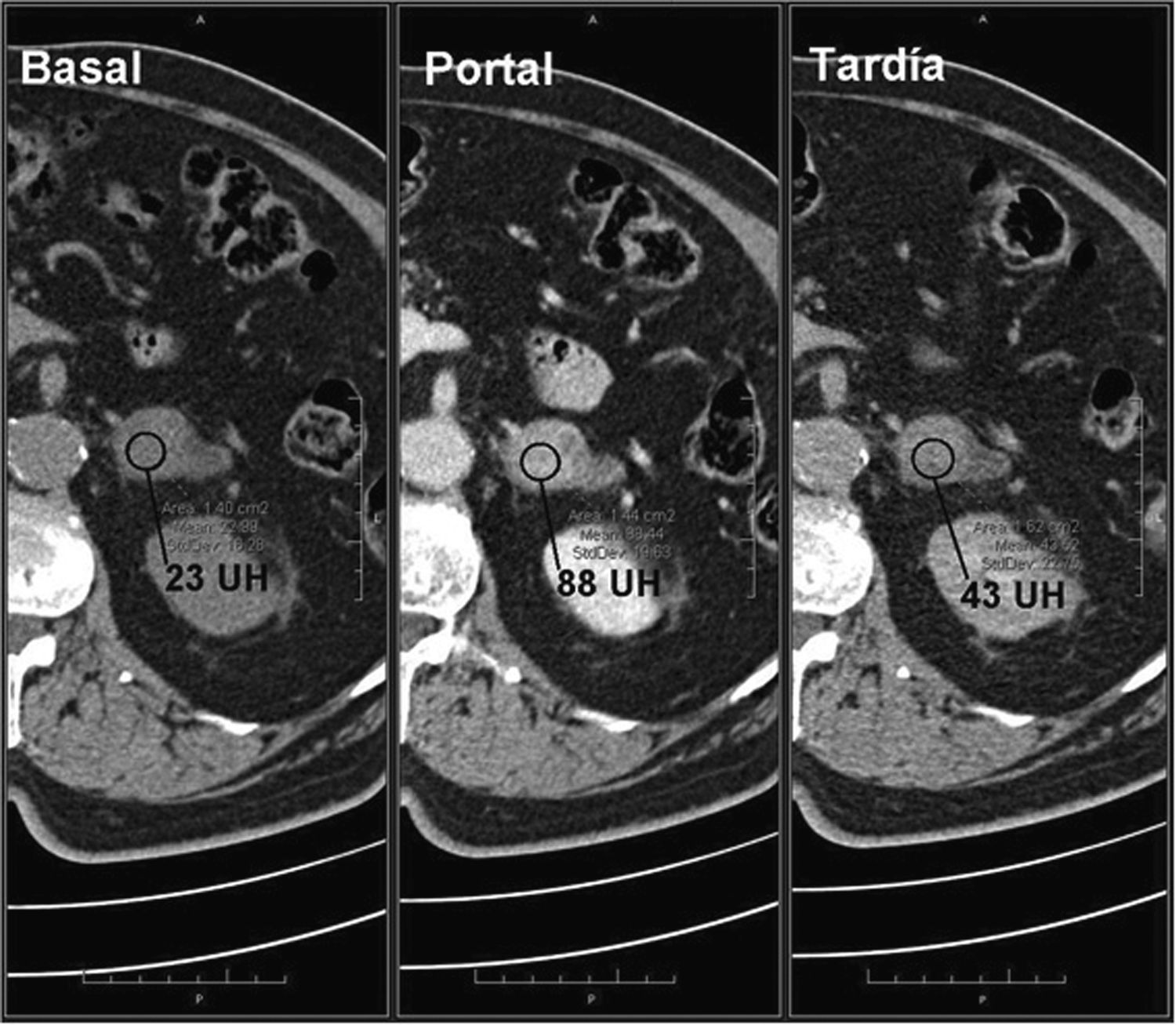
Adenoma suprarrenal. Paciente de 56 años en estudio por masa renal izquierda sometido a TC abdominal con contraste endovenoso en fases portal a los 60 segundos y tardía a los 15 minutos. Se observa una lesión nodular en la glándula suprarrenal izquierda. No se dispone de adquisición basal, por lo que no se puede realizar el cálculo del lavado del contraste absoluto. Sin embargo, se observa un lavado relativo del contraste de aproximadamente 96%, sugestivo de adenoma.
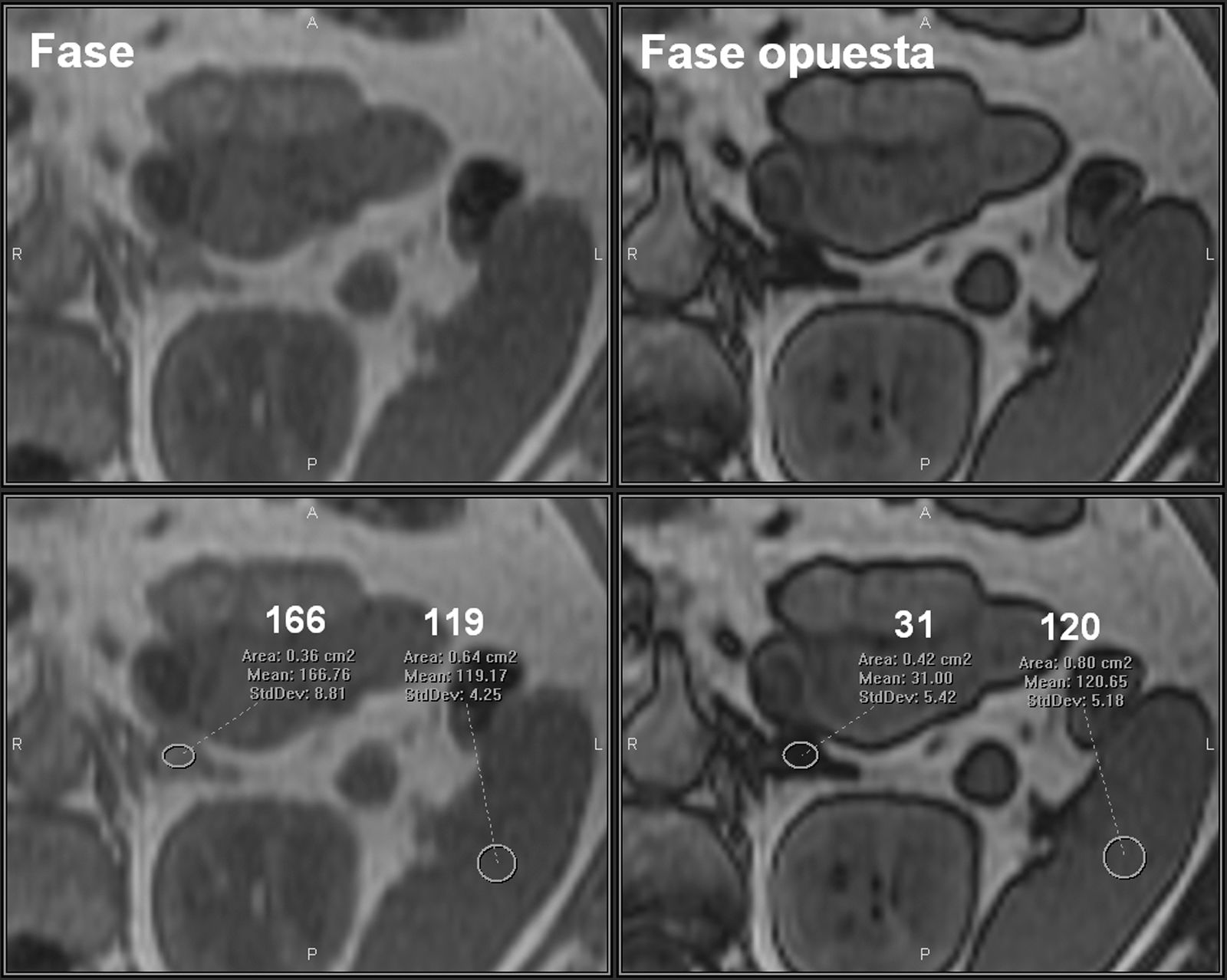
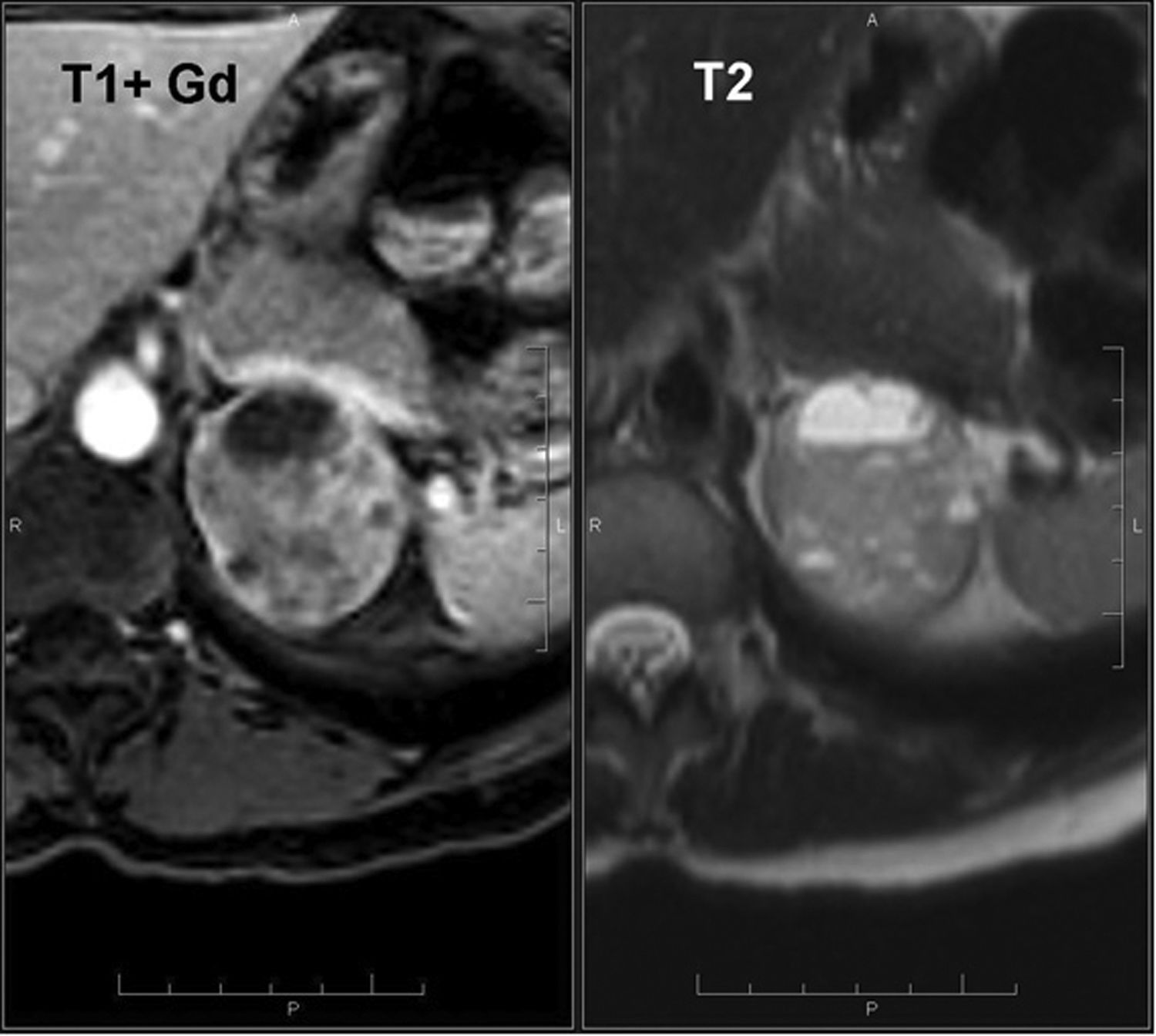
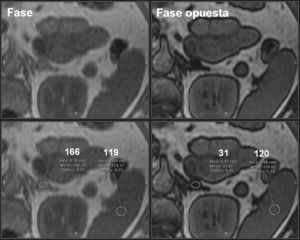
Por RM, en las secuencias eco de gradiente en fase y fase opuesta, la pérdida de señal en fase opuesta, denominada desplazamiento químico, indica la presencia de lípidos intracitoplasmáticos24–26, lo que permite la caracterización de los adenomas con una sensibilidad del 81 al 100% y una especificidad del 94 al 100%24,26,49. En términos cuantitativos, un ratio adrenal/bazo ≤ 70%50,51 o un porcentaje de pérdida de intensidad de señal > 16,5 es compatible con adenoma52. Sin embargo, el análisis visual del fenómeno del desplazamiento químico comparándose la intensidad de la lesión adrenal con la intensidad esplénica es un método más sencillo, y está descrita una efectividad equiparable a valoraciones cuantitativas28,29 (fig. 5).
Adenoma suprarrenal. Paciente de 52 años sometida a RM abdominal por hallazgo casual en TC de un nódulo suprarrenal izquierdo. En la secuencia eco de gradiente en fase opuesta, se observa una pérdida significativa de la señal del nódulo suprarrenal con respecto a la secuencia en fase, lo que sugiere fuertemente el diagnóstico de adenoma suprarrenal.
La técnica del desplazamiento químico no tiene utilidad en adenomas de > 30 UH de atenuación basal y es equiparable a la TC basal en los ≤ 10 UH23,25,50,52. En los de atenuación entre 10-30 UH, si bien su sensibilidad para adenomas es menor que el cálculo del lavado por TC, su uso estaría indicado porque presenta una mayor sensibilidad que la TC basal y evita la radiación derivada de las tres fases del TC con contraste.
Tras la administración de contrastes de gadolinio, los adenomas presentan un moderado realce con un rápido lavado, mientras que las lesiones malignas y feocromocitomas muestran un marcado realce con un lavado lento53. No existe consenso sobre la utilidad de la valoración cuantitativa de las curvas de captación de contraste30,53, aunque se han descrito diferencias significativas en el tiempo al pico de realce («time-to-peak» en inglés) entre los adenomas y lesiones malignas31.
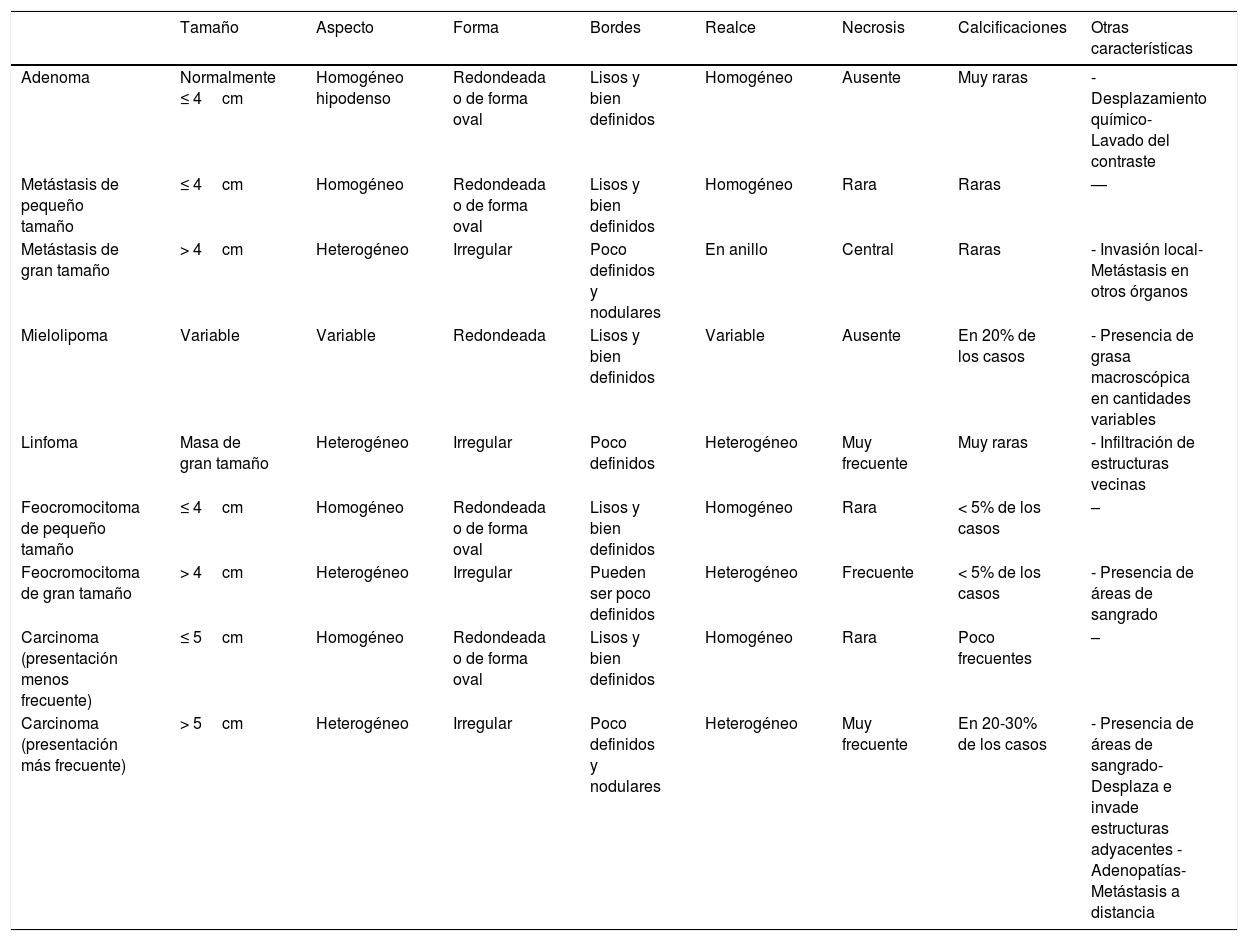
MetástasisLas metástasis adrenales de mayor tamaño se acompañan de datos que sugieren malignidad por TC y RM (tabla 1) mientras que cuando se trata de lesiones pequeñas, su aspecto es indiferenciable de los adenomas en muchos casos6,13,15.
Hallazgos por imagen de las lesiones suprarrenales más frecuentes
| Tamaño | Aspecto | Forma | Bordes | Realce | Necrosis | Calcificaciones | Otras características | |
|---|---|---|---|---|---|---|---|---|
| Adenoma | Normalmente ≤ 4cm | Homogéneo hipodenso | Redondeada o de forma oval | Lisos y bien definidos | Homogéneo | Ausente | Muy raras | - Desplazamiento químico- Lavado del contraste |
| Metástasis de pequeño tamaño | ≤ 4cm | Homogéneo | Redondeada o de forma oval | Lisos y bien definidos | Homogéneo | Rara | Raras | — |
| Metástasis de gran tamaño | > 4cm | Heterogéneo | Irregular | Poco definidos y nodulares | En anillo | Central | Raras | - Invasión local- Metástasis en otros órganos |
| Mielolipoma | Variable | Variable | Redondeada | Lisos y bien definidos | Variable | Ausente | En 20% de los casos | - Presencia de grasa macroscópica en cantidades variables |
| Linfoma | Masa de gran tamaño | Heterogéneo | Irregular | Poco definidos | Heterogéneo | Muy frecuente | Muy raras | - Infiltración de estructuras vecinas |
| Feocromocitoma de pequeño tamaño | ≤ 4cm | Homogéneo | Redondeada o de forma oval | Lisos y bien definidos | Homogéneo | Rara | < 5% de los casos | – |
| Feocromocitoma de gran tamaño | > 4cm | Heterogéneo | Irregular | Pueden ser poco definidos | Heterogéneo | Frecuente | < 5% de los casos | - Presencia de áreas de sangrado |
| Carcinoma (presentación menos frecuente) | ≤ 5cm | Homogéneo | Redondeada o de forma oval | Lisos y bien definidos | Homogéneo | Rara | Poco frecuentes | – |
| Carcinoma (presentación más frecuente) | > 5cm | Heterogéneo | Irregular | Poco definidos y nodulares | Heterogéneo | Muy frecuente | En 20-30% de los casos | - Presencia de áreas de sangrado- Desplaza e invade estructuras adyacentes - Adenopatías- Metástasis a distancia |
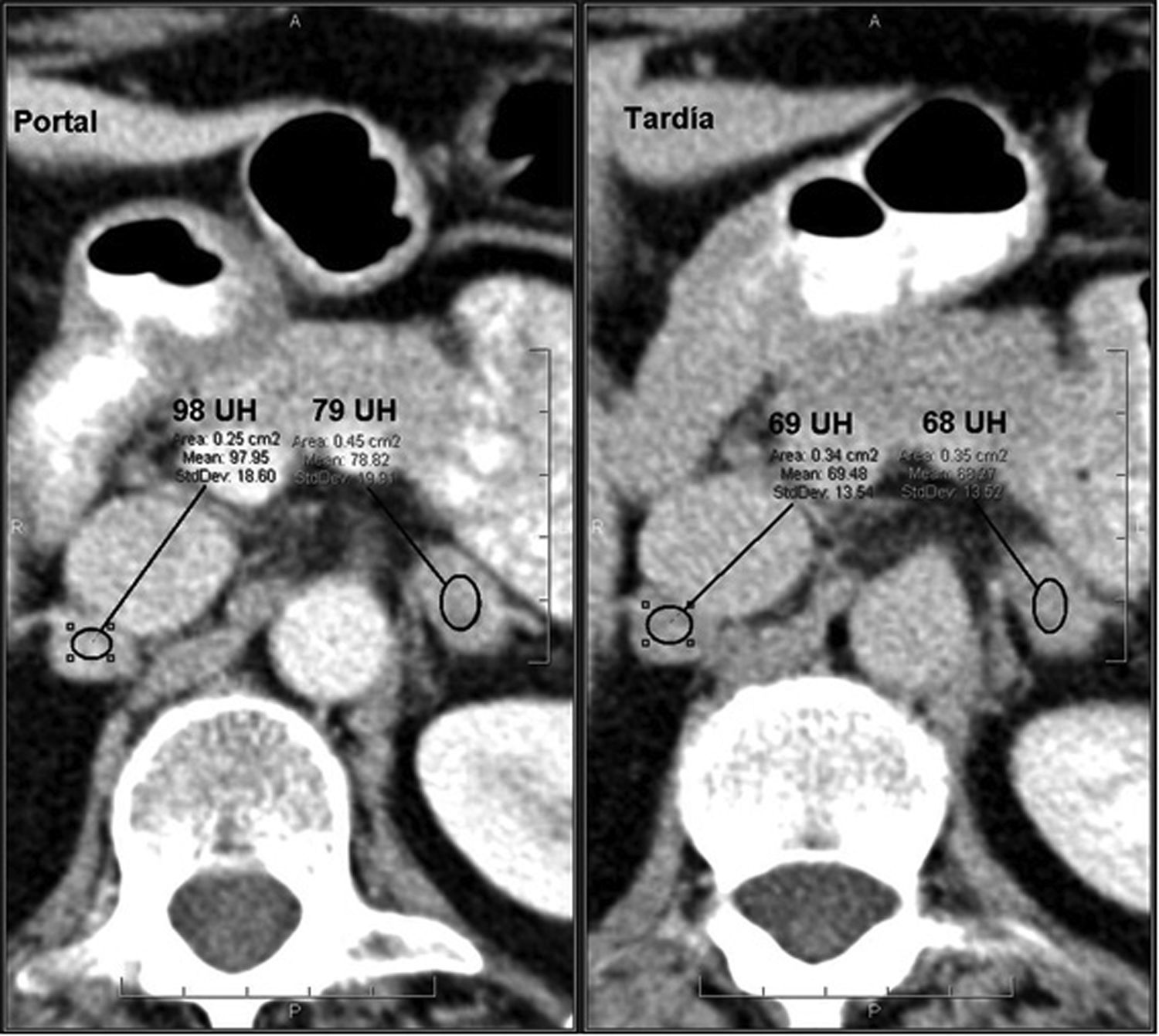
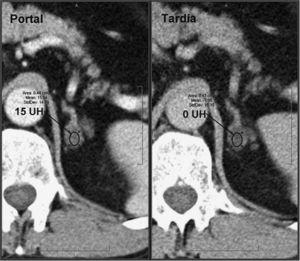
En los estudios de TC dinámicos con contraste, las metástasis presentan valores bajos de aclaramiento absoluto del contraste (< 0,6%) y relativo (< 0,4%) (fig. 6), y en los estudios de imagen de desplazamiento químico por RM no pierden señal en las secuencias en fase opuesta, hallazgos estos que se consideran inespecíficos.
Metástasis suprarrenal. Paciente con historia de carcinoma de mama sometida a TC con contraste endovenoso en fases portal a los 60 segundos y tardía a los 15 minutos. Se observan lesiones nodulares homogéneas, redondeadas/ovaladas, de contornos lisos y bien definidos localizadas en ambas glándulas suprarrenales. La lesiones presentan un aclaramiento relativo del contraste del 28% (derecha) y del 12% (izquierda), inespecíficos. En un estudio TC de control a los 4 meses, se observó un crecimiento de las lesiones, confirmando el diagnóstico de metástasis.
Un reciente metaanálisis37 ha demostrado que la PET/TC con 18F-FDG tiene una sensibilidad del 97% y una especificidad del 91% para diferenciar entre lesiones benignas y malignas, y que el análisis cualitativo (comparación visual entre la captación de la masa adrenal y la captación hepática) tiene mayor exactitud respecto a los análisis cuantitativos. El estudio sugiere que la PET/TC es una herramienta de gran exactitud para diferenciar entre patología adrenal maligna y benigna en lesiones de más de 1cm, sobre todo en el contexto de pacientes oncológicos, siendo por lo general innecesarios otros estudios de imagen en este subgrupo de pacientes.
Sin embargo, la PET/TC también presenta limitaciones: se ha descrito una tasa del 9% de falsos positivos37 debido a distintas causas benignas54,55, y una tasa del 3% de falsos negativos37 en el contexto de lesiones metastásicas hemorrágicas o necróticas, de pequeño tamaño (< 10mm) o en metástasis de tumores de bajo metabolismo (carcinoma bronquioloalveolar y tumores carcinoides)54. Además, es una exploración de elevado coste y escasa disponibilidad28,54.
El METO PET/TC, cuyo uso aún no está ampliamente difundido, permite distinguir tumores adrenocorticales (adenomas, carcinomas) de lesiones no adrenales (metástasis, feocromocitomas, linfomas), con una sensibilidad del 89% y especificidad del 96%38.
El crecimiento de una lesión adrenal en un período menor a 3-6 meses o la aparición de nuevas lesiones son hallazgos altamente sugestivos de malignidad.
Ante un incidentaloma adrenal en un paciente sin un tumor primario identificable y con hallazgos de imagen no concluyentes, la PAAF raramente está indicada dada la baja frecuencia de metástasis, el riesgo de complicaciones y una tasa significativa de falsos negativos, recomendándose normalmente el tratamiento quirúrgico o el seguimiento con TC según las características de la masa y otras características clínicas del paciente (edad, comorbilidades)1,10,28,56. En aquellas lesiones que crecen durante el seguimiento se puede realizar una PAAF antes de plantear la cirugía27.
La principal indicación de la PAAF es cuando haya alta sospecha de metástasis en el contexto de un tumor primario conocido, siempre que el diagnóstico definitivo pueda cambiar la conducta terapéutica27.
MielolipomasLos mielolipomas son tumores formados por cantidades variables de tejido adiposo maduro y elementos hematopoyéticos.
La clave diagnóstica por TC consiste en identificar grasa macroscópica (< -20UH), signo característico que hace innecesaria la realización de otras pruebas adicionales6,57,58 (fig. 7).
La PAAF raramente está indicada, y se reserva únicamente para casos dudosos en que debe diferenciarse de tumores malignos con grasa, básicamente el liposarcoma.
No se ha descrito la transformación maligna del mielolipoma, por lo que no requieren seguimiento ni tratamiento quirúrgico. Sin embargo, en el caso de los mielolipomas de gran tamaño (> 10cm) está justificada su extirpación por el riesgo de sangrado57.
LinfomaEl linfoma primario suprarrenal es extremadamente raro, existiendo aproximadamente 100 casos descritos en la literatura59. Su diagnóstico y tratamiento precoz afecta dramáticamente la supervivencia de los pacientes60.
La mayoría de los linfomas suprarrenales son bilaterales y el 50% se manifiestan clínicamente con insuficiencia adrenocortical.
Los hallazgos por TC y RM (tabla 1) no son suficientemente específicos para establecer un diagnóstico correcto. El linfoma primario de las suprarrenales presenta una elevada captación en el PET/TC con 18F-FDG, propio de su naturaleza maligna60. Debido a la escasa casuística, no hay consenso sobre la técnica a emplear para el diagnóstico definitivo (cirugía versus PAAF).
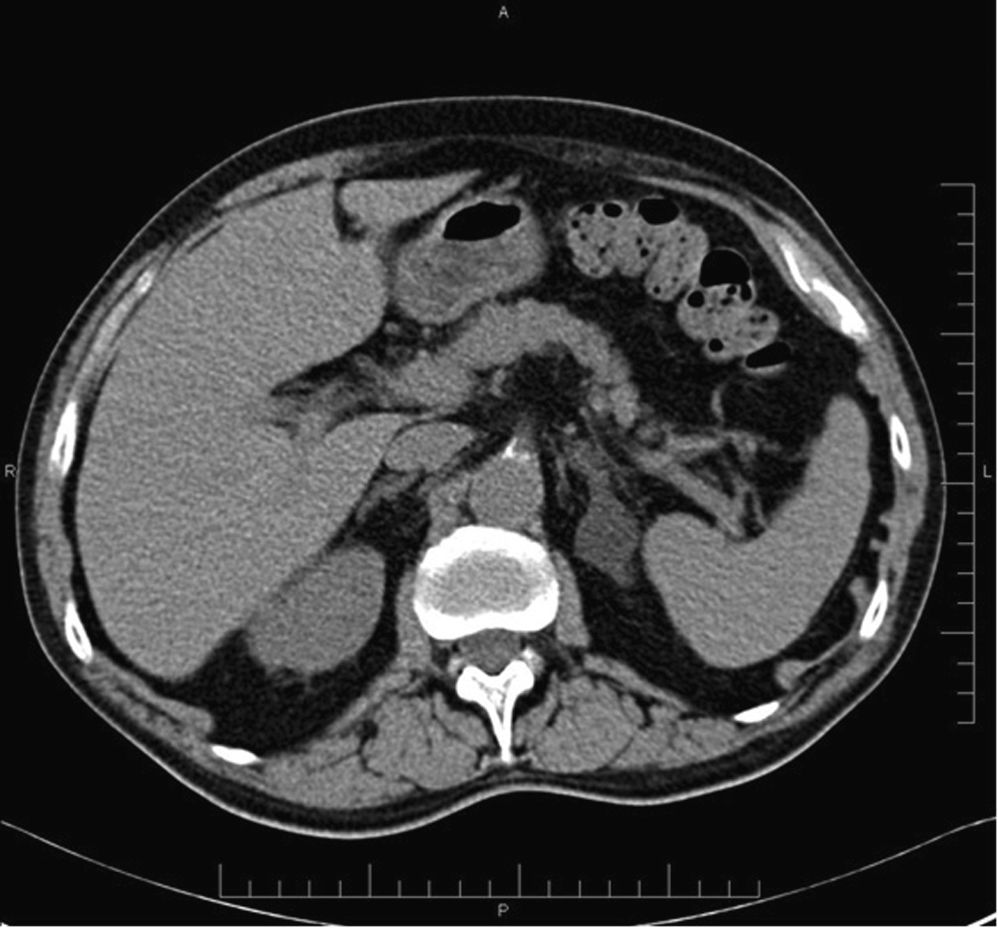
FeocromocitomaLos feocromocitomas de pequeño tamaño suelen presentarse en la TC como lesiones homogéneas ovaladas, bien delimitadas6,61. Los feocromocitomas de mayor tamaño (> 4-5cm) tienen mayor probabilidad de contener áreas de necrosis o hemorragia, ya que son tumores hipervasculares62 con un realce heterogéneo que los hacen indistinguibles de otras neoplasias suprarrenales, por lo que para el diagnóstico es necesaria la correlación bioquímica (fig. 8).
En general, los feocromocitomas no contienen grasa. Sin embargo, en un mínimo porcentaje de los casos, pueden tener suficiente contenido de lípidos intracelulares para presentar valores de atenuación < 10 UH, lo que los haría indistinguibles de adenomas44,62–64. Los valores de lavado absoluto del contraste son < 60% y relativo < 40% en el 84 a 89% de los casos43,45,64,65 y los coeficientes de atenuación en fase portal suelen ser más elevados que en los adenomas (hasta 110-120 UH), aunque existe solapamiento45.
Clásicamente se ha descrito que la administración de contraste yodado puede desencadenar una crisis hipertensiva en pacientes con feocromocitoma, si no se ha realizado un bloqueo de receptores alfa66. No obstante, Mukherjee67 sugiere que los contrastes yodados no iónicos de baja osmolaridad son seguros en los pacientes con feocromocitoma, aunque no estén alfa-bloqueados. En la práctica clínica se suele evitar la administración de contraste yodado si hay alta sospecha de feocromocitoma62.
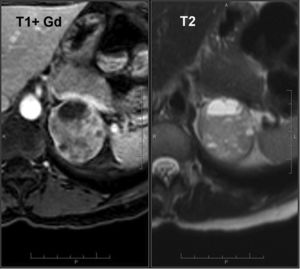
La RM con secuencias ponderadas en T2 es más específica que la TC para el diagnóstico de feocromocitoma62 por la hiperintensidad derivada de la presencia del componente quístico68,69. Los feocromocitomas no pierden señal en la secuencia T1 en fase opuesta44,62–64, a excepción de los pocos casos en los que haya grasa microscópica en su composición. Tras la administración intravenosa de contrastes de gadolinio, se observa un realce intenso y persistente70 (fig. 9).
Feocromocitoma (mismo paciente de la figura 8). RM con contraste endovenoso muestra masa suprarrenal izquierda, heterogénea, con áreas de hiperseñal en secuencias T2 en su interior, que presenta también áreas con intenso realce heterogéneo en secuencias T1 en fase arterial, todo ello sugestivo de feocromocitoma.
En espectroscopia-RM, el feocromocitoma tiene una única firma espectral, mostrando un pico de 6,8-ppm atribuible a la presencia de catecolaminas y sus metabolitos32, aunque son necesarios estudios más amplios para validar la espectroscopia-RM como una herramienta diagnóstica en estos casos.
La gammagrafía con MIBG y el 18F-FDG PET/TC se utilizan para la localización de feocromocitomas sospechados bioquímicamente28,36, pero su uso no suele ser necesario ante un incidentaloma, puesto que la lesión ya está localizada. El METO PET/TC, al poder diferenciar metástasis y feocromocitomas de lesiones adrenocorticales38, podría tener utilidad ante la sospecha de un feocromocitoma.
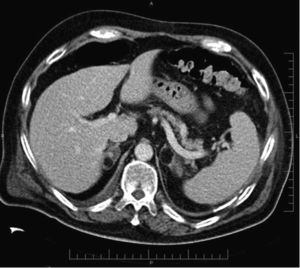
CarcinomaLa prevalencia de carcinoma adrenal está relacionada con el tamaño (2% de los tumores menor o igual a 4cm; 6% entre 4,1 y 6cm, y 25% mayores de 6cm), siendo el pronóstico peor para los de mayor tamaño. La mayoría de los estudios describe una supervivencia < 50% en 5 años, y muchos incluso < 50% a los dos años2.
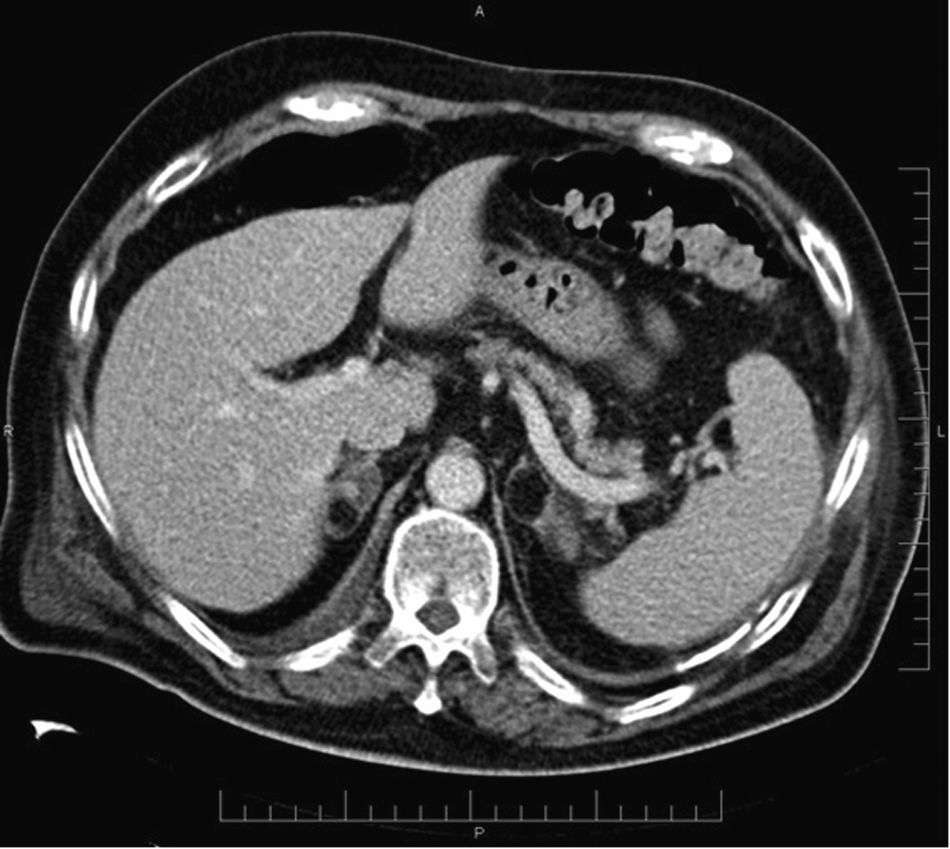
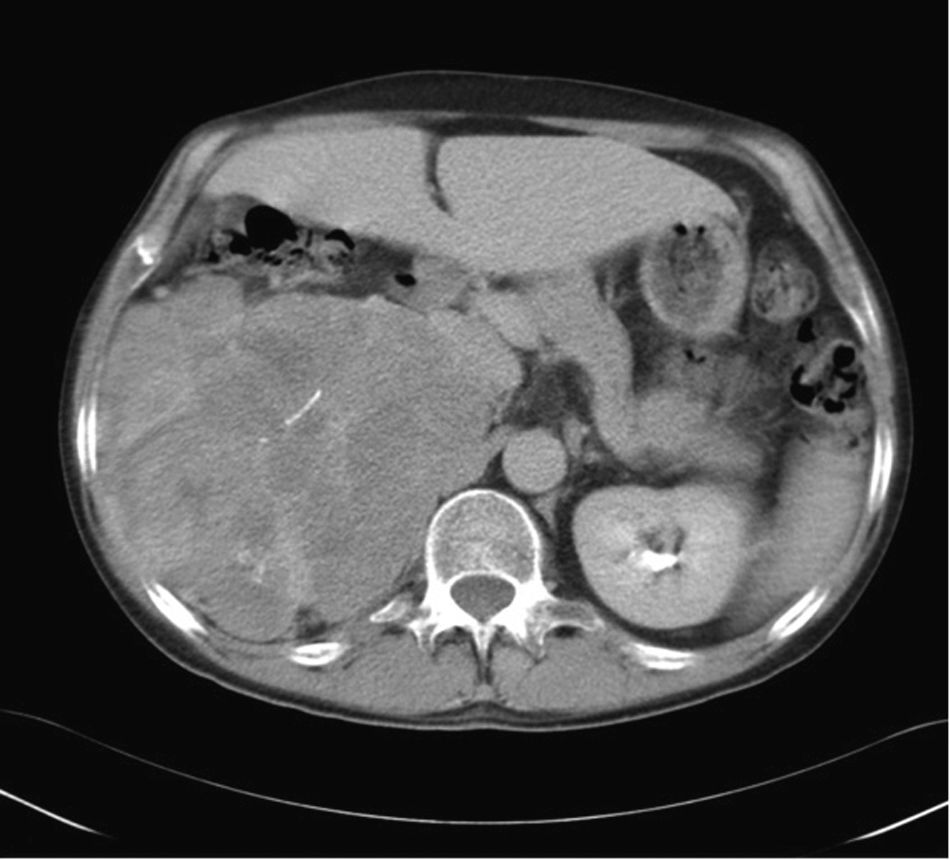
En general, mediante TC y RM se detectan grandes masas (fig. 10) que se acompañan de datos que sugieren malignidad (tabla 1). En algunos casos puede observarse una extensión directa del tumor a la vena cava, cuya identificación es crucial para la planificación quirúrgica71,72. Por otro lado, cuando son pequeños (< 5cm) pueden tener un aspecto igual al de los adenomas71, sin invasión de estructuras adyacentes.
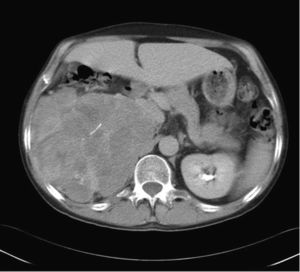
Carcinoma suprarrenal. Paciente de 32 años en estudio por hipercortisolismo e hiperaldosteronismo. La TC con contraste endovenoso en fase tardía muestra una gran tumoración retroperitoneal en el área suprarrenal derecha, con alguna calcificación y un realce heterogéneo de contraste con áreas de captación pseudonodulares intercaladas con áreas de baja atenuación. En secciones craneales a esta imagen, se observaban signos de infiltración del parénquima hepático, todo ello compatible con un carcinoma suprarrenal.
En los estudios de imagen de RM de desplazamiento químico no pierden señal en las secuencias en fase opuesta, dado que no poseen grasa en su composición. Sin embargo, está descrito algún caso de carcinoma adrenal funcionante en el que la presencia de lípidos intracelulares condicionaba una pérdida de señal en fase opuesta73.
El papel de la PET/TC ya ha sido discutido en el apartado «metástasis».
Los carcinomas suprarrenales son tumores de crecimiento muy rápido y es raro que una lesión maligna no tratada permanezca estable durante más de 6 meses, por lo que la estabilidad de una lesión en controles seriados (según el fenotipo de la lesión) suele descartar un carcinoma adrenocortical7,28.
Manejo de la lesión suprarrenal indeterminadaEn todos los pacientes con el hallazgo de un incidentaloma suprarrenal sin historia de malignidad están indicadas pruebas de despistaje de feocromocitoma, de secreción autónoma de cortisol y, si el paciente es hipertenso, de hiperaldosteronismo. La excepción son los pacientes con hallazgos inequívocos de mielolipoma1,2,11. No están indicadas pruebas para despistaje de hipersecreción de estrógenos y andrógenos1.
Los pacientes con feocromocitoma asintomáticos u oligosintomáticos deben ser tratados con adrenalectomía. Para el resto de lesiones funcionantes subclínicas, la opción quirúrgica dependerá de la edad (normalmente se trata quirúrgicamente a los pacientes menores de 40 años) y de las potenciales repercusiones médicas de la hipersecreción hormonal2,11.
Con respecto a los incidentalomas no funcionantes está aceptado resecar las lesiones mayores de 6cm, aunque existen algunas excepciones (hematomas agudos, tuberculosis, mielolipomas, y, posiblemente, las masas no funcionantes en ancianos). Las lesiones menores de 4cm que por imagen presenten bajo riesgo de malignidad, en general no se resecan. La estrategia a seguir en el grupo de lesiones de 4-6cm no está bien definida, pudiendo optar por el seguimiento o la exéresis2,11.
Ante una lesión adrenal incidental no funcionante, menor o igual a 6cm, sin características radiológicas de malignidad, debe realizarse una TC sin contraste para determinar los valores medios de atenuación de la lesión. Si son < 10 UH, realizaremos el diagnóstico de adenoma16,18,19. Si la densidad de la lesión está entre 10-20 UH, se puede realizar un análisis del histograma de la lesión, donde el hallazgo de > 10% de pixeles negativos será diagnóstica de adenoma17,20,21,41. Si los valores medios basales están entre 20-30 UH o el histograma no ha sido concluyente, está indicada la realización de una RM, donde la pérdida de intensidad de señal en las secuencias eco de gradiente en fase opuesta, es característica de adenoma23,25,50,52. Para lesiones con valores de atenuación basales > 30 UH, está indicada la realización de una TC antes y después de la administración de contraste (fase portal a los 60 segundos y fase tardía a los 15 minutos), con cálculo del lavado absoluto del contraste. Los valores ≥ 60% serán compatibles con adenomas16,42,43,45–47.
Una pequeña cantidad de masas adrenales permanecen indeterminadas después de estudio con TC y RM. Se incluyen los adenomas atípicos, metástasis, carcinomas adrenocorticales, linfomas y feocromocitomas. En estos casos está recomendado el PET/TC con 18F-FDG (y en un futuro, con METO), ya que, aunque no pueda establecerse con exactitud la caracterización tisular de la lesión, podrá por lo menos sugerir la naturaleza benigna o maligna de la lesión28,36–38.
Para las lesiones que aún así persisten indeterminadas se recomienda seguimiento, a fin de detectar cambios en el tamaño del tumor o el desarrollo de hiperproducción hormonal. No hay consenso sobre el seguimiento apropiado: la mayoría de los autores1,2,11recomiendan para masas de aspecto benigno, pequeñas (< 3cm), y no funcionantes, un despistaje bioquímico anual durante 4 años y dos estudios de imagen realizados con al menos 6 meses de intervalo. Para lesiones indeterminadas, además del despistaje bioquímico anual durante 4 años, está indicada la realización de una prueba de imagen precoz a los 3-6 meses y controles sucesivos según el grado de sospecha11. La lesión que crezca significativamente de tamaño se considera normalmente maligna7,28.
La adrenalectomía debe priorizarse ante la sospecha de malignidad (crecimiento rápido, bajo contenido lipídico, valores de lavado disminuidos, heterogeneidad, bordes irregulares)2,11.
Ante un incidentaloma adrenal en un paciente sin historia de malignidad y con hallazgos de imagen no concluyentes, la realización de la PAAF raramente está indicada1,10,28,56. Si la lesión presenta crecimiento durante el seguimiento, se puede realizar una PAAF antes de adoptar una decisión quirúrgica27.
En el contexto del paciente oncológico, ante el hallazgo de una lesión adrenal incidental la alta sospecha de metástasis justifica la realización de un PET/TC con 18F-FDG como abordaje diagnóstico inicial37. Un resultado positivo es altamente sospechoso de metástasis, estando indicada la realización de confirmación con PAAF (después de realizar pruebas hormonales para descartar un feocromocitoma), siempre que el diagnóstico definitivo pueda cambiar la conducta terapéutica27. Ante un resultado negativo en la PET/TC, se recomienda seguir la misma conducta sugerida para los pacientes con incidentalomas adrenales sin historia previa de enfermedad maligna.
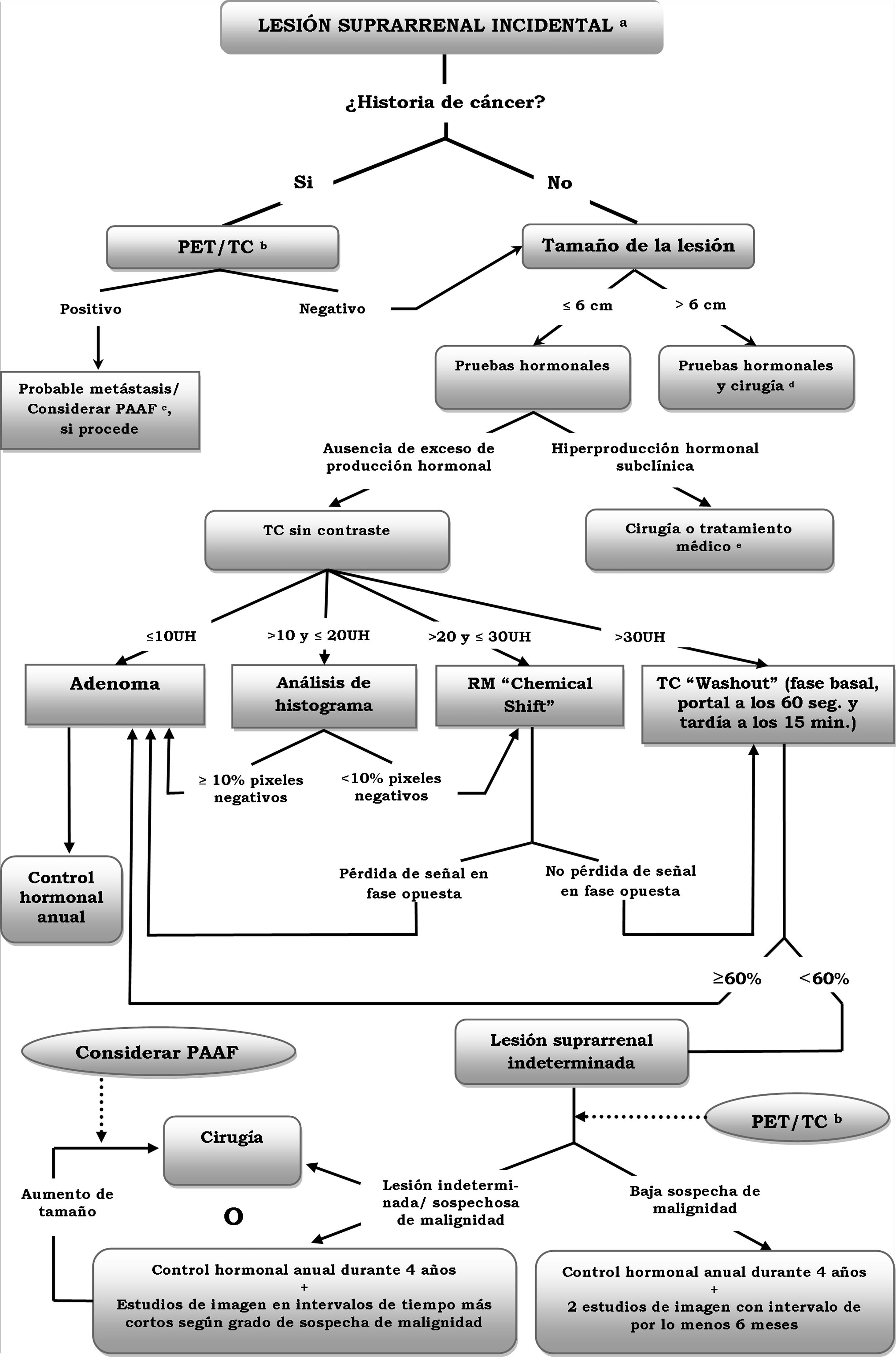
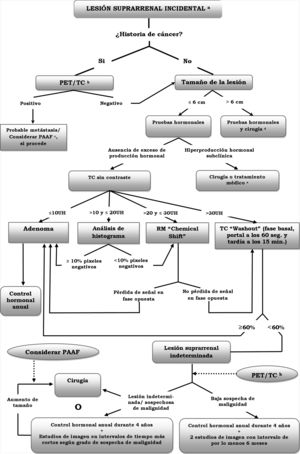
El algoritmo para el diagnóstico y manejo del incidentaloma suprarrenal está representado en la figura 11.
Algoritmo para el manejo del incidentaloma de la glándula suprarrenal. aAnte el hallazgo de características inequívocas de mielolipoma, no son necesarias exploraciones adicionales; bEn la PET/TC con 18F-FDG, una mayor captación de la lesión adrenal respecto al parénquima hepático (análisis visual) es sugestiva de una enfermedad maligna; cEs recomendable realizar pruebas hormonales para descartar un feocromocitoma, previa a la PAAF; dAlgunos autores también recomiendan la resección de las lesiones de 4 a 6cm, sobre todo si presentan criterios sugestivos de malignidad (heterogeneidad y bordes irregulares); eLos feocromocitomas se deben tratar quirúrgicamente. Para el resto de las lesiones la decisión quirúrgica dependerá de la edad y potenciales repercusiones médicas de la hipersecreción hormonal.
El radiólogo debe participar activamente en el diagnóstico de las lesiones suprarrenales indeterminadas utilizando las técnicas de imagen adecuadas. No solo debe ser capaz de diagnosticar aquellas que sean concluyentes por su comportamiento, sino que debe aconsejar sobre el siguiente paso a realizar dependiendo de la disponibilidad y experiencia con las diferentes técnicas de cada centro en aquellas lesiones no concluyentes. El disponer de un algoritmo diagnóstico es fundamental y permite el manejo de las lesiones incidentales de forma adecuada.
Autoría- 1.
Responsables de la integridad del estudio: ROC, RSI, CNM
- 2.
Concepción del estudio: ROC, RSI, LBV, MCSC, CNM
- 3.
Diseño del estudio: ROC, RSI, LBV, MCSC, CNM
- 4.
Obtención de los datos: ROC, RSI, LBV, MCSC, CNM
- 5.
Análisis e interpretación de los datos: ROC, RSI, LBV, MCSC, CNM
- 6.
Tratamiento estadístico: ROC, RSI, CNM
- 7.
Búsqueda bibliográfica: ROC, RSI, CNM
- 8.
Redacción del trabajo: ROC, RSI, CNM
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: ROC, RSI, LBV, MCSC, CNM
- 10.
Aprobación de la versión final: ROC, RSI, LBV, MCSC, CNM
Los autores declaran no tener ningún conflicto de intereses.