INTRODUCCIÓN
¿Qué duda cabe de que la tomografía por emisión de positrones (PET)/tomografía computarizada (TC) tiene un papel importantísimo en la Medicina actual? ¿Quién cree incierto el desarrollo y la implantación progresiva en nuestro entorno clínico de las múltiples formas de hibridación entre imagen anatómica y funcional? ¿Quién no tiene vértigo de asomarse a la Biología Molecular desde un entorno clínico de base hospitalaria? En este artículo se pretende abogar por una aproximación a esta nueva forma de imagen basada en la necesidad de responder a una concepción más actual de los paradigmas de la enfermedad. Una nueva forma de imagen, la llamada «imagen molecular» (IM), será sin duda uno de los entornos de trabajo de los profesionales de la imagen médica1-8.
HACIA UN NUEVO PARADIGMA: LA MEDICINA INDIVIDUALIZADA
La tecnología y la Medicina llevan interactuando en las últimas décadas con imbricaciones progresivamente mayores. Como consecuencia de la revolución científico-tecnológica que comenzó a producirse en las últimas décadas del siglo pasado, estamos asistiendo en la actualidad a un cambio de escenario progresivo e inexorable en la concepción y el ejercicio de la Medicina. Este presente va a caracterizarse por el desarrollo de lo que ya se conoce como «medicina personalizada», donde se da más importancia a los factores individuales que a los generales para atajar la enfermedad y promover la salud.
La mejor comprensión de las bases moleculares de la salud y de la enfermedad están conduciendo a la sustitución de la concepción médica tradicional, de corte fenotípico, basado principalmente en el análisis de los signos y síntomas, y en las experiencias poblacionales, por una actuación diagnóstico-terapéutica más específica y diseñada para cada paciente. Esta Medicina «a la carta» está basada en el genotipo, la bioquímica y las «particulares» alteraciones moleculares de la enfermedad, usando la Biología Molecular para el diagnóstico y el tratamiento de la enfermedad de un individuo. No es sólo que los genes se expresen o se modifiquen por ciertos factores ambientales (estilos de vida, condiciones sociales, etc.), sino principalmente que se utilice el potencial del conocimiento de la formación y la dinámica molecular de las células para detectar, interactuar y modificar la enfermedad.
La base de la nueva pirámide diagnóstica de la «medicina personalizada» va a estar constituida por unas disciplinas (genómica y proteómica) que nos van a permitir seleccionar a poblaciones e individuos «con riesgo» de padecer una determinada enfermedad antes de que aparezcan los síntomas clínicos. A continuación, las técnicas de diagnóstico por IM van a permitir identificar la existencia, localización y extensión de la enfermedad, estratificando el riesgo y posibilitando la realización de «tratamientos a la carta» diseñados para cada paciente. También será tarea de esta IM el monitorizar la eficacia de los tratamientos.
Antes de avanzar en el proceso de reestructuración de nuestras pautas de actuación, recordemos algunos conceptos de relevancia para la IM.
LA GENÓMICA Y LA PROTEÓMICA
La secuenciación de los aproximadamente 25.000 genes del genoma humano ha impulsado enormemente el conocimiento de las causas moleculares de las enfermedades y, por lo tanto, descubrir cómo las diferencias genéticas y las variaciones en la biología celular entre las personas causan o contribuyen al desarrollo de la enfermedad. Si la genómica estructural se orienta a la caracterización y localización de las secuencias de ADN que conforman los genes, la genómica funcional consiste en la obtención de información sobre la función de los mismos.
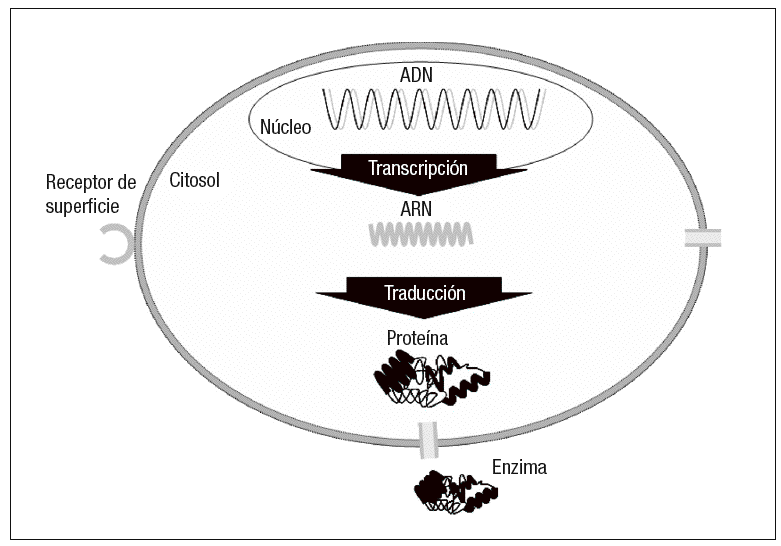
Actualmente se progresa hacia una era pos-genómica, en la que comienza a cobrar cada vez más interés la proteómica. Esta disciplina estudia los proteomas (conjunto de proteínas expresadas por un genoma), siendo su objetivo tratar de descubrir la constelación de proteínas que conforman la estructura y desarrollan la función de las células (fig. 1).
Fig. 1.--Dianas directas para imagen molecular (ácido desoxirribonucleico [ADN], ácido ribonucleico [ARN] o proteínas). Las proteínas pueden ser receptores, antígenos, enzimas, canales o transportadores. El número de dianas por célula aumenta con la expresión genética. Modificada de Wang DS, et al14.
La genómica y la proteómica proporcionan las bases para el desarrollo de soluciones diagnósticas y terapéuticas basadas en un mejor conocimiento de las causas moleculares de las enfermedades, adaptadas a los rasgos genéticos de los pacientes.
LA IMAGEN MÉDICA
Los métodos convencionales del diagnóstico por la imagen se basan en la observación tanto de los cambios anatómicos producidos por la enfermedad (objetivo de la Radiología) como de las alteraciones funcionales (objetivo de la Medicina Nuclear). Este planteamiento clásico tan dicotómico ha ido modificándose progresivamente, ya que las técnicas radiológicas han ido incorporando de manera gradual información funcional (TC de alta resolución, resonancia magnética (RM) funcional y espectroscopia con RM), a la par que la Medicina Nuclear ha mejorado su tecnología instrumental facilitando la obtención de una información funcional regional con mayor precisión estructural.
Sin embargo, el proceso actual de aproximación entre ambas disciplinas se debe fundamentalmente a la conjunción de dos factores: el espectacular desarrollo tecnológico y una nueva concepción del proceso diagnóstico.
El desarrollo tecnológico ha facilitado una convergencia entre la excelente resolución espacial de las técnicas radiológicas con la muy alta sensibilidad intrínseca de las exploraciones de Medicina Nuclear. Este fenómeno ha conducido a la aparición y desarrollo de las técnicas híbridas ([tomogammagrafía] SPECT-TC, PET-TC y PET-RM). Mientras que la SPECT-TC será la técnica convencional más utilizada en la Medicina Nuclear convencional y la PET-TC se está revelando como la técnica de elección en el campo de la Oncología, la PET-RM será fundamental en el estudio de la enfermedad neurológica y probablemente también en la cardiológica.
Por otra parte, y en relación con el proceso diagnóstico, hoy conocemos que las alteraciones morfofuncionales, que son el objetivo de las técnicas diagnósticas convencionales, representan el estadio final de los cambios producidos en la enfermedad. El desarrollo de la genómica y la proteómica ha permitido identificar qué procesos son los responsables de las enfermedades y a qué nivel se sitúan (genes, proteínas, células, tejidos, etc.). Ante una determinada enfermedad hay que identificar en primer lugar cuál es su diana molecular más relevante. Identificada la diana, hay que disponer de un ligando (sonda) que se una (hibride) de forma específica con ella y que después emita una señal que pueda detectarse para ser transformada en imágenes, donde se observe claramente la diana y su localización. Éste es el fundamento de la IM, la localización precisa de una diana molecular de relevancia en la enfermedad. Esta aproximación será posiblemente más útil a los pacientes que las visiones actuales, más parciales y aisladas, de las alteraciones estructurales y ciertos procesos físico-químicos9.
La IM tuvo su origen hace ya varias décadas en el campo de la Medicina Nuclear (gammagrafías con anticuerpos monoclonales y receptores), pero en la actualidad abarca técnicas tanto de Medicina Nuclear como de Radiología y de imagen óptica (SPECT, PET, SPECT-TC, PET-TC, PET-RM, RM funcional, RM espectroscopia, ecografía intravascular e imagen por fosforescencia y autofluorescencia).
De los múltiples ligandos sintetizados que permiten la caracterización molecular in vitro sólo unos pocos muestran las características idóneas (afinidad con la diana, estabilidad y contraste diana-fondo) para ser utilizados in vivo con las técnicas de IM. De las sondas actualmente disponibles, la mayoría se utilizan en las exploraciones de Medicina Nuclear debido a su excelente sensibilidad intrínseca; sin embargo, el desarrollo de técnicas de amplificación de la señal ha permitido la aparición de nuevos agentes moleculares utilizados por otras técnicas de menor sensibilidad intrínseca, aunque de mucha mayor resolución anatómica como la RM y la imagen óptica.
Las indicaciones de la IM están desarrollándose a un ritmo exponencial, aunque muchas de ellas todavía se encuentran en fase experimental. Actualmente parecen consolidadas las aplicaciones oncológicas y en el campo de la angiología, el sistema nervioso central y el corazón, con múltiples avances en otras parcelas de investigación10.
Dado que la exposición detallada de todos estos procesos en un artículo de estas características es imposible, queremos con esta comunicación hacer una muy breve reseña de los avances más importantes que se están desarrollando en IM, empleando equipamientos híbridos, con una aproximación clínica basada en los órganos y sistemas. Con esta aproximación se pretende que la cita de Arthur C. Clarke: any sufficiently advanced technology is indistinguishable from magic, no sea aplicable a la IM si conseguimos entenderla para estar dispuestos a utilizarla y controlarla adecuadamente11.
LA IMAGEN MOLECULAR EN ALGUNOS ENTORNOS CLÍNICOS
En esta parte del trabajo se pretenden repasar brevemente los avances más importantes que en el campo de la IM se están desarrollando en los últimos años.
En Oncología la PET-TC se ha revelado como la técnica de elección para la detección, estadificación, reestadificación y monitorización del tratamiento. Para ello, la PET utiliza como sonda molecular un análogo de la glucosa marcada con 18F (18F-FDG). El fundamento de su empleo se basa en la alta actividad glucolítica de las células tumorales. Su combinación con la imagen de TC (PET-TC) nos permite realizar una más adecuada corrección de atenuación (lo que permite la obtención de los parámetros cuantitativos, standarized uptake values [SUV]) y localizar con mayor precisión las lesiones observadas en la PET.
El empleo de esta tecnología híbrida aumenta la seguridad de la técnica y además aporta una información adicional muy valiosa con respecto a la obtenida si se utilizaran la PET y la TC por separado. Sin embargo, y aunque está mejorando, la resolución espacial de la PET (5-7 mm) todavía es inferior a la TC, lo que dificulta caracterizar metabólicamente las lesiones pequeñas con seguridad. Por otro lado, la sonda 18F-FDG utilizada es inespecífica, dado que también se acumula en las células inflamatorias. Sin embargo, pueden contribuir a realizar un diagnóstico diferencial acertado entre benignidad y malignidad el patrón de distribución de la actividad, la modificación temporal de la actividad (en las imágenes tardías las lesiones oncológicas aumentan su intensidad, mientras que las inflamatorias no lo hacen) y las imágenes de TC. Estos factores reducen la incidencia de falsos positivos y negativos9.
La 18F-FDG PET-TC es también útil para la evaluación de la diseminación tumoral linfática. Sin embargo, también la RM utilizando sondas de nanocristales de óxido de hierro (USPIO) se está mostrando muy eficaz para diferenciar los ganglios normales de los tumorales. Las adenopatías metastásicas, al no acumular este medio de contraste por tener células neoplásicas en su interior, serán hiperintensas en las imágenes de RM potenciadas en T2. Esta técnica, debido a su alta resolución anatómica (< 2 mm), tiene una mayor sensibilidad que la PET-TC para la detección de la afectación adenopática.
Los pacientes que principalmente se benefician de la 18F-FDG PET-TC son aquellos que padecen un carcinoma de células escamosas del cuello, carcinoma de tiroides, carcinoma de pulmón, carcinoma esofágico, carcinoma de mama, carcinoma colorrectal, linfoma de Hodgkin y no-Hodgkin, melanoma y tumores de origen desconocido. Aunque la TC se utiliza todavía para realizar la corrección de atenuación y localizar las lesiones detectadas con mayor precisión, los nuevos equipos TC multidetectores de alto número de coronas favorecen un uso más extendido donde la adquisición de TC de alta calidad tras la administración de un contraste intravenoso se combina con las imágenes de mayor calidad de la PET12. Tanto es así que recientemente se ha reconocido que la PET/TC-colonografía es superior a la combinación estándar de PET y TC en la estadificación del carcinoma colorrectal13.
En la actualidad ya están comenzando a utilizarse nuevas sondas más específicas que la 18F-FDG. Así, la timidina marcada con 18F permite estudiar la proliferación celular, por lo que probablemente será la sonda de elección para la valoración de la respuesta a la terapia. El 18F-fluoromisonidazol (FMSIO) se utiliza para valorar la hipoxia o la 18F-anexina V para la apoptosis. La metionina se emplea en el estudio de tumores de alto grado y la colina marcada con 11C o 18F en los tumores prostáticos. Las hormonas marcadas se están utilizando para valorar la respuesta a la terapia hormonal (en mama y próstata).
Otra forma de imagen molecular es la visualización directa de receptores o antígenos que se expresan sólo en las células tumorales. Como ejemplos están el 111In-octreotido para los tumores neuroendocrinos y sus metástasis que expresan receptores de somatostatina, el 99mTc-depreótido para el carcinoma de pulmón y los anticuerpos anti-antígeno carcinoembrionario (CEA) marcados con 99mTc o con 64Cu en el carcinoma colorrectal. Hay otros trazadores, por ejemplo la 123I-MIBG que se incorpora a la vía metabólica de las catecolaminas y se utiliza para la detección del feocromocitoma y sus metástasis, del neuroblastoma, así como para la tipificación de los tumores glómicos.
La Medicina Molecular terapéutica comprende la utilización de estas sondas con fines terapéuticos utilizando radiotrazadores de mayor energía. Así, se tratan tanto tumores neuroendocrinos como feocromocitomas y neuroblastomas. También hemos comenzado a utilizar los anticuerpos anti-CD 20 marcados con 90Y para el tratamiento de los linfomas no hodgkinianos.
Por otro lado, la sobrexpresión de P-glucoproteína (Pgp) en los tumores malignos limita la efectividad de los agentes quimioterápicos. Actualmente disponemos de sondas que nos permiten estudiar este fenómeno (99mTc-MIBI, 99mTc-tetrofosmin). Además, la terapia tumoral puede controlarse mediante la visualización con RM de células marcadas con partículas de hierro. Las imágenes potenciadas en difusión permiten localizar estas células con una alta precisión.
En el campo de la investigación cabe destacar la utilización de técnicas de imagen óptica (endoscopia con fluorescencia) mediante sondas de catepsina B, proteasa para la objetivación de cánceres de mama y de cerebro.
En el campo de la Neurología la utilización de sondas marcadoras de los mecanismos de neurotransmisión cerebral ha permitido conocer algunos de los procesos bioquímicos que rigen la patogenia de procesos como la enfermedad de Parkinson, la enfermedad de Alzheimer, la esquizofrenia y otras enfermedades psiquiátricas. Las imágenes más conocidas y más utilizadas en la campo de la Medicina Clínica son las relativas a la bioquímica dopaminérgica (marcaje del transportador dopaminérgico con 123I-loflupano, de la DOPA con 18F-DOPA, de los receptores dopaminérgicos D2 con 123I-lobenzamida o 11C o 18F-raclopride). En relación con la utilización de marcadores de los receptores dopaminérgicos D2 se han podido perfilar aspectos del mecanismo de acción y los efectos secundarios de los antipsicóticos actuales. Además, tanto para la SPECT como fundamentalmente para la PET, están disponibles trazadores para el estudio de receptores serotoninérgicos, colinérgicos, opiácidos y glutaminérgicos. Por otro lado, el diagnóstico de enfermedades neurodegenerativas se centra tanto en el análisis del metabolismo (espectroscopía, con disminución de N-acetilaspartato y aumento del mio-inositol) como en marcadores específicos de las placas amiloideas seniles y los ovillos neurofibrilares mediante el marcaje para PET-TC con 18F-FDDNP.
En Cardiología los estudios combinados de perfusión con 13N- amonio, 15O-agua o 82Rb, junto con el de metabolismo con la 18F-FDG, se consideran el patrón-oro para la viabilidad miocárdica. Para el estudio del metabolismo oxidativo se utilizan el palmitato y el acetato, ambos marcados con 11C. Los estudios de inervación adrenérgica con 99mTc-MIBG o con 11C-hidrohiepinefrina se están utilizando para el estudio de la cardiomiopatía y en la monitorización de fármacos. El desarrollo de técnicas de hibridación de PET o SPECT de perfusión con TC de 64 coronas permite conocer el significado hemodinámico de las estenosis coronarias. Además, la posibilidad de realizar simultáneamente la prueba de esfuerzo físico con electrocardiograma (ECG) y obtener las imágenes de perfusión, le confieren a estos estudios un importante valor pronóstico.
También se está progresando en el control de la terapia con células madre en el infarto. La imagen celular debe poder observar la migración desde el sitio del trasplante al área infartada, su distribución y viabilidad. El marcaje intracelular de estas células con USPIO, y su control mediante RM de alta resolución espacial, permite objetivar este proceso. Como limitación, el contraste se diluye con cada división celular, disminuyendo la sensibilidad para detectarlo, y el contraste liberado por muerte celular es fagocitado por los macrófagos disminuyendo la especificidad. Con la inclusión de genes modificados se puede evaluar la supervivencia, migración y proliferación celular mediante PET con 9-(4-18F-fluoro-3-[hidroximetil]butil)guanina.
La enfermedad vascular presenta numerosas áreas de investigación en imagen molecular14. Es de gran interés la identificación de lesiones arterioscleróticas de alto riesgo (placas vulnerables) con objeto de identificar a aquellos pacientes susceptibles de desarrollar enfermedad cardiovascular. Las dos técnicas más utilizadas son la visualización de los macrófagos de la placa mediante RM y la objetivación de la apoptosis mediante técnicas de Medicina Nuclear marcando la anexina V. Mediante RM se puede obtener una imagen de macrófagos marcados con SPIO como expresión de la presencia y extensión de las placas. La presencia y extensión de la fibrosis en las placas se podrá evaluar mediante RM con medios de contraste de una alta relajatividad y con una afinidad muy alta para la fibrosis, como la gadofluorida. Por otro lado, la imagen de trombosis consiste en la visualización de la presencia y distribución de las proteínas de la cascada de la coagulación o mediante sondas de Medicina Nuclear para plaquetas como el 99mTc-glucoproteína IIb/IIIa, antagonista de receptores plaquetarios.
La angiogénesis se podrá evaluar mediante el marcaje de las integrinas. Las *vß3 integrinas se expresan sólo en los vasos neoformados, pero no en los maduros. Se han desarrollado sondas de esta integrina para Medicina Nuclear, RM e imagen óptica. También existen en desarrollo marcadores del factor de crecimiento del endotelio vascular mediante sondas de 111In-VEGF121 para Medicina Nuclear.
Para un acceso a las nuevas sondas se refiere al lector a portales específicos [http://www.ncbi.nlm.nih.gov/books/bookres.fcgi/micad/home.html].
LA IMAGEN MOLECULAR EN NUESTRO ENTORNO
Las sociedades científicas y profesionales relacionadas con la imagen molecular y celular reconocen unas áreas de actuación prioritarias para el desarrollo de la imagen molecular y de los profesionales relacionados con ella15.
Tanto desde la Medicina Nuclear como desde la Radiología se deberían establecer programas formativos de los principios y bases de la imagen molecular; promover la existencia de charlas sobre todos los aspectos de la imagen molecular en todos los foros y congresos de su especialidad; establecer simposios y talleres sobre aspectos particulares de la imagen molecular basada en sistemas y órganos; difundir la información que sobre imagen molecular (reuniones, congresos, ayudas, becas) se produzca en Europa y facilitar la publicación en sus órganos de expresión científicos (revistas, libros, páginas web, etc.) de artículos y revisiones que sobre este tema se produzcan15.
CONCLUSIONES
Las técnicas de imagen generan información tanto funcional como estructural. La utilización de sondas de imagen, junto a equipamientos avanzados, permite ver numerosos complejos moleculares y estructuras celulares.
Las técnicas de imagen molecular posibilitan, directa o indirectamente, recoger y seguir la distribución espacio-temporal de procesos moleculares o celulares con aplicaciones no sólo clínicas (diagnósticas y terapéuticas) sino también básicas (bioquímicas y fisiológicas). En la parte clínica, la Medicina Nuclear y la Radiología están obligadas a trabajar conjuntamente para liderar el desarrollo, la implantación y la evaluación tecnológica de la imagen molecular. Desde esta perspectiva las técnicas de hibridación molecular deben progresar hacia la coordinación de esfuerzos, tanto de formación y utilización, como de investigación, que permitan desarrollarnos plenamente como profesionales de la imagen médica al servicio de la sanidad15.
La imagen molecular dota a los médicos relacionados con la imagen médica de la posibilidad de avanzar sustancialmente en el diagnóstico precoz, la estratificación del riesgo y el pronóstico, y la monitorización del tratamiento de numerosos procesos biológicos y celulares relacionados con la enfermedad. Es el momento de participar en este proceso.
AGRADECIMIENTOS
Al Dr. Juan Sastre, del Departamento de Fisiología de la Universidad de Valencia, por sus precisas correcciones y clarificadores comentarios al manuscrito.