En el tratamiento multidisciplinar del paciente oncológico pediátrico se va a requerir de múltiples pruebas de imagen, tomas de biopsias y resecciones tanto para el diagnóstico como para la estadificación inicial y reestadificación posterior. La existencia de nódulos pulmonares en estos pacientes no siempre es sinónimo de metástasis, por lo que un correcto diagnóstico influirá en su tratamiento y supervivencia. La localización percutánea de los nódulos pulmonares es clave en dos aspectos: por un lado, permite al cirujano resecar la menor cantidad de tejido pulmonar posible, y por el otro garantiza la inclusión del nódulo en la pieza de resección, ya que sin nuestra ayuda esta labor puede ser imposible (nódulos de muy pequeño tamaño, separados de la superficie pleural y por tanto no visibles con el toracoscopio). Presentamos una revisión de la técnica de localización de nódulos pulmonares con arpón para resección toracoscópica con claves para mejorar la misma.
In the multidisciplinary treatment of pediatric oncologic patients, multiple imaging tests, biopsies, and resections are required for diagnosis, initial staging, and posterior restaging. In these patients, pulmonary nodules are not always metastases, so the correct diagnosis of these lesions affects their treatment and the patient's survival. Percutaneous localization of pulmonary nodules is key for two reasons: it enables the surgeon to resect the smallest amount of lung tissue possible and it guarantees that the nodule will be included in the resected specimen. Without percutaneous localization, it can be impossible to accomplish these two objectives in patients with very small nodules that are separated from the pleural surface and therefore impossible to see by thoracoscopy. This article reviews the technique for hook-wire localization of pulmonary nodules and the keys to ensuring the best results.
La aparición de un nódulo pulmonar solitario como hallazgo incidental en el paciente pediátrico no oncológico puede plantear un problema de seguimiento, pero es raro que se trate de un nódulo maligno y por tanto la obtención de muestras histológicas no suele entrar en el algoritmo de diagnóstico de estos pacientes1–3. Sin embargo, en el caso de antecedente tumoral, en muchos casos se requiere de un diagnóstico histológico para la estadificación y planificación del tratamiento.
El pulmón es el órgano al que más frecuentemente metastatizan la mayoría de las neoplasias sólidas pediátricas. El osteosarcoma, el tumor de Wilms (nefroblastoma), los tumores de la familia del sarcoma de Ewing, el rabdomiosarcoma y el hepatoblastoma son los tumores primarios pediátricos que con mayor frecuencia presentan inicialmente o desarrollan metástasis pulmonares a lo largo de la enfermedad4. Pero entre un 30% y un 60% de los nódulos se corresponden con procesos benignos: granulomas, cicatrices posradioterapia, ganglios linfáticos intrapulmonares, cambios por quimioterapia, pequeñas atelectasias e incluso depósitos lipídicos5,6.
El manejo de los nódulos pulmonares –tanto de inicio como de aparición a lo largo de la enfermedad– depende de numerosas variables: por un lado, de las características radiológicas del nódulo, y por el otro y fundamentalmente, del tipo de tumor primario, del estadio inicial del paciente y de su estado basal7.
Las dos técnicas más habituales de resección de estos nódulos pulmonares son la toracotomía abierta y la resección por toracoscopia.
La toracoscopia se ha convertido en poco tiempo en una práctica estandarizada de resección de nódulos pulmonares8. Para aquellos nódulos que son de pequeño tamaño y no contactan con la superficie pleural y por tanto ni se palpan ni se ven, se han desarrollado varios procedimientos que anteceden a la cirugía toracoscópica: marcaje mediante guía localizadora (microcoil, arpón), marcaje mediante tinción (el más comúnmente empleado el azul de metileno) o marcaje mediante radiocirugía (ROLL, Radioguided Occult Lesion Localisation), marcaje con broncoscopia con navegación electromagnética e incluso técnicas combinadas9–13. En la mayoría de las ocasiones es necesaria la participación de técnicas intervencionistas que guían la colocación del marcador mediante tomografía computarizada (TC) o ecografía. Cada técnica tiene sus ventajas e inconvenientes y existen pocos artículos11,13,14 que comparen las técnicas en términos de eficacia, seguridad y complicaciones.
Se suele reservar la toracotomía abierta para pacientes que han sufrido múltiples toracotomías previas o cuando la localización de la lesión impide el correcto abordaje mediante toracoscopia.
Selección de los nódulos a biopsiarLos objetivos de la resección toracoscópica son:
- •
En la mayoría de las neoplasias sólidas confirmar histológicamente la presencia de metástasis.
- •
En el osteosarcoma, el diagnóstico histológico y la resección de todos o la mayoría de los nódulos para disminuir la estadificación del tumor y rediseñar el tratamiento oncológico. Para conseguir este objetivo en el menor número de intervenciones posibles, se intenta la colocación simultánea de varios arpones en el mismo pulmón e incluso en ambos pulmones en el mismo procedimiento, lo que complica la técnica y alarga el procedimiento.
La planificación del marcaje con arpón es cuidadosamente acordada entre oncólogos, cirujanos torácicos y radiólogos. Debido a que salvo en contadas ocasiones (nódulo perifisural, nódulo calcificado en pacientes sin osteosarcoma) no existen características radiológicas específicas que permitan determinar con certeza qué nódulo tiene un mayor aspecto de metástasis1–3,5,15, los criterios que nos van a guiar para seleccionar el nódulo a examinar son:
Accesibilidad: la localización de algunos nódulos dificulta su correcto marcaje con guía mediante TC; por ejemplo, los nódulos centrales (cercanos al hilio pulmonar) o los que se sitúan a la altura de la escápula o en el ápex pulmonar.
Tamaño: se suelen seleccionar los de mayor tamaño, puesto que van a permitir la obtención de una mayor muestra histológica o los que han aumentado su tamaño respecto a controles previos.
Localización: los que se encuentran en los dos tercios periféricos del pulmón son preferibles a los de localización central. Los nódulos de pequeño tamaño en contacto con la pleura se asocian a una mayor tasa de neumotórax y de desalojo accidental.
Indicaciones de localización percutánea de nódulos pulmonares en el paciente oncológico pediátricoAl inicio de la enfermedad:- •
En el caso de los tumores de la familia del sarcoma de Ewing, si existe una evidencia cuestionable de metástasis (es decir, un nódulo de entre 5 y 10 mm o varios nódulos de entre 3 y 5 mm) y se aconseja si existe algún/algunos nódulos aislados que no cumplan estos criterios (uno o varios nódulos <3 mm)7.
- •
En el resto de las neoplasias pediátricas sólidas de la infancia no se recomienda. En función del tamaño y número, unos nódulos se considerarán metástasis definitivas, y si son de pequeño tamaño, evidencia cuestionable de metástasis, y se realizará seguimiento7.
- •
En el tumor de Wilms, los nódulos pulmonares menores de 3 mm no se consideran metástasis según el protocolo UMBRELLA 201616.
- •
No se recomienda obtención de muestra en las metástasis pulmonares del cáncer de tiroides: las metástasis del cáncer de tiroides presentan un patrón miliar característico que no necesita filiación histológica.
- •
Se recomienda obtención de muestra de tejido en todas las neoplasias sólidas más frecuentes de los niños. En estos casos se pueden seleccionar uno o dos nódulos para resección.
- •
Se recomienda realizar resección atípica de todos los nódulos o del mayor número posible de estos en el caso del osteosarcoma, para control y reestadificación de la enfermedad14.
Información y consentimiento: los familiares o tutores legales son informados de la técnica y las complicaciones por el oncólogo y el cirujano pediátrico y se obtiene un consentimiento informado para el procedimiento conjunto. El mismo día del procedimiento, el radiólogo se cerciora de que los pasos del procedimiento han sido correctamente entendidos e informa más pormenorizadamente de la postura en la que irá el paciente, el número de arpones que se van a introducir y la duración estimada del procedimiento. También se les informa de que podrán acompañar al paciente durante el traslado al quirófano, aunque este se realiza con el paciente bajo anestesia general.
Anestesia: todos los procedimientos se realizan bajo anestesia general. Tanto la adquisición de las imágenes como el avance de las agujas se realiza siempre en apnea, ya que el volumen pulmonar al final de la espiración es más reproducible que los volúmenes inspiratorios.
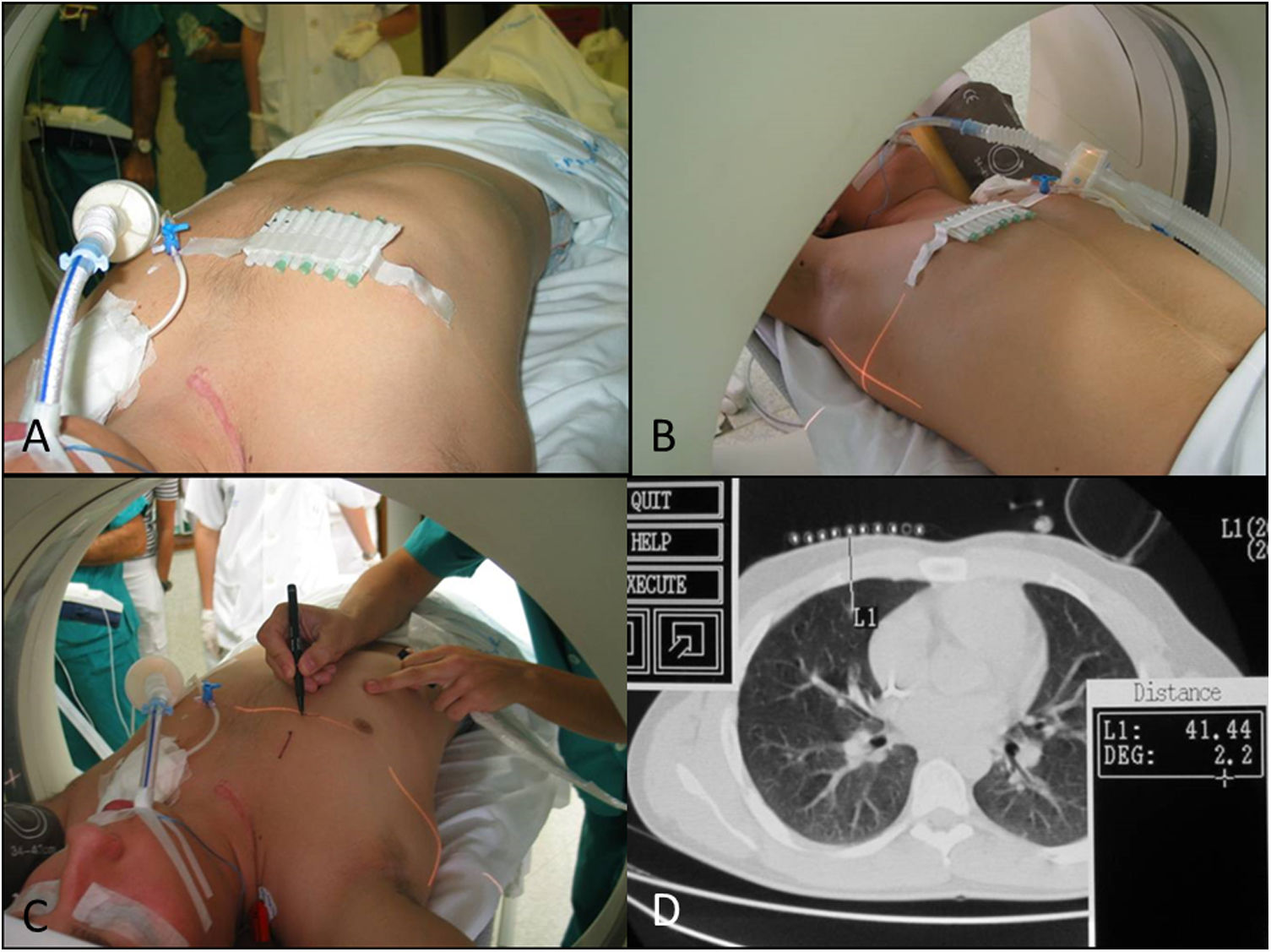
Colocación del paciente y técnica radiológica: en consenso con radiólogos, cirujanos torácicos y anestesistas se decide cuál va a ser la vía de abordaje y por tanto la colocación del paciente (fig. 1), que se mantendrá en el traslado al quirófano.
Paciente con antecedente de sarcoma de Ewing de clavícula derecha. Planificación de la localización de un nódulo situado en segmento 5 de lóbulo medio. A) Colocación de marcas cutáneas. B y C) Selección del nivel mediante luz láser de tomografía computarizada (TC). D) Correspondencia con imagen de la TC a la altura seleccionada. Distancia desde la piel de 4 cm.
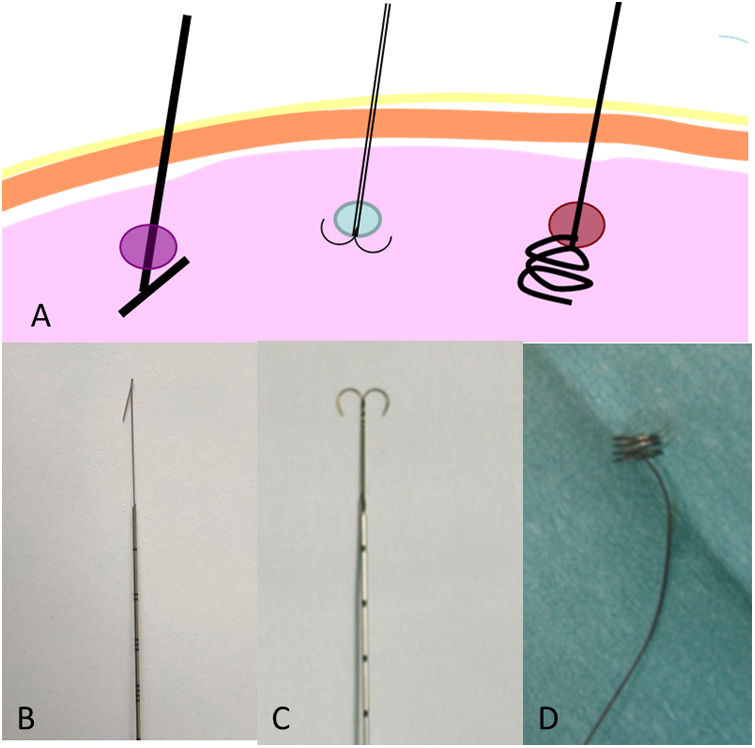
Existen múltiples tipos de arpones (Hawkins, espiral, dual) (fig. 2). La selección dependerá de las preferencias del equipo de radiólogos/cirujanos y no existen estudios que comparen la eficacia y seguridad de cada tipo. En nuestra experiencia, el arpón clásico, tipo Kopans, corta el tejido, ya que el tejido pulmonar es más laxo que el mamario. Tiene una mayor tendencia a moverse (avanzar o retroceder) o a desalojarse durante la cirugía. El arpón espiral17,18, diseñado específicamente para el pulmón, también tiene tendencia al desalojo, ya que las espirales se van desenrollando con la tracción. Presenta, sin embargo, alguna ventaja, como la posibilidad de avance o retroceso mediante la simple rotación del mismo.
En nuestro centro se emplea el arpón de tipo “ancla” (dual), pues nuestros cirujanos torácicos consideran que es más estable, con menor capacidad de avance y desalojo durante la cirugía.
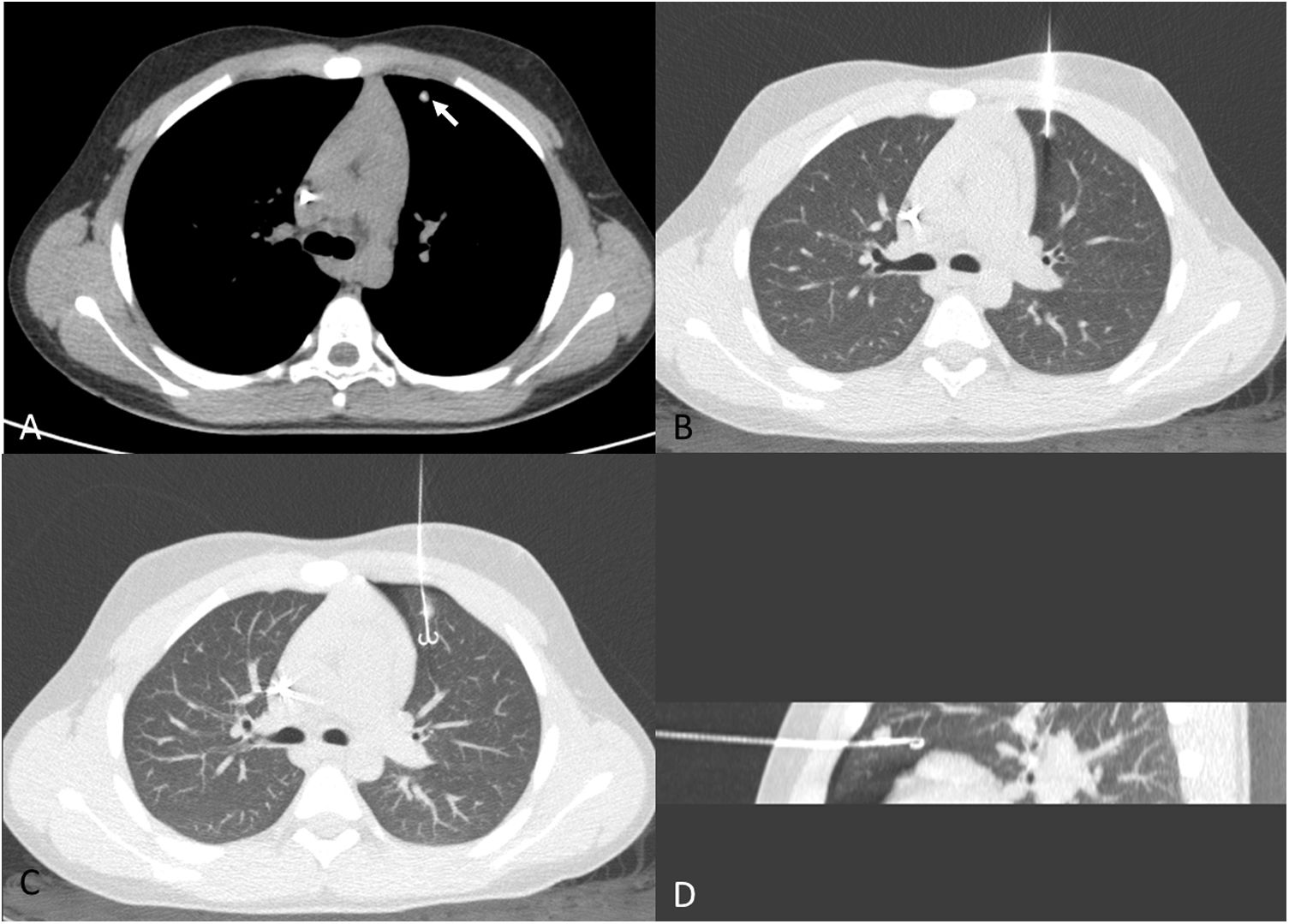
Técnica de inserciónEntrada perpendicular: se accederá al nódulo eligiendo el camino más corto, y con entrada perpendicular a la superficie pleural (fig. 3). Este abordaje facilita, por un lado, la resección en cuña de menor cantidad de tejido y se asocia con menor tasa de complicaciones. Se ha descrito una mayor tasa de desalojo con entradas del arpón con ángulo agudo respecto a la superficie pleural13. Sin embargo, no se debe atravesar una cisura para alcanzar el nódulo: el arpón tiene que entrar en el mismo lóbulo donde se encuentra el nódulo. Por esta razón, en ocasiones se tienen que realizar entradas con ángulo agudo respecto a la superficie pleural (fig. 4).
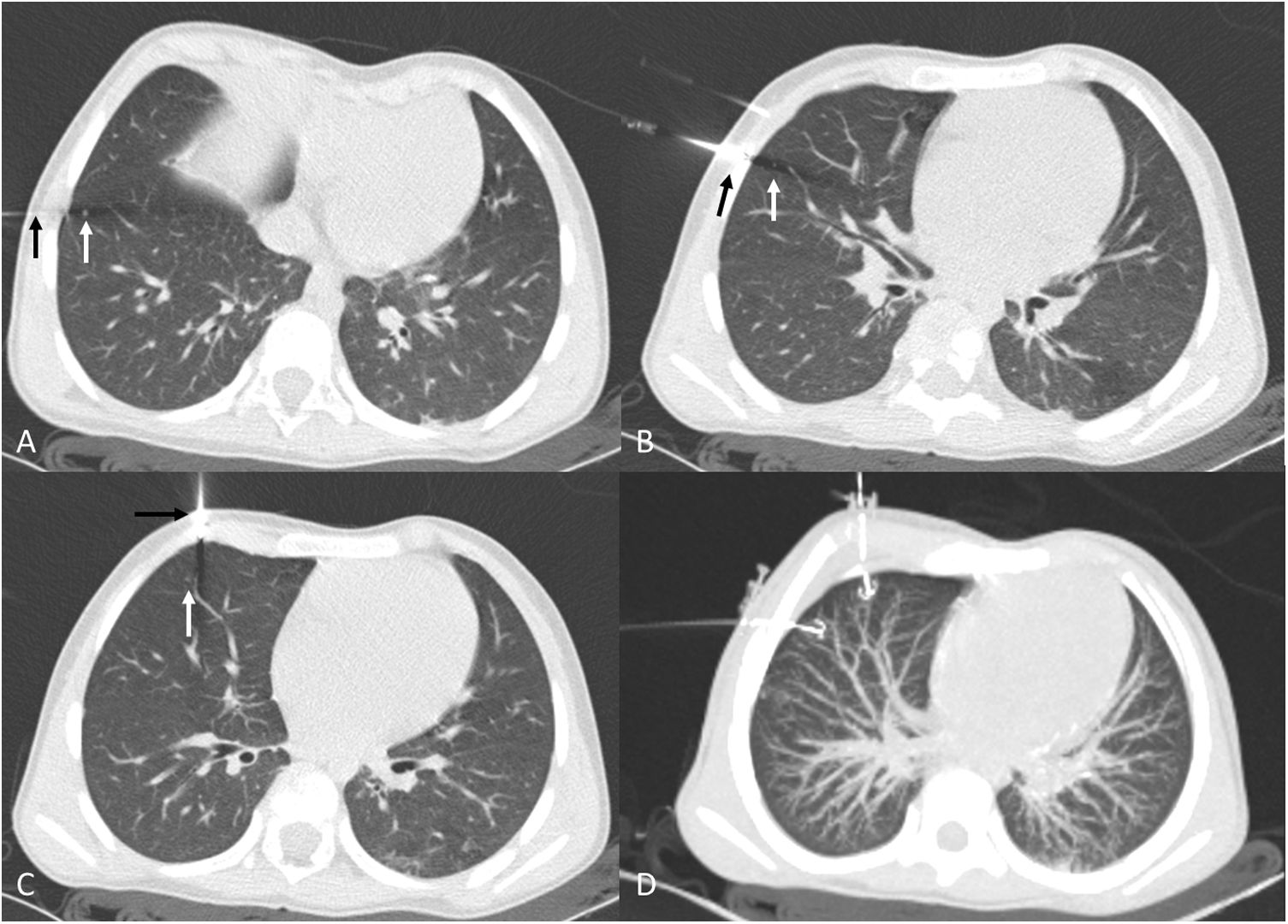
Varón de 12 años con antecedentes de osteosarcoma de fémur distal. A) Nódulo calcificado de reciente aparición en lóbulo superior izquierdo (flecha blanca). B) Abordaje perpendicular a la superficie pleural. Como las adquisiciones se realizan en apnea, los volúmenes pulmonares son más pequeños que en la imagen A, realizado en inspiración sostenida. C) Liberación del arpón. Mínimo neumotórax anterior, sin repercusión clínica. D) Reconstrucción MIP sagital de la liberación del arpón y su relación con el nódulo. Resultado anatomopatológico positivo para osteosarcoma.
Liberación del arpón adyacente al nódulo: sin necesidad de atravesarlo para evitar la infrecuente diseminación tumoral a lo largo del trayecto. La liberación del arpón muy sobrepasado el nódulo tampoco es aconsejable, ya que esto provoca una resección innecesaria de mayor cantidad de tejido pulmonar no patológico.
Marcaje de nódulo único:- •
Se marca la altura y el nivel del nódulo pulmonar mediante marcas cutáneas y guía con láser de TC, se prepara el campo estéril y se avanza la aguja precargada.
- •
Se realiza un control en mitad del procedimiento con la aguja ya insertada en la pared torácica, pero sin llegar a la superficie pleural.
- •
Si la dirección es correcta, se avanza la aguja precargada con el arpón hasta la profundidad que hayamos medido en las imágenes fuente desde la piel hasta llegar a la altura del nódulo o sobrepasarlo muy ligeramente. Se comprueba la posición y se libera el arpón.
- •
Si el paciente presenta varios nódulos que requieren resección, se podrá realizar un pulmón por procedimiento (fig. 5) o bien todos los nódulos de localización anterior (fig. 6) en un procedimiento y los posteriores en otro. La técnica es similar al nódulo único con algunas consideraciones específicas.
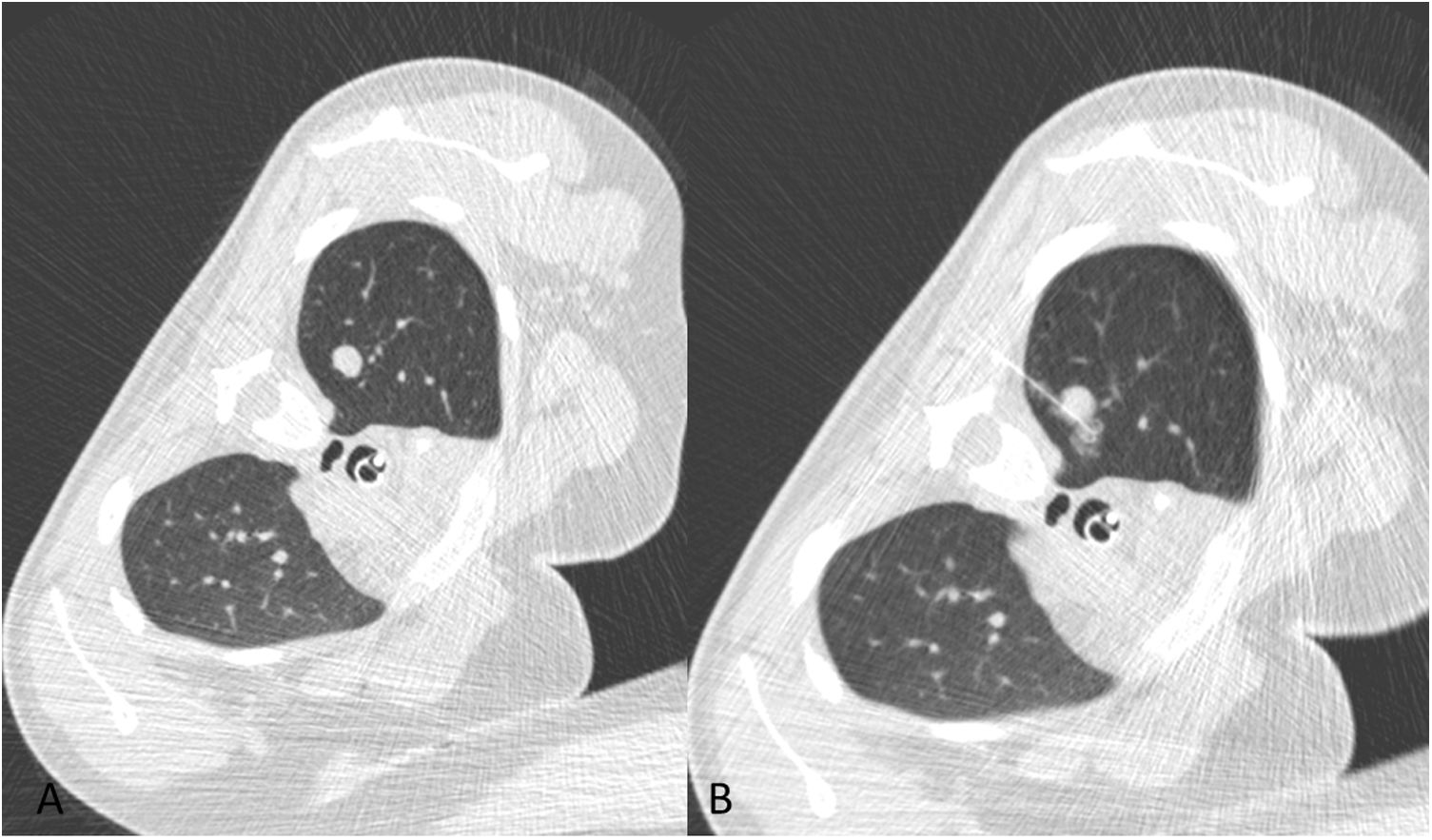
Figura 5.Colocación simultánea de tres arpones pulmonares en paciente de 8 años con antecedente de nefroblastoma y nódulos pulmonares a fin de tratamiento precirugía. Pese al pequeño tamaño de los mismos (3 mm) se decidió en comité determinar si quedaba tumor viable en dichos nódulos para definir la longitud del tratamiento con AVD (actinomicina-vincristina-doxorrubicina). A) Presentación de localización (flecha negra) de nódulo (flecha blanca) en lóbulo inferior derecho. B) Presentación de localización (flecha negra) de nódulo (flecha blanca) en segmento lateral de lóbulo medio (LM). C) Presentación de localización (flecha negra) de nódulo (flecha blanca) en segmento medial de LM. D) Reconstrucción MIP axial de los arpones liberados en LM. El resultado anatomopatológico fue negativo para malignidad.
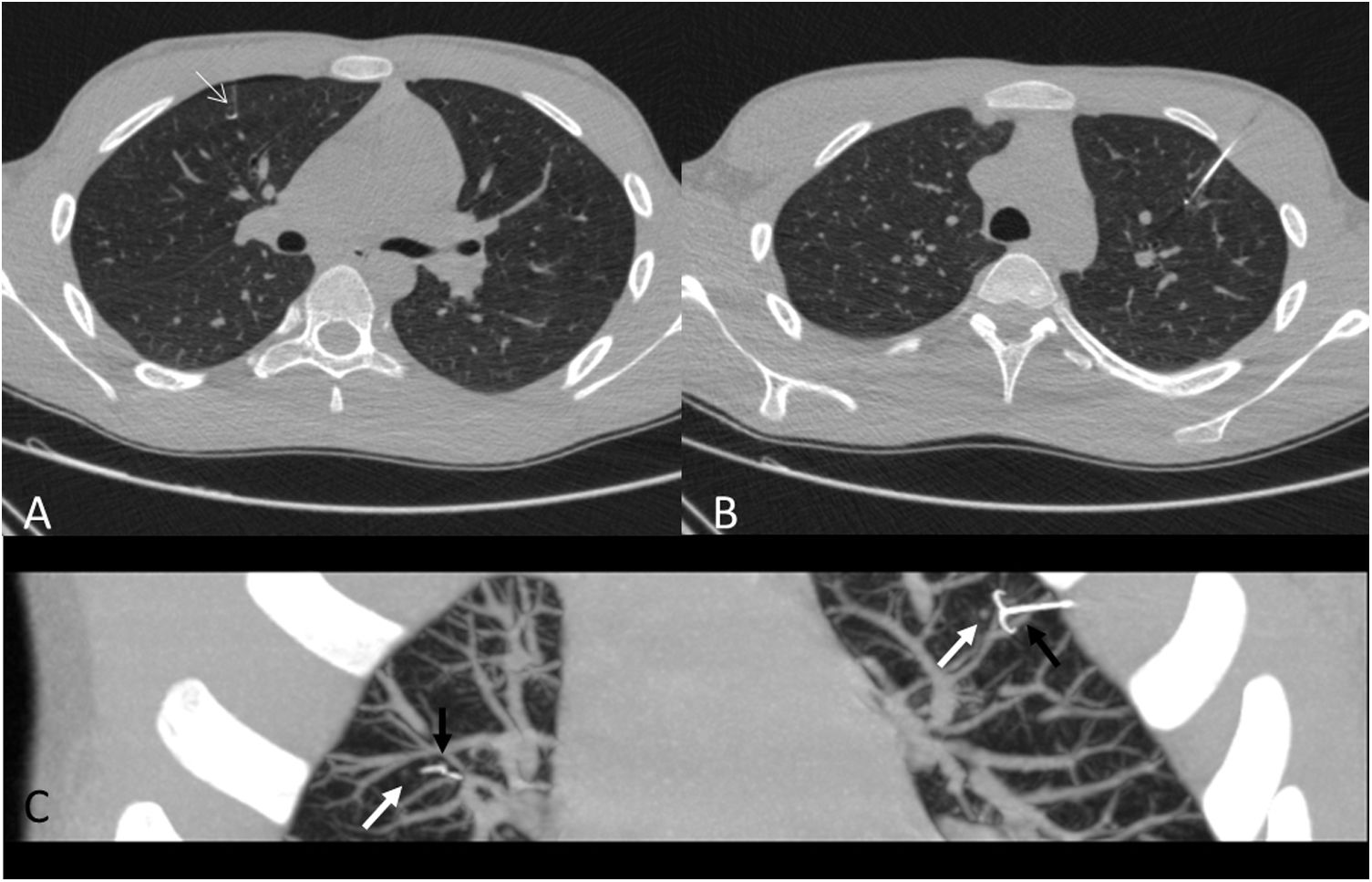
Figura 6.Colocación de un arpón en cada pulmón para marcaje de dos nódulos de localización anterior en paciente de 14 años con antecedente de sarcoma epitelioide, que fueron negativos para malignidad. A) Localización de nódulo (flecha blanca) en lóbulo superior derecho. B) Localización de nódulo en lóbulo superior izquierdo. C) Reconstrucción MIP oblicua que demuestra la liberación simultánea de ambos arpones (flechas negras) adyacentes a los nódulos milimétricos (flechas blancas).
- •
Se avanzan las agujas por la pared torácica hasta quedar cercanas a la superficie pleural, de forma similar al nódulo único. Se reposicionan las agujas que no hayan quedado en el sitio adecuado sin contactar con la superficie pleural.
- •
Se avanzan todos los arpones a la vez hasta que cada uno haya llegado o sobrepasado ligeramente su nódulo. Es importante realizar este paso de forma simultánea en vez de consecutiva, porque la aparición de un neumotórax modifica la localización del resto de los nódulos, por lo que habría que reposicionar las agujas aumentado el tiempo del procedimiento y la dosis impartida al paciente.
El pulmón es un órgano en permanente movimiento y esto favorece el movimiento del arpón y su desalojo. En niños, la tasa de desalojo es mayor que en adultos, ya que el espesor de la pared torácica es muy pequeño y el arpón penetra en el pulmón del paciente escasos centímetros12. Algunos autores proponen evitar la musculatura subescapular, ya que contracciones inadvertidas de esta pueden desalojar con mayor facilidad el arpón9.
Se ha descrito que la fijación del arpón a piel aumenta la tasa de desalojos13,17. Sin embargo, otros autores consideran que una correcta fijación del arpón a piel es indispensable para evitar su desalojo accidental durante la transferencia a la cama y el traslado del paciente a la sala quirúrgica18.
Implementaciones de la técnicaLa existencia de salas quirúrgicas híbridas con una TC mejora significativamente todos los aspectos de la técnica:
- •
La seguridad del paciente, ya que no es necesario ni la transferencia a una cama, ni el traslado al quirófano (con paciente anestesiado), ni la ulterior transferencia del paciente a la mesa quirúrgica.
- •
Disminuye la tasa de desalojo accidental del arpón, porque disminuye el tiempo entre el marcaje y la cirugía.
- •
En caso de marcar con tinción, disminuye el riesgo de diseminación del tinte aplicado al resto del pulmón.
- •
Disminuye la probabilidad de formación de un neumotórax clínicamente significativo.
- •
Disminuye el tiempo quirúrgico y de anestesia.
Se han descrito técnicas combinadas en las que el nódulo se marca con azul de metileno o con sangre autóloga12 y con arpón (técnica dual); así, si se produjese un desalojo del arpón, el área pulmonar permanece marcada con la tinción. El azul de metileno como método de marcaje único difunde fácilmente13 por el tejido pulmonar y por tanto la resección suele ser más amplia que la verdaderamente requerida. También se pueden emplear dos arpones con distintas vías de entrada para marcar el mismo nódulo.
La punción con sistema de navegación avanzado disminuye el tiempo de planificación, la duración del procedimiento, la dosis administrada al paciente y mejora la tasa de éxito, por lo es muy recomendable17.
Radiografía de la pieza: si existen dudas sobre la resección íntegra del nódulo, se puede realizar una radiografía de la pieza con técnica mamográfica. La ecografía para la detección del nódulo pulmonar en la pieza no suele ser rentable, ya que el nódulo queda muchas veces en el centro de la pieza de resección, con aire alrededor y por tanto no es visible mediante el ultrasonido (fig. 7).
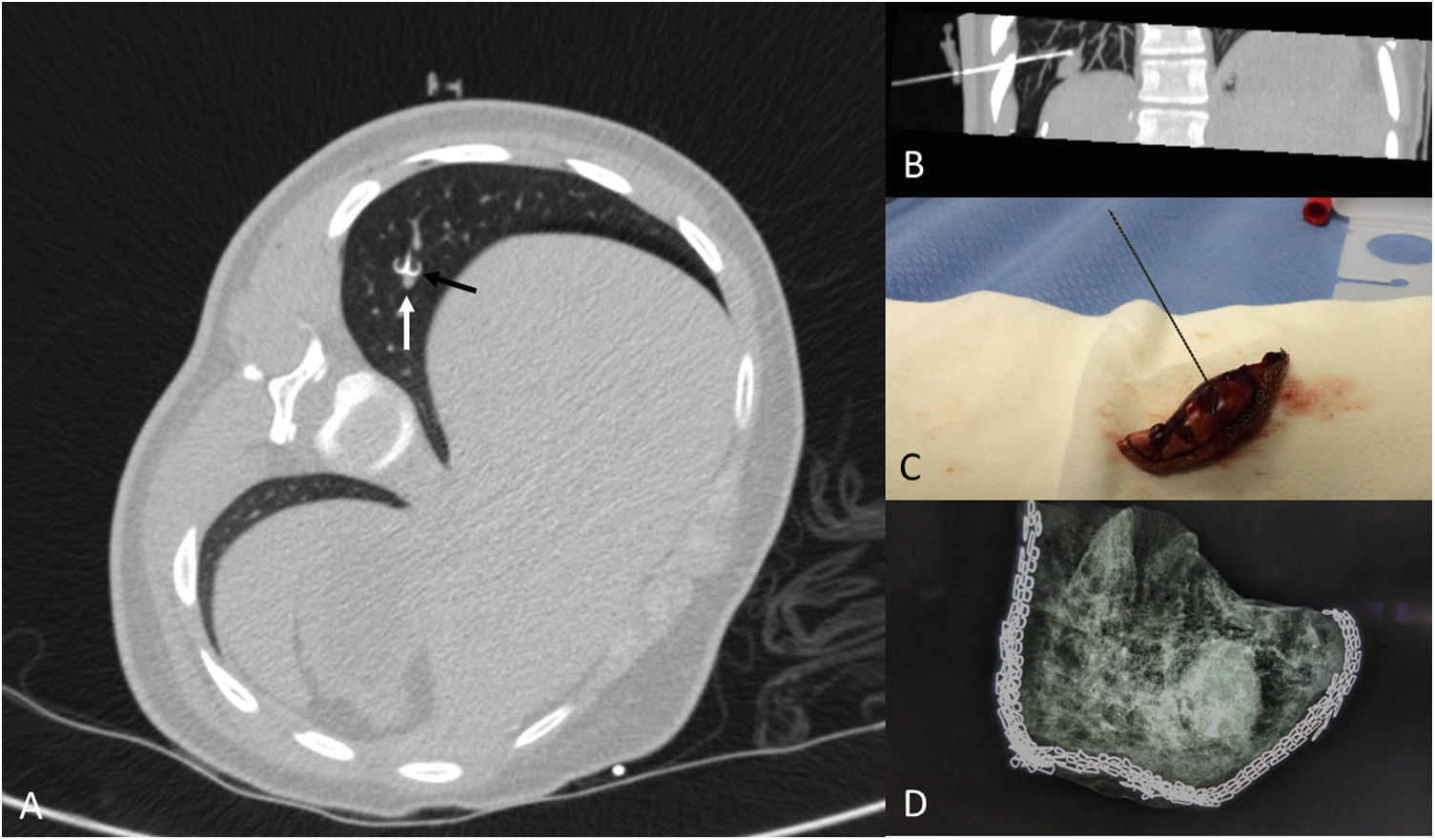
Paciente de 15 años con antecedentes de sarcoma indiferenciado hepático. Aparición de un nódulo pulmonar en base pulmonar derecha durante el tratamiento, que resultó positivo para sarcoma indiferenciado. A) Localización con arpón (flecha negra) del nódulo (flecha blanca). B) Reconstrucción MIP parasagital oblicua demostrando la situación del marcador respecto al nódulo. C) Pieza de segmentectomía atípica. D) Radiografía de la pieza con técnica mamográfica en la que se demuestra la inclusión de todo el nódulo.
En el bloque quirúrgico se retiran los paños en los que viene recubierto el arpón y se preparará de nuevo el campo estéril.
En todos los casos se requerirá ventilación unipulmonar:
- •
En pacientes mayores de 6-8 años, se emplea un tubo endotraqueal (TET) de doble luz (de 26 F o mayor).
- •
En pacientes más jóvenes en los que un 26 F no cabe, se considerará:
- –
La introducción selectiva del TET en el pulmón contralateral, con o sin broncoscopia previa18.
- –
La inserción de un catéter con balón (Fogarty) o bloqueador bronquial en el pulmón ipsilateral.
- •
En los casos en los que el colapso del pulmón no sea adecuado, se insufla aire al hemitórax con una presión de insuflación de 4-6mmHg.
Colocación del paciente y del personal. Se aprovecha la gravedad para mejorar la visualización, de manera que el segmento de pulmón quede “colgando” del arpón. Es importante además una ergonomía en el trabajo que mantenga “en línea” y por este orden a cirujano-paciente-monitor: en los nódulos pulmonares, la posición de partida será un decúbito lateral, con mayor inclinación posterior (si el nódulo es anterior) o anterior (si el nódulo es posterior).
Colocación del cirujano. En general, el cirujano debe situarse en la espalda del paciente si la lesión es más anterior y en el frente si la lesión está situada posterior18.
En ocasiones es posible realizar una toracoscopia de forma bilateral: esta técnica se reserva para pacientes que pueden ser operados en decúbito supino. Si el marcaje de ambos hemitórax no es posible en esa posición, es preferible hacerlo en dos tiempos.
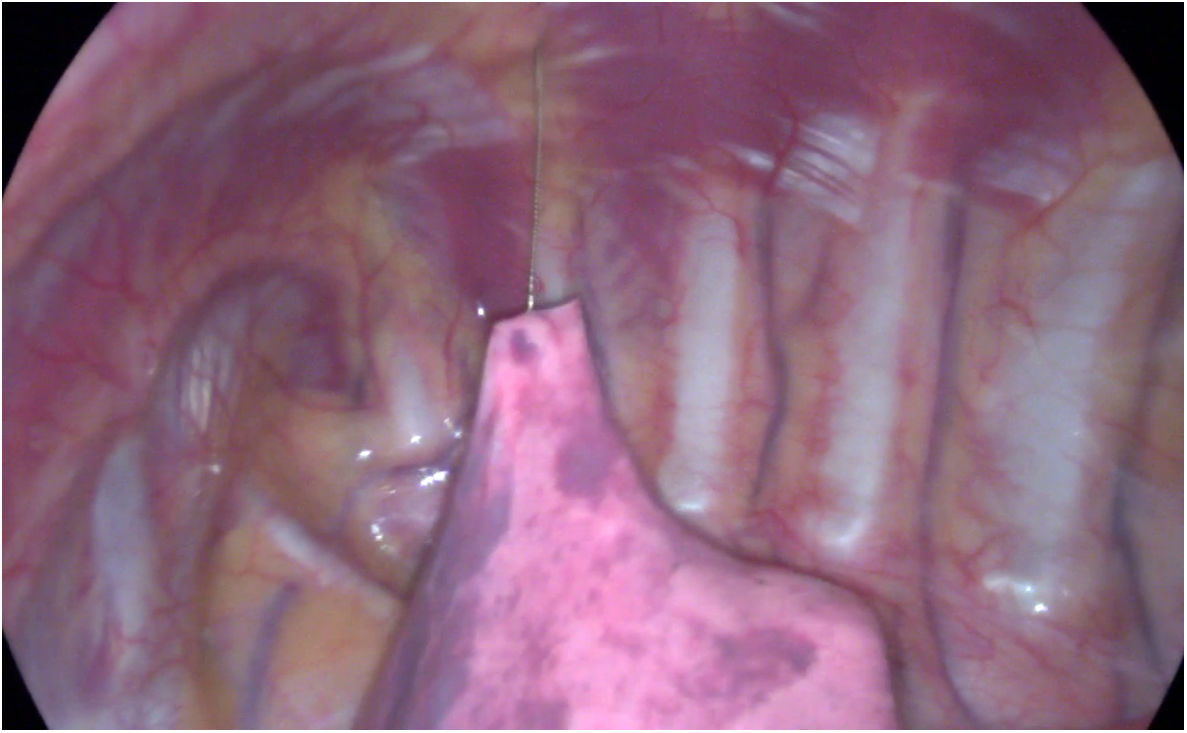
Procedimiento. Se pueden emplear dos o tres puertos de trabajo: si el arpón está bien anclado, es el propio arpón el que nos sirve de sujeción, por lo que nos ahorramos el trocar de apoyo (fig. 8 y vídeo en el material adicional):
- 1.
El primer trocar de 5 mm para lente de 30° se coloca en línea axilar media, en el quinto espacio intercostal. A través de este se insufla en la cavidad pleural CO a flujos (1 lpm) y presiones (4 mmHg) bajas, para ayudar a colapsar el pulmón lentamente y evitar el desalojo del arpón. Es útil tratar de colocar el trocar de la cámara lo más lejos posible de la lesión para que esté fuera del camino de los trocares de trabajo.
- 2.
El segundo puerto de trabajo puede ser una incisión mínima, en ocasiones hasta sin utilización de trocar, a través de la cual se introduce directamente un instrumento de resección (grapadora o endoloop) de 3 mm de diámetro en la cavidad torácica. Esto aporta dos ventajas:
- a)
Mayor movilidad con un instrumento colocado directamente a través del espacio intercostal, ya que el trocar entre las costillas puede impedir ciertos grados de angulación.
- b)
Económica al utilizar la menor cantidad de cánulas posible.
Para la resección del segmento atípico se emplean endoloops o grapadoras de 5 mm en menores de 10 kg y grapadoras en mayores de 10 kg. Por su tamaño, la endograpadora requiere un cierto espacio para su apertura; por tanto, es importante colocar el segundo puerto lejos de la lesión para que haya suficiente espacio para abrirla. El desarrollo de grapadoras anguladas ha permitido una mejora de la técnica para ligar y dividir el parénquima pulmonar en la resección en cuña.
- 3.
El tercer puerto de trabajo puede ser prescindible si el arpón está bien anclado al parénquima pulmonar o bien puede consistir en un trocar de apoyo para sujetar el pulmón.
Una vez resecado el segmento, se corta el alambre del arpón a ras de piel y se recupera la pieza dentro de una endobolsa para prevenir recurrencias en el sitio del puerto. En general, no se recomienda la morcelación de muestras tumorales. Para la mayoría de las biopsias, la bolsa de 10 cm es suficiente y puede introducirse a través del puerto en el que también se inserta la grapadora. Es de vital importancia no extraer una muestra que sea demasiado grande a través de un puerto pequeño, ya que existe la preocupación de que al romper la bolsa se derrame la muestra, lo que podría conducir a la implantación alrededor de la superficie parietal de la cavidad torácica o al puerto. Por lo tanto, ante la duda, se debe ampliar el orificio por el que se extrae la pieza.
La biopsia se introduce en formol y se envía a radiología para valorar si se ha resecado completamente el nódulo en caso de duda o desalojo accidental, o directamente a anatomía patológica para su estudio histológico (fig. 7).
Cuidado postoperatorioSe deja colocado un drenaje torácico, generalmente a través del sitio del trocar más bajo. Se ajusta a succión a 15-20 cm de presión de agua. Los otros sitios de entrada se cierran con sutura absorbible.
El tubo endotraqueal se vuelve a introducir en la tráquea o se retira el bloqueador y se vuelve a insuflar el pulmón. Si no hay evidencia de una fuga de aire, se puede extraer el drenaje torácico y aplicar un vendaje oclusivo antes de la extubación en el quirófano. Si hay una pequeña fuga de aire, puede dejarse el tubo torácico hasta que se haya resuelto.
El dolor suele controlarse de forma adecuada con analgesia intravenosa durante las primeras 12-24 horas. El paciente inicia tolerancia el día de la cirugía y es dado de alta tan pronto como se sienta cómodo con los analgésicos orales y tolere una ingesta oral adecuada (entre 48-72 horas tras la cirugía).
ComplicacionesDe la localización percutáneaLa más frecuente es el neumotórax asintomático, que se ha descrito entre el 4,3% y el 50% de los procedimientos9,13. Es muy rara la aparición de neumotórax sintomáticos que requieran drenaje.
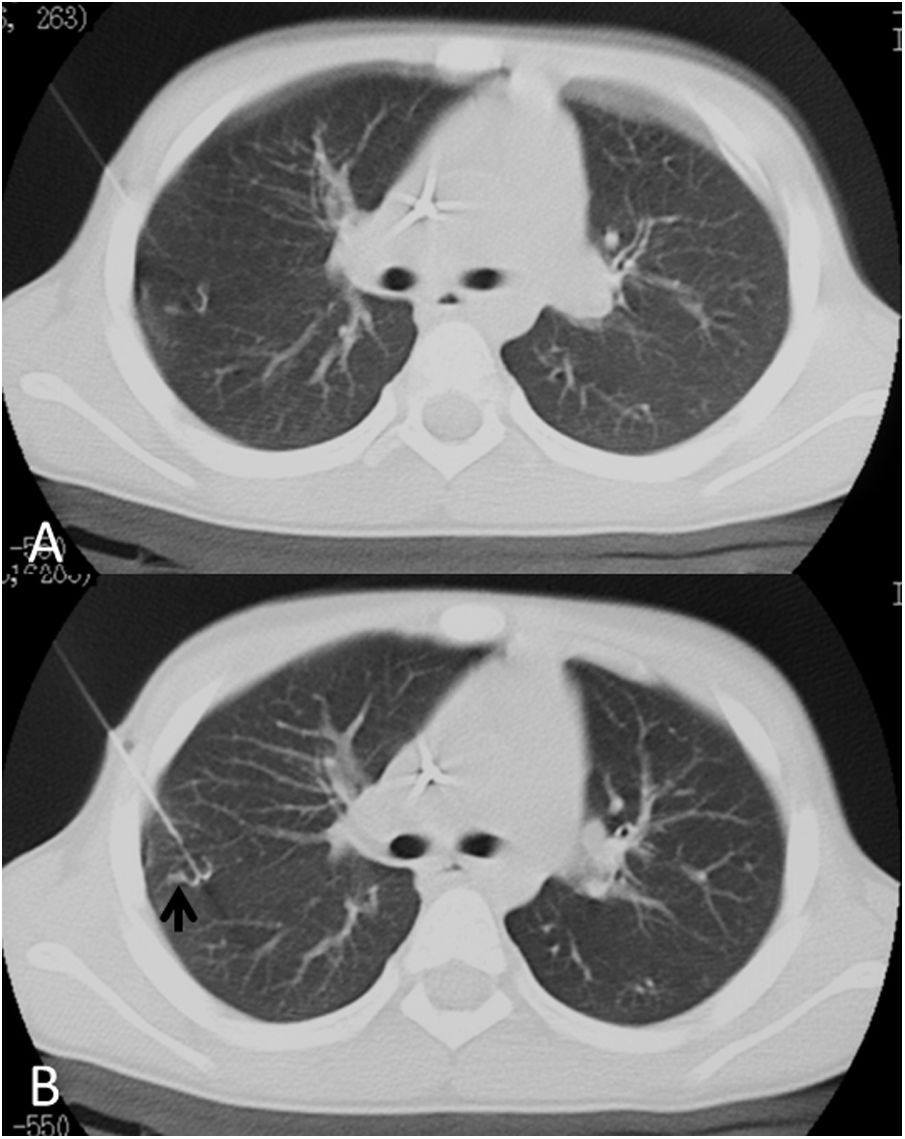
Se puede observar un aumento de densidad a lo largo del trayecto del arpón en relación con hemorragia, lo cual es también muy frecuente, siendo raras las hemorragias sintomáticas que provoquen hemoptisis significativas o hematoma pleural (fig. 9).
Paciente de 16 años con osteosarcoma de isquion y múltiples nódulos pulmonares, con el resultado de nódulos parcialmente calcificados sin evidencia de enfermedad viable. A) Nódulo no calcificado en lóbulo superior izquierdo. B) Localización con arpón y aparición de un área de vidrio deslustrado en la zona de liberación compatible con pequeña hemorragia.
Puede producirse un fallo en la localización del arpón: por desalojo del arpón antes o durante la cirugía con mayores tasas en niños (de alrededor del 20%) que en adultos12; por avance del mismo a más de 4 cm de la profundidad del nódulo.
De la toracoscopiaDe la cirugía: hemorragia intraoperatoria secundaria a la manipulación del pulmón; lesión de estructuras intratorácicas –de carácter excepcional– que incluye la perforación esofágica, lesiones nerviosas o de grandes vasos; neumotórax residual; infección de la herida quirúrgica; intolerancia al material de sutura (granuloma secundario); dolor torácico posquirúrgico.
En el postoperatorio: desprendimiento de las grapas que ocasionen una fístula broncopleural, infección o discrasia sanguínea19.
ConclusiónDescribimos la técnica de localización de nódulos pulmonares y posterior resección toracoscópica en pacientes oncológicos pediátricos, las indicaciones de estas y ofrecemos algunos aspectos prácticos para mejorar la técnica.
Autoría- 1.
Responsable de la integridad del estudio: CGH.
- 2.
Concepción del estudio: CGH, MLD, DCR, MRP.
- 3.
Diseño del estudio: CGH, DCR, MRP.
- 4.
Obtención de los datos: CGH, MLD, DCR, MRP, MCCC.
- 5.
Análisis e interpretación de los datos: CGH, MLD, DCR, MRP, MCC.
- 6.
Tratamiento estadístico: N/A.
- 7.
Búsqueda bibliográfica: CGH, MCC.
- 8.
Redacción del trabajo: CGH, MLD.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MLD, DCR, MRP, MCC.
- 10.
Aprobación de la versión final: CGH, MLD, DCR, MRP, MCC.
Los autores declaran no tener ningún conflicto de intereses.