Suplemento:Actualización y buenas prácticas en los usos de los medios de contraste
Más datosLos medios de contraste yodados (MCI) permiten obtener una mayor atenuación de las estructuras vasculares y viscerales en los estudios radiológicos y son ampliamente utilizados por su buen perfil de seguridad, fácil administración, aceptable tolerancia, amplia distribución y rápida excreción que vienen determinadas por su composición.
La administración de los medios de contraste (MC) se realiza mediante bombas automáticas. Una vez inyectados, se distribuyen en el organismo, en un primer paso intravascular, para posteriormente alcanzar los órganos y difundir al espacio intersticial extracelular, acompañado de un fenómeno de recirculación.
En un estudio de tomografía computarizada (TC), la atenuación obtenida con un MC vendrá determinada por múltiples factores que dependen del paciente, características del MC, su forma de administración, del equipo y técnica empleados para el estudio. Existen diferentes métodos para determinar el retraso con el que se inicia la adquisición, que dependerá del objetivo de la exploración.
Iodinated contrast media enable greater attenuation of vascular and visceral structures in radiological studies and are widely used due to their high degree of safety, easy administration, acceptable level of tolerance, wide distribution and rapid excretion, qualities determined by their composition.
Automated power injectors are used to administer contrast media. Once injected, contrast is distributed throughout the body, remaining in the intravascular space during its first passage before reaching the organs and spreading into the extracellular interstitial space, followed by a recirculation phenomenon.
In CT studies, the level of contrast enhancement obtained is determined by multiple factors including patient-related factors, contrast medium characteristics, method of administration, equipment and technique. Different methods are available for determining the scan timing depending on the aim of the exploration.
Los medios de contraste yodados (MCI) son ampliamente utilizados en el diagnóstico radiológico por su buen perfil de seguridad, fácil administración, aceptable tolerancia, amplia distribución y rápida excreción. Su aplicación principalmente corresponde a la realización de tomografías computarizadas (TC), angiografías, estudios enterales o para el estudio del sistema urinario, entre otros, actuando como contrastes positivos por su capacidad para aumentar la atenuación de los rayos X por los órganos y estructuras vasculares.
Desarrollo y evolución de los medios de contraste yodados: recuerdo históricoEl uso de los medios de contraste (MC) se inició por Haschel et al., que obtuvieron la primera angiografía inyectando un medio basado en mercurio, parafina y cal a una mano amputada1 apenas un mes después del descubrimiento de los rayos X. La utilización del yodo como contraste radiológico surgió en la década de 1920 en estudios urográficos de forma directa2 y posteriormente vía intravenosa3. Otros elementos como el mercurio, torio, plata o plomo se descartaron por toxicidad.
Los primeros contrastes yodados fueron bastante tóxicos, pero en la década de 1920 se empezaron a utilizar ampliamente otros menos tóxicos y más solubles como Selectan® y Uroselectan®. Reformulaciones posteriores dieron lugar a los MCI iónicos hiperosmolales que se usan actualmente4. Torsten Almén, radiólogo sueco, preocupado por el dolor que sufrían algunos pacientes con la administración del contraste yodado iónico, desarrolló en 1969 el primer contraste yodado no iónico hipoosmolal (metizamida)5, que sirvió de base para el desarrollo de nuevos contrastes.
ComposiciónLas moléculas de los diferentes MCI están constituidas fundamentalmente por un anillo de benceno asociando tres átomos de yodo y tres radicales de forma alterna (fig. 1A), obteniéndose así un fármaco estable y reduciendo el riesgo de toxicidad por liberación del yodo.
Los radicales de yodo son los responsables de interaccionar con los rayos X y conseguir el aumento de atenuación de los mismos, como se discutirá posteriormente.
Los radicales unidos a los tres átomos de carbono restantes aumentan la solubilidad de la molécula y facilitan su eliminación. Dependiendo de su composición, estos radicales pueden asociar o no cargas iónicas, existiendo, por tanto, contrastes iónicos y no iónicos, lo que modifica las características fisicoquímicas del fármaco.
Inicialmente los MCI se formularon con un anillo de benceno (monómeros) y posteriormente se desarrollaron contrastes diméricos, con dos anillos de benceno. Los contrastes yodados díméricos permiten portar seis átomos de yodo en una sola molécula, lo que altera sus propiedades e incrementa la atenuación de la radiación6.
Como otros fármacos, los MCI también llevan excipientes, principalmente para mantener un pH neutro o similar a la sangre, evitando alterar el equilibrio ácido-base y la irritación vascular7.
Propiedades fisicoquímicasSolubilidadLa solubilidad en agua es indispensable para su uso intravascular y está facilitada por los radicales unidos al benceno. Se puede conseguir de dos formas: con radicales de tipo sal, lo cual tiene importantes efectos en la ionicidad y osmolalidad, como se verá más adelante (amidotrizoato de sodio y meglumina); o con radicales de tipo hidroxilo, éter y/o amida, que interaccionan con las moléculas de agua aumentando la hidrofilia (iohexol).
IonicidadLos contrastes yodados pueden diferenciarse en contrastes iónicos y no iónicos.
Los iónicos fueron los primeros en desarrollarse. Para aumentar la solubilidad uno de los radicales está constituido por una sal unida a una molécula (sodio, meglumina o calcio), que al diluirse se disocia, resultando dos moléculas: por un lado, un anión (anillo de benceno y yodo) y por otro un catión (fig. 1B).
Los contrastes no iónicos tienen otras moléculas para aumentar la solubilidad y al diluirse se disocian no produciendo cargas iónicas.
Ambos pueden ser monómeros o dímeros, según tengan uno o dos anillos de benceno en su molécula.
OsmolalidadLa osmolalidad corresponde a la concentración de una disolución, definiéndose como el número de partículas por unidad del disolvente en kilogramos.
Los contrastes yodados, poseen generalmente una osmolalidad mayor que la sangre (290 mOsm/kg). Se clasifican en hiperosmolales (cuatro y siete veces la osmolalidad sanguínea, mayor de 1.400 Osm/kg), hipoosmolales (alrededor de dos veces la osmolalidad sanguínea, 400-800 mOsm/kg) y los isoosmolales (osmolalidad similar a la sanguínea).
Los contrastes yodados monoméricos iónicos cuando se disuelven se disocian en dos partículas, lo que supone un aumento de partículas en disolución y por tanto de la osmolalidad, lo cual se relaciona con mayor tasa de eventos adversos, como la nefrotoxicidad8,9. Por ello, el uso de contrastes iónicos para uso intravascular ha disminuido, administrándose preferentemente de forma enteral o intracavitaria. Los dímeros iónicos producen menor número de partículas en disolución a igual concentración de yodo que los monómeros, resultando en contrastes hipoosmolales (tabla 1).
La osmolalidad también está relacionada con la concentración de yodo según la presentación comercial utilizada (expresada en mg/mL de yodo), aumentando la osmolalidad con la concentración (por aumento del número de moléculas por mL).
ViscosidadLa viscosidad corresponde a la resistencia de un fluido a deformarse. Esta propiedad depende del tamaño de la molécula (mayor viscosidad en los dímeros), de la concentración (a mayor concentración mayor viscosidad), de la solubilidad y de la temperatura (aumenta con menor temperatura).
La viscosidad aumentada produce un enlentecimiento de la microcirculación, que podría estar relacionado con el daño renal10, y repercute en la velocidad de administración. Para disminuir estos efectos, los contrastes se calientan previamente a su administración.
Cantidad de yodoLa capacidad de atenuación del contraste yodado depende, entre otros factores, de la cantidad de yodo que tenga el contraste, siendo mayor por molécula en los contrastes diméricos que en los monómeros. La cantidad de yodo también dependerá de la concentración de la presentación farmacéutica elegida y del volumen de contraste administrado.
Clasificación y formas de presentación de los medios de contraste yodadosSegún lo expuesto, los contrastes pueden clasificarse en monómeros iónicos, dímeros iónicos, monómeros no iónicos y dímeros no iónicos (tabla 1). Un ejemplo de los contrastes más habituales se muestra en la tabla 2.
Ejemplos de medios de contraste yodado habituales en nuestro entorno
| Composición | Principio activo | Nombres comerciales | Osmolalidad |
| Monómero iónico | Amidotrizoato meglumina | Radialar® | Alta |
| Amidotrizoato de sodio y meglumina | Trazograf® Urografín® Pielograf ® Gastrografín ® | ||
| Amidotrizoato de sodio, meglumina y calcio. | Plenigraf® | ||
| Dímero iónico | Ioxaglato meglumina | Hexabrix® | Baja |
| Monómero no iónico | Iopamidol | Scanlux® Iopamigita® Iopamiro® | Baja |
| Ioversol | Optiray® | ||
| Iohexol | Omnipaque® Iohexol® Omnitrast® | ||
| Iobritridol | Xenetix® | ||
| Iomeprol | Iomeron® | ||
| Ioversol | Optiray® | ||
| Iopromida | Ultravist® Clarograf® | ||
| Dímero no iónico | Iodixanol | Visipaque® | Isoosmolar |
Además, se emplea ocasionalmente el lipiodol, que es un contraste yodado liposoluble utilizado inicialmente para broncografías, histerosalpingografías y mielografías. En la actualidad está prácticamente en desuso, utilizándose en linfangiografías y esporádicamente en quimioembolizaciones hepáticas4.
Los MCI pueden presentarse en diferentes concentraciones, que varían entre 200 y 400 mgI/mL. También existen diferentes formas de presentación, desde envases monodosis a multidosis, generalmente de 500mL, así como jeringuillas precargadas.
Bases físicas de la atenuación de los rayos X por el contraste yodadoLas imágenes de los estudios TC representan la atenuación del haz de rayos X al atravesar los tejidos que forman parte del objeto de estudio. El coeficiente de atenuación de los tejidos representa la capacidad de reducir la intensidad de radiación incidente y se obtiene midiendo la cantidad de radiación que alcanza los detectores tras atravesar los tejidos y comparándola con la cantidad de radiación emitida. Depende del material, su número atómico (Z) y densidad, y de la energía del haz incidente.
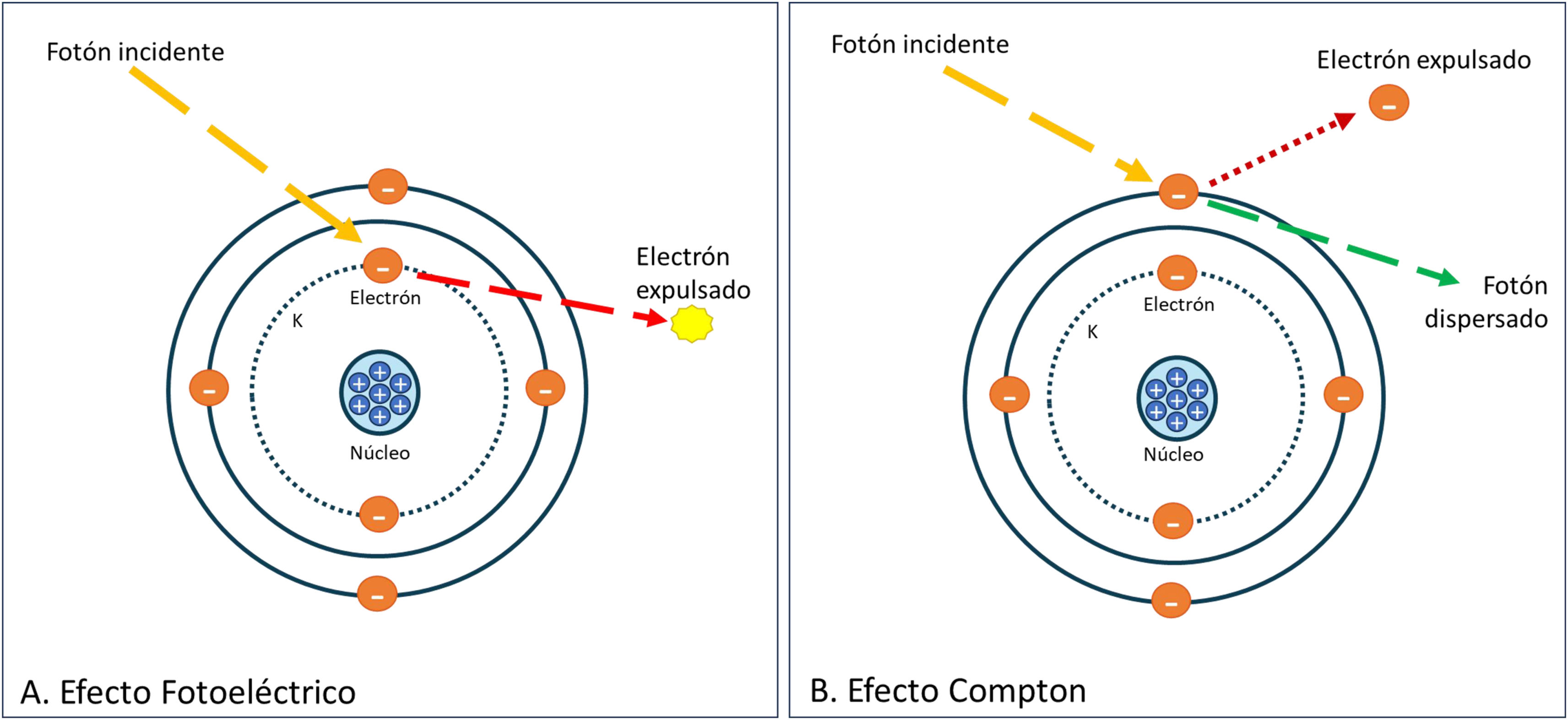
Habitualmente se emplea una diferencia de potencial de 120 kVp, que genera un haz de radiación con un espectro continuo de energías desde 0 a 120 keV, el cual interactúa con el material que atraviesa. Las dos interacciones principales que se producen en este rango de energías son el efecto fotoeléctrico y el efecto Compton11–13 que se representan en la figura 2.
El efecto fotoeléctrico resulta de la interacción del fotón con un electrón de las capas más internas, con mayor energía de ligadura. La capa K es la más fuertemente ligada al núcleo. El fotón es absorbido y el electrón se libera. Para que se produzca esta interacción la energía del fotón debe ser superior a la energía de unión de la capa del electrón al núcleo. La probabilidad de producirse este efecto aumenta con valores de keV justo por encima de la energía de ligadura de la capa k, conocida como «k-edge». Esta energía de unión varía para cada elemento y aumenta a mayor número atómico. A mayor densidad de elementos con alto Z, mayor será la probabilidad de efecto fotoeléctrico.
El efecto Compton se produce por la interacción con los electrones de las capas más externas y casi libres. En este fenómeno el fotón incidente cambia de dirección y cede parte de su energía al electrón.
En los estudios a bajas diferencias de potencial (40-70 kVp) o cuando mediante tecnología espectral analizamos la información obtenida a baja energía, nos acercamos al borde k del yodo, dominando el efecto fotoeléctrico, por el contrario, dicho efecto disminuye a medida que aumentamos el kilovoltaje (140-200 kVp)11–13.
En la práctica clínica, los vasos y tejidos que captan contraste tienen una mayor interacción con el haz de rayos X por un mayor efecto fotoeléctrico. Esto les proporciona una mayor atenuación con respecto al resto de estructuras, fenómeno que aumenta a menor kVp.
Con el uso de los diferentes equipos TC espectrales y softwares de postprocesado se pueden obtener imágenes monoenergéticas a partir de 40 keV, donde predomina el efecto fotoeléctrico y aumenta la atenuación de vasos y tejidos, especialmente cuando empleamos MCI en la exploración, visualizándose mejor. Por el contrario, a mayores valores (mayor de 140 keV), disminuye el efecto fotoeléctrico existiendo una menor atenuación de las estructuras, lo que permite una reducción de los artefactos14–16.
Bombas de inyección y sus posibilidadesLa administración de MC en sus inicios se realizaba mediante infusión o inyección manual. Esta resultaba ineficaz cuando se empezaron a cateterizar vasos en los que era imprescindible aumentar la presión de inyección, imposible de mantener para administrar un gran volumen. El flujo obtenido a través de un tubo cilíndrico hueco, como los catéteres intravasculares, viene determinado por la Ley de Poiseuille (fig. 3) en la que se determina que en la presión necesaria para garantizar el caudal (flujo) influyen la viscosidad del elemento a infundir, la longitud y el radio del tubo17. Como se ha visto, la viscosidad depende de la estructura química del MCI y es proporcional a su concentración e inversamente proporcional a su temperatura.
Determinantes de flujo a través de un catéter.
Adaptado de17
Por estos motivos, se introdujeron en la práctica radiológica las bombas de inyección17. Desde el principio, en su construcción se han empleado dos tecnologías18, la de pistón similar a la de una jeringa normal en la que un émbolo empuja el MCI o la solución, y la tecnología peristáltica, en la que el contenido es desplazado con la rotación de un mecanismo que comprime el tubo por el que transita la sustancia a administrar (fig. 4).
Tecnologías de infusión. A) Sistema de infusión de dos cabezales (SS y MC) de tecnología de pistón con alimentación continua para facilitar recarga. B) Sistema de infusión doble de SS y MC de tecnología peristáltica. En línea discontinua se muestra la porción de uso individual desechable para cada paciente.
Las bombas de inyección de contraste en la rutina asistencial cumplen un triple propósito: alejar al operador del punto de administración minimizando su exposición a radiación, conseguir una inyección adecuada en términos del flujo administrado y facilitar la reproducibilidad de las inyecciones.
Las inyecciones a alto flujo provocaban mayor número de reacciones adversas, especialmente náuseas, por lo que se beneficiaban del empleo de los MC no iónicos por su menor osmolalidad. Al ser estos más caros, Hopper et al.19 propusieron emplear un bolo de suero salino (SS) para disminuir el volumen empleado. Esta situación supuso un hito en los sistemas de inyección, ya que se generalizó el empleo de la administración concomitante del bolo de suero.
Otro ajuste necesario realizado como consecuencia de la administración de altos flujos ha sido la detección y la capacidad de control de la presión de inyección para evitar exceder la tolerancia de los materiales empleados en los catéteres ya que, de lo contrario, estos se romperían con riesgo de extravasación, inyección inefectiva o incluso embolismo intravascular. Se determina mediante el parámetro pounds per square inch (psi) referido a la fuerza, en libras, ejercida por el sistema de inyección en un punto determinado.
Con independencia de la tecnología empleada, todos los sistemas de inyección de contraste tienen unos elementos comunes fácilmente reconocibles20. Estos son un soporte mecánico que puede ser de suelo o techo, una cabeza inyectora equipada con mandos de manipulación y un sistema de control, generalmente a través de una pantalla táctil. Esta pantalla se instala de forma remota en la sala de control de la modalidad respectiva, y constituye un sistema informático que permite diseñar todos los aspectos críticos para el resultado de una administración de contraste como el tipo de sustancia a administrar (MC o suero), volumen, caudal deseado y fases de la administración.
Los avances tecnológicos permiten emplear el suero para realizar inyecciones de prueba evitando la extravasación, disminuir la cantidad de contraste empleado y reducir los artefactos asociados a endurecimiento del haz por altas concentraciones.
Son posibles el ajuste de caudal variable y la mezcla de contraste y suero a lo largo de la inyección, facilitando realce uniforme en exploraciones de alta complejidad como la TC cardiaca. El número de fases de administración de contraste es múltiple, permitiendo protocolos fraccionados (split bolus) de utilidad en aplicaciones como la urografía por TC o en el paciente politraumatizado, consiguiendo efectos combinados de realce de estructuras en una misma adquisición de imágenes.
Las bombas iniciales no estaban preparadas para manejar grandes volúmenes ni para emplearse en entornos de alta rotación de pacientes como los actuales. Como consecuencia de la necesidad de optimizar los tiempos empleados en la recarga de los sistemas inyección y minimizar la posibilidad de contagio cruzado al emplear el mismo equipo en pacientes sucesivos, los equipos han incorporado sistemas automáticos de recarga redundante tanto de suero como de contraste, generalizándose el empleo de válvulas antirreflujo y de porciones de la tubuladura-alargaderas de uso individual y desechables.
La incorporación de comunicación con el sistema RIS-PACS es una de las últimas capacidades añadidas, suponiendo un elemento de seguridad al garantizar la trazabilidad de la inyección para monitorizar cualquier evento de seguridad, facilitar el control de calidad en relación con el grado de realce obtenido en las imágenes y permitir la repetición de condiciones de inyección idéntica en estudios subsiguientes.
Las mismas necesidades (altos flujos de administración, protección del trabajador) y ventajas (reproducibilidad, etc.) obtenidas con las bombas de administración de contraste en las salas de angiografía y de TC justifican su empleo en otras modalidades de imagen como la resonancia magnética o la tomografía por emisión de positrones con TC (PET-TC), aunque en ambos casos las características de los entornos y de los MC (gadolinio y radiotrazadores marcados) obligan a adaptaciones en su diseño21,22.
En la tabla 3 se recogen las características que debería incluir un sistema avanzado de administración de MC para TC para garantizar un desempeño adecuado y seguro.
Características recomendadas para inyectores de medio de contraste para equipos de tomografía computarizada
| Requisito | Deseable | Opcional |
| Doble inyección Contraste- salino | Inyecciones multifase | Mezcla contrastes y flujos variables |
| Flujos al menos 3-5 mL/S | Protocolos grabables | Diagnóstico y monitorización remota |
| Volúmenes MC/SS 150 mL | Ligero | Conexión PACS/RIS |
| Registro Datos inyección | Autónomo de corriente | Detección de fugas de contraste |
| Detección aire en sistema y parada | Detección extravasación | Limitación automática uso fungible |
| Detección sobrepresión y parada | Flujos 1-7 mL/s en intervalos de 0,5 mL | Optimización contraste individualizada |
| Parada automática sistema | KVO | |
| Inyección remota | Volúmenes MC/SS mayores 150 mL | |
| Fungible asequible | Fácil accesibilidad |
MC: medio de contraste; SS: suero salino; KVO: mantenimiento de vía abierta.
Adaptado de Friebe M. 201617.
El realce es el aumento de la atenuación (en Unidades Hounsfield) de una estructura entre un estudio sin y otro con contraste intravenoso. Este aumento está directamente relacionado con la concentración plasmática y tisular del contraste yodado. Es necesario conocer la distribución temporal del MCI para adquirir el estudio con la o las fases adecuadas según la sospecha diagnóstica.
DistribuciónLa vía más frecuentemente utilizada es la vía intravascular intravenosa. En esta, el MCI pasa al torrente venoso de la circulación sistémica y sigue su curso a cavidades cardiacas derechas, circulación pulmonar, cavidades cardiacas izquierdas y retorna a la circulación sistémica, primero por el territorio arterial, luego a órganos y tejidos, para después volver al torrente venoso.
Los MCI comercializados tienen una farmacocinética muy similar. Son moléculas pequeñas, de distribución extracelular y baja tasa de unión a proteínas (1-3%), lo que le otorga una alta capacidad para difundir al espacio intersticial. El transporte está limitado por el flujo vascular.
Tras la administración intravenosa, la concentración del MCI en sangre sigue un modelo de distribución en dos fases23:
- 1.
Fase alfa o de distribución: la concentración plasmática del MCI alcanza su punto máximo tras la inyección. Posteriormente, el MCI difunde rápidamente al espacio intersticial de los distintos tejidos y órganos. En esta primera parte la concentración plasmática presenta una pendiente pronunciada descendente hasta alcanzar un equilibrio entre las concentraciones plasmática e intersticial a los minutos de la inyección. Esta distribución no es homogénea, depende de factores como la perfusión, permeabilidad de la microvasculatura, volumen del órgano y composición del tejido. Se reconocen dos compartimentos, el central, vascular y órganos bien perfundidos (riñón, bazo, hígado), con un mayor realce en la circulación inicial o primer paso, y el periférico representado por los tejidos peor perfundidos (músculo, tejido adiposo o hueso) que muestran menos realce.
- 2.
Fase beta o de eliminación: tras alcanzar el equilibrio entre la concentración plasmática e intersticial, el MCI comienza a eliminarse de modo uniforme, presentando una pendiente menor.
Además, hay tres fenómenos que influyen en la distribución intravenosa del MCI24:
- A.
Dilución: a medida que el contraste avanza, se diluye, afectando principalmente al realce de los órganos más distales al lugar de la inyección.
- B.
Fenómeno de recirculación: el sistema vascular se divide y da lugar a múltiples vías circulatorias simultáneas, cada una con una extensión distinta. Algunos órganos que realzan antes, como el bazo, por proximidad al sitio de inyección y/o mayor vascularización, contribuyen antes al paso de contraste al sistema venoso. El tiempo de tránsito medio para la recirculación es de 15-40 segundos. El fenómeno de recirculación puede contribuir al realce de un órgano y dependerá de la duración de la inyección (fig. 5).
Figura 5.La curva amarilla representa la curva de realce de una estructura en función del tiempo sin tener en cuenta los fenómenos de recirculación y perturbación hemodinámica. La curva azul representa la curva de realce de una estructura en función del tiempo teniendo en cuenta los fenómenos de recirculación y perturbación hemodinámica. A. Inyección corta del MC, la curva real (azul) se estrecha por el fenómeno de perturbación hemodinámica (flecha ascendente rosa); principalmente debido a la velocidad de inyección que acelera el flujo intrínseco más lento de la sangre venosa periférica compactando la duración del paso del bolo de contraste. B. Inyección larga del MC, la curva real (azul) se estrecha por el fenómeno de perturbación hemodinámica (flecha ascendente rosa); y alcanza un mayor pico de atenuación consiguiendo un realce más persistente a lo largo del tiempo por el fenómeno de recirculación.
- C.
Perturbación hemodinámica: el volumen y la velocidad de inyección aceleran el flujo intrínseco más lento de la sangre venosa periférica, compactando la duración del paso del bolo por una estructura.
Estos fenómenos afectan fundamentalmente a los estudios vasculares con una velocidad de inyección alta (3-5mL/s). En inyecciones cortas (hasta 15 segundos), el realce aórtico máximo se verá poco afectado por la contribución del MC recirculado, pero los estudios con inyección prolongada tendrán un realce rápido inicial, un aumento gradual progresivo hasta un pico, y una disminución gradual. Ambos se verán afectados por el fenómeno de perturbación hemodinámica.
Metabolismo y eliminaciónLos MCI no se metabolizan, y en sujetos sanos se elimina aproximadamente el 96% por excreción renal mediante filtración glomerular, sin reabsorción tubular significativa. La vía extrarrenal es despreciable en sujetos sanos, pero puede aumentar hasta un 20% en pacientes con insuficiencia renal, a través de lo que se conoce como excreción vicariante, habitualmente por vía biliar, pero también vía intestinal o transmucosa y en mucha menor medida la saliva, el sudor y las lágrimas. Por ello, no es excepcional identificar contraste en la vesícula en estudios de TC adquiridos a las horas de una administración previa.
La vida media del MCI, es decir, el tiempo en el que la concentración máxima obtenida con la dosis administrada se ha reducido a la mitad, es de aproximadamente 90-120 minutos. En individuos sanos se logra una excreción del 12% a los 10 minutos, permitiendo la adquisición de una fase excretora después de este tiempo. En las primeras 24 horas se alcanza una excreción del 90%, aunque puede retrasarse hasta semanas en el caso de existir una alteración renal.
Particularidades en la farmacocinética de los medios de contraste yodadosExisten algunas particularidades en relación con la farmacocinética de los MCI que se deben conocer:
- 1.
Las moléculas no atraviesan la barrera hematoencefálica, pero pueden difundir al líquido cefalorraquídeo.
- 2.
En el embarazo, los MCI atraviesan la barrera placentaria y pasan a la circulación sanguínea del feto, lo que puede condicionar disfunción de la glándula tiroidea, que es el efecto adverso más importante. Por este motivo, en aquellos países que no se realice un cribado de hipotiroidismo neonatal rutinariamente, es necesario descartarlo en recién nacidos cuyas madres han sido sometidas a estudios con MCI durante el embarazo. No se han demostrado efectos teratógenos de los contrastes yodados, aunque sí de la radiación ionizante25–28.
- 3.
Lactancia: Como se ha mencionado, el 90% del MCI desaparece del torrente sanguíneo materno en 24 horas. Solo el 1% se excreta por la leche materna y menos del 1% del contraste ingerido por el lactante se absorbe en el intestino. De esta forma, se estima que solo el 0,01% del MCI administrado puede llegar al torrente sanguíneo del lactante. Esta dosis representa menos del 1% de la que se administra en aquellos casos que es necesario hacer un estudio de imagen a un lactante. Por tanto, no se recomienda suspender la lactancia. Se debe advertir que se puede alterar el sabor de la leche materna26–30.
El realce del MCI en un estudio TC se ve afectado por numerosos factores que dependen del paciente, del MC y del equipo utilizado31.
Entre los aspectos más relevantes relacionados con el paciente destacan:
- A.
Peso corporal: Existe una relación inversamente proporcional entre la magnitud del realce y el peso corporal. A mayor peso, hay mayor volumen sanguíneo y de otros tejidos, por ende, se requiere mayor dosis de contraste.
- B.
Gasto cardiaco: El tiempo necesario para lograr el realce deseado es inversamente proporcional al gasto cardiaco, lo cual es un factor crucial a la hora de planificar un estudio TC. Una disminución en el gasto cardiaco ralentiza la circulación, retrasando el realce óptimo en todas las fases. El tiempo de llegada del bolo de contraste y el tiempo hasta el realce máximo en todos los órganos están estrechamente relacionados con el gasto cardiaco.
Los aspectos relacionados con el MC se verán en otro artículo de esta monografía, pero incluyen principalmente el propio MC utilizado, su volumen y concentración de yodo, la vía de acceso, la velocidad con la que se inyecta y la duración de la inyección.
Hay dos conceptos fundamentales que van a condicionar las necesidades de contraste que vamos a emplear y su forma de administración, son el flujo de yodo y la carga de yodo, que serán esenciales para definir un protocolo de administración de contraste, según se trate de un estudio vascular o visceral, respectivamente. El flujo de yodo hace referencia a la velocidad con la que el yodo entra en el torrente sanguíneo, y viene definida por la velocidad de inyección del MC en mililitros por segundo (mL/s) y la concentración de yodo de dicho MC, habitualmente expresada en gramos de yodo por mL (gI/mL). Multiplicando ambos factores se obtiene el flujo de yodo por segundo (gI/s), iodine delivery rate (IDR), que será uno de los factores que más impacto tiene en la calidad de un estudio vascular. La carga de yodo viene definida como la cantidad de yodo administrada por peso corporal del paciente, y habitualmente se expresa como gramos de yodo por kilogramo de peso (gI/kg). La carga de yodo se calcula multiplicando el volumen del MC por la concentración de yodo de este, dividiéndolo por el peso del paciente. La carga de yodo será el parámetro fundamental para considerar en los estudios que persiguen un adecuado realce visceral.
Por último, los parámetros técnicos como principalmente el kilovoltaje, la duración del estudio o si se dispone de información espectral, condicionan el realce obtenido.
Métodos para determinar el retraso de un estudioExisten varios métodos para determinar el retraso con el que se adquiere una TC tras la administración del contraste. Este retraso será un aspecto esencial a la hora de definir un protocolo de exploración y viene determinado por el objetivo del estudio24,31. Hay tres métodos principales, los dos primeros permiten calcular con precisión el retraso diagnóstico (RD) y se explican en la figura 6:
Técnica de bolus test o bolo de prueba, habitualmente utilizada para estudios vasculares. A) Inyecciones cortas, el retraso se calcula como «Tiempo hasta el pico de realce menos la mitad del tiempo de adquisición del estudio». B) Inyecciones largas, el retraso se calcula como «Tiempo hasta el pico de realce menos un tercio del tiempo de adquisición del estudio». C y D) Técnica de bolus tracking o seguimiento del bolo para inyecciones cortas (C) y largas (D): se inyecta la dosis completa de bolo de contraste y comienza una adquisición secuencial que se detiene cuando el realce supera un umbral predeterminado, tras superar un tiempo de retraso adicional diagnóstico, establecido en función de la fase o fases deseadas, comienza la adquisición del estudio TC.
Método del bolo de prueba o bolus test: Implica la inyección de un bolo de prueba pequeño (10-20mL) del MCI antes de la adquisición de la TC diagnóstica con el bolo de dosis completa. En el topograma del estudio a realizar, se elige un nivel en el que se adquiere un único corte transversal de baja energía, en el que se coloca una región de interés (ROI) sobre un órgano diana, comúnmente una estructura vascular. Tras 5 a 10 segundos, se adquieren múltiples imágenes secuenciales, registrando una curva de intensidad de realce (UH) dentro de la ROI en función del tiempo. El bolo de prueba y el bolo diagnóstico deberán inyectarse a la misma velocidad. El tiempo hasta el realce máximo de contraste del bolo de prueba, junto con la duración de la inyección y la duración de adquisición, permiten calcular el retraso (fig. 6A y B).
Esta técnica prácticamente solo se utiliza para estudios vasculares con inyecciones cortas, como se explica en la figura 6A. En caso de estudios vasculares con inyecciones largas (fig. 6B), la curva de realce es más prolongada y asimétrica al estar influenciada por el fenómeno de recirculación, debiendo adaptar el cálculo del tiempo de RD.
Seguimiento del bolo o bolus tracking: Similar al método del bolo de prueba, pero utilizando la dosis completa de MC. Se coloca la ROI en un órgano diana y se registra una UHen función del tiempo. La adquisición secuencial se detiene cuando el realce supera un umbral predeterminado por el operador, y tras superar un tiempo de RD adicional, también previamente establecido en función de la fase o fases deseadas, comienza la adquisición del estudio TC (fig. 6C y D).
El método de seguimiento de bolo resulta más eficiente, ya que no requiere dos inyecciones separadas y optimiza el uso del contraste.
Su precisión depende del valor de umbral fijado y del RD, que dependerá del órgano a estudiar y el propósito del estudio.
Retraso fijo: Esta opción implica asignar sistemáticamente un retraso específico a todos los pacientes según la fase que se desea adquirir. Este tiempo fijo se basa en la fisiología conocida de la circulación sanguínea en una región anatómica específica o en la experiencia previa. No tiene en cuenta el gasto cardiaco del paciente, por lo que es más susceptible de resultar en estudios con un realce inadecuado, aumentando el riesgo de necesitar la repetición del estudio. Además, si el gasto cardiaco del paciente varía entre dos estudios serán más difícilmente comparables entre sí.
ConclusiónEn este artículo se repasan diversos aspectos de las propiedades, farmacocinética y distribución de los MCI, analizamos el mecanismo por el que atenúan los rayos X y se discuten algunos aspectos que afectan a su uso intravascular.
Autoría- 1.
Responsable de la integridad del estudio: Jorge Cobos Alonso, Juan José Arenas-Jiménez
- 2.
Concepción del estudio: Jorge Cobos Alonso, Claudia Fontenla-Martínez, Luis Concepción Aramendía, Juan Matías Bernabé García, Juan José Arenas-Jiménez
- 3.
Diseño del estudio: Jorge Cobos Alonso, Claudia Fontenla-Martínez, Luis Concepción Aramendía, Juan Matías Bernabé García, Juan José Arenas-Jiménez
- 4.
Obtención de los datos; Jorge Cobos Alonso, Claudia Fontenla-Martínez, Luis Concepción Aramendía, Juan Matías Bernabé García, Juan José Arenas-Jiménez
- 5.
Análisis e interpretación de los datos: Jorge Cobos Alonso, Claudia Fontenla-Martínez, Luis Concepción Aramendía, Juan Matías Bernabé García, Juan José Arenas-Jiménez
- 6.
Tratamiento estadístico: No procede
- 7.
Búsqueda bibliográfica: Jorge Cobos Alonso, Claudia Fontenla-Martínez, Luis Concepción Aramendía, Juan Matías Bernabé García, Juan José Arenas-Jiménez
- 8.
Redacción del trabajo: Jorge Cobos Alonso, Claudia Fontenla-Martínez, Luis Concepción Aramendía, Juan Matías Bernabé García, Juan José Arenas-Jiménez
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: Jorge Cobos Alonso, Claudia Fontenla-Martínez, Luis Concepción Aramendía, Juan Matías Bernabé García, Juan José Arenas-Jiménez
- 10.
Aprobación de la versión final: Jorge Cobos Alonso, Claudia Fontenla-Martínez, Luis Concepción Aramendía, Juan Matías Bernabé García, Juan José Arenas-Jiménez
Este trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.