Editado por: Dr. José Luis del Cura Rodríguez - Servicio de Radiodiagnóstico, Hospital Universitario Donostia, Donostia-San Sebastián, España
Última actualización: Diciembre 2023
Más datosSi en muchos campos de la medicina el intervencionismo ecográfico ha aportado grandes avances, sin duda en lo que respecta a las terapias endovenosas ha supuesto una revolución.
El presente artículo pretende repasar los principios básicos para desarrollar una estrategia a seguir en los tratamientos ecoguiados de varices en los miembros inferiores. Así mismo, busca transmitir una breve perspectiva sobre las principales técnicas endovenosas disponibles en la actualidad.
Dichas técnicas las dividiremos principalmente en aquellas que se sirven de un catéter con el fin de ocluir los ejes safenos rectos (ablación térmica/no térmica) y aquellas otras opciones, como es la esclerosis con espuma, que permite su uso en todo tipo de varices, incluso las de origen pélvico.
Although ultrasound-guided interventional procedures have resulted in great advances in many fields of medicine, this approach has revolutionized endovascular procedures.
This paper aims to review the basic principles to develop a strategy to follow in ultrasound-guided treatments of varices in the lower limbs, as well as to provide a brief overview of the main endovenous techniques available nowadays.
We divide these techniques into those that use catheters to occlude straight saphenous axes (thermal / non-thermal ablation) and other options, such as foam sclerotherapy, which can be used in all types of varices, even in those originating in the pelvis.
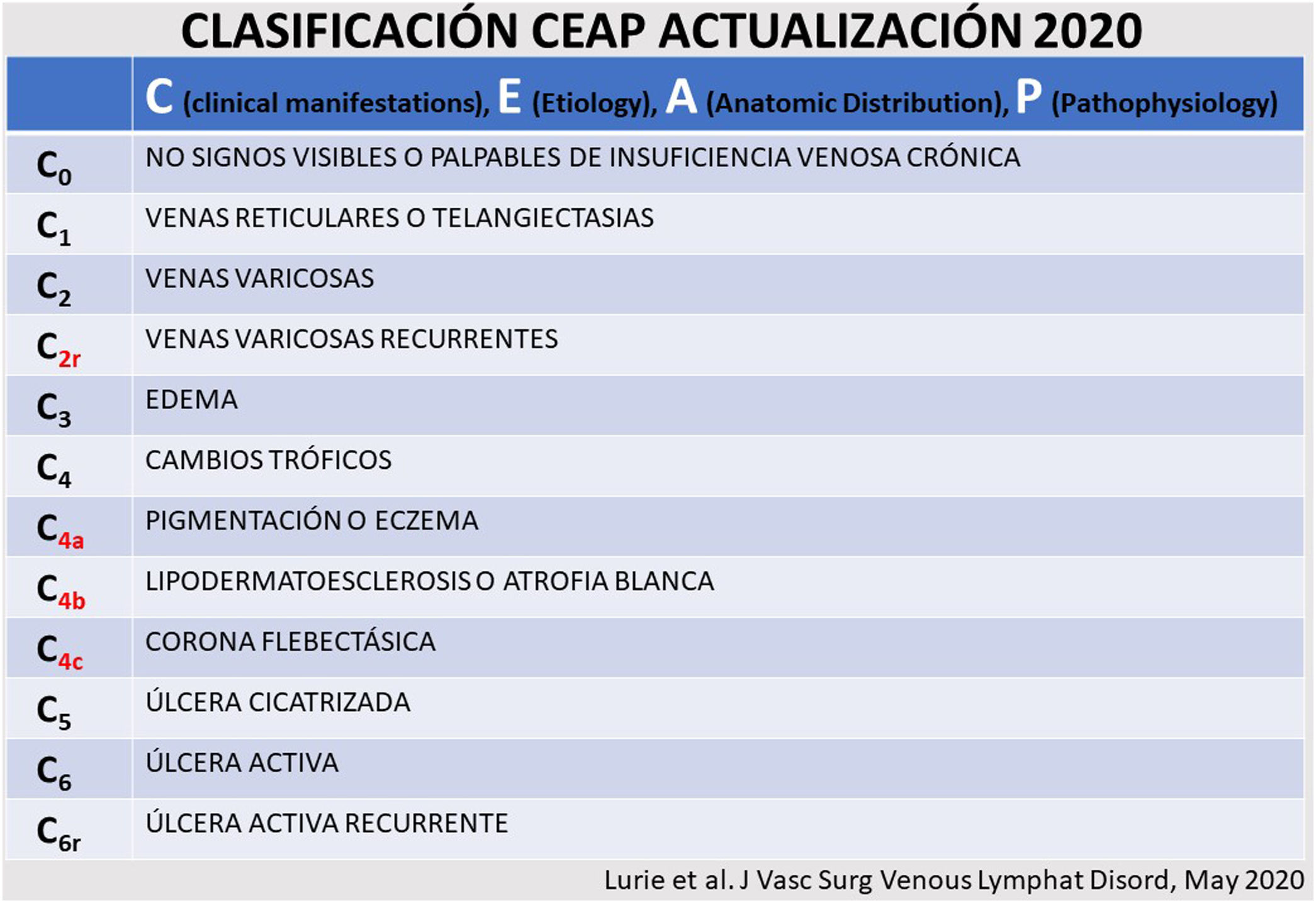
Las varices de los miembros inferiores (MMII) constituyen una de las manifestaciones más frecuentes del síndrome de insuficiencia venosa crónica (IVC). Están incluidos en los estadios C2-C6 de la clasificación CEAP1,2 (fig. 1).
Las varices suponen una enfermedad crónica con desigual evolución, que puede afectar a la calidad de vida de los pacientes.
Previa instauración de medidas conservadoras, generalmente la indicación de tratamiento invasivo de las varices en MMII vendrá dada por la existencia de síntomas clínicos (dolor, pesadez, calambres, etc.), cambios tróficos severos en la piel o la existencia de complicaciones previas (tromboflebitis, úlceras o varicorragias). La motivación estética también ha de tenerse en cuenta.
En las últimas décadas se han desarrollado técnicas endovenosas guiadas por ecografía para el manejo de la IVC, como son las ablaciones térmicas (endoláser, radiofrecuencia y ablación por vapor de agua), los procedimientos mecánico-químicos (MOCA), los puramente químicos (esclerosis líquida y en espuma) y las oclusiones mediante pegamentos derivados del cianoacrilato.
Esto ha supuesto una revolución en el tratamiento de las varices, como lo fue en su día la ecografía Doppler en el diagnóstico de la IVC, hasta el punto de que en 2013 el National Institute For Health and Clinical Excellence del Reino Unido (NICE) recomendó que la ablación endovenosa térmica (endoláser o radiofrecuencia) y la esclerosis con espuma ecoguiada debían ser ofrecidas como primera opción de tratamiento frente a la cirugía convencional3.
El objetivo del presente artículo es describir los principios básicos que deben regir la estrategia del tratamiento ecoguiado de varices en los MMII y hacer un breve repaso de las principales técnicas existentes en la actualidad.
Estrategia de tratamientoAntes de plantear cualquier tipo de intervención sobre varices en MMII, se hace imprescindible un buen conocimiento de la fisiopatología, anatomía y alteraciones hemodinámicas subyacentes a la IVC.
Una vez sentada la indicación de tratamiento y tras haber implementado las medidas higiénico-dietéticas pertinentes (uso de medias elásticas, realización de ejercicio físico frecuente, etc.), el primer paso es llevar a cabo un mapeo exhaustivo mediante eco-Doppler en bipedestación.
Es conveniente seguir una metodología de exploración concreta que nos permita sistematizar el estudio4.
Deberemos determinar aquellos segmentos patológicos con reflujo demostrado superior a 0,5 s tras compresión manual, así como identificar el origen de los diferentes shunts5. Estos suelen provenir de:
- •
Algún eje safeno o red secundaria (safena mayor, menor, accesoria y vena Giacomini).
- •
Cavernomas o neocayados en relación con cirugías previas, origen pélvico o perforantes incompetentes.
El objetivo del tratamiento intervencionista de las varices en MMII ha de ser eliminar aquellos segmentos refluyentes o avalvulados que están suponiendo una sobrecarga hemodinámica a la extremidad. Cómo lo hagamos dependerá de la estrategia elegida.
Clásicamente se conocen diferentes aproximaciones para estratificar el tratamiento de las varices: la técnica suiza (escuela de Sigg), la técnica irlandesa (escuela de Fegan) o la francesa (escuela de Tournay). La escuela francesa probablemente sea la más extendida, y promulga una erradicación escalonada de los segmentos refluyentes, desde los segmentos craneales o proximales, a los caudales o distales.
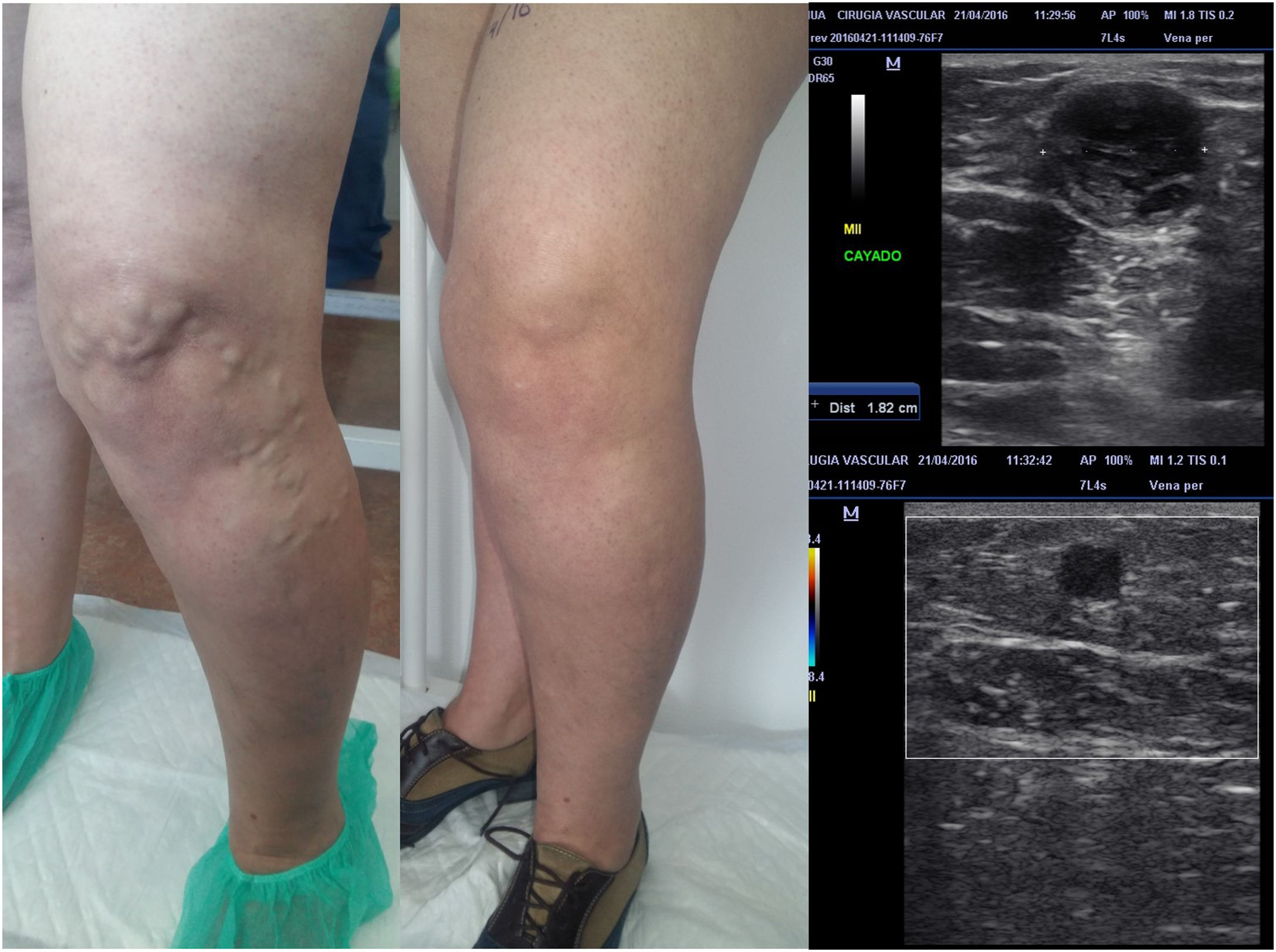
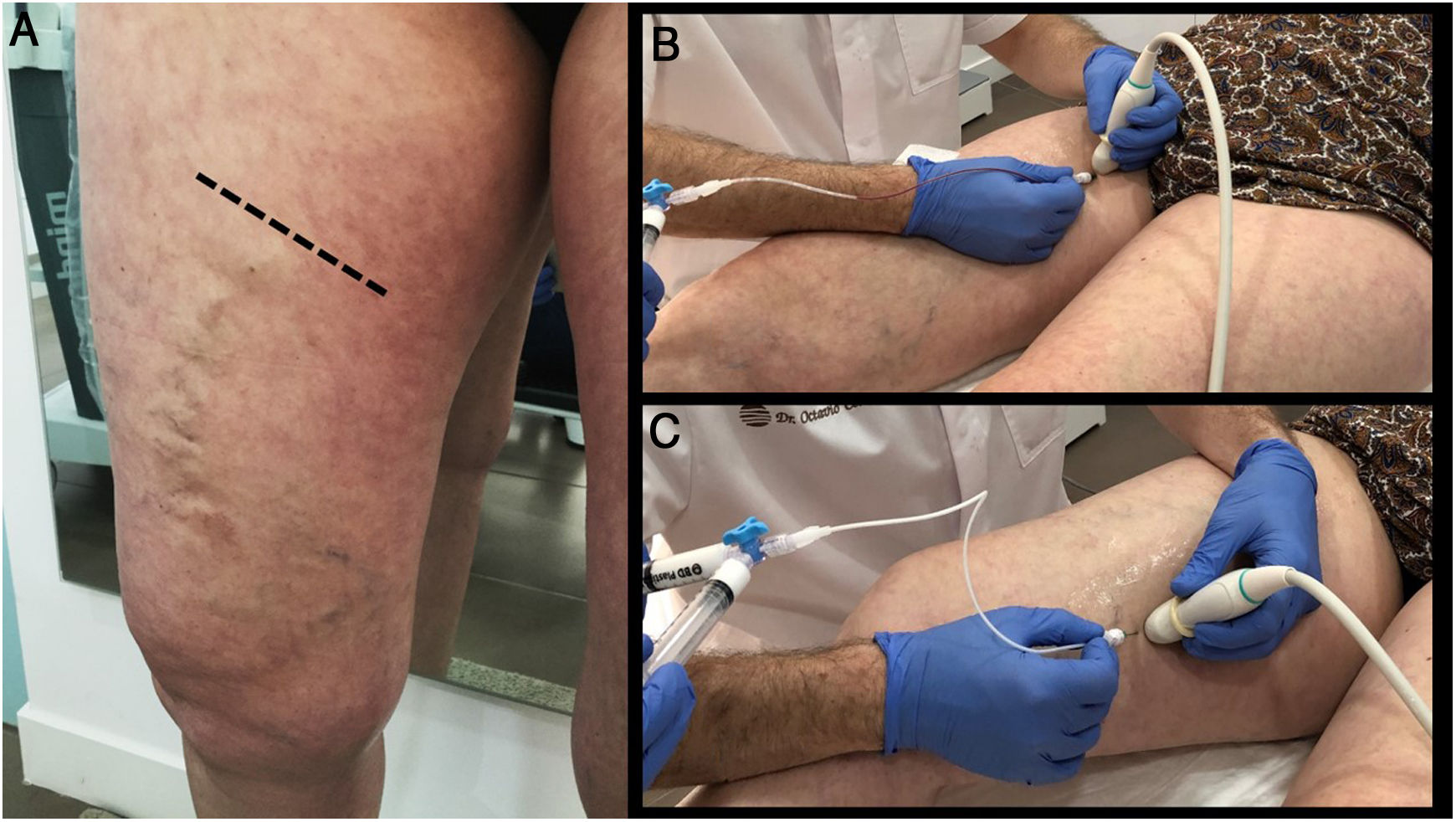
Dicha aproximación permite ir despresurizando los segmentos distales paulatinamente, con lo que, a lo largo del periodo de tratamiento, cada vez afrontaremos varices de menor calibre y, por tanto, con menor potencial de complicaciones (fig. 2).
La importancia de una buena planificación. A la paciente de la figura únicamente se le trató el eje safeno (segmento proximal o craneal), responsable de las tributarias que discurren sobre la rodilla. En el control posterior, se evidencia la práctica desaparición de las mismas. En un segundo tiempo hay que realizar esclerosis ecoguiada de dichas tributarias, que en la actualidad son de mucho menor calibre. La técnica se realizó con ablación MOCA, mediante catéter Clarivein de la vena safena mayor, consiguiendo buena oclusión, incluso de segmentos dilatados en cayado (18 mm).
Todo esto hace que los tratamientos percutáneos de varices sean escalonados en el tiempo, al contrario de la cirugía clásica, en la que la pretensión es la eliminación o corrección del problema subyacente en un solo acto.
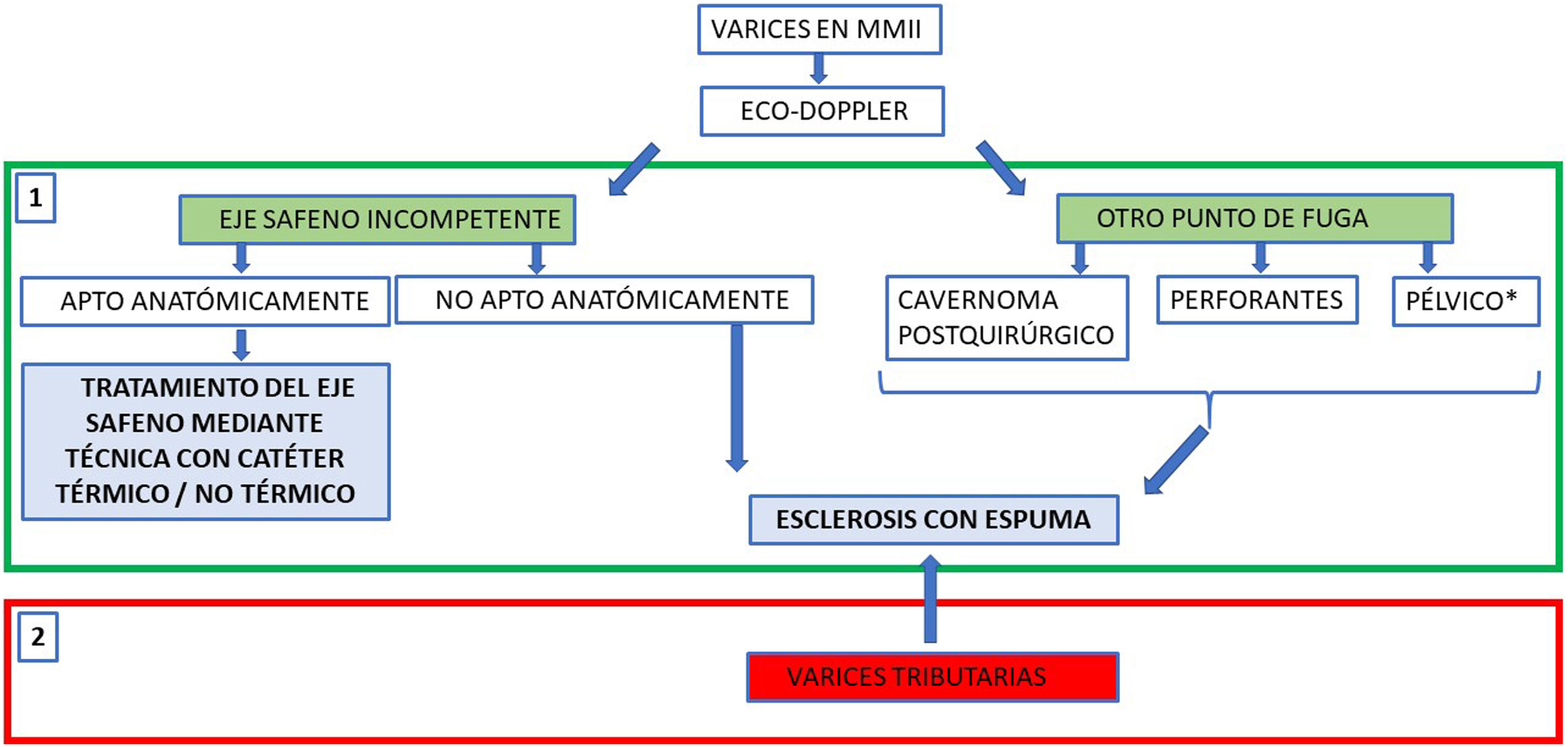
A modo de resumen, podemos diferenciar dos fases (fig. 3):
- 1.
En una primera fase, se prioriza la oclusión de segmentos proximales. En el caso, en el que el origen del reflujo provenga de ejes safenos incompetentes y adecuados anatómicamente, se prefiere el uso de técnicas mediante catéter por poseer estas mejores tasas de oclusión a largo plazo. En aquellos casos en que no se pueda emplear una técnica mediante catéter para ocluir los segmentos proximales, como son las recidivas posquirúrgicas, las varices tortuosas dependientes de un punto de fuga pélvico o de perforantes incompetentes, se realizará inyección directa de espuma esclerosante o incluso de agente adhesivo (glue).
- 2.
En la segunda fase, se tratan las varices tributarias o distales que, tras haber disminuido su calibre por estar despresurizadas, responderán mejor a la inyección ecoguiada de espuma esclerosante.
Esquema general de cómo plantear una estrategia de tratamiento percutáneo de varices en miembros inferiores, según esté localizado el punto de fuga proximal o inicio del reflujo. Una variante a la esclerosis con espuma, para ocluir puntos de fuga proximales no aptos para catéter, podría ser la inyección directa de agente adhesivo (cianoacrilato), aunque de uso muy marginal. En el reflujo de origen pélvico, si la paciente presenta síntomas de síndrome congestivo pélvico, el tratamiento de elección sería la embolización de venas gonadales. Sin embargo, la esclerosis desde la zona perineal puede ser suficiente para controlar las fugas hacia miembros inferiores.
Independientemente del tratamiento realizado, se recomienda la utilización posterior de medias compresivas (30-40 mmHg) durante unas 2 o 3 semanas (salvo en el caso del cianoacrilato).
No existe consenso sobre la prescripción de heparinas de bajo peso molecular profiláctica, salvo en casos con antecedentes de trombosis venosa profunda (TVP), tromboflebitis de repetición, obesidad o trombofilia conocida. Se deberán hacer controles ecográficos y clínicos, al menos tras 1, 3 y 6 meses6.
Ablación de ejes safenos mediante técnicas con catéterComo previamente se ha expuesto, han proliferado diferentes tipos de técnicas endovenosas ecoguiadas para oclusión de ejes safenos patológicos. Sin embargo, un factor limitante es que se precisan unas condiciones anatómicas favorables para la navegabilidad y efectividad del sistema: ausencia de tortuosidad en la vena safena, ausencia de segmentos ocluidos, trayecto preferiblemente subfascial, diámetro limitado, etc.
Actualmente, no se puede establecer una única, que prevalezca claramente sobre el resto, ni un protocolo estandarizado. En todo caso, serían las ablaciones térmicas, las que poseen mayores seguimientos a largo plazo, pudiéndose considerar el gold standard de dichos procedimientos. Aunque, finalmente, serán las virtudes de cada una de las modalidades, las preferencias del operador y el contexto en el que se realicen, los que inclinarán la balanza hacia un lado u otro.
Se distinguen principalmente dos familias de técnicas, atendiendo a si se utiliza una fuente de calor como método para dañar la vena (termoablación) u otros mecanismos para anular el eje safeno insuficiente (ablaciones no térmicas). Del mismo modo, se puede realizar la diferenciación entre aquellas técnicas que precisan la aplicación de anestesia tumescente o no (fig. 4).
La infiltración tumescente perivenosa consiste en la inyección abundante de una solución que incluye suero salino, lidocaína e incluso bicarbonato y adrenalina. Se inyecta en el compartimento safeno, y su finalidad es colapsar la vena, separarla de estructuras que pueden dañarse por el calor (piel y nervio safeno) y anestesiar el trayecto a tratar.
TermoablaciónEn este grupo se distinguen el endoláser, la radiofrecuencia y la ablación mediante vapor de agua (en desuso).
Las técnicas de termoablación, debido a su mecanismo de acción basado en utilizar una fuente de calor para producir el daño parietal en la vena, hacen que sea necesaria la aplicación de una tumescencia en los tejidos perivenosos, como se indicaba previamente.
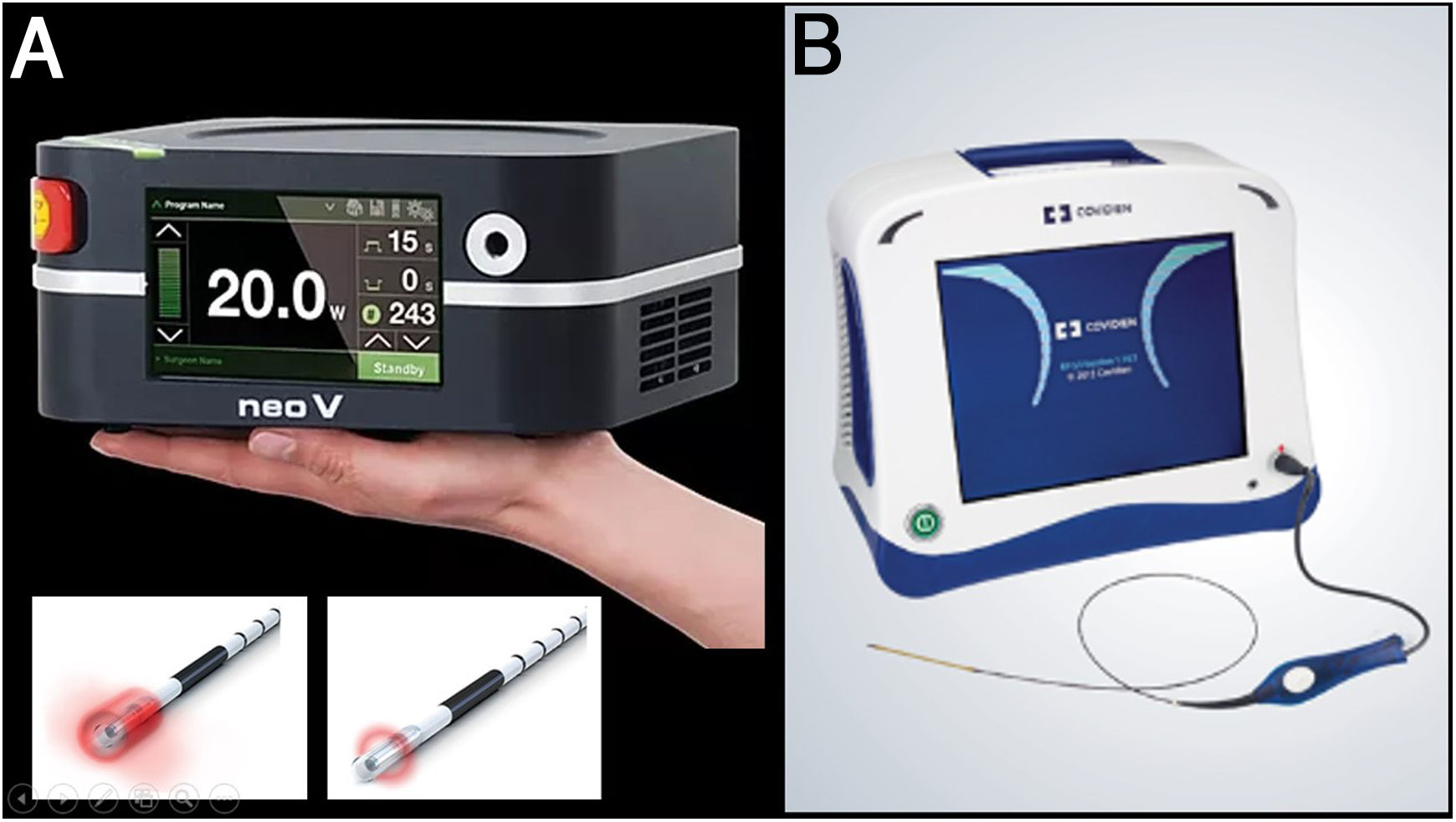
En 1999, Carlos Boné describió el uso de láser endovenoso como método de tratamiento de la incompetencia de ejes safenos. Desde ese momento, las técnicas de ablación mediante calor han sido las más ampliamente empleadas y las más contrastadas, hasta el punto de que, actualmente, las guías internacionales recomiendan la ablación térmica como tratamiento de primera línea en caso de reflujo de ejes safenos3,6,7 (fig. 5).
A) Las primeras fibras de endoláser que estuvieron disponibles fueron las de 810nm. Pronto fueron apareciendo las de 980nm de longitud de onda y 1470nm. Estas dos fibras son las más empleadas en la actualidad. Recientemente han comenzado a aparecer dispositivos de 1980nm. La diferencia fundamental entre las longitudes de onda se basa en el cromófobo objeto de estas (el láser de 980nm tiene como objetivo tanto el agua como la sangre, y los de 1470 y 1980 tienen como objetivo únicamente el agua; esto redunda en un mayor daño parietal con menores efectos adversos). B) El mecanismo de acción de la radiofrecuencia es, a través de radiación electromagnética no ionizante, elevar la temperatura de los tejidos (idealmente solo la pared venosa) por encima de los 120°C.
Los métodos de ablación de ejes safenos con catéter han demostrado una efectividad similar o superior a la cirugía convencional y tasas de oclusión mayores y más consistentes que la esclerosis con espuma8.
Mediante guía ecográfica, debemos llevar el extremo activo del catéter y situarlo a unos 2-4cm del confluente safeno-femoral, dependiendo de la técnica empleada.
El objetivo de alejar el inicio de la ablación del confluente safeno-femoral, es preservar el retorno venoso pudendo, epigástrico y circunflejo, y minimizar el riesgo de TVP.
Al ser puramente percutáneas y guiadas con ecografía, estas técnicas supusieron una revolución, ya que ofrecían la posibilidad de tratar a los pacientes de forma ambulatoria e incluso potencialmente fuera de quirófano convencional. Tanto la radiofrecuencia (RF) como el endoláser han ido madurando progresivamente, ofreciendo una buena estandarización del procedimiento, especialmente el sistema RF ClosureFast® (Medtronic, Minneapolis, MN, EE. UU.), que realiza ablaciones segmentarias y solapadas cada 7cm.
Ambas tienen ventajas e inconvenientes similares. Comparten tasas de oclusión de en torno al 90-95%, con seguimientos a largo plazo. Sin embargo, la necesidad de la tumescencia hace que los procedimientos sean más largos y molestos para el paciente. Así mismo, como ya se ha comentado, comparten potenciales complicaciones en relación con daño a estructuras vecinas (quemaduras cutáneas, lesiones neurales, etc.).
Ablación no térmicaPosteriormente a los procedimientos de termoablación, surgieron diferentes métodos de oclusión de ejes safenos. Cabría destacar, por su proliferación, la ablación mecánico-química (MOCA) y la oclusión mediante cianoacrilato.
Estas técnicas han demostrado tasas de oclusión similares al láser y RF, aunque en general tienen menos seguimiento a largo plazo. Sin embargo, por no precisar la realización de anestesia tumescente, son los métodos ideales para practicar fuera de quirófano, ya que son más rápidos y mucho menos molestos para el paciente durante y tras el tratamiento9.
Como ventaja añadida, al no utilizar fuente de calor, no existe la posibilidad de daño neural ni cutáneo, por lo que permiten realizar ablaciones de todo el eje safeno hasta el tobillo.
MOCA (ablación mecánico-química)Actualmente hay dos dispositivos disponibles en el mercado: Clarivein® (Merit Medical, South Jordan, UT, EE.?UU.) y Flebogrif® (Balton® Warsaw, Pl).
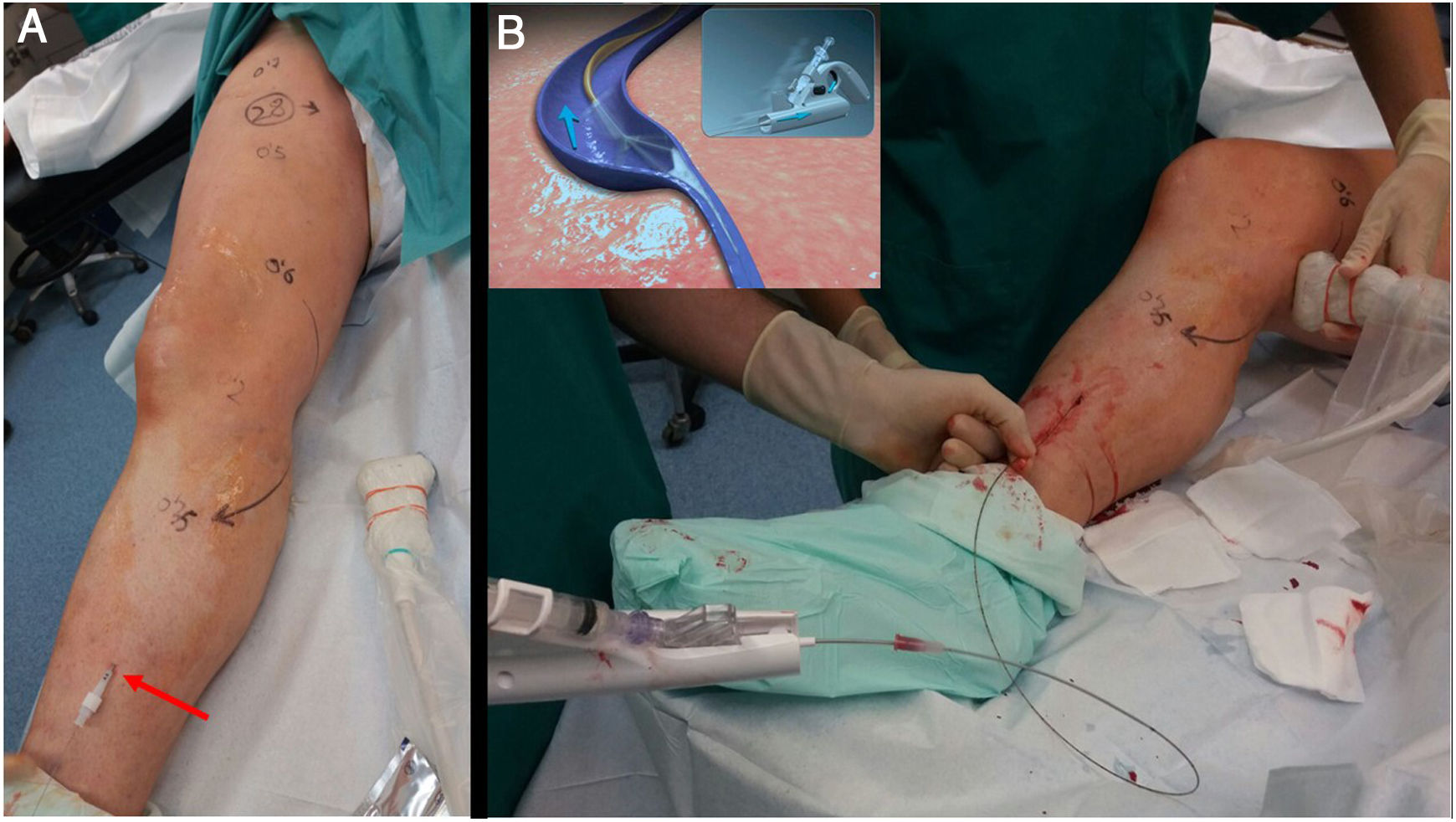
Clarivein® lo inventó un radiólogo intervencionista estadounidense (Michael Tal) mientras miraba su lavadora centrifugar. Necesitaba un método no térmico para tratar una vena ciática persistente sin dañar el nervio ciático en un paciente con síndrome de Klippel-Trénaunay. Está basado en un daño doble a la pared endotelial de la vena: mecánico, con la fricción del terminal metálico al rotar a 3500rpm, y simultáneamente, al aplicar un espray de líquido esclerosante (polidocanol o tetradecil sulfato de sodio) (fig. 6).
A) Las técnicas de ablación no térmica permiten recorridos extensos de tratamiento (hasta perimaleolar) sin riesgo de daño neural por temperatura. B) Tratamiento de vena safena mayor en todo su recorrido, mediante catéter Clarivein de 85cm. La retirada ha de ser muy lenta, mientras vamos inyectando suavemente polidocanol o STS líquido al 2%. La rotación del extremo metálico del catéter va dañando el endotelio venoso y repartiendo circunferencialmente el esclerosante.
El efecto Vortex creado por la rotación hace que el esclerosante se reparta en los 360° de la pared venosa, lo que sumado al daño mecánico consigue tasas de oclusión del 91-96% y 87% a los 2 y 3 años10,11. Como inconvenientes se le achaca que puede ser doloroso si la varilla metálica se atrapa en alguna rama, y que en presencia de segmentos tortuosos no permite la utilización de guía. Sin embargo, su morfología y bajo perfil le confieren muy buena navegabilidad.
Flebogrif® es un dispositivo de más reciente distribución, aunque su concepción fue incluso anterior. Inicialmente pasó inadvertido, tras ser el resultado de una tesis de investigación en la Universidad de Lublin (Polonia), y posteriormente fue rescatado y mejorado por T. Zubilewich en colaboración con Balton®. Consta de un catéter 6F en cuyo extremo, tras realizar una maniobra de pull-back, se exponen 5 terminales de nitinol con punta ligeramente afilada. Estos terminales van dañando el endotelio de la vena a su retirada. Durante dicha retirada, desde el cayado hacia el punto de entrada se va inyectando espuma de polidocanol o tetradecil sulfato de sodio al 3%, en orden de 1ml cada 5cm (fig. 7).
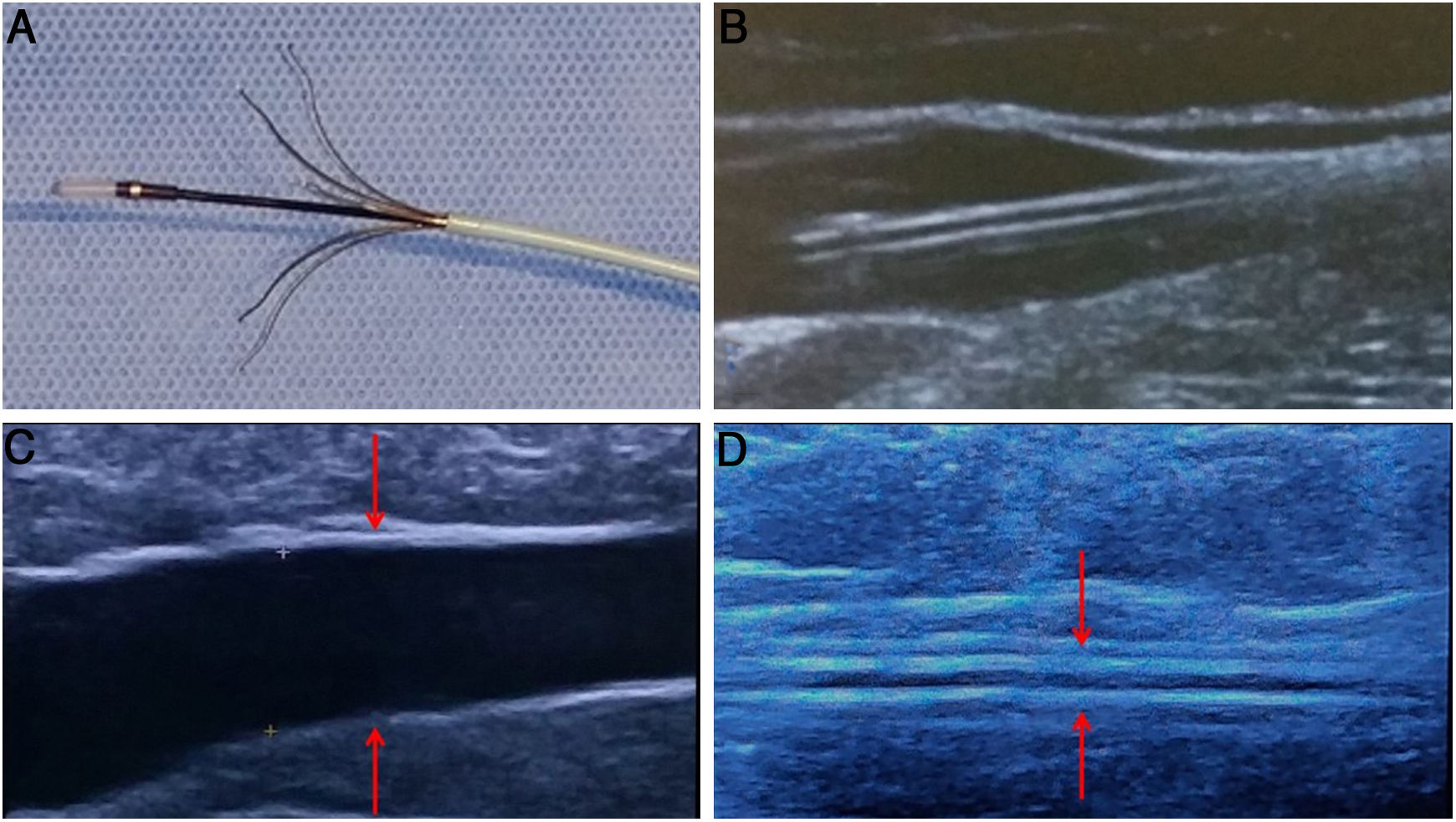
Como característica diferencial, permite realizar una pasada inicial, sin inyectar espuma, pero con los terminales expuestos, con el fin de inducir espasmo en el eje safeno y optimizar el efecto de la espuma esclerosante (fig. 8).
A) Detalle del catéter Flebogrif® con los elementos metálicos “cortantes” expuestos y su imagen ecográfica (B). Dicho dispositivo permite la realización de un pase previo, sin inyectar espuma, únicamente erosionando el interior de la vena, lo cual produce un espasmo en el eje safeno que favorece la acción posterior de la espuma (C).
Destaca su extremada sencillez de uso y versatilidad (catéter sobre guía 0,035”), su práctica ausencia de dolor para el paciente y la posibilidad de tratar ejes de mayor diámetro (hasta 20 mm). Se le atribuye una tasa de oclusión del 92% a los 12 y 24 meses12,13.
Oclusión mediante cianoacrilatoAunque el cianoacrilato ha sido ampliamente utilizado por los radiólogos y neurroradiólogos intervencionistas como método de embolización desde los años 80 del pasado siglo, no ha sido hasta hace relativamente poco que ha comenzado a usarse en el tratamiento de varices.
Desde su aprobación y marcado CE, en otoño de 2011, del primer sistema de oclusión de vena safena mediante adhesivo especialmente formulado (n-butil-2-cianoacrilato), multitud de pacientes se han beneficiado de dicha técnica.
Dicha formulación busca dos objetivos: que la consistencia del pegamento tras polimerizar sea menos dura y más flexible para evitar sensación de cuerpo extraño y, en segundo lugar, que el tiempo de polimerización (solidificación) permita al producto alejarse lo suficiente del extremo del catéter, sin riesgo de migrar.
Al igual que en las técnicas MOCA, no precisa la utilización de anestesia tumescente.
Como factor diferencial y exclusivo, al provocarse una unión inmediata de ambas paredes de la vena, permite prescindir de medias de compresión elástica tras el procedimiento.
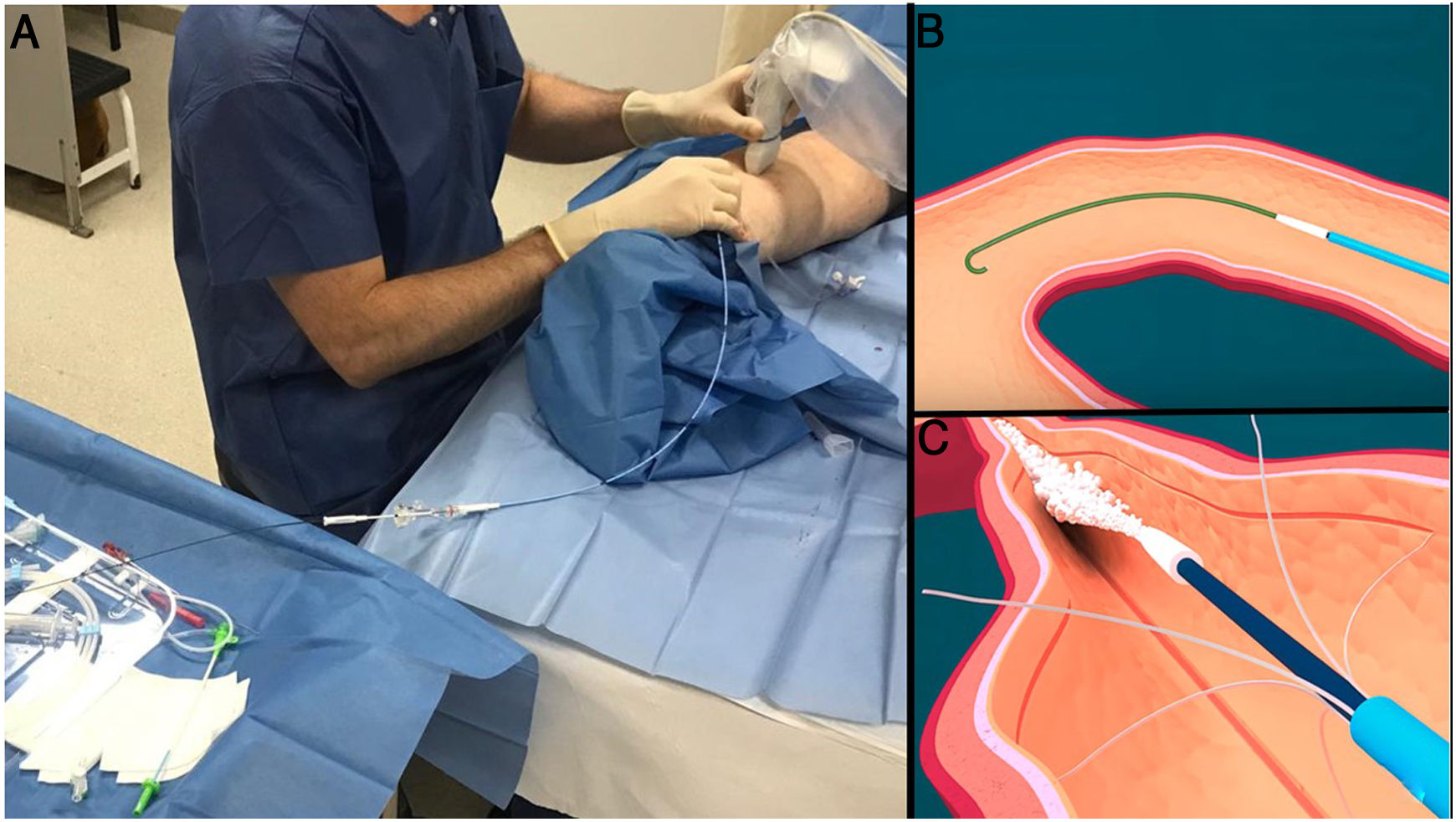
El procedimiento se realiza igualmente con una mínima cantidad de anestesia local en el punto de entrada, y mediante guía ecográfica se accede navegando a través del eje safeno, hasta unos 2-3cm del confluente con el SVP. Los distintos sistemas disponibles constan de un catéter y una pistola dispensadora. En el caso de Venablock® (Invamed Health, Ankara,TR), consta además de una luz LED que permite el seguimiento del extremo del catéter a simple vista, salvo en muslos demasiado gruesos (fig. 9).
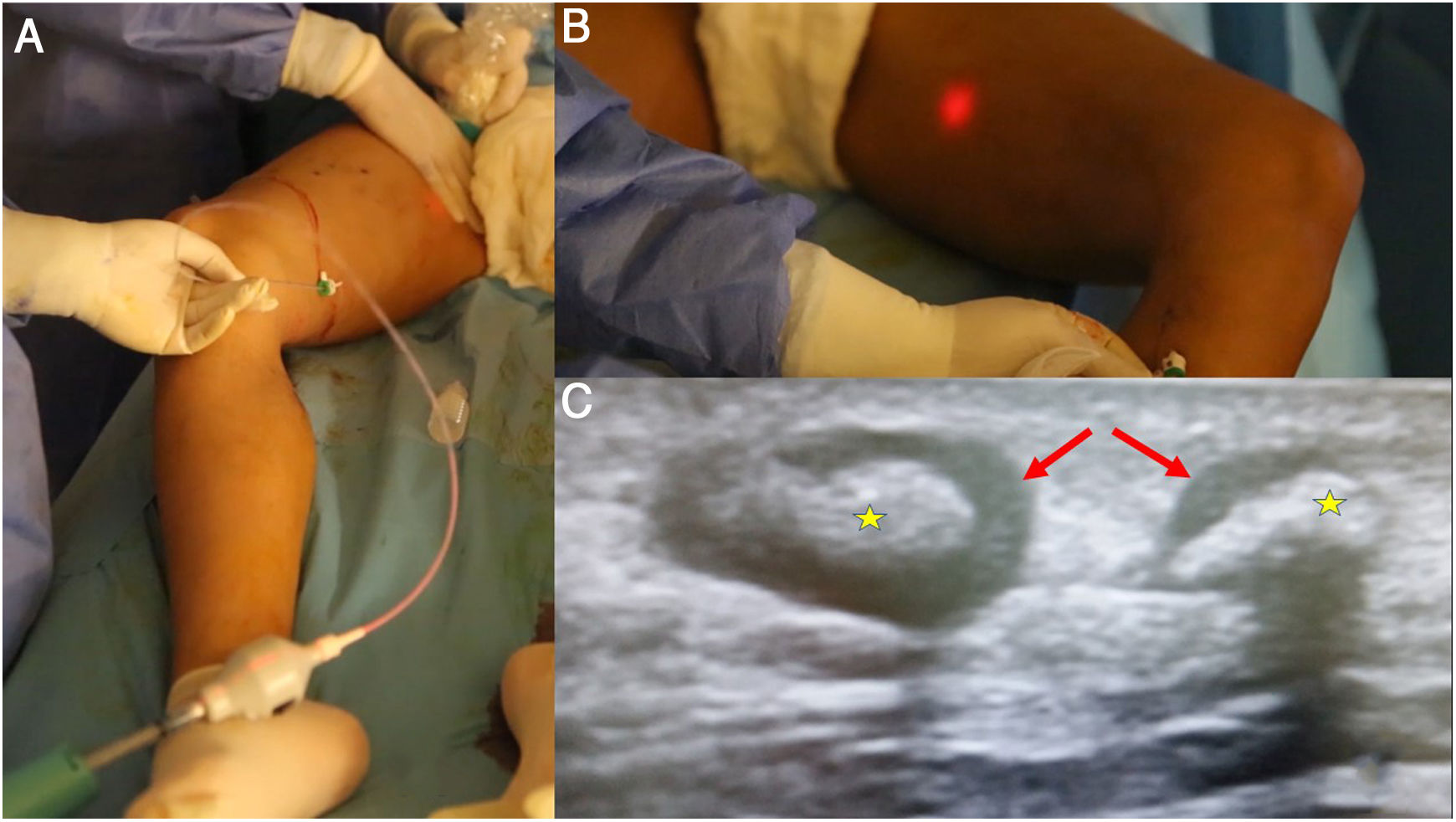
A) Entre los sistemas de oclusión de eje safeno, mediante cianoacrilato, el más extendido y con mayor trayectoria es el Venaseal®, pero recientemente han aparecido varios dispositivos que comparten la misma filosofía. Constan de un catéter de características determinadas para minimizar el riesgo de adhesión a la vena y una pistola dispensadora. B) El dispositivo Venablock® dispone, a su vez, de una luz LED en su extremo que permite la visualización directa del recorrido en determinados casos. C) Existe la posibilidad de tratar ramas tributarias tortuosas mediante punción directa e inyección de cianoacrilato. El control ecográfico a las pocas semanas muestra signos inflamatorios (que contribuirán a la oclusión de la vena) con importante engrosamiento de paredes (flechas) y ocupación de la luz con material que produce sombra acústica (estrellas).
Es de vital importancia realizar una compresión enérgica sobre el trayecto de la ablación, ya que, aunque la polimerización del adhesivo provoca un aumento de la temperatura momentánea hasta unos 45-50°C, no es este el mecanismo de acción, sino una oclusión de la luz vascular por adhesión de sus paredes.
Respecto a los resultados, en el caso del sistema VenaSeal® Closure system (Medtronic, Minneapolis, MN, USA), que es el más ampliamente distribuido y sobre el que más literatura científica hay disponible, las tasas de oclusión notificadas son de 99,6% a los 6 y 12 meses, similares o incluso superiores a la RF y el láser14,15. En un estudio retrospectivo de un único centro reportan tasas de oclusión del 96,4% a los 6 años16.
Además de la ablación/oclusión de los ejes safenos mediante cianoacrilato a través de catéter, también se puede realizar punción e inyección directa del pegamento, para tratar ramas tributarias o perforantes. Algunas firmas poseen un producto especialmente diseñado para tal fin, con tiempos de polimerización modificados y adaptables, según la dilución en dextrosa (Veinoff®, Invamed Health, Ankara, TR). El gran inconveniente de dicho procedimiento es que no podemos utilizar el método habitual de aspirado, para comprobar la situación intravascular de la aguja, ya que la entrada de sangre provocaría una polimerización inmediata del producto.
Ablación química mediante escleroterapiaLa escleroterapia consiste en la inyección de un producto químico irritante en la luz de la vena, con el fin de provocar una reacción inflamatoria principalmente de su endotelio y la posterior obliteración fibrosa del segmento venoso tratado. Buscamos provocar un daño irreversible en la pared, en forma de varicoflebitis, controlada e idealmente de baja intensidad17.
El objetivo no es producir una oclusión venosa a costa de segmentos con varicotrombosis, ya que el componente trombótico es susceptible de recanalizarse y volver al estado previo.
En este sentido, tendremos en cuenta únicamente la inyección del agente esclerosante en forma de espuma, ya que es conocido hace tiempo que su acción sobre las venas es mucho mayor que en su forma líquida. El esclerosante en su forma líquida queda relegado a su uso en telangiectasias y venas reticulares (a partir de 4mm, la dilución del esclerosante hace que se vuelva ineficaz).
En 1995, el cirujano vascular granadino Juan Cabrera notificó excelentes resultados en el tratamiento de varices tronculares con su fórmula patentada de microespuma18. Posteriormente, en el año 2000, Lorenzo Tessari describió su método de producción de espuma, probablemente el más sencillo y extendido19 (fig. 10).
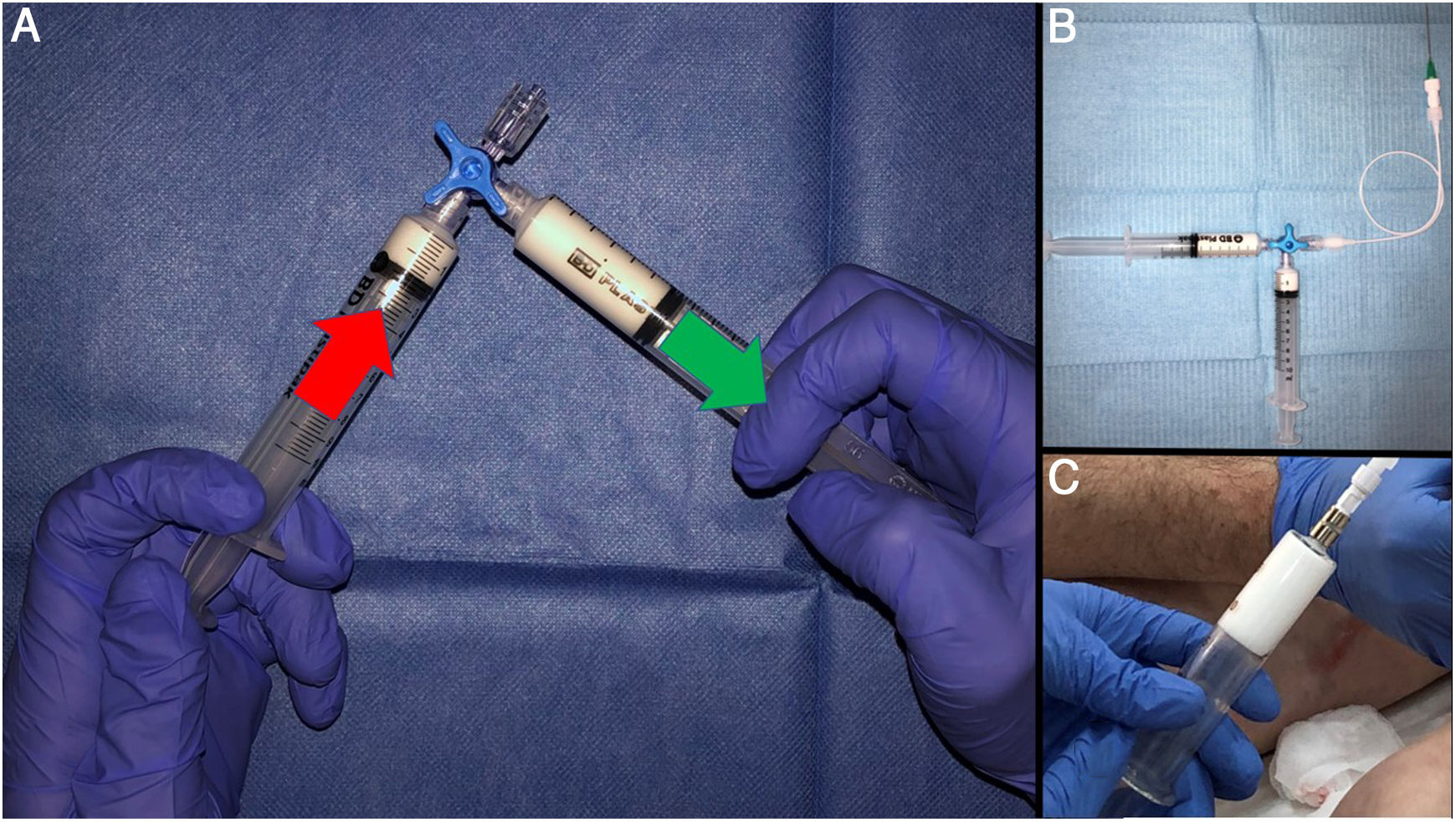
A) La técnica descrita por Tessari consiste en un paso enérgico desde una jeringa a otra, a través de una llave de tres vías. La turbulencia creada forma la espuma. Se considera que, con unos 20 pasos, la calidad de la espuma es estándar. Si no se utilizan jeringas luer lock, se recomienda apoyarlas contra la mesa o incluso contra el propio abdomen. Se puede cerrar parcialmente la llave, para mejorar la calidad de la espuma. Está demostrado que se obtienen burbujas de menor tamaño. B) Así mismo, se recomienda el uso de material con la menor cantidad de lubricante posible. Las jeringas BD del ejemplo tienen menos de 0,25 mg/cm2 de aceite de silicona. Se pueden añadir filtros (Sterifix ®, BRAUN, de 5 micras) que homogenizan el tamaño de la burbuja, disminuyendo el fenómeno de coalescencia. C) Las jeringas de cristal conservan en mejores condiciones la espuma.
Sin embargo, sigue existiendo una gran variabilidad técnica en la realización de la esclerosis guiada por ecografía y, por tanto, en los resultados. Los metaanálisis de la ecoescleroterapia no soportan la comparación con la safenectomía y las técnicas de ablación térmica en cuanto al tratamiento de los ejes safenos se refiere20. Aun así, no tiene competidor en cuanto a simplicidad, bajo coste, seguridad y buenos resultados en global.
Sin profundizar en exceso, actualmente en España disponemos de dos esclerosantes del tipo detergente, aptos para su uso en espuma: Etoxiesclerol© (Lauromacrogol 400, también conocido como polidocanol) y más recientemente se ha incorporado el Veinfibro© (tetradecil sulfato de sodio). Ambos muestran unas características y modo de empleo similares, atribuyéndose al Veinfibro© un mayor rango de acción, por ser 1,5-2 veces más potente a igual concentración que el etoxiesclerol©21.
El éxito del tratamiento con espuma ecoguiada es una conjunción entre la calidad de la espuma esclerosante que empleamos y el modo de distribuirla. En este último aspecto, es de vital importancia un buen control de la técnica de punción ecoguiada. El efecto de la espuma esclerosante sobre la pared venosa varía en función del tiempo de contacto con el endotelio y de la concentración del producto empleado. Debemos tener estos dos parámetros en cuenta, con el fin de seleccionar la concentración de esclerosante, en relación con el tamaño y localización de las venas a tratar.
A modo de orientación, existen dosis recomendadas de espuma esclerosante, ajustadas al tamaño de la variz a tratar (p. ej., varices tributarias, no superar el 2% de polidocanol o el 1% de tetradecil sulfato de sodio). Estas dosis sugeridas en las guías europeas sobre escleroterapia son genéricas22 y probablemente muy superiores a las que utilizaría la mayoría de los profesionales. Existen métodos para optimizar la acción esclerosante sin necesidad de que sea a costa de la concentración de producto, como la elevación de la extremidad o la utilización de torniquetes.
Por lo tanto, como conceptos generales “una buena distribución puede suplir una mala espuma” y, por el contrario, una buena espuma mal distribuida puede ser, a la vez, ineficaz e incluso producir complicaciones por exceso de acción esclerosante.
La fabricación de la espuma en detalle excede el propósito del presente artículo, pero unas claves prácticas para recordar serían:
- •
Cuánto más pequeña sea la burbuja en general, más estable es la espuma (ley de Laplace), y cuanto más estable es, más capaz de desplazar la sangre y mayor tiempo de contacto con el endotelio.
- •
La proporción de líquido/gas recomendada en general es 1:4. Existe una fracción gaseosa mínima para que una espuma se comporte como un sólido y sea más capaz de desplazar la sangre, que es de 0,64 (el 64% del volumen de la espuma debe estar compuesto de gas). En la práctica diaria hay que ir adaptando la cantidad de gas según la concentración del esclerosante, para evitar espumas demasiado líquidas o demasiado secas.
- •
No deben pasar más de 60-120 s desde la fabricación de la espuma, hasta su inyección.
- •
Debemos intentar utilizar material libre de silicona en la medida de lo posible, ya que esta degradará la espuma en nuestro sistema. Igualmente, si añadimos filtros al sistema, facilitamos un tamaño homogéneo de la espuma, lo cual minimiza el fenómeno físico de coalescencia, y hace nuestra espuma más estable.
La escleroterapia, aunque muy segura, no está exenta de complicaciones (reacciones adversas al esclerosante, necrosis cutáneas, síntomas neurológicos, etc.). Se recomienda un estudio detallado de estas antes de su utilización generalizada.
TécnicaAtendiendo a las fases recomendadas por la agencia francesa de acreditación y evaluación en la salud ANAES23, se distinguen:
- 1.
Evaluación ecográfica del segmento a tratar.
- 2.
Punción venosa con control ecográfico.
- 3.
Verificación de posición e inyección del fármaco con control ecográfico.
- 4.
Control ecográfico postinyección, verificación del espasmo venoso y reparto.
- 1.
Evaluación ecográfica del segmento a tratar, sea eje safeno o ramas tributarias. Como se ha reseñado previamente, es de vital importancia realizar una buena planificación del tratamiento. Antes de llevar a cabo las punciones (de craneal a caudal idealmente), debemos haber elegido con anterioridad los lugares en los que vamos a realizarlas, ya que la propia expansión de la espuma nos impedirá hacerlo a posteriori. Es importante, siempre que se pueda, elegir puntos de punción profundos, ya que recordemos que el lugar de inyección es el punto de mayor concentración y mayor tiempo de acción del esclerosante. La evaluación ecográfica, así mismo, nos permite localizar arteriolas cuya punción e inyección de esclerosante sería desastrosa.
- 2.
Punción venosa con control ecográfico. Hay profesionales que prefieren la palomilla asociada a jeringa luer lock. Otros, sin embargo, utilizan alargaderas conectadas a agujas 22-25G o incluso punción directa con jeringa.
- 3.
3.Verificación de posición e inyección del fármaco con control ecográfico. Una vez puncionada la vena, debemos asegurarnos de la posición intravascular, aspirando antes de inyectar (fig. 11).
Figura 11.A) Se empieza con una buena evaluación ecográfica para planificar el tratamiento. Esta paciente presenta un segmento intrafascial de la vena safena accesoria, previo a su recorrido subcutáneo. Eso nos permite utilizar concentraciones mayores proximalmente, lo que minimiza el riesgo de complicaciones cutáneas. B) Punción de proximal a distal siempre, para evitar que el reparto de la espuma nos impida acceder a otros puntos del recorrido venoso. Aspirado de sangre para comprobar posición intravenosa. C) Inyecciones en puntos más distales y superficiales, adaptando las concentraciones del esclerosante. Cuanto más superficial, menor concentración.
- 4.
Al aspirar, deberemos evitar que llegue sangre al interior de la jeringa, ya que el contacto de una pequeña cantidad de sangre con la espuma es suficiente para desactivarla en unos segundos, a través de las proteínas plasmáticas24.
- 5.
Control ecográfico postinyección, verificación del espasmo venoso y reparto. Un buen reparto de la espuma en segmentos no demasiado extensos desde el punto de punción, mediante la técnica de milking (repartir la espuma con el transductor ecográfico) optimizará los resultados. También podemos utilizar la propia presión del transductor, para bloquear el paso de la espuma a través de perforantes o del cayado.
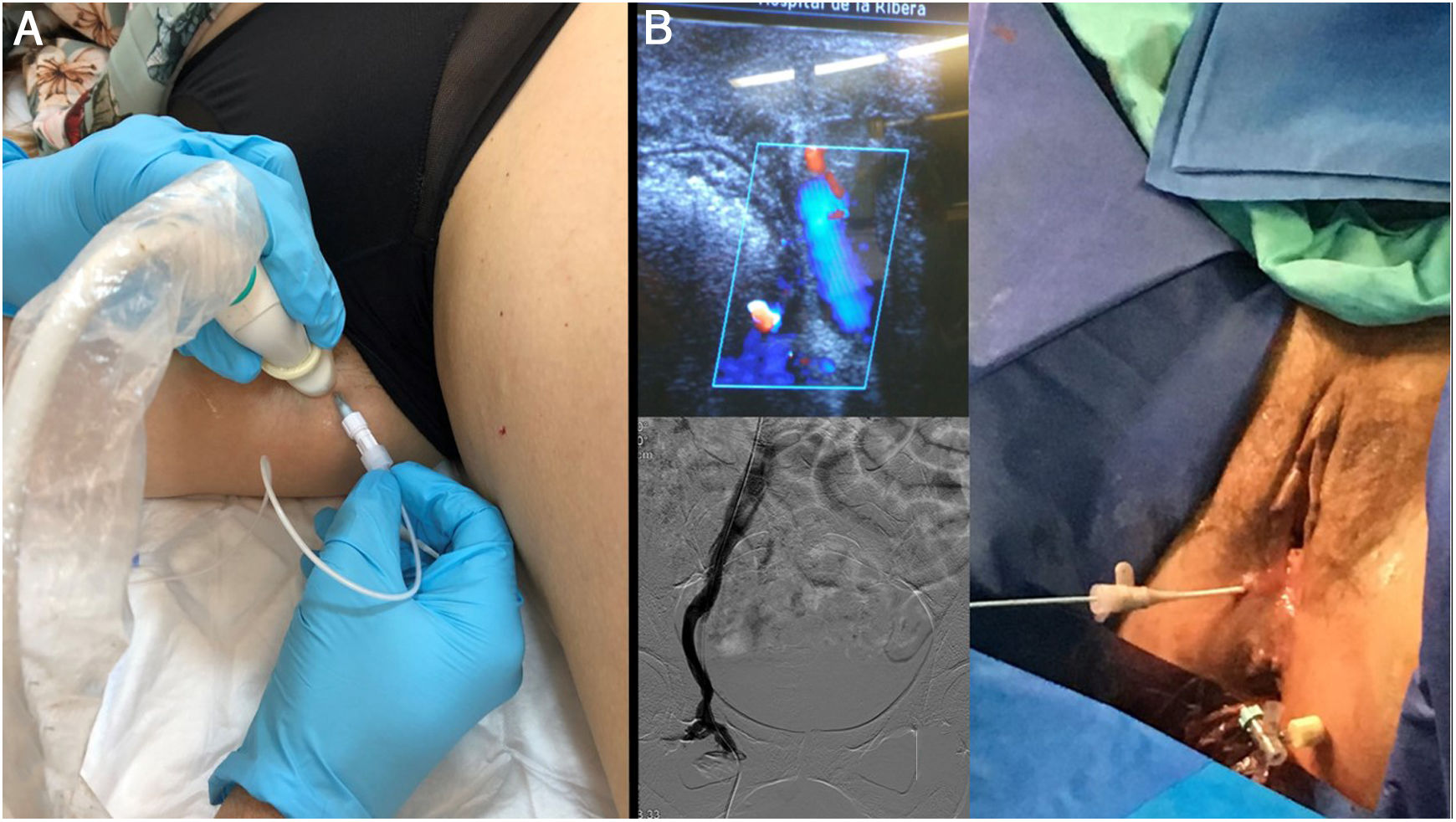
Aunque el manejo ideal de las varices gonadales y su versión clínica, en forma de síndrome congestivo pélvico, es a través de flebografías y embolizaciones selectivas de los segmentos pélvicos refluyentes, es posible también el tratamiento de aquellos segmentos incompetentes provenientes de la pelvis (puntos de fuga pélvicos), mediante esclerosis con espuma ecoguiada. Así mismo, la ecografía es una herramienta imprescindible para cateterizar venas de difícil acceso, a través de un acceso pudendo (fig. 12).
A) La presencia de shunts de origen pélvico es muy frecuente, y se puede tratar sin necesidad de realizar una embolización de las varices pélvicas, especialmente cuando la paciente no presenta síntomas de congestión pélvica y la motivación final es únicamente controlar el reflujo hacia los miembros inferiores. B) En aquellos casos en los que debido a embolizaciones previas no es posible acceder a los plexos varicosos pélvicos distales por la vía convencional, mostramos un acceso ecográfico alternativo a través de la vena pudenda en el canal de Alcok (punto de fuga P), que permite incluso su cateterización. Desde este abordaje, es posible embolizar segmentos proximales a través de catéter y/o realizar una inyección directa de espuma.
La proliferación de técnicas endovenosas para el tratamiento de las varices en MMII, especialmente en lo referente a los ejes safenos, puede resultar abrumadora. Se ha pretendido aportar una perspectiva global y una breve pincelada de alguna de ellas.
Las ideas básicas que nos gustaría recalcar son que actualmente, mediante todo este conjunto de técnicas, no es necesario recurrir a la cirugía convencional para el tratamiento de varices en MMII y que progresivamente irán suplantando a esta última por su menor morbilidad. Se les puede achacar un mayor coste, pero es un tema controvertido, ya que a su vez evitan la utilización de quirófanos convencionales, hospitalizaciones y bajas laborales.
Actualmente. los dispositivos de oclusión de ejes safenos muestran unas efectividades similares. Por ese motivo, la elección de una técnica en concreto o una combinación de ellas lo consideramos un tema menor, en comparación con el desarrollo de una correcta estrategia de tratamiento.
Sin embargo, hay un aspecto que por sí solo puede marcar la diferencia a la hora de obtener buenos resultados, y es un manejo exquisito de la ecografía tanto diagnóstica como intervencionista.
FinanciaciónSin financiación.
Conflicto de interesesProctor y consultor para Merit Medical, Cook, Terumo y Logsa Endomedical S.L.
Agradezco con cariño a mis compañeros del servicio de angiología y cirugía vascular, así como a mis compañeros de radiología vascular, su apoyo y ayuda estos años.