La elastografía hepática representa un método no invasivo de uso actual para el diagnóstico de fibrosis desarrollado a partir de las limitaciones encontradas con la biopsia hepática, los marcadores serológicos y las modalidades de imagen tradicionales durante la última década. Existen diferentes métodos de elastografía por ultrasonido, de los cuales hasta el momento la elastografía por ondas de choque ha demostrado superioridad para el diagnóstico de fibrosis clínicamente significativa, en la que la detección temprana de la enfermedad modifica el tratamiento y mejora el pronóstico. Se pretende realizar una corta revisión de los diferentes métodos de elastografía mediante ultrasonido, haciendo énfasis en la elastografía por ondas de choque, así como los aspectos técnicos para su realización y los puntos clave para su interpretación.
Liver elastography is a noninvasive method for diagnosing fibrosis that has been developed over the last decade in response to the limitations of liver biopsies, blood markers, and traditional imaging modalities. There are different methods of measuring tissue stiffness through ultrasound; thus far, shear wave elastography has proven superior for diagnosing clinically significant liver fibrosis, where early detection modifies the approach to treatment and improves prognosis.
This article aims to provide a brief review of the different methods for performing elastography with ultrasound, focusing especially on shear wave elastography and on technical aspects for carrying out the procedure and key points for interpreting the findings.
La fibrosis hepática constituye la respuesta cicatricial del hígado ante lesiones de diferente causa, que al hacerse persistentes generan cambios en la arquitectura del hígado. El daño se inicia con el depósito subendotelial de tejido fibroso que progresa a ser panlobular, con la consiguiente formación de nódulos en etapas avanzadas, como la cirrosis1–3. Aproximadamente un 20-30% de los pacientes con hepatopatía crónica desarrollan cirrosis, situación que aumenta significativamente el riesgo de desarrollo de carcinoma hepatocelular y de otras complicaciones, como hipertensión portal, ascitis, encefalopatía y disfunción metabólica1,2.
A través del tiempo se ha considerado que, una vez iniciada la fibrosis, el proceso se vuelve irreversible, teniendo progresión variable según factores propios del paciente (edad, consumo de alcohol y coinfección por virus de la inmunodeficiencia humana u otros virus)4. Sin embargo, en los últimos años se ha demostrado que existe la posibilidad de revertir, o al menos detener, los cambios relacionados con la fibrosis, específicamente si se detecta y trata desde etapas iniciales3,5.
La hepatopatía alcohólica ha sido una de las principales causas de fibrosis y cirrosis durante todos los tiempos, así como la hepatitis B. Sin embargo, actualmente la incidencia de cirrosis ha venido aumentando a causa del desarrollo de más casos de hepatitis C y de esteatohepatitis no alcohólica (esta última con una prevalencia del 3% en la población mundial)5,6. Otras causas incluyen fármacos y toxinas, como el metotrexato y la vitamina A; infecciones como la esquistosomiasis, la brucelosis y la sífilis; enfermedades autoinmunes; enfermedades metabólicas (enfermedad de Wilson y hemocromatosis), y obstrucción biliar crónica. También existen casos de fibrosis hepática idiopática5.
Diagnóstico de la fibrosis hepáticaLa determinación de la extensión y la gravedad de la fibrosis hepática es fundamental para el manejo del paciente, para el seguimiento de las complicaciones y para la evaluación de la respuesta al tratamiento1. Hasta el momento, la biopsia hepática (percutánea, laparoscópica, quirúrgica o transyugular) con tinción selectiva para moléculas de tejido conectivo sigue siendo el método más preciso para determinar el grado de fibrosis, la gravedad del daño y las posibles enfermedades concomitantes5,7. Existen al menos tres sistemas histológicos validados para la estratificación de la fibrosis hepática: la puntuación de Ishak, el sistema de Desmet/Scheur y el sistema METAVIR, que es el más utilizado en la actualidad3. El sistema METAVIR consta de cinco categorías, de las que F0 es un hígado completamente normal, F1 es cuando existe fibrosis periportal, F2 es cuando además hay formación de tabiques fibrosos incompletos, F3 es cuando hay tabiques fibrosos completos, y F4 es cuando también hay nódulos, que representa el estadio de cirrosis8.
Aunque hasta el momento es el método de elección para el diagnóstico, la biopsia hepática representa un método invasivo con posibles complicaciones que varían desde dolor, hemorragia leve e hipotensión transitoria hasta hemorragia grave, peritonitis, sepsis y perforación de órganos vecinos, entre otras, alcanzando una mortalidad de 1 por 10.0009,10. Además, la interpretación tiene una variabilidad interobservador de hasta el 20%, y el principal fallo es el de error de muestreo, que se presenta en el 33-50% de los casos, ya que dada la distribución difusa y no homogénea de la enfermedad, el tamaño de la muestra solo representa aproximadamente 1/50.000 de la masa total del hígado3,7,9. Por otro lado, supone un aumento de los costos hospitalarios, ya que en torno a un 2-3% de los pacientes requieren hospitalización por complicaciones asociadas11.
Por este motivo se han realizado numerosos esfuerzos buscando marcadores séricos que reflejen la alteración de la función hepática (indirectos) o la actividad de enzimas involucradas en la producción de matriz extracelular que puedan predecir el grado de fibrosis (directos)7,9,12. Sin embargo, los marcadores indirectos se han correlacionado principalmente con el grado de inflamación más que con el grado de fibrosis, y al igual que los marcadores directos son muy costosos y poco disponibles3,5,10.
Durante las últimas décadas, las técnicas de imagen se han incluido dentro de los protocolos de evaluación de pacientes con fibrosis hepática. Se han utilizado la ecografía, la tomografía computarizada y la resonancia magnética, principalmente, para la identificación de cambios morfológicos derivados de la progresión normal de la enfermedad, como la alteración de la ecogenicidad, la lobulación de los contornos hepáticos, la aparición de nódulos fibróticos, la disminución del tamaño del lóbulo hepático derecho con aumento del tamaño del lóbulo caudado, y los cambios por hipertensión portal, entre otros. Sin embargo, todas estas modalidades tienen limitaciones, y los cambios morfológicos significativos se presentan en etapas avanzadas de la enfermedad, por lo que en estadios tempranos, cuando identificar la enfermedad puede cambiar completamente su curso, todas las modalidades tienen una baja sensibilidad y poca especificidad7,13,14.
Ante las limitaciones de la biopsia hepática, los marcadores serológicos y los métodos de imagen descritos, durante la última década se ha promovido la búsqueda de nuevos métodos no invasivos para la cuantificación de la fibrosis. Han aparecido técnicas, como la elastografía por resonancia magnética y la elastografía por ultrasonido, en la que se incluyen la elastografía cuantitativa y la elastografía semicuantitativa, las cuales estiman el grado de fibrosis mediante la medición de la dureza del tejido según la velocidad de propagación de las ondas de sonido en el mismo. La dureza o la elasticidad de un tejido se describe según el modelo de Young (E=3qV2), donde q representa la densidad del tejido y V es la velocidad de propagación de la onda de choque, lo cual se expresa en kilopascales (kPa) y metros por segundo (m/s)1,9,10.
Técnicas de elastografíaLas técnicas de elastografía se utilizan con el fin de determinar las propiedades mecánicas de un tejido, como la dureza. Esto se logra mediante la aplicación de fuerzas que deforman el tejido y producen cambios medibles en el mismo. Las fuerzas de aplicación pueden ser compresión estática manual o por el propio movimiento de los órganos (elastografía semicuantitativa), compresión dinámica inducida por vibraciones o compresión mediada por impulsos mecánicos o generados por ultrasonido (elastografía cuantitativa). Estas últimas son las más utilizadas en la actualidad en los métodos de elastografía; la elastografía semicuantitativa utiliza fuerzas mecánicas externas y la elastografía cuantitativa utiliza fuerzas de radiación acústica internas1,15.
La elastografía estática es una técnica semicuantitativa en la cual se adquieren y comparan datos de la dureza del tejido antes y después de la aplicación de presión y compresión externa manual. Se obtiene una medición indirecta de la elasticidad del tejido midiendo su deformidad después de la compresión, la cual es inversamente proporcional a su dureza. El desplazamiento del tejido deformado se grafica en mapas en escala de grises o en colores1,16,17.
La elastografía de transición (otra técnica semicuantitativa), más ampliamente conocida como FibroScan®, consta de un transductor de ultrasonido unidimensional no incorporado a un equipo de ecografía convencional, capaz de generar una vibración con una onda de amplitud moderada y baja frecuencia, cuya velocidad de propagación se mide para determinar la elasticidad del tejido en un cilindro de parénquima con una profundidad de aproximadamente 25-65mm1,9,18. En esta modalidad no se cuenta con una imagen asociada, lo cual supone una desventaja respecto a las técnicas cuantitativas. En estudios recientes se ha demostrado una sensibilidad de hasta el 91% y el 87% para el diagnóstico de fibrosis y cirrosis, respectivamente, con una especificidad del 91% y del 85%, respectivamente13,19.
La elastografía por fuerzas de radiación acústica (ARFI) es uno de los tipos de elastografía cuantitativa. Utiliza un transductor unidimensional para la medición de la elasticidad del tejido, como la elastografía de transición, pero además permite visualizar el área evaluada (1×0,5cm) en modo B bidimensional, ya que se encuentra incorporado a un equipo de ultrasonido convencional. El pulso de baja frecuencia que genera el transductor produce simultáneamente desplazamiento axial del tejido y ondas de choque, y la medida de la velocidad de la onda de choque perpendicular al transductor expresa la dureza del tejido1,4,17.
La elastografía por ondas de choque, técnica cuantitativa, fue introducida en el año 2005 y su principal ventaja es que permite la medición de la dureza del tejido en tiempo real sin que se vea afectada por los movimientos del paciente. No requiere un generador externo para la formación de la onda de choque, sino que el mismo transductor produce fuerzas de radiación internas (tipo ARFI) que inducen su formación y propagación en el tejido. La medición, que también puede hacerse retrospectivamente, se presenta en mapas de colores que dan la referencia anatómica, y adicionalmente en kPa, incluyendo el valor promedio con desviaciones estándar20.
Se han realizado numerosos estudios en todo el mundo que demuestran la utilidad de la elastografía por ondas de choque para el diagnóstico de la fibrosis hepática en sus diferentes estadios, con una correlación con el estudio histopatológico (que es el método de referencia) del 83%, superior a la de los demás métodos. Así mismo, se ha demostrando su superioridad para la determinación de los estadios F2 y F3, en los cuales la intervención temprana puede cambiar el curso de la enfermedad, con una sensibilidad promedio del 84,7% y el 78,3%, y una especificidad del 92,1% y el 80,9% respectivamente15,21–23. Para la determinación de la fibrosis avanzada o la cirrosis y sus complicaciones alcanza una sensibilidad del 91,2%, con una especificidad del 79,7-80%24,25. Con respecto a la reproducibilidad, se ha encontrado una correlación intraobservador de 0,95 (con un intervalo de confianza de 0,93-0,98) e interobservador de 0,88 (con un intervalo de confianza de 0,83-0,94)26.
IndicacionesLas indicaciones clínicas actualmente aceptadas para la elastografía hepática incluyen la estratificación del grado de fibrosis en pacientes con enfermedad hepática crónica con el objetivo de determinar la presencia o ausencia de fibrosis avanzada (F4), el seguimiento de pacientes con fibrosis ya diagnosticada, la evaluación de pacientes con hipertensión portal de causa no aclarada, y la evaluación de la respuesta al tratamiento en pacientes con fibrosis establecida8.
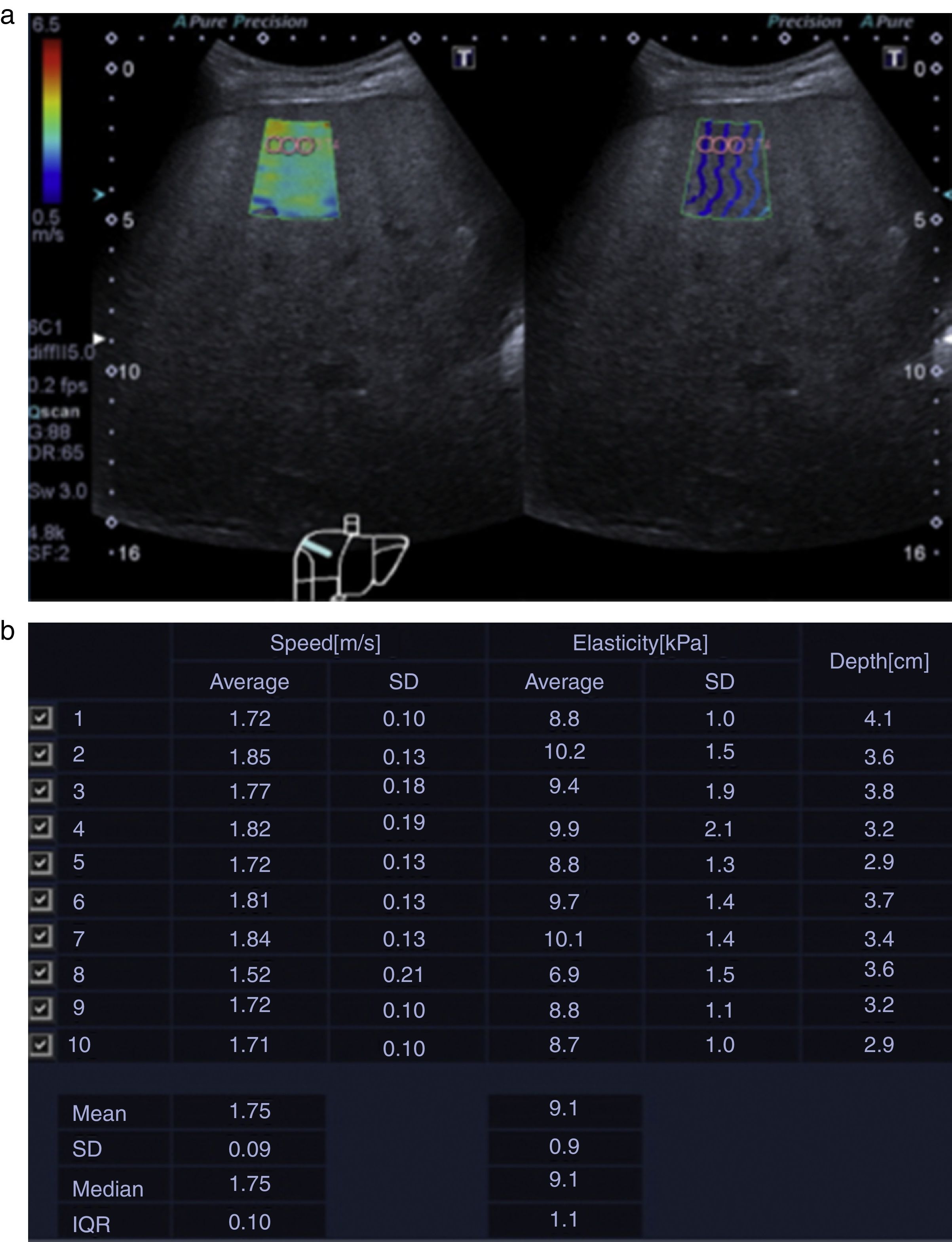
Técnica de realizaciónLa medición debe hacerse con el paciente en decúbito supino o con rotación de 30° hacia el lado izquierdo y elevación del brazo derecho para aumentar la ventana acústica intercostal. El transductor debe colocarse en posición intercostal, y una vez ajustados los parámetros en modo B, identificando una porción de parénquima hepático libre de vasos sanguíneos y a 2cm de la cápsula hepática, se realiza la medición con respiración suspendida en espiración8,27 (fig. 1).
Deben realizarse al menos 10 mediciones en la zona de interés y reportar la media y la mediana, tanto en kilopascales (kPa) como en metros por segundo (m/s). Al menos el 60% de estas mediciones tienen que ser de buena calidad, entendido como una medición con un valor numérico diferente a 0 y una relación entre el rango intercuartílico (IQR) y la mediana menor de 0,308.
Interpretación de los resultadosPara la interpretación de los resultados hay que basarse en las recomendaciones del consenso de la Society of Radiologists in Ultrasound, realizado en octubre de 2014 y publicado en junio de 20158.
Es importante tener en cuenta que, aunque los estudios demuestran una adecuada correlación entre el valor en kPa de la dureza hepática y los estadios METAVIR, el valor de la dureza hepática por sí solo no establece el diagnóstico de fibrosis hepática. Es fundamental la correlación de estos hallazgos con las características específicas del paciente, ya que existen muchas fuentes de variabilidad, como se muestra en la tabla 1, que deben considerarse, y aún no hay estudios específicos sobre el tema8,28.
Posibles fuentes de variabilidad en la elastografía
| • Causa de la enfermedad hepática (hepatitis C, esteatohepatitis, etc.) |
| • Comorbilidad del paciente (enfermedad agudizada o descompensada, insuficiencia cardiaca congestiva, colestasis) |
| • Modalidad utilizada |
| • Factores específicos del equipo |
| • Variabilidad en la medición (técnica, localización en el hígado, operador) |
| • Factores propios del paciente (sexo, obesidad, ascitis, estado posprandial) |
| • Indicación del estudio |
| • Prevalencia de la enfermedad (precisión y valores predictivos) |
Los valores de la medición en kPa deben ser interpretados según dos valores de corte, como se muestra en la tabla 2, teniendo en cuenta el equipo utilizado y que deben ser pacientes con enfermedad compensada8. De esta manera, existen dos grandes grupos: pacientes sin fibrosis clínicamente significativa y pacientes con fibrosis clínicamente significativa.
Recomendaciones del consenso de la Society of Radiologists in Ultrasound para la interpretación de los resultados de la elastografía por ondas de choque
| Fibrosis hepática clínicamente no significativa: grado METAVIR ≤F2 | Fibrosis hepática clínicamente significativa: grado METAVIR F4 y F3 en pacientes seleccionados |
|---|---|
| <7kPa (<1,5 m/s) | >15kPa (>2,2 m/s) |
| Equipos aprobados: SuperSonic Imagine, Toshiba y GE. | |
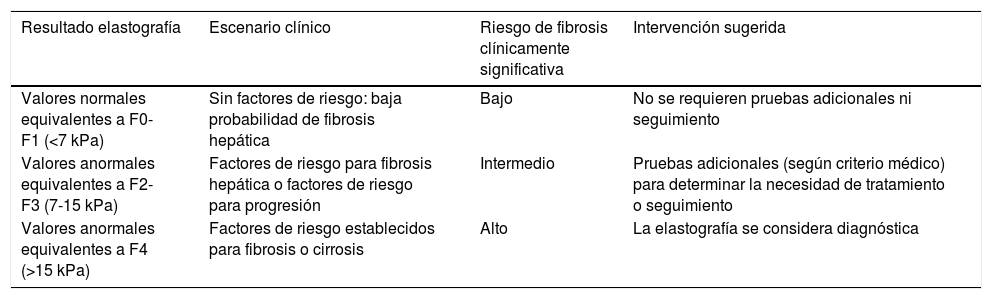
Adicionalmente, según estos valores, y dependiendo del escenario clínico, los pacientes pueden concentrarse en una de tres categorías de riesgo para fibrosis clínicamente significativa: bajo, intermedio y alto. La primera categoría incluye los pacientes con valores de elastografía normales, equivalentes a F0-F1 (<7kPa), sin factores de riesgo y con baja probabilidad de fibrosis hepática clínicamente significativa. Estos pacientes no requieren seguimiento ni pruebas adicionales. En la segunda categoría están los pacientes con valores de elastografía anormales, equivalentes a F2-F3 (7-15kPa), con factores de riesgo para fibrosis hepática o para progresión de la enfermedad si ya tienen el diagnóstico. Estos pacientes, que representan el grupo intermedio, requieren pruebas adicionales (según criterio médico) para determinar la necesidad de tratamiento y seguimiento. La tercera categoría agrupa aquellos pacientes con valores de elastografía francamente anormales, equivalentes a F4 (>15kPa), con factores de riesgo establecidos para fibrosis y cirrosis. En este grupo, la elastografía se considera diagnóstica y no se requiere biopsia de confirmación; adicionalmente puede utilizarse como método de seguimiento y evaluación de la respuesta al tratamiento (tabla 3 y fig. 2).
Categorías de riesgo para fibrosis clínicamente significativa según el resultado de la elastografía y el escenario clínico, e intervención sugerida
| Resultado elastografía | Escenario clínico | Riesgo de fibrosis clínicamente significativa | Intervención sugerida |
|---|---|---|---|
| Valores normales equivalentes a F0-F1 (<7 kPa) | Sin factores de riesgo: baja probabilidad de fibrosis hepática | Bajo | No se requieren pruebas adicionales ni seguimiento |
| Valores anormales equivalentes a F2-F3 (7-15 kPa) | Factores de riesgo para fibrosis hepática o factores de riesgo para progresión | Intermedio | Pruebas adicionales (según criterio médico) para determinar la necesidad de tratamiento o seguimiento |
| Valores anormales equivalentes a F4 (>15 kPa) | Factores de riesgo establecidos para fibrosis o cirrosis | Alto | La elastografía se considera diagnóstica |
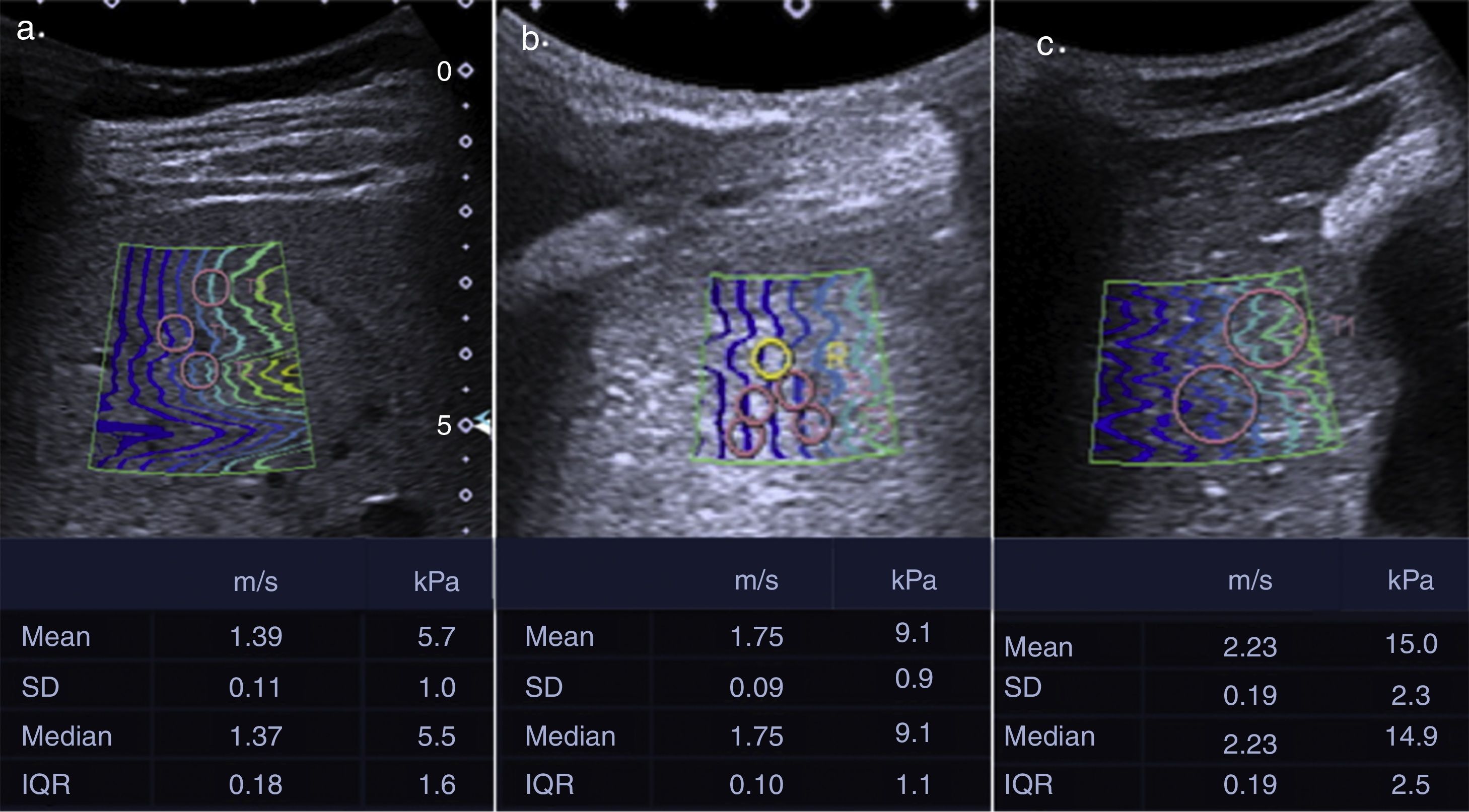
Elastografías de hígado en diferentes pacientes. a) Mujer de 23 años con elevación de las enzimas hepáticas, sin otros factores de riesgo. Por los valores obtenidos se considera una paciente con bajo riesgo de fibrosis clínicamente significativa. El resultado de patología fue de esteatosis leve. b) Varón de 23 años con sospecha de cirrosis hepática e hipertensión portal. Por los valores obtenidos se considera un paciente con riesgo moderado de fibrosis clínicamente significativa. El resultado de patología fue concordante con cambios por fibrosis sinusoidal mínima sin evidencia de cirrosis ni enfermedad necroinflamatoria. c) Varón de 45 años con hepatopatía en estudio. Por los valores obtenidos se considera un paciente con riesgo alto de fibrosis clínicamente significativa. El resultado de patología fue concordante con enfermedad necroinflamatoria crónica en estadio de cirrosis temprana.
La elastografía hepática representa un método no invasivo de uso actual para el diagnóstico de fibrosis. Aunque existen diferentes métodos de elastografía, hasta el momento se ha demostrado la superioridad de la elastografía por ondas de choque para el diagnóstico de fibrosis clínicamente significativa. A pesar de que los estudios demuestran una adecuada correlación entre el valor en kPa de la dureza hepática y los estadios METAVIR, existen múltiples fuentes de variabilidad en la medición, por lo que solo el valor de la dureza hepática no establece el diagnóstico de fibrosis y es fundamental la correlación de estos hallazgos con las características específicas del paciente y el escenario clínico. Valores normales de elastografía en pacientes sin factores de riesgo definidos permiten descartar el diagnóstico de fibrosis clínicamente significativa, y valores francamente anormales en pacientes con riesgo permiten confirmar el diagnóstico de fibrosis avanzada o cirrosis. Sin embargo, en el grupo de pacientes con riesgo intermedio siguen siendo necesarias pruebas adicionales, como marcadores séricos, otras modalidades de imagen y biopsia hepática, para hacer un diagnóstico preciso.
Autoría- 1.
Responsables de la integridad del estudio: VM y JAR.
- 2.
Concepción del artículo: VM y JAR.
- 3.
Diseño del artículo: VM y JAR.
- 4.
Obtención de los datos: No aplica.
- 5.
Análisis e interpretación de los datos: No aplica.
- 6.
Tratamiento estadístico: No aplica.
- 7.
Búsqueda bibliográfica: VM y JAR.
- 8.
Redacción del trabajo: VM.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: VM y JAR.
- 10.
Aprobación de la versión final: VM y JAR.
Los autores declaran no tener ningún conflicto de intereses.
Al grupo de Radiología e Imágenes Diagnósticas del Hospital Universitario de la Fundación Santa Fe de Bogotá.