Editado por: Dr. Tomás Ripollés González - Servicio de Radiodiagnóstico, Hospital Universitari Doctor Peset, València, España
Última actualización: Abril 2021
Más datosEl estudio del tubo digestivo con ecografía está experimentando en los últimos años un auge debido a las cualidades que tiene frente a otras técnicas como la endoscopia, la entero-TC o la entero-RM. Su capacidad de valorar la pared intestinal y elementos que la rodean sin necesidad de administración de contraste y la posibilidad de evaluar la elasticidad y peristaltismo de estas estructuras están generando un progresivo interés en su utilización. En este artículo se describen la técnica ecográfica y sus modalidades, así como las características normales de la pared intestinal y de las estructuras contiguas. Se revisan, con un enfoque práctico, los principales hallazgos patológicos y su interpretación, y los diferentes patrones de presentación, que nos aportarán una aproximación útil para orientar el diagnóstico.
Ultrasound is being increasingly used to study the digestive tract because it has certain advantages over other techniques such as endoscopy, CT enterography, and MR enterography. Ultrasound can be used to evaluate the bowel wall and the elements that surround it without the need for contrast agents; its ability to evaluate the elasticity and peristalsis of these structures is increasing interest in its use. This article describes the techniques and modalities of bowel ultrasound, as well as the normal features of the bowel wall and contiguous structures. It uses a practical approach to review the main pathological findings and their interpretation, and the different patterns of presentation, which will help orient the diagnosis.
La ecografía intestinal ha sido una técnica limitada generalmente al estudio de patología aguda del tubo digestivo en el escenario de urgencias, donde ha demostrado ser de gran utilidad para determinadas patologías como la apendicitis, la diverticulitis aguda o la obstrucción intestinal. La mejora en la resolución de los equipos y el creciente interés y experiencia de los radiólogos han permitido el desarrollo de esta técnica en muchos más ámbitos, como la patología subaguda y en enfermedades crónicas.
La capacidad de la ecografía (similar a la tomografía computarizada [TC] o la resonancia magnética [RM]) para evaluar la inflamación transmural o las alteraciones de las estructuras vecinas es una de las principales ventajas frente a la endoscopia. Por otra parte, la ecografía es una herramienta muy accesible y bien tolerada por los pacientes, no requiere preparación previa y aporta más detalles que la TC en la valoración de las capas de la pared intestinal y en la valoración de la motilidad. Entre las limitaciones nos encontramos la dificultad en el seguimiento de todo el intestino delgado, la peor calidad de la imagen en los pacientes obesos por no poder usar transductores de alta frecuencia, y que la obtención e interpretación de imágenes es dependiente de operador. La curva de aprendizaje es larga y requiere un entrenamiento específico, pero, por otro lado, la experiencia previa en ecografía abdominal acelera este proceso.
A lo largo de este artículo se describe la técnica de la ecografía intestinal y de las diferentes modalidades disponibles. La interpretación de los hallazgos de la ecografía intestinal incluirá: la valoración del grosor de la pared intestinal, la conservación de las capas, la simetría del engrosamiento, su extensión y distribución y la vascularización con la ecografía Doppler color y con contraste intravenoso. También comprenderá la valoración del calibre, la elasticidad y la motilidad intestinal, y la evaluación de otros hallazgos adicionales en la pared, alteraciones transmurales, en los ganglios linfáticos y en el mesenterio.
Preparación, técnica y modalidades de estudioPreparaciónEl paciente no requiere una preparación específica para una ecografía intestinal ordinaria. Únicamente se recomienda ayuno de al menos 4-6 horas1, con el objetivo de disminuir el aire luminal, que en cantidades excesivas dificulta la exploración, y reducir el peristaltismo.
Técnica de exploraciónAunque el contexto clínico debe orientar cada exploración, para una valoración óptima del tracto gastrointestinal es necesaria una sistemática de exploración, conocer las referencias anatómicas y combinar el uso de transductores de distintas frecuencias. Además, es conveniente aplicar una compresión gradual para disminuir la distancia entre el transductor y la zona de interés, y también para mejorar la ventana acústica, que se consigue mediante el desplazamiento de la grasa intraabdominal y los segmentos intestinales interpuestos con gas2.
En primer lugar, se debe realizar una evaluación de los órganos sólidos abdominales con un transductor convex de baja frecuencia, seguido de un estudio inicial del intestino delgado y del colon, para conocer su disposición anatómica y tratar de detectar hallazgos patológicos. Asimismo, gracias a su mayor penetración, suele ser preferible en los pacientes obesos, en el estudio de las asas intestinales de localización pélvica y para el recto. A continuación, se explora el intestino con un transductor convex o lineal de media o alta frecuencia (5-15 MHz), cuya superior resolución permite realizar una valoración minuciosa de los segmentos intestinales sospechosos, definir el estado de las capas de su pared, y las alteraciones en las estructuras adyacentes (grasa perientérica, peritoneo, adenopatías y vasos)3,4. Un punto de partida apropiado es el ciego, habitualmente localizado en la fosa ilíaca derecha y reconocible por su contenido de material fecal con sombra acústica y falta de peristaltismo, tras lo cual se desplaza el transductor siguiendo las diferentes porciones del colon de forma continua hasta, al menos, el sigma proximal. El llenado vesical permite, con frecuencia, verificar que el recto es normal. Por otra parte, desde el ciego resulta sencillo localizar el íleon terminal, que debe seguirse proximalmente, y a continuación evaluar el resto del íleon y el yeyuno con movimientos paralelos del transductor en dirección craneocaudal, hasta cubrir todo el abdomen y la pelvis; por último, el antro gástrico y el duodeno pueden explorarse desde el epigastrio1–3,5,6.
Técnicas DopplerLa imagen en Doppler color y power Doppler es útil para detectar presencia o ausencia de vascularización en las lesiones, así como incrementos del flujo tanto en los vasos mesentéricos que se dirigen al asa intestinal como en los vasos intramurales del segmento intestinal patológico.
Es importante adecuar la sensibilidad del color para valorar la vascularización mural, usando un preajuste especial previamente optimizado para la detección de flujo lento de pequeños vasos. La persistencia del color debe estar en nivel medio o alto, con un filtro de pared bajo (40-50 Hz), PRF entre 800 y 1500 y escala de velocidades bajas. La ganancia debe ser ajustada al máximo, pero evitando artefactos de ruido de color7. La ausencia de detección de vascularización en un segmento con pared engrosada puede deberse, en ocasiones, a la poca sensibilidad del equipo, a los parámetros Doppler elegidos inadecuados, al índice de masa corporal alto o a la localización profunda del asa.
Contraste oralDe forma similar a la entero-RM o entero-TC, en la ecografía, la toma de un contraste líquido anecoico y no reabsorbible (p. ej., 500ml de solución de polietilenglicol) produce una distensión completa del intestino delgado8 y disminuye los artefactos acústicos gaseosos, lo que se traduce en una mayor precisión para valorar la pared9. Su acrónimo en inglés es SICUS (small intestine contrast ultrasonography). Los estudios que utilizan esta técnica muestran mayor capacidad para valorar el intestino delgado proximal y detectar estenosis, además de disminuir la variabilidad interobservador. Sin embargo, incrementa la duración del procedimiento de 25 a 60 minutos y, al aumentar el peristaltismo, dificulta la valoración del Doppler color10,11.
Contraste intravenosoEl único contraste intravenoso de segunda generación aprobado por la Agencia Europea de Medicamentos para ser empleado en ecografía abdominal es SonoVue®, que contiene microburbujas de hexafluoruro de azufre.
La frecuencia del transductor seleccionado determina la dosis de contraste, que oscila entre 2,4 y 4,8ml1. A diferencia de la imagen Doppler, permite estudiar la microvascularización de la pared intestinal, cuyo patrón de realce normal comprende tres fases: a) 10-20 segundos: llegada del contraste a los capilares sanguíneos; b) 30-40 segundos (fase arterial): alcanza la máxima intensidad; c) 30-120 segundos (fase venosa): lavado de contraste12,13. Con el fin de disminuir la subjetividad propia del análisis cualitativo del realce, los equipos de ecografía actuales incorporan diferentes herramientas informáticas para el análisis cuantitativo y semicuantitativo14. Se ha demostrado que existe una relación lineal entre la concentración de microburbujas y la intensidad de la señal ecográfica, lo que posibilita cuantificar el realce del contraste para que el método sea más objetivo15. Esta técnica también está indicada para discriminar la naturaleza vascular o avascular de las masas inflamatorias, diferenciando flemón (con realce) de absceso (ausencia de realce)1,16.
ElastografíaEn función del sistema empleado para estimar la rigidez de un tejido se distinguen dos tipos de elastografía: “strain” y “shear wave”. La mayoría de los estudios en el tracto gastrointestinal se han desarrollado en pacientes con enfermedad de Crohn, con el fin de valorar su capacidad para clasificar las estenosis en inflamatorias o fibrosas en los pacientes con aquella enfermedad17,18, recomendando preferiblemente la técnica “strain”19. La elastografía también aporta información valiosa en la estadificación preoperatoria del carcinoma de recto al aplicarla junto a la ecografía endorrectal19. Estas dos indicaciones clínicas se reflejan en la recientes recomendaciones de la EFSUMB (European Federation of Societies for Ultrasound in Medicine and Biology) del uso de la elastografía en el tubo digestivo19.
Patrones normales y patológicosLa evaluación del tracto intestinal debe realizarse teniendo en cuenta las características ecográficas de la pared, del contenido intraluminal, del peristaltismo y de los hallazgos extraintestinales. El reconocimiento del tramo se hará en función de la localización y del patrón de los pliegues. El estómago muestra los pliegues más o menos gruesos, dependiendo del contenido de la luz, mientras que las asas de intestino delgado pueden tener apariencias muy variables según la distensión, contenido aéreo o líquido; el yeyuno presenta las características válvulas conniventes, con pliegues más apilados y mayor contenido líquido, al contrario que el íleon, de paredes más lisas y con menor peristaltismo. El colon, por otra parte, muestra casi siempre mayor contenido de gas y el patrón de haustras, y su localización sirve de referencia en las regiones paracólicas1,3,5,20.
Pared intestinalCaracterísticas normalesEl grosor normal de la pared intestinal es menor de 2mm cuando está distendida la luz1, pero si está colapsada puede ser normal hasta 3mm en el intestino delgado y 4mm en el colon21. Las excepciones son el estómago, que puede medir hasta 6mm, el antro pilórico y el recto (hasta 7 mm). En ausencia de patología, el sigma puede mostrar hipertrofia de la muscular y alcanzar hasta 5mm de grosor2,5,21,22.
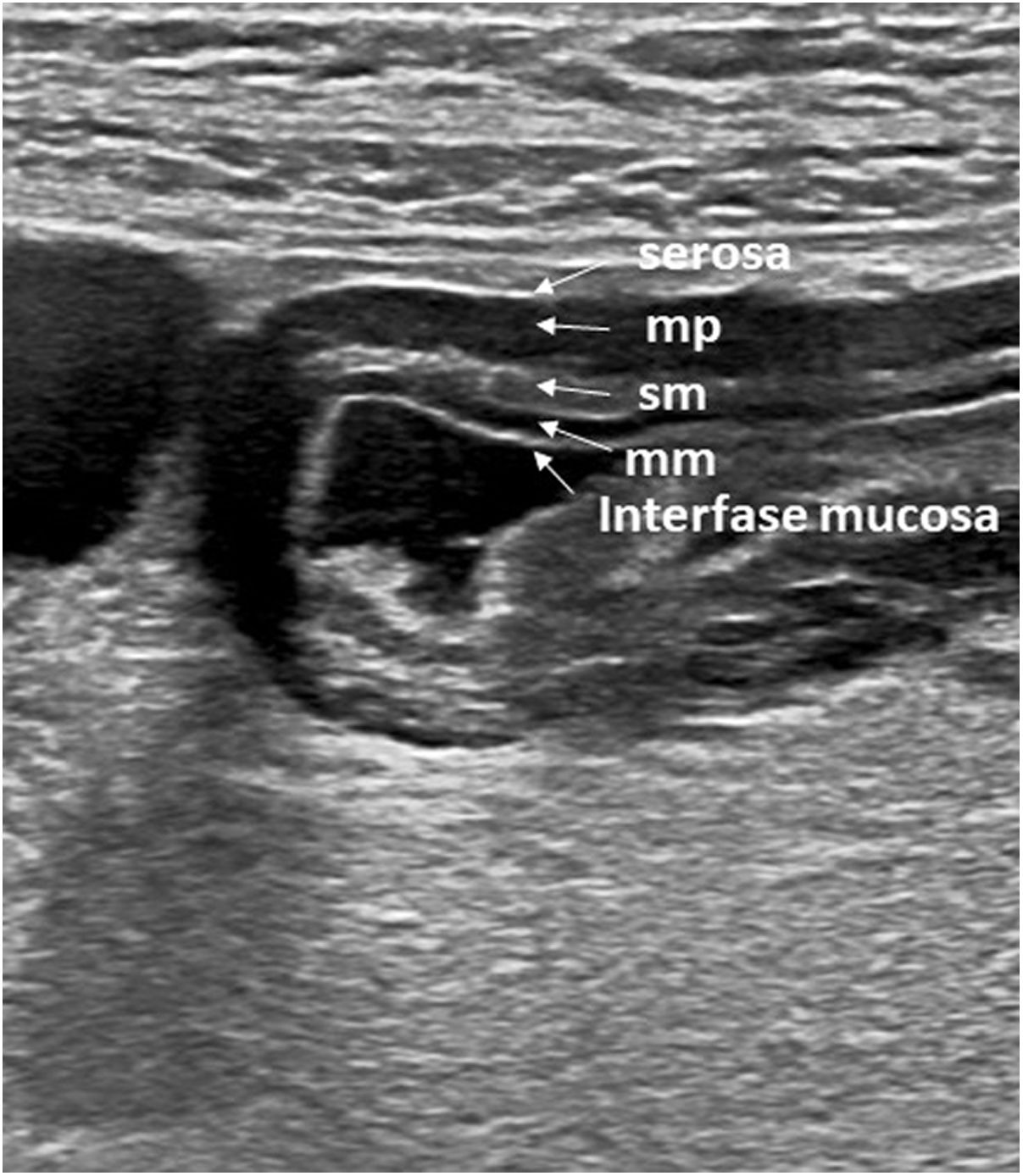
Clásicamente, se definen 5 capas en la pared intestinal, alternando la ecogenicidad entre ellas23 (fig. 1). Estas capas se identifican mejor si la pared está engrosada, con líquido en la luz y usando transductores de alta frecuencia.
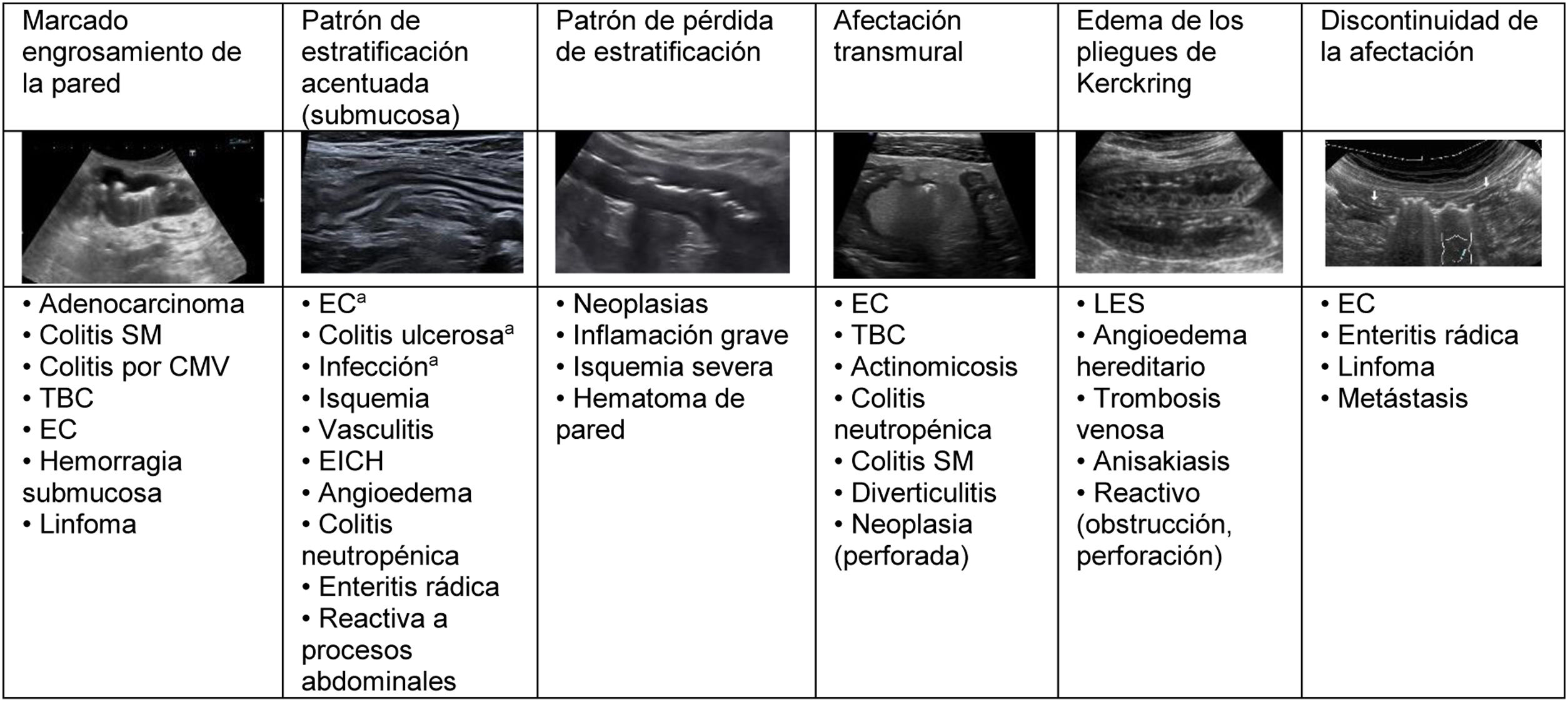
Patrones de afectación de la pared.
a La acentuación es más pronunciada que en otras patologías.
Colitis SM: colitis seudomembranosa; Colitis CMV: colitis por citomegalovirus; TBC: tuberculosis; EC: enfermedad de Crohn; EICH: enfermedad de injerto contra huésped; LES: lupus eritematoso sistémico.
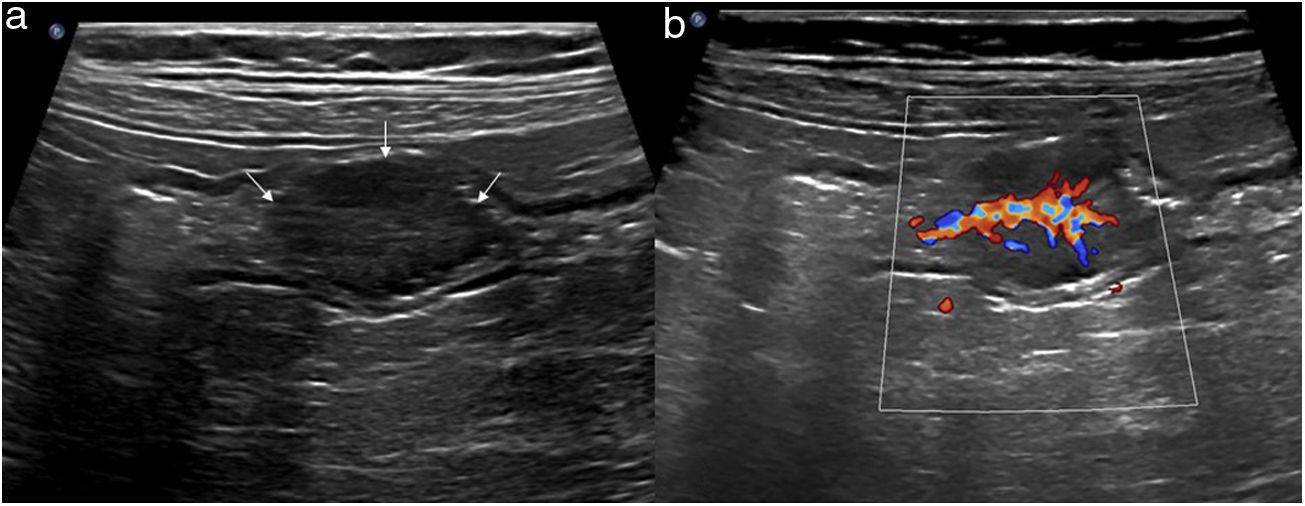
El aumento del grosor de la pared es el principal hallazgo en el estudio de la patología intestinal y, además, es el único parámetro cuantitativo. En la mayoría de estudios publicados solo se utiliza este valor como criterio de enfermedad. Se debe medir desde la serosa hasta la interfase de la mucosa con la luz, y aunque es un signo sencillo de valorar, es inespecífico, pues se manifiesta en la mayor parte de la patología inflamatoria, infecciosa, isquémica y tumoral2,5. El engrosamiento suele ser muy prominente en la patología tumoral, aunque en algunos procesos inflamatorios o infecciosos también puede ser muy marcado (fig. 2)24.
Apariencia ecográfica normal de las capas de la pared del antro gástrico. Imagen axial que muestra 5 capas que, de dentro afuera, son: 1) interfase mucosa, capa ecogénica que representa la interfase de la luz gástrica con la superficie mucosa; 2) muscularis mucosae (mm), capa hipoecoica que representa la capa profunda mucosa; 3) submucosa (sm), capa hiperecoica; 4) muscular propia (mp), capa hipoecoica; 5) serosa, capa ecogénica y la más externa.
El engrosamiento asimétrico es característico de las neoplasias, aunque puede ocurrir en la enfermedad de Crohn, en la tuberculosis y actinomicosis intestinal, en la enteropatía por antiinflamatorios no esteroideos, en la diverticulitis y en el linfoma (excepcionalmente es simétrico en este tipo de neoplasia y en el carcinoma escirro)3,24. En las úlceras gástricas o duodenales también se produce engrosamiento asimétrico de la pared20, y en estos casos es útil la búsqueda de líquido periduodenal y la presencia de gas en la úlcera dentro de la pared engrosada.
Estratificación de la paredSe describe el patrón de estratificación acentuada cuando se reconocen las capas con claridad, sobre todo la submucosa (ecogénica). En general, es característico de patología benigna y más marcado en las infecciones y patología inflamatoria, incluida la enfermedad de Crohn (fig. 2)4,25. Por otra parte, la pérdida de estratificación es una de las características de los procesos malignos del tubo digestivo. No obstante, aunque no haya infiltración tumoral, la existencia de un importante infiltrado leucocitario o de otro tipo de exudación puede generar hipoecogenicidad de la capa submucosa y una apariencia de pérdida de las capas, como ocurre en los casos de inflamación o isquemia grave (fig. 2)26–28.
En las enfermedades con afectación transmural también se pierde la apariencia de las capas y la pared intestinal muestra una ecogenicidad muy baja, pudiéndose acompañar de otros hallazgos extramurales como fístulas, flemones y abscesos4, y en ocasiones, hasta perforación con gas ectópico en vecindad. Aunque es más frecuente en la enfermedad de Crohn, otras patologías como la diverticulitis pueden manifestarse de esta forma (fig. 2).
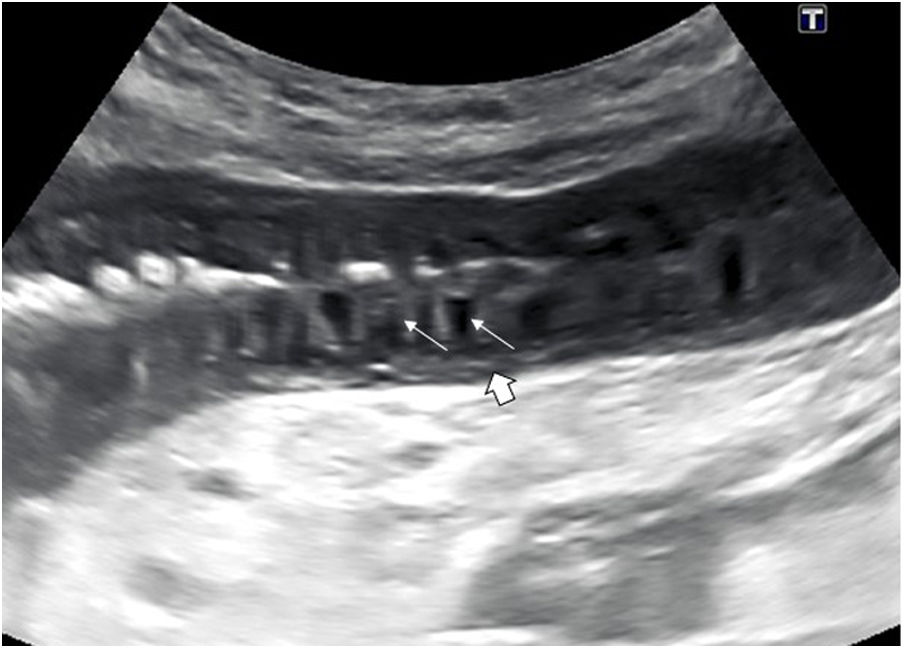
Un patrón característico es el edema de la muscularis-mucosae, en el que la capa más superficial adquiere una apariencia quística de las válvulas conniventes o edema de los pliegues de Kerckring (fig. 3). Este hallazgo se ha descrito en una serie de patologías, generalmente agudas, reversibles y benignas (tabla 1)29–31. Dada la variedad de etiologías, su interpretación debe realizarse en el contexto clínico y evolutivo.
Imagen longitudinal de un asa de intestino delgado, que muestra un engrosamiento hipoecoico de apariencia quística de las válvulas conniventes (flechas finas), que representa edema en las capas superficiales, con la submucosa fina (flecha gruesa). Las pruebas serológicas confirmaron que se trataba de una ileítis por anisakis.
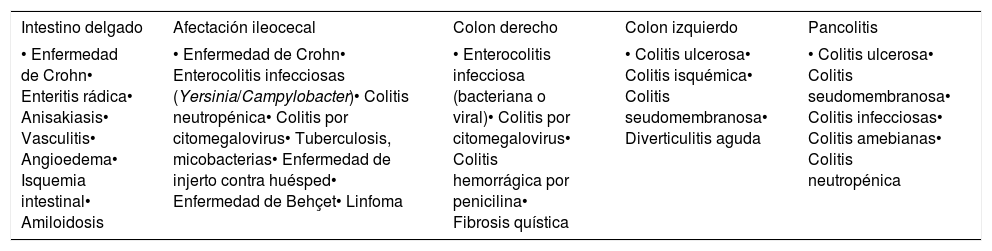
Distribución de las patologías intestinales
| Intestino delgado | Afectación ileocecal | Colon derecho | Colon izquierdo | Pancolitis |
|---|---|---|---|---|
| • Enfermedad de Crohn• Enteritis rádica• Anisakiasis• Vasculitis• Angioedema• Isquemia intestinal• Amiloidosis | • Enfermedad de Crohn• Enterocolitis infecciosas (Yersinia/Campylobacter)• Colitis neutropénica• Colitis por citomegalovirus• Tuberculosis, micobacterias• Enfermedad de injerto contra huésped• Enfermedad de Behçet• Linfoma | • Enterocolitis infecciosa (bacteriana o viral)• Colitis por citomegalovirus• Colitis hemorrágica por penicilina• Fibrosis quística | • Colitis ulcerosa• Colitis isquémica• Colitis seudomembranosa• Diverticulitis aguda | • Colitis ulcerosa• Colitis seudomembranosa• Colitis infecciosas• Colitis amebianas• Colitis neutropénica |
El aumento de la mucosa-muscularis mucosae también se observa en la hiperplasia nodular linfoide, con un marcado engrosamiento nodular e hipoecoico de esta capa que le confiere un aspecto en empedrado, apreciando la submucosa fina. Esta entidad se suele manifestar en niños y jóvenes en el colon, íleon terminal y apéndice, y puede representar un hallazgo incidental, aunque se ha relacionado con enfermedades infecciosas y con estados de inmunodeficiencia32. Suele asociar adenopatías regionales 33.
Existe un tipo característico de colitis, llamada colitis seudomembranosa, causada por Clostridium difficile, que inicialmente puede manifestarse como un engrosamiento hipoecoico muy marcado y nodular de la mucosa, que se correlaciona con el aspecto de acordeón descrito en la TC (haustración muy prominente)34,35.
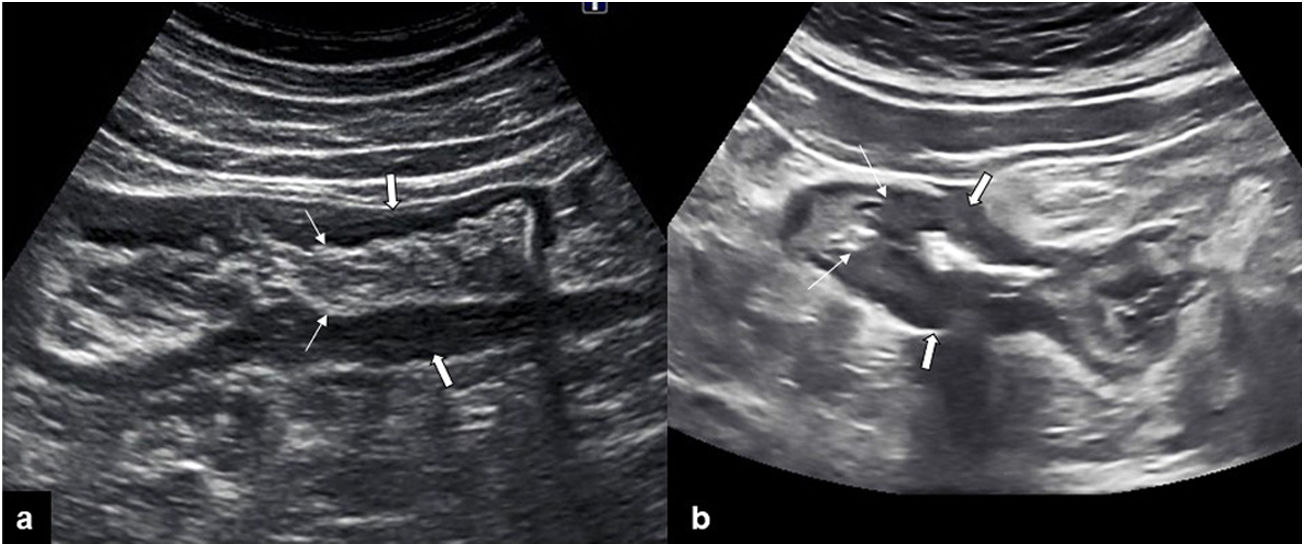
El engrosamiento de la capa muscular propia se observa claramente en la patología diverticular del colon, ya sea en la enfermedad diverticular (hipertrofia muscular) o en la inflamación aguda o crónica (diverticulitis). Se identifica como una marcada prominencia de la capa hipoecoica de la muscular, que no siempre es simétrica, con los característicos divertículos protruyendo hacia fuera de la pared. Las capas internas, como la muscularis mucosae o la submucosa, están conservadas, hallazgo que es muy útil para diferenciar esta patología de un engrosamiento tumoral de la pared, especialmente de las neoplasias perforadas36 (fig. 4).
a) Imagen longitudinal del sigma, que presenta las paredes engrosadas a expensas de la capa muscular propia hipoecoica (flechas gruesas), con preservación de las capas internas (flechas finas), lo cual sugiere benignidad. b) Imagen longitudinal del sigma, donde se observa un marcado engrosamiento mural, pérdida del patrón en capas (flechas gruesas) y una transición abrupta (flechas finas), hallazgos que orientan a malignidad.
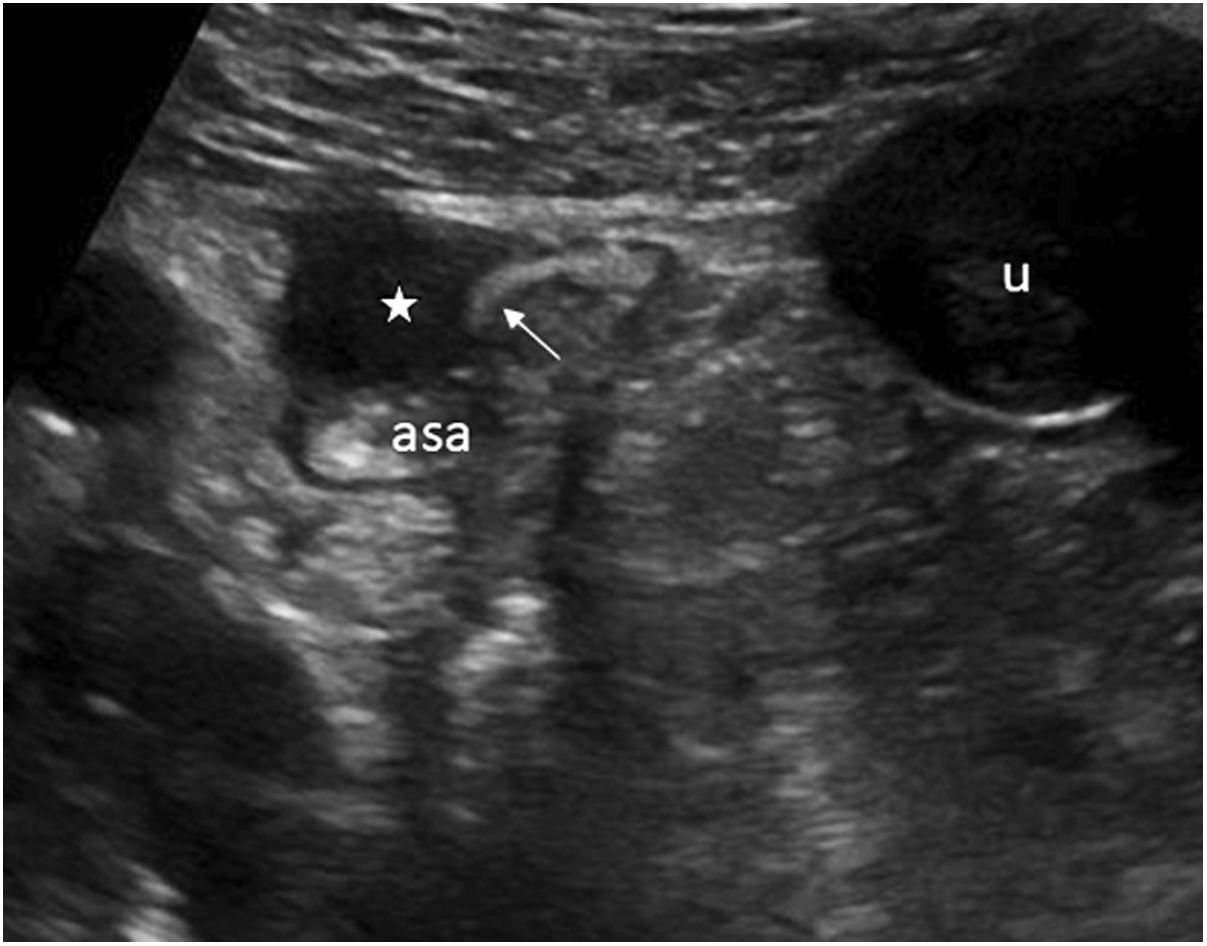
Otras entidades pueden afectar a las capas más externas de la pared (serosa), como los implantes tumorales o la endometriosis intestinal, y se manifiestan por lo general como lesiones iso- o hipoecoicas, que moldean la pared, y que pueden provocar retracciones y acodamientos de asas22,37. Para reconocer estas entidades, es muy importante observar que las capas más internas están preservadas, aunque si progresan pueden infiltrar toda la pared. En el caso concreto de la endometriosis intestinal, la localización suele ser el recto, el sigma o incluso el íleon, y se reconoce como lesiones muy hipoecoicas, con aspecto lenticular, redondeado o en penacho de plumas, que retraen el asa y pueden incluso provocar obstrucción38. La imagen característica ecográfica, junto con el contexto clínico, ayudará a su diagnóstico (fig. 5).
Ecografía de la región pélvica. Se identifica un asa de intestino delgado (asa) con un acodamiento provocado por un tejido hipoecoico (asterisco) interpuesto por fuera de la pared, que corresponde a un implante de tejido endometriósico ectópico. La capa submucosa ecogénica (flecha) no está afectada. U: útero.
La afectación larga (10-30 cm) es característica de la enfermedad de Crohn, patología infecciosa, enteritis por radiación, edema, origen isquémico, vascular o hemorrágico, así como de linfoma. La afectación de segmentos cortos es propia del adenocarcinoma, a diferencia de la diverticulitis, en que la extensión es moderada (5-10 cm). La afectación discontinua es característica de la enfermedad de Crohn, aunque puede hallarse en otras entidades28 (fig. 2).
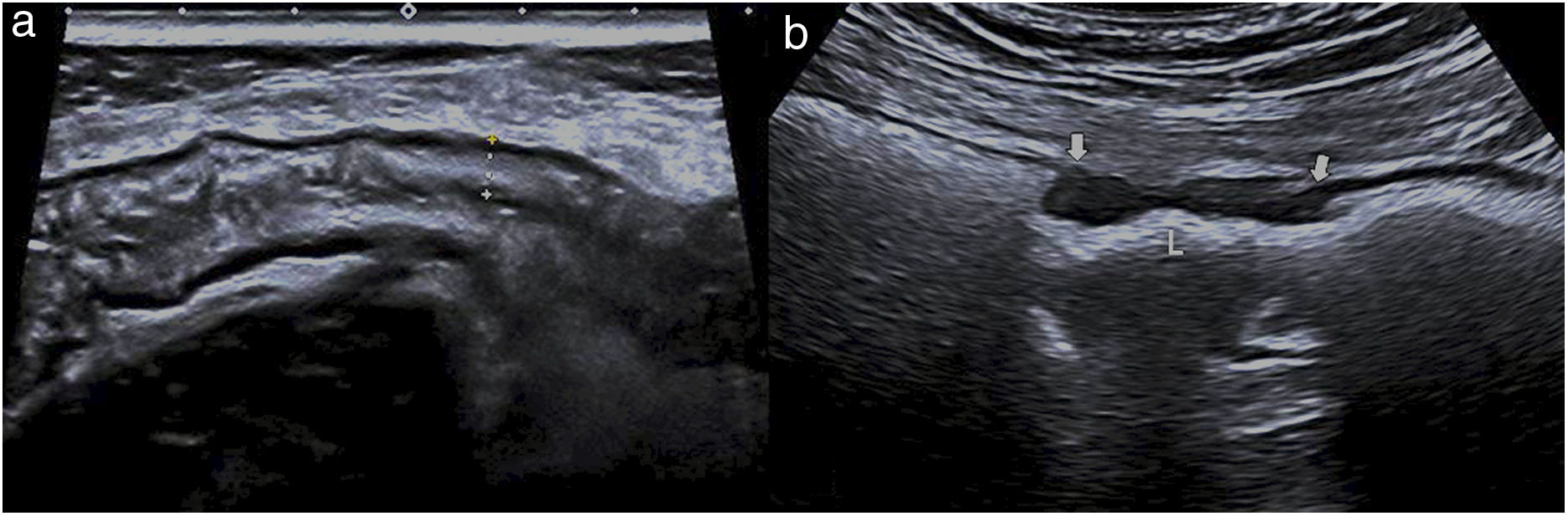
Por regla general, son características de benignidad la afectación larga, concéntrica y con preservación de las capas, y es más característico de malignidad el tramo corto, asimétrico y con pérdida de la estructura de capas (fig. 6)36.
a) Imagen ecográfica del colon descendente que presenta un engrosamiento simétrico de la pared, con conservación de las capas (entre cursores) y afectación de un tramo largo, relacionado con colitis isquémica. b) Imagen ecográfica que muestra un tramo corto de la pared de sigma con engrosamiento asimétrico e hipoecoico (flechas gruesas) por adenocarcinoma, con pérdida de la estructura de las capas. L: luz.
La forma de distribuirse los segmentos afectados también puede aportar información de la patología subyacente, pues algunas patologías tienen afinidad por ciertos tramos del tubo digestivo33 (tabla 1).
VascularizaciónEn general, la pared del tubo digestivo normal muestra poca señal con la ecografía Doppler color. La presencia de hiperemia orienta a patología inflamatoria y neoplásica. Se utiliza una escala semicuantitativa para medir el grado de vascularización, valorando el número de vasos detectados por centímetro cuadrado. La escala modificada de Limberg consta de 4 grados: grado 0=ausencia de vasos; grado 1 o leve flujo=menos de 2 señales/cm2; grado 2 o moderado flujo=de 3 a 5 señales/cm2; grado 3 o marcado flujo=más de 5 señales/cm239. Esta escala se utiliza sobre todo en la enfermedad inflamatoria intestinal, en la medición de la actividad inflamatoria.
La ausencia de flujo puede sugerir origen isquémico, como en el caso de isquemia mesentérica aguda40,41, donde se puede revisar la permeabilidad de los vasos mesentéricos. El uso de contraste intravenoso permite valorar la perfusión de las asas isquémicas42.
Calibre, elasticidad, y peristaltismoEl diámetro máximo de las asas intestinales varía entre 2 y 2,5cm y el del colon, hasta 5cm, aunque el ciego puede exceder esta medida. Si la luz está colapsada, se puede ver una línea ecogénica central que representa la interfase entre las dos mucosas, pero si hay líquido en la luz, el contenido es anecoico y permite definir mejor las paredes, marcándose en caso de obstrucción las válvulas conniventes del intestino delgado y las haustras del colon20,22,28. La ecografía no solo puede detectar la presencia de obstrucción intestinal, sino que puede localizar el nivel y la causa.
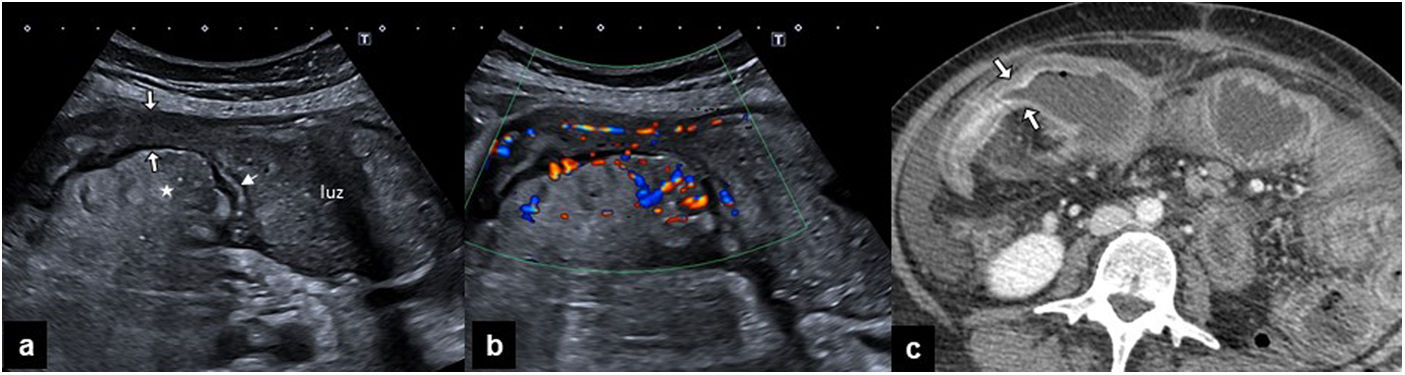
Cuando la pared intestinal es patológica pierde elasticidad, y eso se manifiesta como una rigidez o dificultad en la compresión. Este es uno de los hallazgos más útiles en ecografía para reconocer la inflamación, como en el caso de la apendicitis. Por otra parte, cuando la pared está engrosada y rígida, puede provocar estenosis de la luz, como ocurre en la enfermedad de Crohn o en los tumores intestinales (fig. 7).
a) Ecografía del vacío derecho en un paciente con enfermedad de Crohn, que muestra un asa de intestino delgado dilatada y con contenido intestinal en la luz. Distalmente, se aprecia un engrosamiento homogéneo de la pared (flecha fina), que condiciona una estenosis (flechas gruesas), provoca obstrucción y asocia inflamación de la grasa que rodea la porción mesentérica del asa (asterisco). b) La ecografía Doppler color del mismo segmento demuestra una marcada hiperemia de la pared del asa estenótica y de los vasos mesentéricos. c) Tomografía computarizada abdominal con contraste intravenoso, que muestra la dilatación de las asas (a) y un realce estratificado de la pared de la estenosis inflamatoria (flechas).
Una de las propiedades más interesantes de la técnica ecográfica es la capacidad de valorar la dinámica intestinal1. La estimación y cuantificación de la actividad peristáltica es difícil y subjetiva, puesto que va a depender del estado de ayuno y de otros factores más complejos. El aumento del peristaltismo se manifiesta con movimientos de vaivén del líquido y de la pared. La frecuencia y amplitud de contracciones es muy marcada en la patología infecciosa y en enteropatías por malabsorción. En los cuadros de obstrucción aguda se produce un aumento del peristaltismo por el intento del contenido de sobrepasar el obstáculo, pero si la obstrucción es severa o de larga evolución, puede ocurrir el efecto contrario y manifestarse como un íleo paralítico, con escaso movimiento de asas intestinales. La presencia de líquido libre se ha correlacionado con un alto grado de obstrucción43.
En la enfermedad celiaca, el trastorno de la motilidad se acompaña de otras alteraciones, como la pérdida de los pliegues de Kerckring en el yeyuno, yeyunización del íleon, exceso de líquido luminal, invaginaciones transitorias, así como aumento del número y tamaño de las adenopatías en la enfermedad activa19.
MesenterioEs muy característica la afectación de la grasa en algunos procesos inflamatorios agudos como la diverticulitis y apendicitis, y se reconoce por el aumento de su ecogenicidad y la ausencia de compresión. Este hallazgo nos permite localizar el segmento intestinal afectado pues, además de rodearlo, en ocasiones es más prominente que el engrosamiento de la pared (fig. 8). Otras patologías que asocian afectación de la grasa son las perforaciones por cuerpo extraño, las úlceras duodenales, las apendicitis epiploicas y los infartos omentales; estas dos últimas entidades sin engrosamiento mural intestinal asociado2.
a) Ecografía de un paciente con enfermedad de Crohn con actividad inflamatoria. Engrosamiento simétrico e hipoecoico del íleon terminal. Adyacente al mismo se observa la grasa mesentérica con aumento de su ecogenicidad (flechas), con pérdida de su aspecto estriado y formando un tejido compacto, que provoca la separación de las otras asas. b) Paciente con apendicitis aguda, donde se aprecia la grasa aumentada de ecogenicidad (asterisco), que resalta y aísla al apéndice engrosado (entre cursores).
Una forma particular de afectación del mesenterio ocurre en la enfermedad de Crohn, descrito como proliferación fibrograsa. Este hallazgo se manifiesta como marcado tejido hiperecoico con efecto masa, que rodea al asa inflamada y desplaza el resto de las asas. Aunque se ha relacionado con actividad inflamatoria, se puede encontrar en enfermedad en remisión. Puede asociar aumento de la vascularización con ecografía Doppler color (signo del peine), y en algunos pacientes con buena respuesta al tratamiento disminuye o desaparece25.
AdenopatíasLos ganglios mesentéricos son parte de la evaluación de la patología intestinal y un hallazgo muy frecuente e inespecífico. El tamaño, número, forma y ecogenicidad de las adenopatías en la cavidad abdominal nos pueden ayudar a diferenciar entre causas infecciosas, inflamatorias o tumorales.
Los ganglios mesentéricos normales presentan un tamaño inferior a 4mm en el eje corto en los adultos y hasta 8mm en los niños, y muestran una forma ovalada1. Las adenopatías de etiología infecciosa o inflamatoria son pequeñas, redondeadas y múltiples, y se hallan en la raíz del mesenterio o perientéricas. En las enterocolitis de origen bacteriano se han descrito frecuentemente relacionadas con Campylobacter, Salmonella y Yersinia, asociando en estos casos diferentes grados de afectación de la región ileocecal2.
En la tuberculosis, las adenopatías pueden ser marcadamente hipoecoicas, por necrosis (tabla 2). En esta entidad, además del engrosamiento hipoecoico de la pared, suele asociar alteraciones en mesenterio. Otras entidades que se describen en la tabla pueden mostrar este aspecto anecoico de las adenopatías. En la enfermedad celíaca, esta apariencia está asociada a peor pronóstico o malignidad (linfoma de células T).
La presencia de adenopatías con calcificaciones se relaciona con metástasis de tumores ováricos y del tumor carcinoide, linfoma tratado, amiloidosis y tuberculosis22.
Hallazgos adicionales en la pared y extraluminalesÚlceras superficiales, profundas, fisurasLas úlceras superficiales y profundas se pueden identificar ecográficamente cuando la pared intestinal está engrosada, como en la enfermedad de Crohn, y se manifiestan en forma de pequeñas imágenes lineales ecogénicas en las capas superficiales o como irregularidades más groseras en el espesor de la pared, cuando las úlceras son más profundas (fig. 9). Si progresan en profundidad dan lugar a fisuras y, una vez que se extienden por fuera de la pared, originan tractos sinusales, que se identifican como trayectos lineales hipoecoicos atravesando el mesenterio, los cuales terminan en un fondo de saco ciego o en una masa inflamatoria mesentérica25.
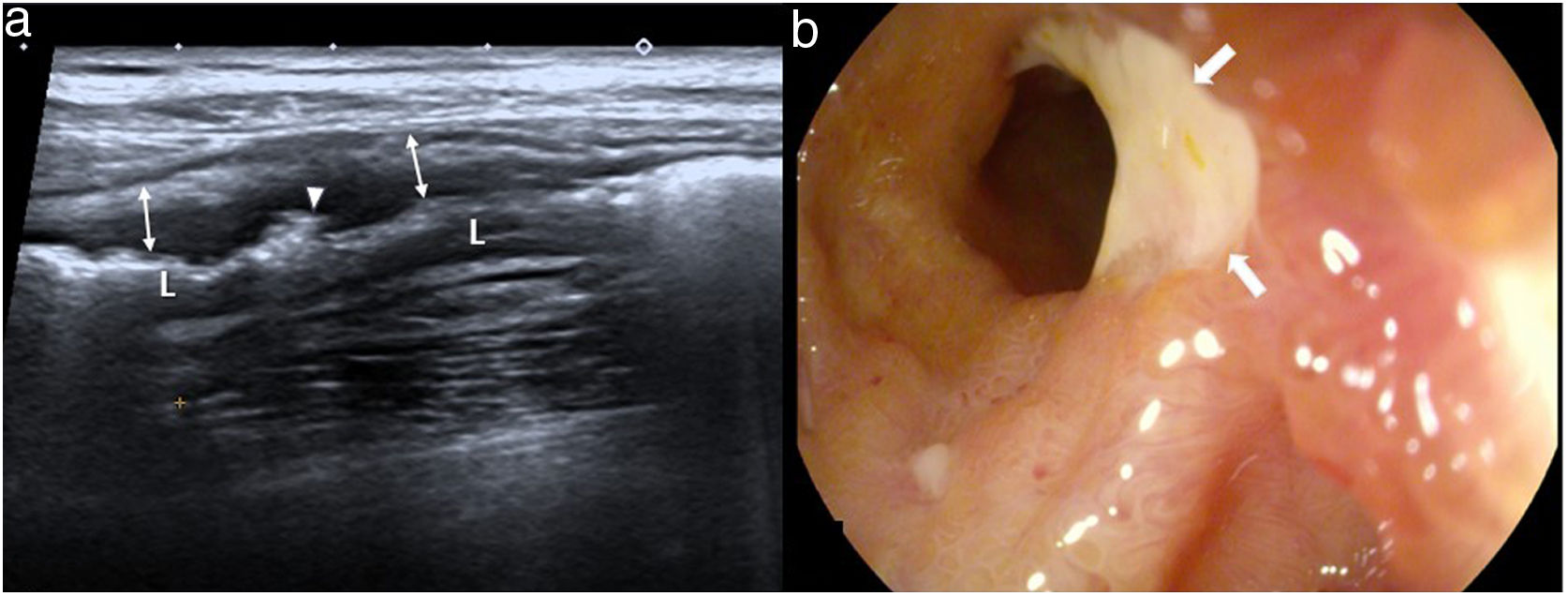
Enfermedad de Crohn de íleon. a) Imagen longitudinal que muestra un engrosamiento marcado de la pared (flechas), preservación del patrón en capas y múltiples irregularidades en la capa más superficial, una de ellas más pronunciada (cabeza de flecha), que corresponde a una úlcera rellena de gas. b) Imagen de ileoscopia donde se aprecia una úlcera de gran tamaño (flechas) en íleon terminal, con mucosa hiperémica.
Las fístulas se identifican como tractos hipoecoicos que conectan un asa intestinal con otra asa o bien con otros órganos, retroperitoneo o piel. Pueden tener gas en su interior; en ese caso, el tracto se ve hiperecoico. En la enfermedad de Crohn, con frecuencia se asocian a estenosis con actividad inflamatoria.
Tanto los flemones como los abscesos son masas inflamatorias y tienen una apariencia similar en ecografía. En general, se aprecian como lesiones hipoecoicas, que están peor definidas en el caso de los flemones y, por el contrario, con paredes más precisas en los abscesos, y pueden contener gas o un nivel hidroaéreo. La ecografía Doppler color y, sobre todo, el uso de contraste intravenoso, permiten diferenciarlas con seguridad: los flemones muestran vascularización en el interior y realzan de forme difusa, mientras que los abscesos únicamente realzan en la periferia, con una zona central no captante y con ausencia de flujo Doppler color. El contraste define mejor el tamaño del absceso, dato que ayuda a tomar decisiones en el tratamiento4,5,16.
DivertículosLos divertículos se aprecian en ecografía como saculaciones hacia fuera de la pared intestinal, con diferentes apariencias según el contenido: hipoecoico si están rellenos de líquido, hiperecogénico si el contenido es gas, o con sombra acústica posterior si contienen un fecalito. Aunque podemos encontrarlos en todo el intestino, son más frecuentes en el hemicolon izquierdo.
Los hallazgos típicos de diverticulitis aguda son: a) engrosamiento segmentario de pared con conservación de la estructura en capas, con predominio de la capa muscular propia; b) aumento de la ecogenicidad de la grasa adyacente, y c) el propio divertículo inflamado44. Adicionalmente, en las diverticulitis complicadas podemos encontrar pequeñas burbujas de gas en vecindad, fístulas y abscesos, como signos de microperforación45.
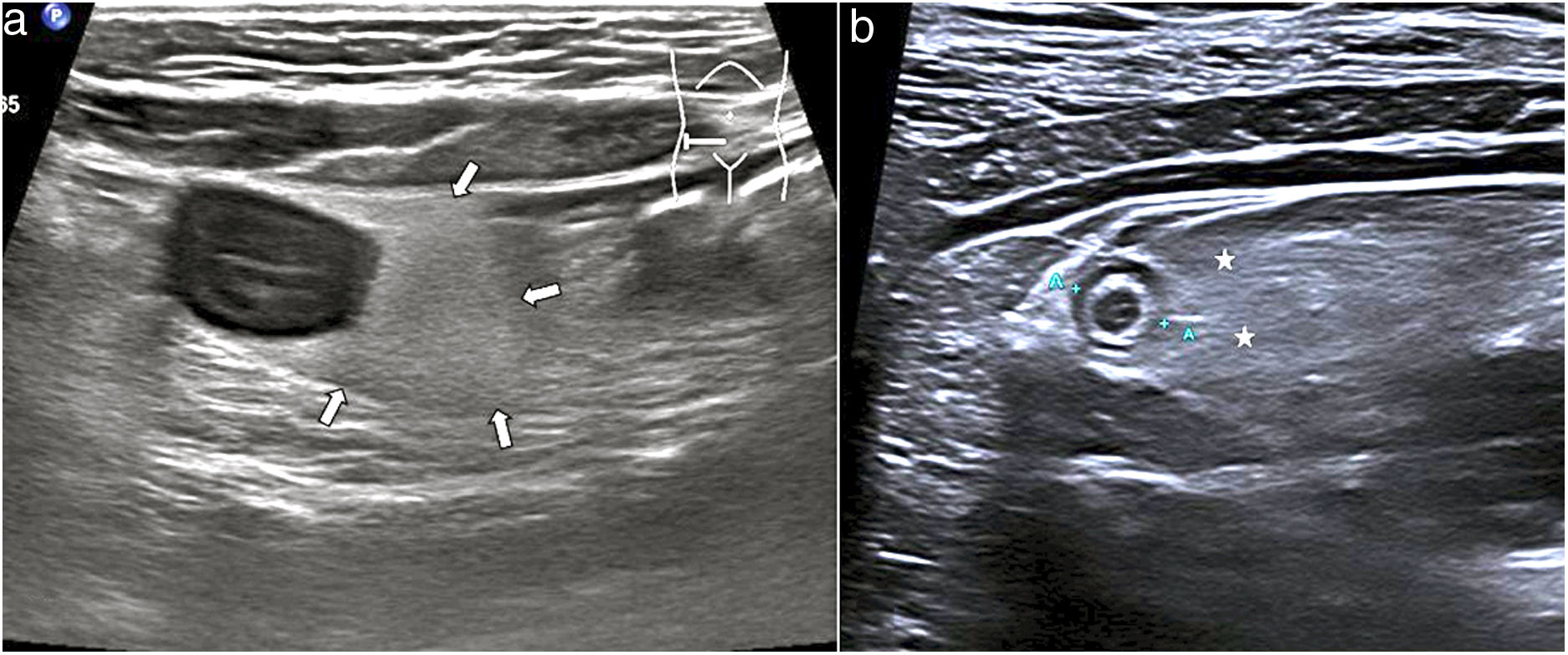
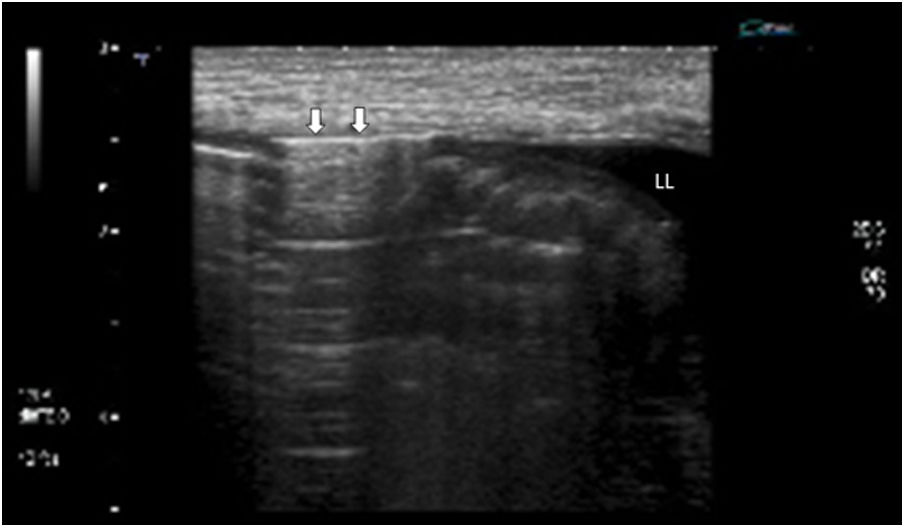
Gas extraluminalEntre las causas más frecuentes de neumoperitoneo por perforación de víscera hueca están las úlceras duodenales y gástricas, diverticulitis, enfermedad de Crohn, neoplasias perforadas, patología iatrogénica y los traumatismos. El gas libre se estudia mejor con el paciente en decúbito supino o en decúbito lateral izquierdo con abordaje intercostal. Se identifica como una línea hiperecoica o pequeñas burbujas de gas, que causan artefactos de reverberación, y se localizan entre la pared abdominal y la superficie hepática anterior. Este gas se desplaza cambiando al paciente de posición y desaparece al aplicar presión (fig. 10).
a) Imagen longitudinal en el vacío izquierdo, con transductor lineal, en un paciente con perforación intestinal. Se aprecia una imagen hiperecogénica lineal (flechas) que se interpone entre la pared abdominal anterior y las asas intestinales adyacentes, que corresponde a gas ectópico en la cavidad peritoneal. Pequeña cantidad de líquido libre (LL).
El gas también se puede reconocer dentro de las colecciones intraabdominales como pequeños focos puntiformes hiperecogénicos o como una imagen lineal si es más abundante. Ante estos hallazgos, en el contexto adecuado, la presencia de asas intestinales con líquido en la luz y paréticas nos puede indicar que se trata de una peritonitis generalizada21,46,47.
Neumatosis intestinalAunque la neumatosis o presencia de gas en la pared intestinal se ha descrito asociada a dos patologías con mal pronóstico, como la isquemia intestinal y la enterocolitis necrotizante, se puede hallar en otras patologías benignas. Podemos detectar la neumatosis como pequeños focos ecogénicos lineales en el espesor de la pared engrosada, dibujando los pliegues o rodeando toda la pared (signo del círculo), lo que lo diferencia del gas intraluminal y de la seudoneumatosis, en las que el aire queda atrapado entre los pliegues intestinales28,48.
Masas y tumoraciones de paredEn ecografía, las tumoraciones pequeñas son difíciles de identificar. Podemos clasificarlas como: a) lesiones intraluminales o polipoides; b) intramurales, que provocan engrosamiento de la pared; c) extraluminales o tumoraciones con crecimiento exofítico.
Lesiones intraluminales: se pueden manifestar en forma de lesiones polipoideas que se proyectan hacia la luz, difíciles de reconocer si esta no se encuentra distendida por líquido o gas. Adoptan este aspecto los lipomas, que son hiperecogénicos y de consistencia blanda37, los adenocarcinomas polipoideos, que pueden alcanzar gran tamaño, y los pólipos inflamatorios, que suelen ser pequeños. La presencia de pedículo vascular ayuda a identificarlas (fig. 11)35. En ocasiones, estas lesiones son causa de invaginación.
a) Imagen ecográfica de un asa de intestino delgado en la que se aprecia una lesión hipoecoica intraluminal (flechas), de estructura sólida y morfología ovoidea, que respeta las capas de la pared. b) Ecografía Doppler color en la que se identifica un pedículo vascular central, lo que confirma que se trata de una tumoración polipoide.
Tumoraciones intramurales: es una de las formas de presentación más reconocida de las neoplasias infiltrantes de colon y de intestino delgado que, en general, muestran un engrosamiento asimétrico, corto y con pérdida de la estructura de capas, y que en ocasiones da lugar a una apariencia de seudorriñón. Este patrón es característico de los adenocarcinomas, que pueden estenosar la luz y provocar obstrucción intestinal, a pesar de tener un tamaño pequeño. El linfoma intestinal se suele manifestar con un pronunciado engrosamiento y muy hipoecoico, aunque puede mostrar preservación de la mucosa y, a diferencia del adenocarcinoma, no suele provocar estenosis de la luz. Es habitual la asociación de adenopatías con apariencia seudoquística28.
Masas exofíticas: algunas tumoraciones dependen de las capas externas, como la muscular propia, y crecen hacia fuera. Es una forma frecuente de manifestación de las neoplasias mesenquimatosas, como los leiomiomas y especialmente los tumores del estroma gastrointestinal (GIST), que son hipoecoicos, bien definidos y muy vascularizados. Conforme van creciendo, pueden presentar áreas quísticas debido a la necrosis, hemorragia o degeneración quística6,49.
ConclusiónLa ecografía intestinal nos ofrece una oportunidad única de estudiar el tracto digestivo de forma no invasiva y en condiciones fisiológicas, aportándonos además información de su motilidad, elasticidad y vascularización y permitiendo el diagnóstico de muy diversos tipos de patología intestinal. Sin embargo, es un procedimiento que precisa una curva de aprendizaje, por lo que se requieren conocimientos de la técnica ecográfica. Su disponibilidad, buena tolerancia y alto rendimiento favorecen su uso en el seguimiento de procesos intestinales subagudos o crónicos, y es, además, la técnica de uso prioritario en la edad pediátrica, jóvenes y embarazadas.
Autoría- 1.
Responsable de la integridad del estudio: MJMP.
- 2.
Concepción del estudio: MJMP, EBG y JAMB.
- 3.
Diseño del estudio: MJMP y EBG.
- 4.
Obtención de los datos: MJMP, EBG y JAMB.
- 5.
Análisis e interpretación de los datos: MJMP y EBG.
- 6.
Análisis estadístico: No precisa.
- 7.
Búsqueda bibliográfica: MJMP y JAMB.
- 8.
Redacción del trabajo: MJMP, EBG y JAMB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MJMP y JAMB.
- 10.
Aprobación de la versión final: MJMP.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.