El osteosarcoma y el sarcoma de Ewing son los tumores óseos más frecuentes en niños. El objetivo de este estudio es describir las características clínicas y radiológicas en el momento de la presentación de una amplia cohorte de niños con estas enfermedades, los hallazgos radiológicos útiles para diferenciarlas y los principales factores pronósticos.
Materiales y métodosAnálisis retrospectivo de los hallazgos clínicos y de imagen de 83 niños diagnosticados y tratados de sarcoma de Ewing y osteosarcoma en un hospital pediátrico durante un periodo de 10años.
ResultadosAmbos tumores presentaban características radiológicas agresivas como márgenes permeables o apolillados, disrupción cortical, reacción perióstica discontinua, intensa captación de contraste, necrosis tumoral y componente de partes blandas. Se diferenciaban en su localización, en su matriz ósea y en su predilección por sexo. El osteosarcoma se presentó con mayor frecuencia en la metáfisis de los huesos largos (62%) con una apariencia blástica (53%). El sarcoma de Ewing mostró predilección por los pacientes varones (71%) y se presentó en los huesos planos (42%) y en la diáfisis de los huesos largos (58%) con una apariencia lítica (82%). El 29% de los niños presentaban metástasis en el momento del diagnóstico, localizadas con mayor frecuencia en los pulmones. Las tasas de supervivencia fueron del 78% en el osteosarcoma y del 76% en el sarcoma de Ewing. La enfermedad metastásica, las características radiológicas agresivas y un bajo porcentaje de necrosis tumoral tras la quimioterapia neoadyuvante se asociaron a un mal pronóstico (p<0,05).
ConclusionesLas técnicas de imagen permiten diagnosticar con seguridad los tumores óseos pediátricos malignos en niños y pueden diferenciar el sarcoma de Ewing del osteosarcoma en función del sexo, de la localización y de la apariencia de la neoplasia. La enfermedad metastásica, la presencia de características radiológicas agresivas y un bajo porcentaje de necrosis tumoral tras la quimioterapia neoadyuvante se asociaron a un mal pronóstico.
Osteosarcoma and Ewing sarcoma are the most frequent malignant bone tumours in children. The aim of this study is to characterize clinical and radiological features at presentation of a large cohort of children with these diseases, radiological findings useful to differentiate them and the main prognostic factors.
Material and methodsRetrospective analysis of clinical and imaging findings of 83 children diagnosed and treated of Ewing sarcoma and osteosarcoma in a paediatric hospital during a period of 10years.
ResultsBoth tumours showed aggressive radiological features such as permeative or moth-eaten margins, cortical disruption, discontinuous periosteal reaction, intense contrast uptake, tumoral necrosis and soft-tissue component. They differed in their location, osseous matrix and gender predilection. Osteosarcoma occurred more frequently in the metaphysis of long bones (62%) with a blastic appearance (53%). Ewing sarcoma showed a predilection for male patients (71%), occurred in flat bones (42%) and in the diaphysis of long bones (58%) with a lytic appearance (82%). 29% of children presented with metastases at diagnosis, most frequently located in the lungs. Survival rates were 78% in osteosarcoma and 76% in Ewing sarcoma. Metastatic disease, aggressive radiological features and low percentage of tumoral necrosis after neoadjuvant chemotherapy were associated with poor prognosis (P<.05).
ConclusionsImaging can confidently diagnose malignant paediatric bone tumours in children and may differentiate Ewing sarcoma from osteosarcoma, based on gender, location and appearance of the neoplasm. Metastatic disease, presence of aggressive radiological features and low percentage of tumoral necrosis after neoadjuvant chemotherapy were associated with poor prognosis.
Los tumores óseos malignos representan aproximadamente el 8% de las neoplasias malignas en niños1. Los más frecuentes son el osteosarcoma (OS) y el sarcoma de Ewing (SE)2. Se trata de lesiones agresivas que tienden a metastatizar al pulmón. Por ello, el diagnóstico precoz es esencial para mejorar la tasa de supervivencia3.
El diagnóstico por imagen puede identificar características agresivas en ambos tipos de tumores, como destrucción ósea, reacción perióstica o masa de partes blandas asociada4,5. El OS y el SE pueden diferir en su localización ósea y en el patrón radiológico, lo que es importante para ayudar a distinguirlos, ya que se diferencian en su historia natural y en su enfoque terapéutico2.
La prueba de imagen inicial para la evaluación de dichos tumores son las radiografías convencionales. La tomografía computarizada (TC) se utiliza en áreas anatómicas específicas y para excluir metástasis pulmonares. La resonancia magnética (RM) se utiliza para determinar la extensión local de la enfermedad5.
Los principales objetivos de este artículo eran describir las características radiológicas del SE y del OS en una gran cohorte de niños y determinar las diferencias entre ellas respecto a las pruebas de imagen. En segundo lugar, analizamos la correlación entre la presencia de características radiológicas agresivas, metástasis en el momento del diagnóstico y respuesta histológica al tratamiento neoadyuvante, y la supervivencia global y la supervivencia libre de eventos.
Materiales y métodosPoblación del estudio y resultados de interésSe revisaron retrospectivamente casos de niños diagnosticados con un tumor óseo primario (OS o SE) y tratados en un hospital pediátrico de tercer nivel en un periodo de 10años (de 2011 a 2020, ambos incluidos). Se analizaron las historias clínicas, los estudios de imagen archivados en el Sistema de Comunicación y Archivo de Imágenes (Picture Archiving and Communication System [PACS]) y los informes radiológicos, y se recogieron los siguientes datos:
- •
Datos epidemiológicos: sexo y edad.
- •
Datos clínicos: tipo de tratamiento (cirugía, quimioterapia, radioterapia y/o trasplante de células madre hematopoyéticas) y tasas de supervivencia.
- •
Diagnóstico histológico tras biopsia o cirugía, y porcentaje de necrosis tumoral tras el tratamiento neoadyuvante. Se fijó un valor de corte del 90% para dividir a los pacientes entre los que respondieron bien o mal al tratamiento.
- •
Características radiológicas en el momento del diagnóstico:
- -
Se revisaron radiografías convencionales y TC analizando lo siguiente:
- ∘
Localización del tumor en el esqueleto (axial o apendicular, hueso largo o plano) y localización longitudinal en los huesos largos (metáfisis, diáfisis o epífisis).
- ∘
Patrón radiológico: lítico, blástico o mixto. En caso de matriz blástica, se determinó el tipo de mineralización (osteoide o condral).
- ∘
Márgenes: geográficos (bien definidos con o sin bordes escleróticos), mal definidos (amplia zona de transición), apolillados o permeativos (pequeñas zonas parcheadas y mal definidas de lisis ósea con márgenes mal definidos).
- ∘
Afectación cortical: no agresiva (hiperostosis, festoneado endostal o cortical abombada) o agresiva (disrupción cortical).
- ∘
Reacción perióstica: ausente, no agresiva (sólida o unilaminar) o agresiva (reacción multilaminar en piel de cebolla o apariencia multilaminar discontinua, incluidos patrones espiculados, de cepillo, de sol naciente y triángulo de Codman).
- ∘
- -
Se revisaron RM previas al tratamiento analizando lo siguiente:
- ∘
Presencia de componente/masa de partes blandas.
- ∘
Patrón de realce: difuso, heterogéneo o periférico.
- ∘
Afectación epifisaria en OS.
- ∘
Presencia de metástasis discontinua o a saltos (skip metastases) y/o metástasis a distancia.
- ∘
- -
Los datos recogidos se analizaron con el programa IBM SPSS Statistics v27.0.1.0.
Los resultados epidemiológicos, clínicos, histológicos y radiológicos se compararon por diagnóstico (OS frente a SE) mediante estadística descriptiva. Los resultados cualitativos (sexo, características radiológicas, necrosis tumoral y tratamiento) se expresan como porcentajes. Los resultados cuantitativos (edad, tiempo de supervivencia) se expresan como media y desviación estándar.
El resultado reacción cortical se dividió en dos grupos: no agresiva (hiperostosis, festoneado endostal y abombamiento cortical) y agresiva (disrupción cortical). El resultado reacción perióstica se dividió en dos grupos: no agresiva (sin reacción perióstica, sólida y unilaminar) y agresiva (reacción multilaminar en piel de cebolla o apariencia multilaminar discontinua incluidos patrones espiculados, de cepillo, de sol naciente y triángulo de Codman).
Se utilizó la prueba ji al cuadrado para evaluar las diferencias entre las variables cualitativas y la prueba t de Student para las variables cuantitativas. Debido al pequeño tamaño de la muestra, para algunas de las variables dicotómicas (cirugía, radioterapia, trasplante de células madre hematopoyéticas [TCMH] y metástasis a saltos o discontinua) se rechazó la prueba ji al cuadrado en favor de la prueba exacta de Fisher. El mismo problema se planteó para el resultado afectación cortical (subdividido inicialmente en «ausente/festoneado endostal/insuflación/hiperostosis/destrucción») y para reacción perióstica (subdividido inicialmente en «ausente/unilaminar/continua/discontinua»). Se resolvió agrupando los datos en dos subgrupos en función de su agresividad (agresiva y no agresiva).
Para evaluar la variable cuantitativa tiempo de supervivencia se utilizó la prueba t de Student. En el caso del resultado edad, se comprobó la no normalidad de su distribución en los dos grupos de pacientes mediante Shapiro-Wilk, por lo que se sustituyó la prueba t de Student por la prueba no paramétrica U de Mann-Whitney.
Para poder comparar la supervivencia entre los pacientes diagnosticados con OS y SE, se llevó a cabo un análisis de supervivencia de Kaplan-Meier. Se comparó la supervivencia entre OS y SE mediante pruebas Log-Rank y Breslow (tabla 1). Además, se obtuvieron curvas de Kaplan-Meier para ambos grupos (fig. 1).
Por último, se realizó un análisis de regresión de Cox bivariante para evaluar la relación entre cada variable y el resultado tiempo de supervivencia. La asociación entre el tiempo de supervivencia y cada una de las variables se expresa mediante un cociente de riesgo y el coeficiente de regresión de Cox. Se creó el resultado agresividad, que incluye a aquellos pacientes con característica agresiva en al menos uno de los resultados radiológicos (márgenes, reacción cortical o reacción perióstica). Las variables con p<0,25 en el análisis bivariante se incluyeron en un análisis multivariante (tabla 2). La asociación entre el tiempo de supervivencia y cada una de las variables se expresa mediante un cociente de riesgo y el coeficiente de regresión de Cox. En ambos casos se utilizó la prueba de Wald.
Análisis bivariante y multivariante para estimar el valor pronóstico y la supervivencia de diversas características clínicas y de imagen de 83 niños con osteosarcoma y sarcoma de Ewing
| Variable | Hazard ratio | Coeficiente de regresión de Cox | p | |
|---|---|---|---|---|
| Análisis bivariante | ||||
| Supervivencia (días) | Diagnóstico (OS/SE) | 0,89 | −0,11 | 0,81 |
| Sexo (M/F) | 1,55 | 0,44 | 0,34 | |
| Metástasis | 4,88 | 1,59 | <0,001 | |
| Necrosis tumoral tras el tratamiento (%) | 0,98 | −0,02 | 0,06 | |
| Márgenes agresivos | 0,56 | −0,57 | 0,31 | |
| Afectación cortical agresiva | 0,61 | −0,50 | 0,28 | |
| Reacción perióstica agresiva | 0,75 | −0,28 | 0,59 | |
| Características de imagen agresivas | 0,30 | −1,21 | 0,11 | |
| Análisis multivariante | ||||
| Supervivencia (días) | Enfermedad metastásica | 4,77 | 1,56 | 0,002 |
| Necrosis tumoral tras el tratamiento (%) | 0,98 | −0,02 | 0,04 | |
| Características radiológicas agresivas | 0,22 | −1,50 | 0,06 | |
Los valores p<0,05 se consideraron significativos en todos los casos.
ResultadosOchenta y tres pacientes pediátricos (47 niños y 36 niñas) fueron diagnosticados de un tumor óseo primario en nuestro hospital en un periodo de 10años (2011-2020). Cuarenta y cinco de ellos tenían OS y 38, SE. En la tabla 3 se recogen los datos epidemiológicos, clínicos y radiológicos de la cohorte de estudio.
Características clínicas, patológicas y radiológicas de 83 niños con sarcoma de Ewing u osteosarcoma
| Osteosarcoma(n=45) | Sarcoma de Ewing(n=38) | p | |
|---|---|---|---|
| Datos epidemiológicos | |||
| Edad (media ±desviación estándar) | 11,8±3,1 | 11,0±3,6 | 0,46 |
| Sexo (masculino), % (n) | 44,4% (20) | 71,1% (27) | 0,015 |
| Características radiológicasa | |||
| Patrón radiológico, n (%) | <0,001 | ||
| No visible | 1 (2,2%) | 5 (13,2%) | |
| Lítico | 20 (44,4%) | 31 (81,6%) | |
| Blástico | 12 (26,7%) | 0 | |
| Mixto | 12 (26,7%) | 2 (5,3%) | |
| Márgenes, n (%) | 0,053 | ||
| Geográficos | 4 (8,9%) | 1 (3%) | |
| Mal definidos | 19 (43,2%) | 8 (24,2%) | |
| Apolillados/permeativos | 21 (47,7%) | 24 (72,7%) | |
| Reacción cortical, n (%) | 0,146 | ||
| No agresiva | 20 (44,4%) | 11 (29%) | |
| Agresiva | 25 (55,6%) | 27 (71%) | |
| Reacción perióstica, n (%) | 0,685 | ||
| No agresiva | 9 (20%) | 9 (23,7%) | |
| Agresiva | 36 (80%) | 29 (76,3%) | |
| Componente de partes blandas, n (%) | 38 (84,4%) | 33 (86,8%) | 0,757 |
| Necrosis tumoral, n (%) | 27 (62,8%) | 15 (41,7%) | 0,06 |
| Realce con gadolinio, n (%) | 0,09 | ||
| Heterogéneo | 29 (67,4%) | 23 (63,9%) | |
| Difuso | 3 (7%) | 8 (22,2%) | |
| Periférico | 11 (25,6%) | 5 (13,9%) | |
| Variables clínicas | |||
| Enfermedad metastásica, n (%) | 12 (27%) | 12 (32%) | 0,6 |
| Pulmonar | 11 (91,7%) | 10 (83,3%) | |
| Metástasis a saltos | 1 (8,3%) | 3 (25%) | |
| Tratamiento | |||
| Cirugía, n (%) | 45 (100%) | 32 (84,2%) | 0,017 |
| Quimioterapia, n (%) | 45 (100%) | 38 (100%) | |
| Radioterapia, n (%) | 0 (0%) | 21 (55%) | <0,001 |
| TCMH, n (%) | 0 (0%) | 7 (18,4%) | 0,021 |
| Supervivencia, n (%) | 35 (77,8%) | 29 (76,3%) | 0,87 |
| Tiempo de supervivencia (días) (media ±desviación estándar) | 598,78±37,8 | 575,66±45,07 | 0,732 |
TCMH: trasplante de células madre hematopoyéticas.
Todos los OS se localizaban en huesos largos. Los huesos afectados con más frecuencia fueron el fémur distal (56%) (fig. 2), la tibia proximal (20%), el húmero proximal (13%) y el radio distal (2%). El SE afectó a los huesos largos (55%) (fémur proximal 24%, tibia 16%, peroné 13% y radio 3%) y al esqueleto axial (ilion 18% [fig. 3], sacro 11%, costillas 5%, isquion 3% y pubis 3%). Otras localizaciones poco frecuentes fueron la rama mandibular derecha y el calcáneo izquierdo.
A)Radiografía frontal y reconstrucción de TC en el plano coronal de una niña de 11años con un osteosarcoma (OS) localizado en la cara lateral de la metáfisis del fémur distal derecho. Se presentaba como una lesión lítica excéntrica con márgenes bien definidos (flecha blanca), disrupción cortical, reacción perióstica agresiva (triángulo de Codman) (flecha negra) y componente de masa de partes blandas. B)Radiografía frontal y reconstrucción de TC en el plano coronal de un niño de 14años con un OS localizado en la metáfisis del fémur distal izquierdo. La lesión mostraba un patrón blástico con mineralización del osteoide y reacción perióstica de cepillo (flechas negras).
Niño de 12años con sarcoma de Ewing del hueso ilíaco izquierdo. La radiografía frontal de la pelvis (A) mostraba una extensa lesión permeativa en el ilion izquierdo (asterisco negro). La reconstrucción de TC coronal (B) delineaba mejor el tumor, su extensión al sacro (flecha blanca) y la masa de partes blandas asociada (puntas de flecha blancas), que también se muestra en la RM axial T2 (C). La radiografía de tórax posteroanterior frontal (D) demostró la presencia de metástasis pulmonares bilaterales (puntas de flecha negras).
Los tumores de huesos largos pueden clasificarse, según la localización longitudinal dentro del hueso, en epifisarios, metafisarios o diafisarios. En nuestro grupo de niños, la mayoría de los OS se localizaron en la metáfisis (62%) (fig. 2), mientras que la mayoría de los SE se originaron en la diáfisis (52,4%). Es poco frecuente que estos tumores muestren un origen epifisario. No obstante, en nuestro grupo hallamos 2 casos (9,5%) de SE epifisarios (fig. 4). En el caso del OS, puede afectar a la epífisis cuando se extiende directamente desde la región metafisaria, a través de la fisis, como ocurrió en 5 niños de nuestro grupo (fig. 5).
Radiografía frontal (A) y reconstrucción de TC en el plano coronal (B) de un niño de 10años con un sarcoma de Ewing localizado en la región epifisaria medial del fémur distal izquierdo, que se presenta como una lesión lítica permeativa (flechas blancas). No se asociaba reacción perióstica ni masa de partes blandas.
Niño de 13años con un osteosarcoma originado en la metáfisis distal del fémur izquierdo. Las radiografías frontal y lateral (A y B, respectivamente) mostraban una lesión metafisaria agresiva con patrón blástico osteoide y reacción perióstica agresiva en forma de cepillo (flecha negra) y triángulo de Codman (flechas blancas). La RM sagital T1 (C) y la RM coronal T1 con supresión grasa tras la administración de gadolinio (D) mostraron un gran componente de partes blandas (puntas de flecha blancas) y la extensión tumoral a través de la fisis hasta la epífisis (punta de flecha negra).
Las lesiones óseas se evaluaron inicialmente con radiografías convencionales. Posteriormente, se realizó una RM para evaluar la extensión tumoral. En algunos casos se requirió TC o ecografía para evaluar características específicas de las lesiones (tabla 3).
Metástasis, tratamiento y supervivenciaLa presencia de metástasis en el momento del diagnóstico se observó en 24 niños (tabla 3).
El tratamiento consistió en una combinación de terapia sistémica (quimioterapia) y local (cirugía y/o radioterapia) (tabla 3). El porcentaje medio de necrosis tumoral tras el tratamiento fue del 82% (DE: 20%) en el OS y del 87% (DE: 20%) en el SE. Seis niños con SE no pudieron ser intervenidos quirúrgicamente debido a la localización del tumor en el esqueleto axial y/o a la presencia de metástasis a distancia.
Diecinueve niños fallecieron: 10 con OS y 9 con SE. El tiempo medio de supervivencia en el momento de este estudio era de 20meses. No se encontraron diferencias estadísticas en las tasas de supervivencia entre OS y SE (tabla 2). En el gráfico de supervivencia se observa que en ambos tumores la tasa de mortalidad aumentó durante el primer año hasta estabilizarse en torno a una supervivencia del 76% a los 150días para el SE y del 78% a los 270 días para el OS (fig. 1).
La enfermedad metastásica, un bajo porcentaje de necrosis tumoral y determinadas características radiológicas agresivas se asociaron a un peor pronóstico (tabla 3).
Se halló asociación estadística entre la presencia de metástasis en el momento del diagnóstico y una menor supervivencia global (p=0,002). Fue casi 5 veces más frecuente el evento «muerte» por unidad de tiempo en pacientes con metástasis en el diagnóstico. Un alto porcentaje de necrosis tumoral tras el tratamiento neoadyuvante también se asoció a una mayor tasa de supervivencia (p=0,037). La asociación entre características radiológicas agresivas y menores tasas de supervivencia se aproximó a la significación estadística (p=0,057).
DiscusiónLos tumores óseos primarios malignos representan el 8% de todas las neoplasias malignas pediátricas1. Los dos sarcomas óseos más frecuentes en la población pediátrica son el OS (55%) y el SE (35%)6. El OS tiene una distribución por edades de tipo bimodal que alcanza su máximo en la adolescencia temprana (15-29años) y por encima de los 65años7. El SE se observa con mayor frecuencia en pacientes de 4 a 25años de edad7. En la literatura, ambos tumores muestran un predominio masculino, con una relación hombre-mujer de 1,2 en el OS y de 1,1 en el SE6. En nuestra cohorte de pacientes con OS hubo un predominio femenino que podría explicarse por el grupo de muestra relativamente pequeño y por los criterios de inclusión (niños hasta 14años).
LocalizaciónLos tumores óseos primarios suelen aparecer en una localización característica del esqueleto8,9. El OS tiene predilección por los puntos de crecimiento óseo rápido, como las regiones metafisarias10, mientras que el SE tiende a seguir la distribución de la médula roja, predominantemente en la región diafisaria de los huesos largos y del esqueleto axial2. Aunque el OS afecta con mayor frecuencia a los huesos largos, también puede afectar a los huesos planos (20% de los casos), como la pelvis, los huesos faciales o la columna vertebral4,11. Nuestra cohorte de pacientes confirmó estos hallazgos. Sin embargo, en nuestra cohorte todos los OS se localizaban en huesos largos, probablemente debido al tamaño relativamente pequeño de la muestra.
Hallazgos en imagenLas pruebas de imagen tienen un papel fundamental para establecer el diagnóstico inicial de los tumores óseos y, posteriormente, orientar el tratamiento5. Las radiografías convencionales son la modalidad de imagen inicial para su evaluación12, pues permiten la clasificación de la lesión como agresiva o no agresiva mediante el análisis de algunas características de imagen, como los márgenes, la expansión cortical o la reacción perióstica5,8.
Los márgenes tumorales y la zona de transición entre la lesión y el hueso adyacente son factores clave para determinar la agresividad de la lesión, ya que son indicadores de su tasa de crecimiento5,8. Unos márgenes afilados bien definidos, con o sin borde esclerótico, indican una tasa de crecimiento lenta y, por tanto, aparecen en lesiones no agresivas. Por el contrario, los márgenes mal definidos, apolillados o permeativos aparecen en los tumores agresivos de crecimiento rápido5. En nuestro grupo de pacientes, el patrón lítico permeativo fue el más frecuente en los niños con SE, probablemente debido a su origen y diseminación a través de la médula ósea roja (fig. 6). Por el contrario, el patrón blástico fue más frecuente en el OS debido a su origen mesenquimal con diferenciación osteoblástica que conduce a neoformación ósea.
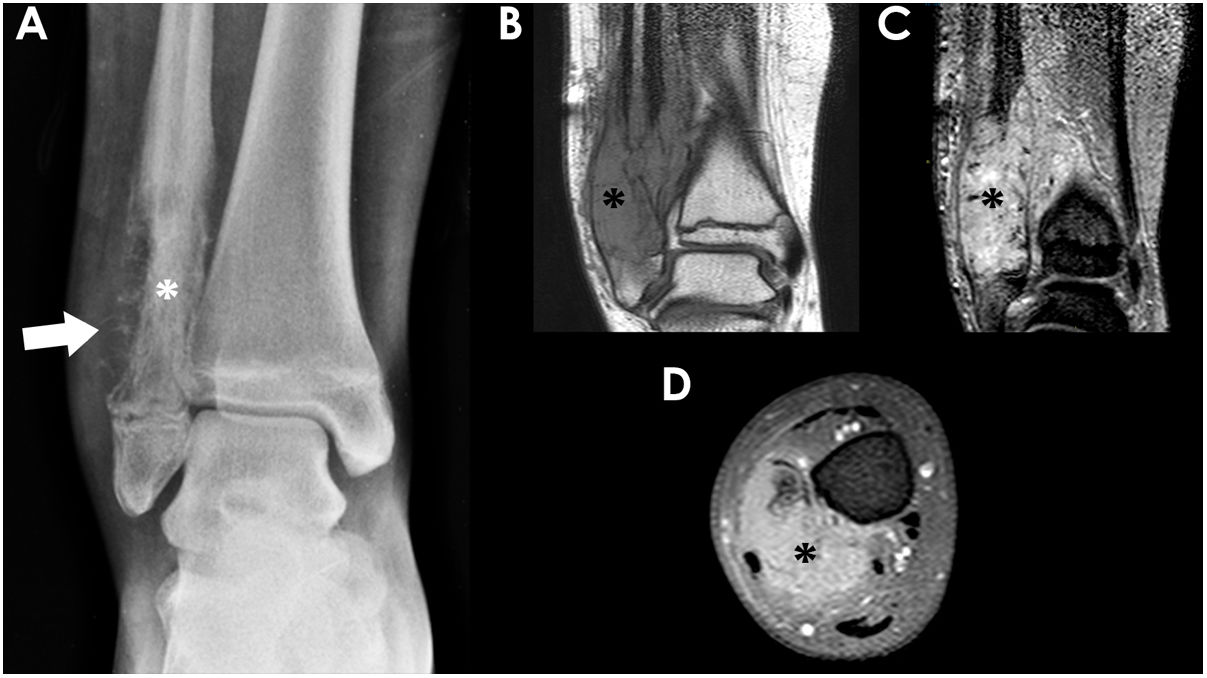
Niño de 14años con un sarcoma de Ewing localizado en la metáfisis distal del peroné derecho. La radiografía frontal del tobillo (A) mostraba una lesión lítica con disrupción cortical extensa (asterisco blanco) y reacción perióstica agresiva (flecha blanca). Las RM coronal T1 (B), coronal T2 con supresión de grasa (C) y axial T1 con supresión de grasa poscontraste (D) mostraron la presencia de un componente de partes blandas asociado con captación ávida de contraste (asteriscos negros).
La afectación cortical también refleja la tasa de crecimiento de una lesión. Cuando una lesión medular de crecimiento lento se extiende, provoca la erosión de la superficie interna de la cortical, lo que conduce a insuflación o festoneado endostal. En las lesiones agresivas, la rápida tasa de crecimiento no permite la regeneración ósea y puede conducir a su disrupción8.
Por último, la reacción perióstica es una característica menos específica de la naturaleza de una lesión ósea5. Las reacciones periósticas sólidas o unilaminares suponen apariencias no agresivas que indican una lesión de crecimiento lento, lo que da al hueso la oportunidad de «tapiar» la lesión. Los patrones multilaminares o de piel de cebolla son apariencias intermedias. Las lesiones agresivas suelen mostrar una reacción perióstica discontinua, como los patrones espiculados, de cepillo, de sol naciente o de triángulo de Codman8. En nuestro grupo, la mayoría de las lesiones mostraron una reacción perióstica agresiva, sin diferencias entre OS y SE.
La RM de los tumores óseos primarios es obligatoria en su evaluación para determinar el estadio y como planificación quirúrgica6,10, aunque algunos tumores requieren el uso de TC en lugar de RM debido a su localización en huesos complejos, vértebras o huesos craneofaciales10.
El protocolo de RM debe incluir una imagen potenciada en T1 (T1WI), una imagen potenciada en T2 (T2WI) con recuperación de inversión de tau corta (Short Tau Inversion Recovery [STIR]) y supresión de grasa, una imagen potenciada en difusión (DWI) y una T1WI con supresión de grasa poscontraste6. La RM proporciona información sobre la matriz tumoral, su extensión local y la respuesta al tratamiento10.
La evaluación de la extensión tumoral local es de especial importancia para guiar los procedimientos quirúrgicos; en concreto, la identificación de la diseminación epifisaria a través de la fisis13. La T1WI ofrece la mejor definición anatómica de la invasión de la médula ósea para determinar el tamaño de la lesión14. Por el contrario, las secuencias T2WI o STIR y supresión de la grasa pueden mostrar un tamaño de lesión falsamente aumentado, ya que potencian la señal producida por el edema peritumoral14.
La RM también permite evaluar la presencia y la extensión de la masa de partes blandas asociada, que es un indicador de agresividad biológica (fig. 7). Es más frecuente y voluminosa en los tumores SE, pero los OS pueden mostrar ocasionalmente un gran componente de partes blandas que dificulta su diferenciación. Esta masa de partes blandas suele expandirse y provocar disrupción en la cortical ósea, pero en ciertos casos de SE puede extenderse a través de los canales de Havers y no alterar la cortical15.
Niña de 10años con un osteosarcoma convencional del fémur distal derecho que presentó una fractura patológica. La radiografía lateral del fémur (A) mostraba una fractura diafisaria espiroidea (puntas de flecha negras). La radiografía frontal realizada 3meses después (B) mostraba una mala consolidación de la fractura y la presencia de una lesión permeativa subyacente con reacción perióstica agresiva (flecha blanca). La RM coronal T1 poscontraste con supresión de grasa (C) delineaba el tumor, con intensidad heterogénea y un voluminoso componente de partes blandas (asterisco blanco).
El campo de visión de eje largo debe cubrir la totalidad del hueso afectado y de las articulaciones adyacentes para poder evaluar adecuadamente las metástasis a saltos6, que son pequeñas lesiones sincrónicas localizadas en el mismo hueso pero separadas del tumor primario por una médula normal intermedia10,16.
La RM también es útil en la evaluación de la respuesta tumoral al tratamiento neoadyuvante6,10, ya que es el principal factor pronóstico en OS y SE (una necrosis tumoral superior al 90% se correlaciona con un mejor pronóstico)6. Pueden producirse cambios morfológicos tras la neoadyuvancia —principalmente, reducción del volumen tumoral—, pero dichos cambios no siempre se correlacionan con el porcentaje de necrosis6. La RM funcional con mapas de DWI y de coeficiente de difusión aparente (ADC), así como las secuencias dinámicas con contraste, son herramientas de imagen para la evaluación no invasiva de la respuesta del tumor primario6.
Tanto el SE como el OS presentan hallazgos agresivos que reflejan su grado de malignidad y muestran algunas características de imagen superpuestas que dificultan la discriminación entre ambos tumores7. No hemos encontrado diferencias estadísticamente significativas en las características de imagen entre OS y SE (p>0,05), aparte de la localización. Estudios recientes han analizado las secuencias DWI de ambos tumores y han encontrado diferencias significativas en el ADC del SE (0,6-0,8×10−3mm2/s) y del OS (1,2-1,5×10−3mm2/s)7, lo que puede convertirlo en una herramienta útil en casos difíciles con características de imagen superpuestas. No pudimos evaluar los valores de ADC tumorales en nuestro grupo de pacientes, ya que la DWI no se incluyó de forma rutinaria en nuestro protocolo de RM al inicio del estudio.
Enfermedad metastásicaCerca del 10 al 20% de los pacientes con un tumor óseo maligno padecen enfermedad metastásica17, siendo la localización más frecuente los pulmones (85%), seguida de la médula ósea (8-10%) y, ocasionalmente, los ganglios linfáticos10. La enfermedad metastásica es un claro indicador de mal pronóstico16, como se constató en nuestro grupo, en el que las tasas de supervivencia fueron 5 veces más bajas en los pacientes con metástasis.
Para detectar la diseminación metastásica puede realizarse una prueba de cuerpo entero mediante tomografía por emisión de positrones con fluorina-18-fluorodesoxiglucosa (PET-FDG)6. La RM de cuerpo entero es una técnica prometedora para la evaluación de metástasis extrapulmonares en todo el cuerpo, pero no se ha investigado ni validado en OS o SE en la misma medida que la PET-FDG6.
Dado que la localización más frecuente de las metástasis son los pulmones, es obligatorio realizar una TC torácica en una fase temprana para evaluar la presencia de metástasis pulmonares6,10, así como para evaluar su número y su distribución, ya que son factores pronósticos importantes11. En general, cualquier lesión pulmonar mayor de 10mm o múltiples lesiones (3 o más) mayores de 5mm se consideran evidencia de metástasis11. La incorporación de imágenes de proyección de máxima intensidad (MIP) mejora la sensibilidad, la especificidad y la precisión de la TC para la detección de metástasis pulmonares6. Desgraciadamente, el número de nódulos pulmonares determinados por la TC no se correlaciona con el número detectado en cirugía, y rara vez las características de estos nódulos en la TC son definitivas para la enfermedad metastásica13. Por lo tanto, con frecuencia se requiere un diagnóstico histológico, pues la presencia de metástasis pulmonares eleva la estadificación de la enfermedad; en estos casos, la TC se destina a guiar la biopsia quirúrgica13.
Las metástasis a saltos representan micrometástasis embólicas en los sinusoides de la médula del mismo hueso que son discontinuas desde el tumor primario. Se consideran una enfermedad tumoral local, y pueden producirse a través de la articulación adyacente al tumor primario (metástasis a saltos transarticular)13. Aunque son raras (más frecuentes en el OS que en el SE), las metástasis a saltos suelen presentarse en sarcomas de alto grado e implican un pronóstico significativamente peor para el paciente. Además, necesitan una modificación del procedimiento quirúrgico, ya que en estos casos puede que no se puedan realizar intervenciones conservadoras con la extremidad2,13.
TratamientoEl tratamiento estándar actual para el OS consiste en quimioterapia neoadyuvante, resección quirúrgica y quimioterapia adyuvante2,9. La supervivencia a 5años del OS se ha situado entre el 70% y el 80% en los últimos 40años. Se espera que los nuevos fármacos quimioterapéuticos a medida del paciente, del tumor y del perfil genético mejoren la supervivencia en el futuro9. La cirugía es esencial para lograr el control local de la enfermedad9. En la actualidad se prefiere la cirugía conservadora de la extremidad siempre que sea posible; la amputación solo se utiliza en casos concretos11. Incluso en ausencia de metástasis detectables, se asume que la mayoría de los OS son micrometastásicos en el momento del diagnóstico, lo que requiere una terapia sistémica9. El uso de quimioterapia neoadyuvante se ha convertido en el protocolo estándar de tratamiento para obtener resultados óptimos, ya que reduce el tamaño tumoral y las micrometástasis potenciales, permite realizar cirugías de salvamento de extremidades y reduce las tasas de recurrencia10,18. La radioterapia local es un tratamiento de segunda elección debido a la resistencia del OS a la radiación ionizante10. Puede barajarse como tratamiento paliativo en la enfermedad avanzada o en los tumores axiales9,19. La irradiación externa junto con la terapia sistémica puede ser un enfoque apropiado para el control local y el alivio de los síntomas10. El manejo del SE suele incluir una combinación de tratamiento sistémico (quimioterapia) y local (radioterapia y/o cirugía)2. La quimioterapia es imprescindible debido a la naturaleza diseminada de este tumor17. La terapia local depende en gran medida del individuo; el abordaje óptimo se deduce de multitud de factores (edad del paciente, localización del tumor, tamaño y extensión local)16,17,20. La resección quirúrgica de la lesión es preferible cuando es posible obtener márgenes quirúrgicos negativos con una morbilidad aceptable. La radiación puede proporcionar un control local igualmente duradero, pero conlleva un riesgo asociado a largo plazo de neoplasias malignas secundarias. Sin embargo, si la cirugía causara una morbilidad excesiva, la radioterapia puede proporcionar resultados de tratamiento similares20.
PronósticoEn nuestro estudio, la tasa de supervivencia global fue del 78% en el OS y del 76% en el SE, con un tiempo de supervivencia medio de 20meses, resultados que concuerdan con la literatura. Se han descrito varios factores pronósticos, como el tamaño del tumor, la respuesta a la quimioterapia favorable y la metástasis en el momento del diagnóstico17,21,22.
Los recientes avances terapéuticos han mejorado la supervivencia global de estos niños. Se ha demostrado que la necrosis inducida por la quimioterapia es un factor pronóstico importante en pacientes con tumores óseos primarios2,9,19,23. Una buena respuesta histológica a la quimioterapia neoadyuvante se define como menos del 10% de células tumorales viables en el momento de la cirugía9. Los pacientes con un mayor grado de necrosis tumoral en el examen histológico tienen una mayor tasa de supervivencia global2,9,17,19. Nuestros resultados son coherentes con los estudios previos. La necrosis tumoral inducida por el tratamiento neoadyuvante se correlacionó con la evolución de los pacientes.
La enfermedad metastásica en el momento del diagnóstico se asocia a una disminución significativa de las tasas de supervivencia21. En el presente estudio, la incidencia de metástasis fue del 27% para el OS y del 32% para el SE, y se confirmó como un factor pronóstico independiente de una menor supervivencia (p=0,002).
LimitacionesAlgunas limitaciones del presente estudio son su carácter retrospectivo y el haber sido realizado en un solo centro. Además, los niños incluidos en el estudio procedían de diferentes puntos geográficos del país, algunos de ellos de otros distritos sanitarios, lo que dificultó la obtención de algunos datos clínicos y la información de seguimiento. Los estudios de imagen se adquirieron durante un periodo de diez años, por lo que hubo algunas variaciones en la calidad de la RM y en los protocolos debido al paso del tiempo. No se obtuvieron en todos los estudios imágenes potenciadas en difusión o técnicas de perfusión por RM. Por lo tanto, no pudimos evaluarlas en este estudio. Tampoco hemos evaluado el uso de PET-TC en estas patologías con el objetivo de limitar la extensión del artículo.
ConclusiónEste estudio ha demostrado que el diagnóstico por imagen desempeña un papel crucial en el diagnóstico inicial del osteosarcoma y el sarcoma de Ewing en niños. El osteosarcoma afecta a la metáfisis de los huesos largos con una apariencia blástica, mientras que el sarcoma de Ewing afecta a los huesos planos y a la diáfisis de los huesos largos con un patrón lítico. La supervivencia global fue de casi el 80%, similar en ambos tumores. La presencia de características radiológicas agresivas, metástasis en el momento del diagnóstico y ausencia de necrosis inducida por la quimioterapia se correlacionaron con un peor pronóstico.
FinanciaciónNo se obtuvo financiación pública ni comercial para la elaboración de este estudio.
Autoría- 1.
Responsable de la integridad del estudio: CMR
- 2.
Concepción del estudio: CMR, MBG, JIGC, PCD
- 3.
Diseño del estudio: CMR, PCD
- 4.
Obtención de los datos: CMR, MBG, JIGC, PCD
- 5.
Análisis e interpretación de los datos: CMR, MBG, JIGC, PCD
- 6.
Tratamiento estadístico: MBG
- 7.
Búsqueda bibliográfica: CMR
- 8.
Redacción del trabajo: CMR, MBG
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: PCD, JIGC
- 10.
Aprobación de la versión final: CMR, MBG, PCD
Los autores declaran no tener ningún conflicto de intereses.