El diagnóstico urgente de una tromboembolia pulmonar (TEP) aguda se beneficia del uso de pautas de decisión clínica basadas en la evidencia que mejoran el pronóstico de los pacientes y reducen el empleo innecesario de pruebas de imagen. En este artículo se explican los algoritmos para el diagnóstico de la TEP publicados más recientemente por las sociedades científicas implicadas, en la población general y en situaciones especiales, intentando esclarecer las dudas frecuentes y analizar las controversias persistentes. También se discute la necesidad de controlar con imagen la resolución de la TEP tras el tratamiento anticoagulante, actualmente no recomendado en las guías clínicas.
The urgent diagnosis of acute pulmonary thromboembolism benefits from the use of evidence-based clinical guidelines that improve patients’ prognoses and reduce the unnecessary use of imaging tests. This article explains the diagnostic algorithms for pulmonary thromboembolism most recently published by the relevant scientific societies both for the general population and for special situations, trying to clear up common doubts and analyzing persistent controversies. It also discusses the need to follow up the thromboembolism after anticoagulation treatment, which is not currently recommended in the guidelines.
El diagnóstico de la tromboembolia pulmonar (TEP) aguda es importante por la frecuencia de este cuadro y de otros de presentación clínica similar, y por la elevada morbimortalidad asociada en ausencia de tratamiento. La capacidad diagnóstica y la disponibilidad de la angiografía por tomografía computarizada (angio-TC) pulmonar ha generado un incremento progresivo de solicitudes urgentes de esta prueba, acompañado de un menor número de estudios con diagnóstico de TEP1. Si bien la angio-TC puede mostrar diagnósticos alternativos, esto no justifica su empleo generalizado porque se ha observado que en muy pocos casos estos diagnósticos cambian la actitud terapéutica1,2. Para evitar un uso inapropiado de la técnica es necesario establecer algoritmos diagnósticos comunes, preferiblemente basados en guías de práctica clínica con buenos niveles de evidencia y grados de recomendación. A pesar de que en las guías clínicas de la TEP persisten algunas controversias y muchas de las recomendaciones se establecen por consenso de expertos (sin ensayos ni metaanálisis que las avalen), su seguimiento no solo evita TC innecesarias, sino que también reduce el porcentaje de eventos tromboembólicos debidos a fallos en el diagnóstico3. Una forma de mejorar la adherencia a las recomendaciones científicas es disponer de un algoritmo diagnóstico escrito en el servicio de urgencias3, que se ajuste a los medios disponibles y sea conocido por todo el personal médico implicado. Otro recurso es la utilización de sistemas electrónicos de soporte de decisión clínica basados en la evidencia, que han demostrado disminuir el número de estudios de TC para descartar TEP en el servicio de urgencias en un 20%, así como un mayor rendimiento diagnóstico de la prueba4.
Tras el diagnóstico de TEP, el seguimiento con pruebas de imagen no está recomendado en las guías clínicas; en este trabajo se revisa la trascendencia de identificar trombosis residual según la literatura disponible hasta la fecha.
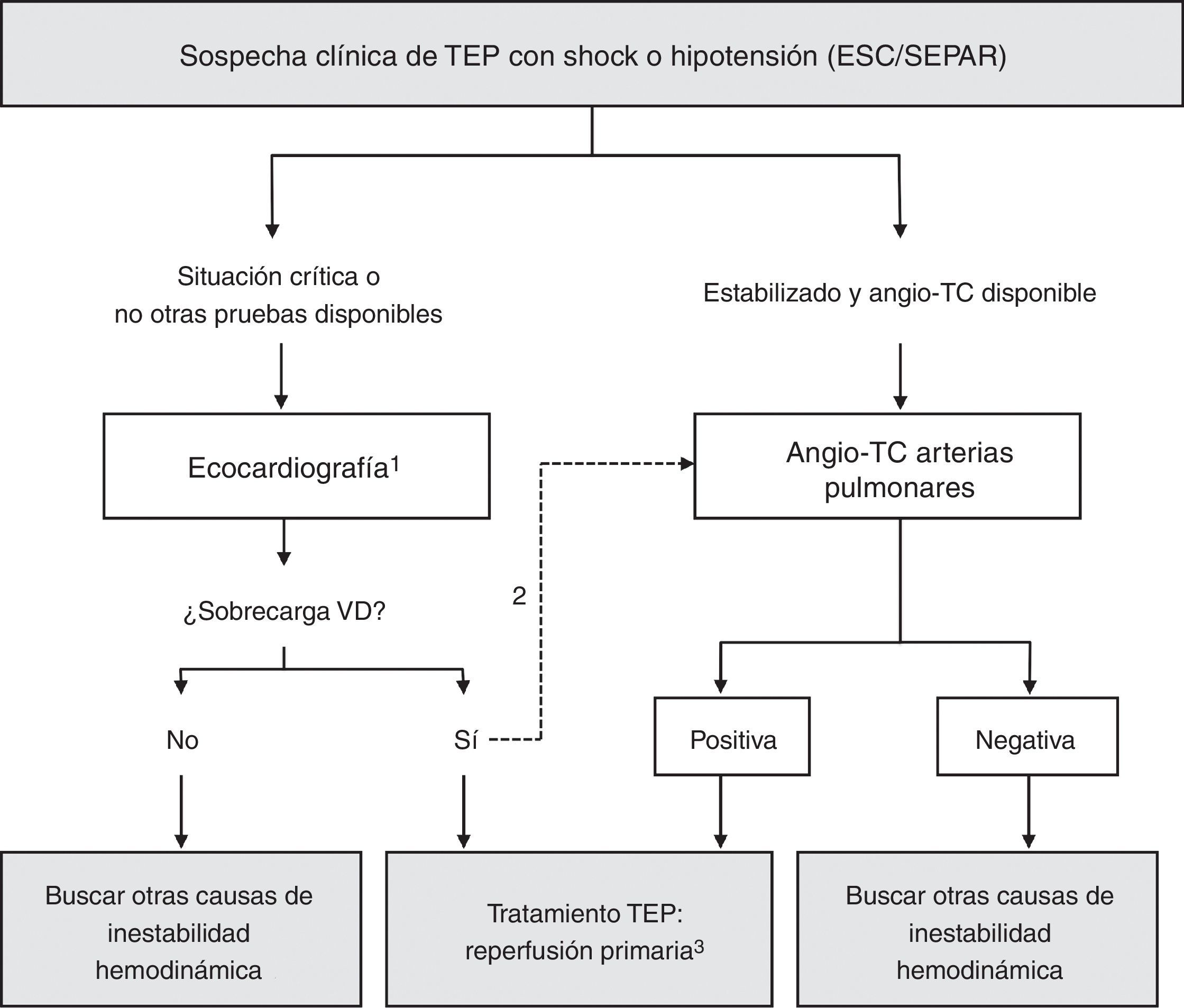
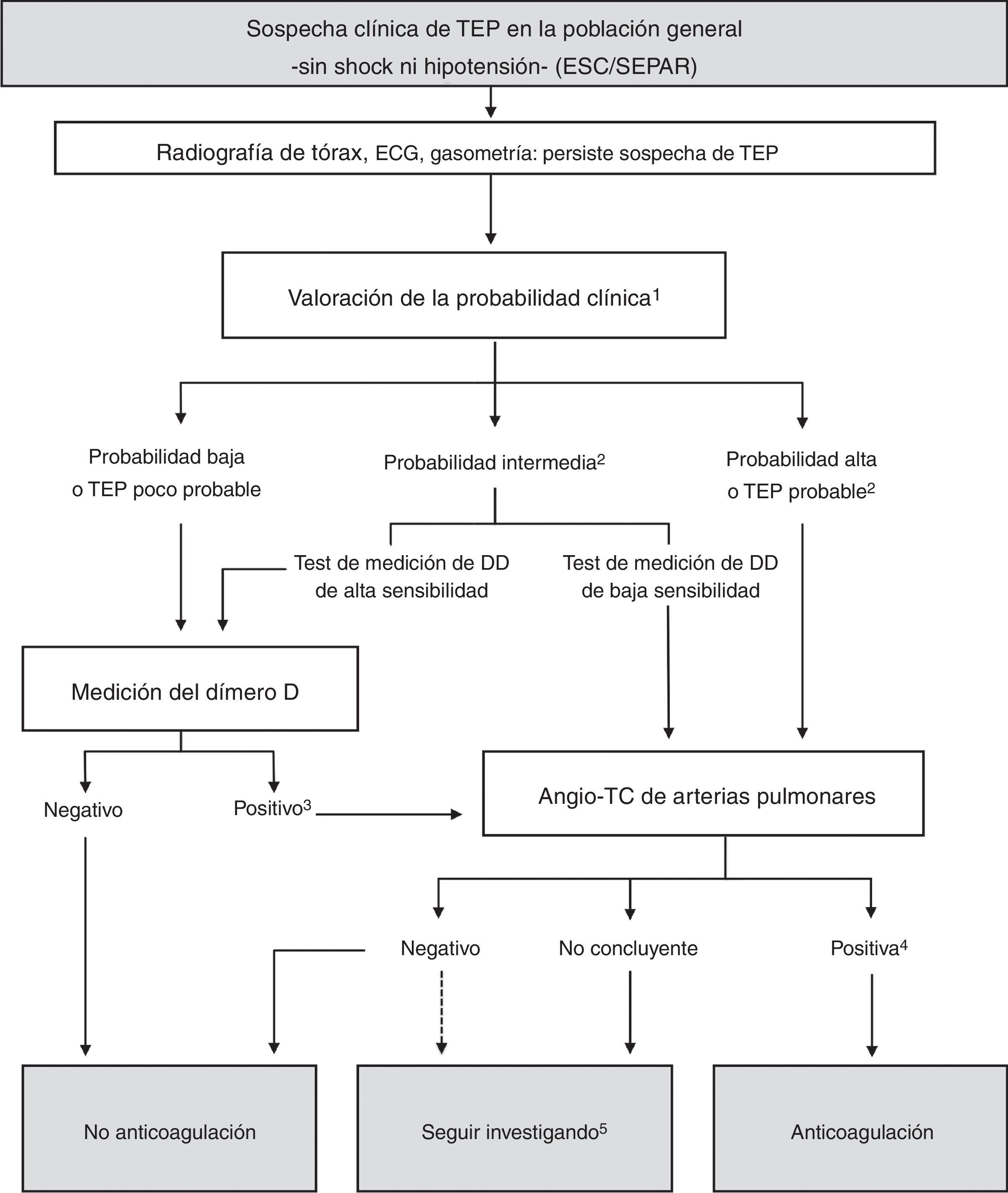
Algoritmo actualizado para el diagnóstico de la tromboembolia pulmonar agudaDiagnóstico de la tromboembolia pulmonar aguda en la población generalLa guía de práctica clínica de la European Society of Cardiology (ESC) de 2014 sobre el diagnóstico y el tratamiento de la TEP aguda5, que ha sido traducida al español6, presenta un algoritmo diagnóstico detallado y actualizado para la población general que sigue indicaciones muy similares a las propuestas por las guías del American College of Radiology (ACR) de 20127. Asimismo, el Consenso nacional sobre el diagnóstico, estratificación de riesgo y tratamiento de los pacientes con tromboembolia pulmonar, publicado en 2013 por la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)8, coincide en la misma estrategia diagnóstica. En las figuras 1 y 2 se exponen estos algoritmos comunes, en pacientes sin y con estabilidad hemodinámica, respectivamente; se han añadido detalles y comentarios explicativos, sin modificar la estrategia. En el texto y las figuras se hace referencia entre paréntesis al tipo de recomendación de la guía de la ESC: clase (I, se recomienda; IIa, se debe considerar; IIb, se puede recomendar; III, no se recomienda) y nivel de evidencia (A, basada en múltiples ensayos clínicos aleatorizados o metaanálisis; B, basada en un único ensayo clínico o en grandes estudios no aleatorizados; C, basada en el consenso de expertos o en pequeños estudios).
Algoritmo basado en las guías de la European Society of Cardiology (ESC) de 2014 y la normativa de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) de 2013. MMII: miembros inferiores; TEP: tromboembolia pulmonar; TVP: trombosis venosa profunda; VD: ventrículo derecho.
1En un paciente muy inestable, la identificación de disfunción del ventrículo derecho por ecocardiografía transtorácica (IC) es suficiente motivo para la reperfusión inmediata. A la cabecera del enfermo también pueden buscarse trombos en el ventrículo derecho, las arterias pulmonares y los miembros inferiores, que refuercen el diagnóstico (IIbC).
2Si el paciente ya está estable o la TC se encuentra disponible, conviene confirmar la TEP con angio-TC de arterias pulmonares (IC).
3Reperfusión primaria: trombólisis (alternativas: embolectomía quirúrgica o percutánea).
Algoritmo basado en las guías de la European Society of Cardiology (ESC) de 2014 y la Normativa de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) de 2013. DD: dímero D; ECG: electrocardiograma; TEP: tromboembolia pulmonar.
1Escala de Wells o de Ginebra. Esquema de tres niveles o simplificado.
2 En caso de probabilidad intermedia o alta, o TEP probable, se recomienda iniciar la anticoagulación parenteral durante el proceso diagnóstico (IC).
3Dímero D positivo si superior a 500. Ajustar el valor a la edad si >50 años.
4La angio-TC se considera positiva si muestra TEP segmentaria o más proximal, y se debe iniciar o continuar el tratamiento anticoagulante (IB).
5La angio-TC negativa descarta una TEP (IA), salvo en pacientes con alta probabilidad clínica, en quienes puede considerarse seguir investigando antes de retirar la anticoagulación (IIaB).
En los pacientes con shock e hipotensión en los que se sospecha TEP (fig. 1), el diagnóstico diferencial incluye la disfunción valvular, el taponamiento, el síndrome coronario agudo y la disección aórtica. La ecocardiografía transtorácica es la primera prueba a realizar en el paciente inestable (IC), pues la identificación de una hipertensión pulmonar aguda y la disfunción del ventrículo derecho en este contexto confirmarán que la causa de la inestabilidad hemodinámica es una TEP, y será suficiente para indicar la reperfusión inmediata9. La presencia de coágulos en el ventrículo derecho (rara) apoyará la necesidad de trombólisis10. Si existen dudas entre una TEP aguda y una descompensación de una hipertensión pulmonar crónica pueden ser de ayuda la ecocardiografía transesofágica, para detectar trombos en las arterias pulmonares principales y lobares proximales11, y la ecografía venosa de compresión de miembros inferiores (MMII) para valorar una trombosis venosa profunda (TVP) (IIbC). No obstante, siempre que sea posible, porque el paciente se haya estabilizado y se disponga de la técnica, debe realizarse una angio-TC para confirmar la TEP (IC). La angiografía pulmonar puede plantearse tras un cateterismo coronario que no ha explicado el cuadro (IIbC), en especial si se plantea una trombectomía percutánea.
En pacientes hemodinámicamente estables (fig. 2), la estrategia diagnóstica más aceptada para la población general se basa en la probabilidad clínica, el valor del dímero D y la angio-TC de arterias pulmonares. A continuación se explican los pasos del algoritmo, las dudas frecuentes y las controversias persistentes.
Pasos del algoritmo- •
Pruebas complementarias iniciales:
Las manifestaciones más frecuentes de la TEP son la disnea, el dolor pleurítico o centrotorácico, y la taquipnea, y son menos frecuentes el síncope, la hemoptisis, la fiebre y las palpitaciones. Todos estos síntomas obligan a realizar una radiografía de tórax urgente, que permitirá un primer diagnóstico diferencial de patología torácica; en caso de ser normal o presentar hallazgos específicos de TEP, se reforzará esta sospecha. El electrocardiograma se solicita principalmente para descartar signos de isquemia coronaria aguda como causa de la sintomatología torácica; en la TEP suele ser normal o mostrar taquicardia sinusal, y solo en algunos casos orientará el diagnóstico por la presencia de signos de sobrecarga del ventrículo derecho. La gasometría arterial informa del grado de hipoxemia, habitual en el paciente con TEP y normalmente acompañada de hipocapnia, pero un resultado normal no excluye el diagnóstico.
- •
Probabilidad clínica pretest:
Es necesario establecer una probabilidad clínica pretest (IA) en función de la evaluación clínica, las pruebas básicas y los antecedentes del paciente3,12. Los sistemas de puntuación clínica validados (escala de Wells y escala de Ginebra) establecen grados de probabilidad de TEP baja, intermedia o alta, y de forma simplificada, probable o improbable. A pesar de que la puntuación de la escala de Ginebra es más objetiva, la escala de Wells parece ser más robusta y específica para la determinación de la probabilidad de TEP13; no obstante, ambas son aceptadas.
- •
Dímero D:
Debe solicitarse la determinación del dímero D en pacientes con TEP improbable o de probabilidad baja, porque un valor <500μg/l excluye TEP con un alto valor predictivo negativo (IA)14. Conviene ajustar el valor de corte a la edad en los pacientes ≥50 años de edad (valor de corte=edad×10μg/l), lo que aumenta la especificidad de la prueba, conservando una buena sensibilidad, respecto a la utilización del valor fijo15. En caso de probabilidad intermedia, un valor negativo del dímero D puede excluir la TEP si se ha obtenido con una prueba de sensibilidad alta (IA)16, pero no se ha demostrado que esto sea así con una prueba de sensibilidad moderada, en cuyo caso puede considerarse la realización de una prueba de imagen (IIbC). Hay que conocer la sensibilidad del método de medición del dímero D empleado en cada centro8. En pacientes con TEP probable o de alta probabilidad, un dímero D negativo no descarta una TEP con seguridad (IIIB) y es recomendable siempre investigar mediante imagen17.
- •
Pruebas de imagen:
- –
La angio-TC es actualmente la prueba de imagen de elección para investigar una sospecha de TEP. Si es positiva, se debe iniciar o continuar el tratamiento anticoagulante (IB). Un resultado negativo descarta una TEP en situaciones pretest de improbable o probabilidad baja o intermedia (IA), y se considera una estrategia segura18,19.
- –
La gammagrafía de ventilación-perfusión (V/Q) pulmonar permite descartar la TEP con un alto valor predictivo negativo (IA), pero se considera una segunda opción por el alto número de estudios no diagnósticos. Este número disminuye considerablemente si la radiografía de tórax es normal20, por lo que la guía de la ESC apoya que sea la prueba de primera línea en pacientes jóvenes para evitar la radiación. También es la alternativa en pacientes con contraindicación a la angio-TC, y resulta una herramienta de ayuda cuando la probabilidad clínica pretest es alta y la angio-TC es negativa.
- –
La ecografía venosa de compresión de MMII es muy útil, porque el diagnóstico de TVP proximal aumenta la probabilidad de TEP y permite iniciar el tratamiento de la enfermedad tromboembólica venosa (ETV), que incluye a ambas (IB). Sin embargo, las guías no la indican como primera prueba en la sospecha clínica de TEP en la población general, y consideran que hay que empezar por una prueba de imagen torácica21. Se propone, independientemente de la presencia de síntomas en las piernas, en las mismas situaciones que la gammagrafía22 (IIbB). Otras posibles indicaciones, que se explican en el siguiente apartado, son los casos de probabilidad clínica baja con angio-TC positiva o de trombos limitados a arterias subsegmentarias.
- –
La angiografía pulmonar es una prueba invasiva no exenta de riesgos23 y con resultados similares a los de la angio-TC, por lo que queda fuera del algoritmo diagnóstico inicial. Se puede recomendar en último lugar cuando hay discrepancia entre la probabilidad clínica y el resultado de las pruebas no invasivas (IIbC)24.
- –
- •
¿Se debe añadir sistemáticamente una venografía por TC de pelvis-MMII a la angio-TC pulmonar para descartar la TEP? Las guías no lo recomiendan. En el estudio PIOPED II (principalmente con equipos de cuatro filas de detectores) se observó que mejoraba la sensibilidad de detección de ETV, pero también se concluyó que empleando los criterios de la escala de Wells en la estrategia diagnóstica se alcanzaba la misma sensibilidad sin necesidad de venografía por TC24. Esta exploración añade una radiación pélvica importante, por lo que si conviene valorar una TVP es preferible la ecografía venosa de compresión de MMII; los resultados son similares o incluso mejores, y la trombosis pélvica aislada es rara25–27.
- •
¿La ecografía venosa de compresión de MMII debe ser proximal o completa, incluyendo la región distal? En los algoritmos diagnósticos de la TEP la ecografía se limita a la región proximal (desde las ingles hasta el hueco poplíteo), porque un estudio completo alarga el tiempo de exploración y la mayoría de los pacientes con un trombo únicamente distal no tienen TEP28. La trombosis proximal en pacientes con sospecha clínica de TEP tiene un alto valor predictivo positivo y su presencia es suficiente para instaurar tratamiento anticoagulante. No hay la misma evidencia respecto al riesgo/beneficio de la anticoagulación en una TVP distal aislada, pero los estudios apuntan a que evitaría la propagación proximal y en consecuencia la incidencia de TEP29. Si se detecta una TVP distal aislada en un paciente con sospecha de TEP, debe considerarse la realización de más pruebas para confirmarlo (IIaB).
- •
Si se sospecha TEP aguda y se ha realizado una ecografía que muestra una TVP proximal, ¿debe hacerse una angio-TC pulmonar o una gammagrafía V/Q de urgencia? La guía de la ESC considera que una ecografía venosa proximal positiva en un paciente con sospecha clínica de TEP es criterio de confirmación de TEP (IB) y puede evitar realizar un estudio torácico en casos seleccionados (IIbB). Se entiende que, en el resto de las situaciones, confirmar o descartar la TEP es importante para evaluar correctamente la situación clínica y el pronóstico del paciente. Si bien las guías no especifican en qué momento hacerlo, debe ser cuanto antes, aunque no imperiosamente de urgencia si no modifica el tratamiento urgente.
- •
¿En el paciente con dolor torácico agudo de posible origen coronario es conveniente realizar una angio-TC de triple descarte en lugar de una coronariografía por TC? Es un «área de incertidumbre» en las guías y, hasta la fecha, a la espera de una mejor definición de sus indicaciones, no parece conveniente porque a pesar de que aumenta ligeramente el número de TEP y de síndromes aórticos agudos diagnosticados, su prevalencia es baja y supone más radiación, volumen de contraste y número de estudios de calidad no diagnóstica30.
- •
¿Es igual de seguro y eficiente este algoritmo para pacientes con ETV previa? Esta situación implica una mayor probabilidad clínica, puede que unos valores de dímero D persistentemente anormales y una obstrucción embólica residual. Es probable que, por estos motivos, en un metaanálisis reciente esta estrategia resulte segura, pero su eficiencia es relativamente baja comparada con la de la población sin antecedentes de ETV31.
- •
En pacientes con TEP probable o con una probabilidad pretest alta y angio-TC negativa, ¿se descarta la TEP o hay que seguir investigando antes de retirar la anticoagulación? Las guías aceptan ambas opciones y señalan que tanto la necesidad de más pruebas como la naturaleza de estas siguen siendo controvertidas. En el estudio PIOPED II, la angio-TC tuvo un valor predictivo negativo más bajo en este grupo de pacientes (60%)24, lo cual apoya que se siga investigando con otras pruebas (gammagrafíaV/Q o ecografía venosa de compresión de MMII). Sin embargo, se han publicado otros estudios en contraposición; entre ellos, un metaanálisis centrado en pacientes con TEP probable o probabilidad alta que determinó que tanto la angio-TC negativa sola como la angio-TC negativa seguida de ecografía de MMII negativa eran estrategias seguras, con un riesgo de TEP fatal bajo y equiparable32. Más recientemente, un estudio prospectivo concluye que sí es necesario seguir estudiando a este grupo de pacientes por la alta incidencia de ETV (5,2%) no identificada en la angio-TC pulmonar y detectada mediante otras pruebas o en el seguimiento, aunque sin evolución fatal. Esta propuesta debe considerarse con precaución y tener en cuenta que se refiere especialmente a pacientes sin un diagnóstico alternativo y con enfermedad cardiopulmonar subyacente33.
- •
Los pacientes con probabilidad clínica pretest baja y angio-TC positiva, ¿deben tratarse directamente o seguir estudiándose? Las guías recomiendan tratamiento con cautela, dado que en el PIOPED II se observó que el valor predictivo positivo de la TC desciende al 58% en el grupo de probabilidad baja24. Se deduce que conviene reevaluar la clínica y la TC en estos casos. Falta evidencia sobre la necesidad de realizar más pruebas que lo confirmen, en especial si los coágulos se limitan a las arterias segmentarias (o subsegmentarias).
- •
¿Qué significación clínica tiene la identificación en una angio-TC de trombos limitados a uno o varios vasos subsegmentarios? Las guías clínicas consideran la TC «positiva» para TEP solo si muestra un trombo en arterias segmentarias o más proximales. El hallazgo de un trombo en un vaso distal tiene bajo valor predictivo positivo y poca concordancia entre observadores. Algunos autores describen que su detección ha aumentado con los equipos multidetector, sin que haya tenido una influencia significativa en el pronóstico del paciente34,35, mientras otros detectan una repercusión clínica similar a la de los trombos más centrales, aunque determinada por los factores de riesgo y la probabilidad pretest36. No hay ensayos clínicos aleatorizados que permitan saber si el riesgo de progresión o de recurrencia es suficientemente alto como para justificar la anticoagulación. La 10ª edición de la Guía CHEST37 considera que es más probable que el diagnóstico de un trombo subsegmentario sea correcto si: 1) la TC es de alta calidad, con buen relleno de las arterias pulmonares distales; 2) hay múltiples defectos intraluminales; 3) los defectos afectan a arterias subsegmentarias en su porción más proximal; 4) los defectos se ven en más de una imagen; 5) los defectos se rodean de contraste en lugar de aparecer adheridos a las paredes arteriales; 6) los defectos se ven en más de una proyección; 7) los pacientes están sintomáticos y no es un hallazgo incidental; 8) hay alta probabilidad clínica pretest de TEP; y 9) el dímero D está elevado, en particular si el aumento es marcado y no existe otra explicación. Por ello, en caso de observar un trombo subsegmentario aislado, conviene que se reevalúe por un radiólogo torácico; la Guía CHEST propone realizar una ecografía venosa de MMII para descartar una TVP tratable y, si es negativa, decidir individualmente entre seguimiento ecográfico o anticoagulación. La ESC también propone considerar la realización de más pruebas en esta situación (IIbC).
- •
¿Tiene algún papel la angiografía por resonancia magnética (angio-RM) pulmonar en el algoritmo diagnóstico de la TEP? Las guías clínicas no consideran que esta técnica esté indicada (IIIA) por la baja sensibilidad obtenida en el estudio PIOPED III38, el alto porcentaje de estudios no concluyentes y la baja sensibilidad en los vasos segmentarios39. Ahora bien, muchos autores apoyan su uso porque, si el estudio es óptimo, la especificidad y la concordancia entre lectores es alta, y un resultado positivo para TEP podría permitir instaurar un tratamiento anticoagulante39.
Los factores de riesgo de reacción adversa al contraste yodado deben ser evaluados antes de realizar una angio-TC, siguiendo las recomendaciones de las guías clínicas sobre medios de contraste40,41 y los protocolos consensuados en cada centro para determinar el grado de contraindicación del contraste y la pauta de profilaxis requerida en caso necesario.
Indicación de pruebas complementarias en población especial
| Pruebas indicadas en población especial | Dímero D | RX de tórax | Ecografía venosa de MMII | Gammagrafía V/Q | Angio-TC de arterias pulmonares |
|---|---|---|---|---|---|
| Riesgo de NIC, o alergia y jóvenes (Guía clínica de la ESC) | ++ | ++ | + Si RX de tórax patológica o gammagrafía no disponible. IIbB | ++ Si RX de tórax normal. IA | + Si RX de tórax patológica o gammagrafía no disponible. (Con profilaxis si es necesario.) |
| Embarazo (Guía clínica de la ATS y la STR) | − D, baja evidencia | ++ F, muy baja evidencia | + Solo si síntomas de TVP. D, muy baja evidencia | ++ Si RX tórax normal. F, baja evidencia | + Si RX tórax patológica y no hay diagnóstico ni sospecha de TVP. D, muy baja evidencia. O si la gammagrafía no es diagnóstica y se decide seguir estudiando. F, muy baja evidencia. |
| Embarazo (Guía clínica de la ESC) | + IIbC | + Si la ecografía es negativa. | ++ IIbC | ++ Si no TVP y RX de tórax normal. IIbC | + Si no TVP y RX de tórax patológica o gammagrafía no disponible. IIaC |
++ prueba de primera elección;+ prueba que puede ser útil;−Prueba no recomendada.
ATS/STR: American Thoracic Society/Society of Thoracic Radiology; ESC: European Society of Cardiology; MMII: miembros inferiores; NIC: nefropatía inducida por contraste yodado; RX: radiografía; TVP: trombosis venosa profunda; V/Q: ventilación/perfusión.
Grado de recomendación: D, recomendación débil; F, recomendación fuerte (según la guía ATS/STR). El nivel de evidencia de esta guía está basado en el sistema GRADE.
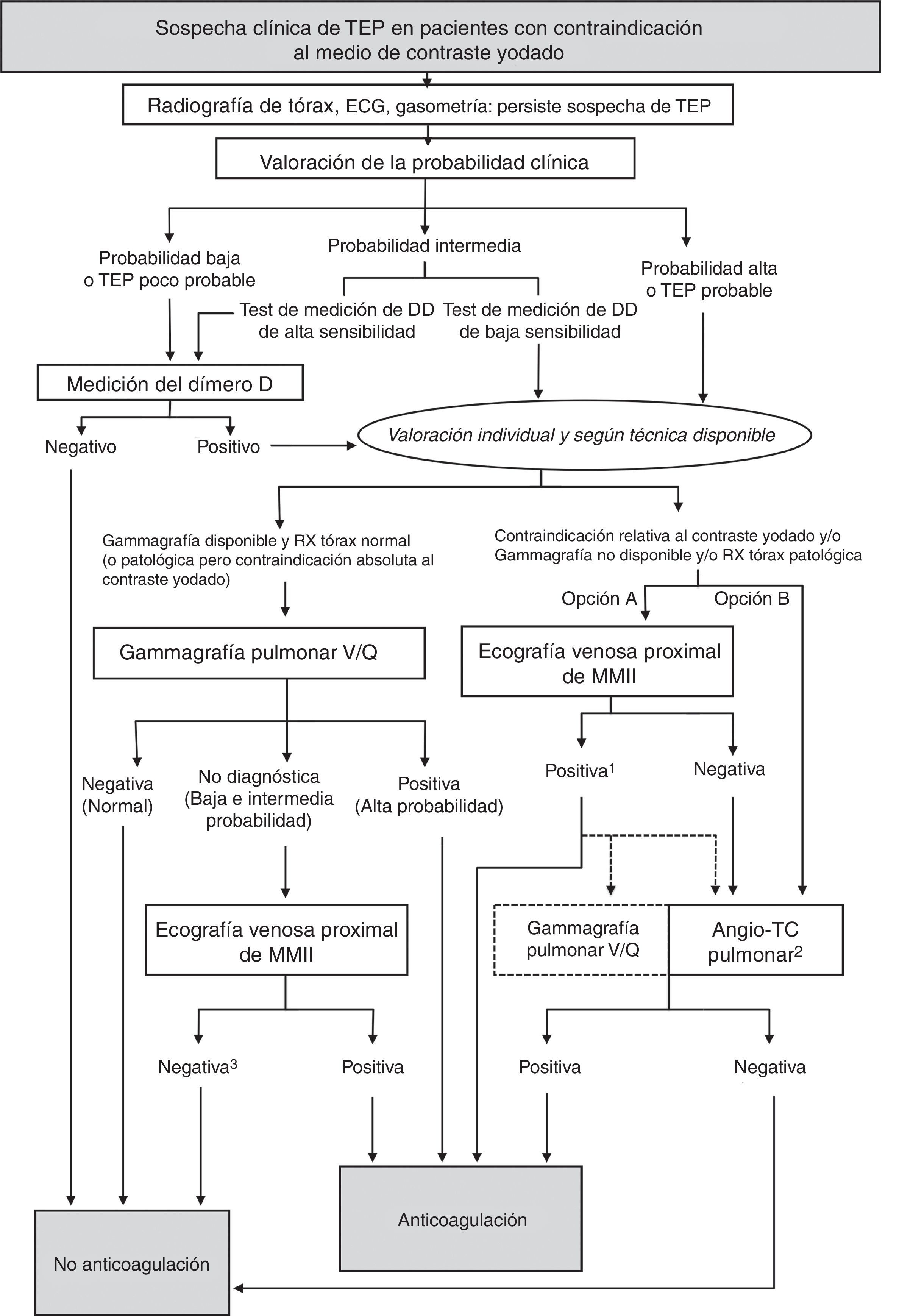
Algoritmo propuesto a partir de las recomendaciones de las guías clínicas para el diagnóstico de TEP y de las guías de prevención en el empleo de medios de contraste yodado. ECG: electrocardiograma; MMII: miembros inferiores; TEP: tromboembolia pulmonar; TVP: trombosis venosa profunda.
1El diagnóstico de TVP indica anticoagulación. La posterior realización y elección de la prueba torácica dependerá del grado de contraindicación del contraste yodado, la disponibilidad de la gammagrafía y la radiografía de tórax (normal o patológica).
2Seguir la pauta de profilaxis para reacciones al contraste establecida en cada centro.
3En caso de probabilidad alta o de TEP probable (y de forma controvertida en la probabilidad intermedia) debe valorarse, de acuerdo con el especialista correspondiente, la realización de una angio-TC pulmonar.
Las guías para el diagnóstico de TEP no han diseñado un algoritmo específico para este grupo de pacientes, pero sí proponen la gammagrafía V/Q como alternativa válida a la angio-TC y señalan la utilidad de la ecografía de compresión venosa de MMII antes de la angio-TC para buscar TVP y evitar otras pruebas (IIbB).
En este trabajo se proponen dos estrategias en función de la disponibilidad de la gammagrafía, la radiografía de tórax (normal/anormal) y el grado de contraindicación de la administración de contraste yodado (fig. 3):
- •
Gammagrafía V/Q, si se decide evitar contraste yodado, se dispone de la técnica en la urgencia y la radiografía de tórax es normal. a) Si la gammagrafía de perfusión es “normal”, descarta la TEP42 (IA). b) Un estudio de V/Q de “alta probabilidad” de TEP es suficiente para instaurar un tratamiento anticoagulante42. No obstante, si la probabilidad clínica pretest es baja puede considerarse individualmente la realización de más pruebas (IIaB). c) Los estudios no diagnósticos requieren realizar otras pruebas. Si la probabilidad clínica pretest es baja o improbable, una ecografía venosa de MMII negativa se considera suficiente para descartar ETV (IIaB), pero no así en caso de probabilidad clínica alta o TEP probable, y de forma controvertida en la probabilidad intermedia, en las que debe valorarse la necesidad de más pruebas.
- •
En el resto de las situaciones, en ausencia de contraindicación absoluta, puede realizarse la angio-TC con la profilaxis correspondiente. La ecografía venosa proximal de MMII, realizada antes de la TC, tiene la ventaja de que un resultado positivo permite iniciar el tratamiento anticoagulante y confirmar la TEP cuando sea posible, lo cual ofrece un intervalo de tiempo para disponer de la gammagrafía o administrar una profilaxis más segura para una angio-TC. En casos seleccionados, incluso puede evitar el estudio torácico (IIbB). Conviene saber que la ecografía es más rentable en pacientes con síntomas en las piernas y en mayores de 80 años, puesto que en ellos se detectan más trombos en las venas de los MMII43.
- •
Consideraciones generales:
La TEP es una complicación poco frecuente, pero constituye la primera causa de mortalidad durante el embarazo en los países desarrollados. En más del 50% se produce durante las primeras 20 semanas y el riesgo persiste aproximadamente hasta 6 semanas posparto. En la actualidad no existe una escala clínica validada para mujeres embarazadas. En un estudio retrospectivo se obtuvieron unas altas sensibilidad y especificidad de los criterios de la escala de Wells modificados en gestantes, pero se requiere mayor investigación44. También se ha propuesto la regla LEFt de predicción de TVP, que combina síntomas en la pierna izquierda (left, L), diferencia en la circunferencia de la pantorrilla ≥2cm respecto a la contralateral (edema, E) y presentación en el primer trimestre (First trimester, Ft). Si no se cumple ninguno de los criterios LEFt, la probabilidad de TVP es muy baja45.
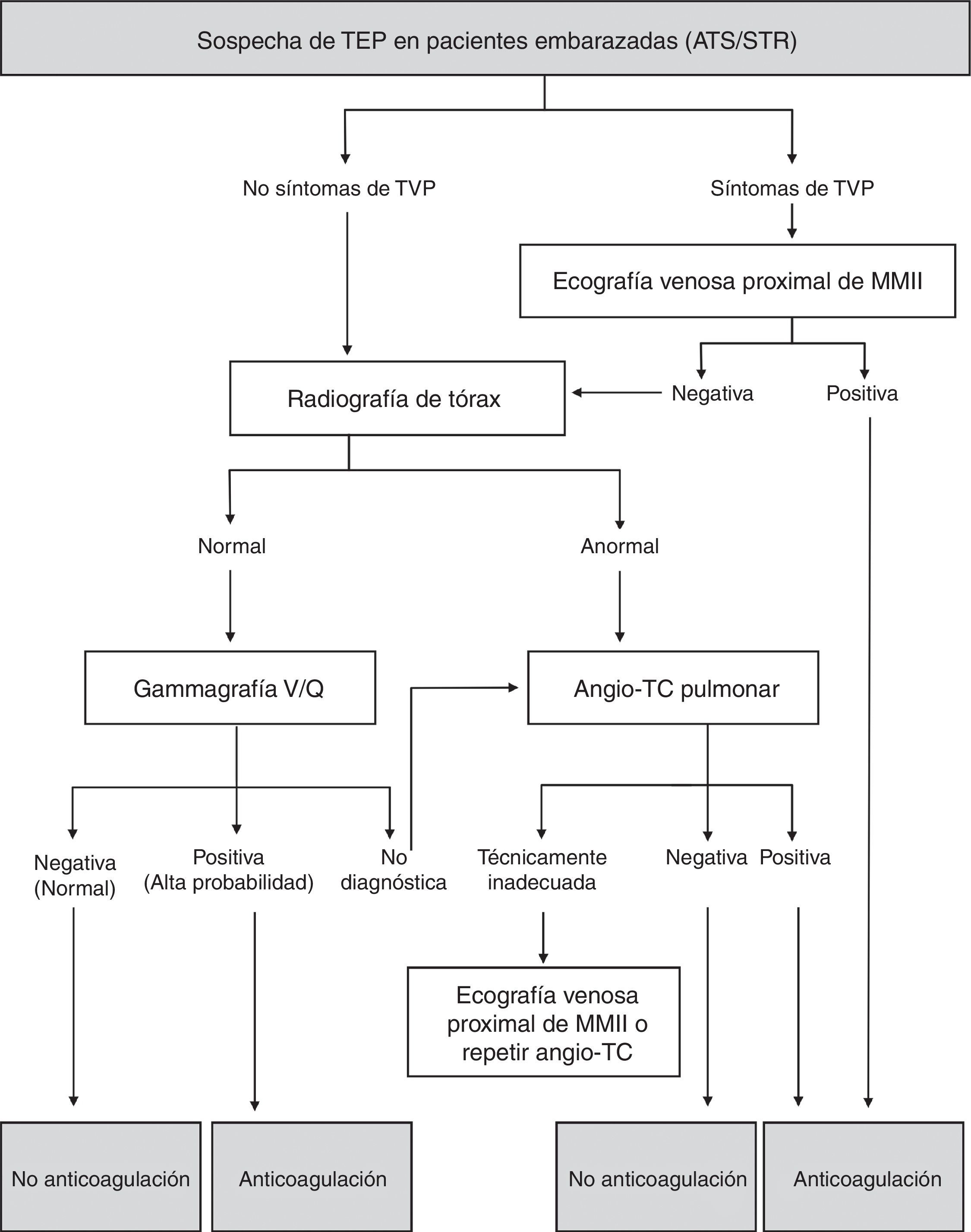
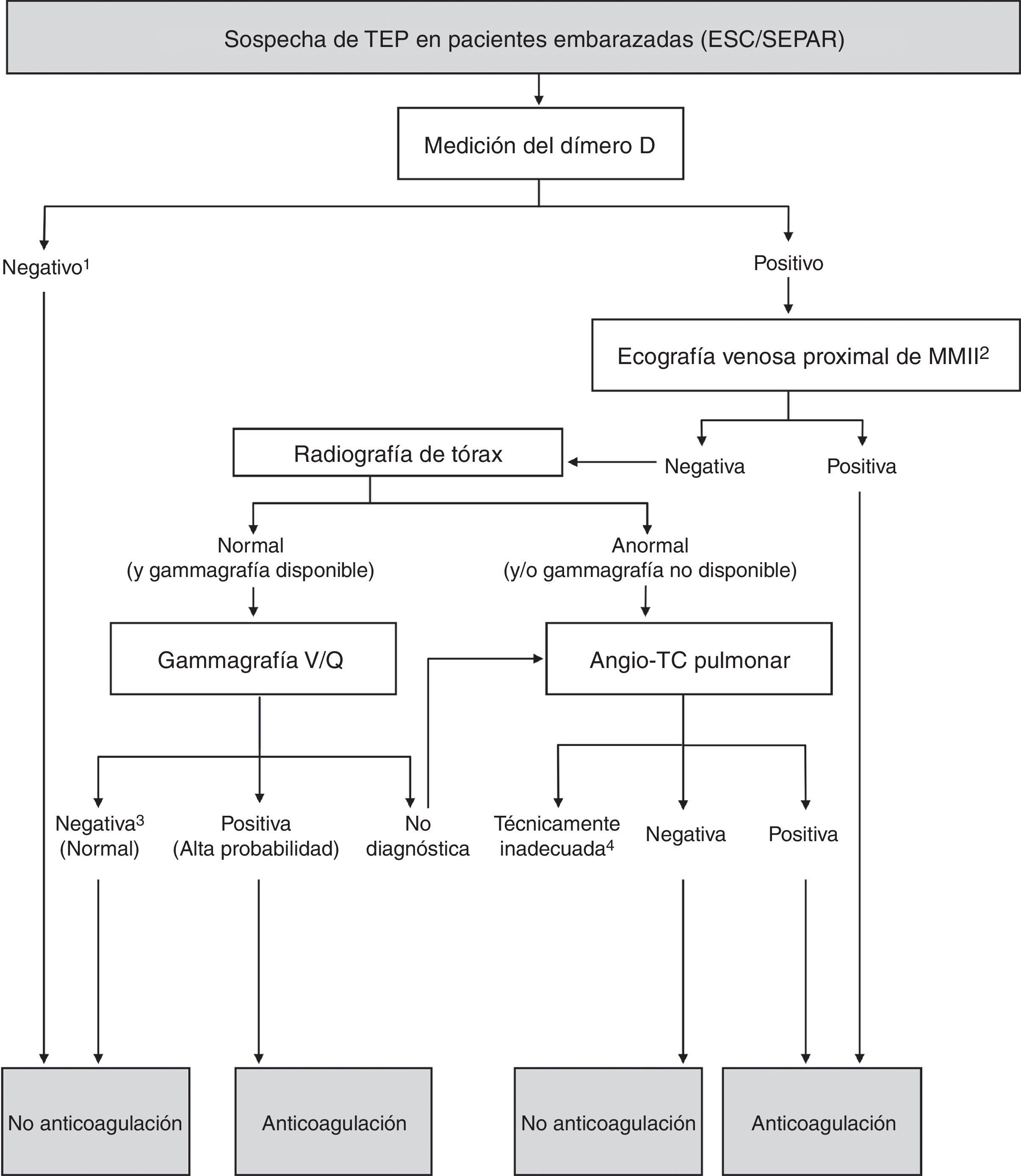
Figura 5.Algoritmo basado en las recomendaciones de la European Society of Cardiology (ESC) de 2014 y la normativa de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) de 2013. DD: dímero D; MMII: miembros inferiores; TEP: tromboembolia pulmonar.
1La guía de la ESC emplea el dímero D (IIbC), y la normativa SEPAR directamente realiza ecografía de MMII (no hace mención al dímero D).
2La ecografía venosa de MMII es la prueba de imagen de primera línea independientemente de la existencia o no de síntomas en piernas.
3En caso de probabilidad alta o de TEP probable (y de forma controvertida en la probabilidad intermedia) debe considerarse, de acuerdo con el especialista correspondiente, la realización de una angio-TC pulmonar.
4No se especifica cuál es la actitud en caso de TC no diagnóstica.
El dímero D se eleva fisiológicamente en el curso del embarazo y supera con frecuencia el valor de corte diagnóstico, con una menor especificidad de la prueba, lo que hace controvertida su utilidad. Algunos autores consideran que no debe emplearse en el algoritmo diagnóstico y señalan su falta de sensibilidad46 y los casos publicados de TEP con dímero D negativo47 en esta población. En contraposición, otros autores obtuvieron un valor predictivo negativo para TVP del 100% en gestantes en el primero y el segundo trimestres con una prueba de aglutinación altamente específica, e intentaron establecer valores de corte para el dímero D específicos en estas pacientes48, pero faltan estudios prospectivos amplios que permitan validarlos.
El algoritmo de pruebas de imagen debe encontrar el equilibrio entre el riesgo por radiación ionizante y la certeza diagnóstica. El tratamiento anticoagulante conlleva riesgos y afecta a la planificación de la anestesia en el parto. Además, el diagnóstico de ETV condiciona la decisión de anticoncepción y la indicación de profilaxis en futuras gestaciones.
La ecografía venosa de compresión de MMII en pacientes embarazadas se espera que sea positiva hasta en un 58,3% si se cumplen dos o más de las variables LEFt. En ausencia de síntomas en las piernas su indicación es más controvertida, porque el número de ecografías que deberían realizarse para detectar un caso se supone alto, dada la baja prevalencia de la TEP en las embarazadas49.
La radiosensibilidad de las glándulas mamarias está aumentada durante el embarazo y la lactancia. La gammagrafía V/Q supone menor radiación mamaria que la angio-TC y tiene un valor predictivo negativo para la TEP similar; además, la radiación puede reducirse aún más prescindiendo del estudio de ventilación en caso de tener una radiografía de tórax normal50. A pesar de las mejoras de los equipos de TC de última generación y del empleo de una técnica de baja dosis, la mama recibe un 30% más de dosis efectiva que con la gammagrafía de perfusión pulmonar51. A esto hay que añadir que la angio-TC pulmonar en las embarazadas muchas veces no es diagnóstica por el frecuente artefacto de interrupción del contraste por sangre procedente de la vena cava inferior no contrastada52. Sin embargo, la probabilidad de que una gammagrafía pulmonar V/Q sea diagnóstica es mayor si la radiografía de tórax es normal, lo cual es frecuente en esta población20. En cuanto al feto, con ambas técnicas la cantidad de radiación absorbida está en cifras muy inferiores al umbral de peligro de lesiones fetales53. Aunque la normativa de la SEPAR indica el uso de protectores de bismuto para las glándulas mamarias si se realiza TC, esto no debería ser una recomendación general. Si el equipo dispone de técnicas de modulación de dosis, estas consiguen mayores reducciones de dosis mamaria que los protectores de bismuto. Si además se cubren las mamas con estos protectores (siempre después de adquirir el topograma), se corre el riesgo de que mínimas modificaciones geométricas en su colocación originen variaciones en la dosimetría y artefactos54.
En una serie reciente de 127 embarazadas con sospecha de TEP estudiadas con TC de emisión de fotón único (SPECT) V/Q, todos los estudios fueron diagnósticos incluso con radiografía de tórax patológica55, y la radiación mamaria absorbida fue mucho menor que con la TC56. La mayor limitación es la falta de disponibilidad de la técnica.
El uso de la angio-RM no está definido por falta de estudios respecto a su capacidad diagnóstica en gestantes y al efecto del gadolinio en el feto a largo plazo. La angio-RM sin contraste intravenoso está en investigación, con resultados aceptables en población no embarazada, y puede tener un papel en gestantes en el futuro.
- •
Recomendaciones de las guías clínicas:
En 2011, la American Thoracic Society (ATS) y la Society of Thoracic Radiology (STR) elaboraron conjuntamente una guía de práctica clínica para evaluar la sospecha de TEP en el embarazo (fig. 4). No recomiendan el uso del dímero D. Indican una radiografía de tórax a toda embarazada con sospecha de TEP y una ecografía venosa de compresión de MMII solo en caso de síntomas de TVP. Sin embargo, en la guía de la ESC de 20145 y en la normativa de la SEPAR de 20138 (fig. 5) la prueba de imagen de primera línea en las embarazadas es la ecografía venosa de compresión de MMII, incluso en ausencia de síntomas en las piernas. Por otro lado, todas las guías coinciden en emplear la gammagrafía si la radiografía de tórax es normal y no hay TVP (clínica ni por ecografía), para evitar la radiación mamaria. La angio-TC debe considerarse si la radiografía es anormal, no se dispone fácilmente de gammagrafía o no es diagnóstica y se decide seguir estudiando.
La TVP proximal residual valorada con ecografía venosa de compresión de MMII al finalizar la anticoagulación se ha propuesto como un posible marcador de recurrencia que podría ayudar a determinar la duración del tratamiento anticoagulante en la ETV no provocada. Sin embargo, un metaanálisis ha mostrado que su asociación con la recurrencia es en general débil57.
La trombosis pulmonar detectada por imagen puede etiquetarse como residual a los 3 meses del episodio agudo, puesto que los cambios esperados a partir de ese momento son mínimos a pesar del tratamiento anticoagulante. Su incidencia tras una TEP aguda es muy variable (del 16% al 66,7%)58–60, en parte debido a las características poblacionales y a la técnica diagnóstica empleada. Tras la anticoagulación, la normalización del estudio se ha descrito con más frecuencia con angio-TC que con gammagrafía V/Q, posiblemente porque esta última puede detectar defectos de perfusión por trombos residuales en vasos muy distales no valorables por angio-TC. La trombosis pulmonar residual, tanto diagnosticada mediante gammagrafía V/Q61 como por angio-TC59,62, no se ha asociado a recurrencia; además, en la literatura hay una discordancia entre el alto porcentaje de trombosis pulmonar residual y la baja incidencia registrada de repetición de una TEP sintomática (3%)63. Por otro lado, un estudio detectó que el 92% de los pacientes con recurrencia de TEP sí tenían defectos de perfusión en la SPECT V/Q de control tras el tratamiento del primer episodio64. Esta técnica es muy sensible en la detección de trombosis crónica60, pero el significado de estos resultados y su utilidad en el seguimiento requieren mayor investigación.
Además del riesgo de recurrencia, en torno al 50% de los pacientes que han sufrido una TEP presentan limitaciones funcionales con empeoramiento de su calidad de vida. Algunos de ellos (un 10% a un 30%) muestran a su vez un cuadro de alteraciones de la perfusión, la ventilación pulmonar o la función cardiaca denominado síndrome postembolia pulmonar65, y en los casos más extremos desarrollan una hipertensión pulmonar tromboembólica crónica (HPTC), cuya incidencia se estima en el 0,1% al 9,1% en los primeros 2 años. En estos cuadros clínicos hay casos sin y con trombosis pulmonar residual en las pruebas de imagen. En pacientes con HTPC se han registrado antecedentes de ETV en el 80% de los casos, pero la mayoría de las trombosis pulmonares residuales no originan HPTC, pues también participan procesos de remodelado vascular actualmente en estudio. Los factores de riesgo de desarrollar una HPTC son diferentes a los de la ETV. Por tanto, hasta la fecha no hay evidencia científica que avale la evaluación de una trombosis residual tras el tratamiento anticoagulante, dado que no se ha definido como marcador pronóstico que modifique el tratamiento. Tampoco se ha considerado que la ecocardiografía tenga fundamento en ausencia de síntomas, dado que la mayoría de los pacientes no desarrollan disfunción cardiaca ni hipertensión pulmonar.
En defensa de realizar una angio-TC de control tras la anticoagulación se considera útil disponer de una imagen basal que facilite la diferenciación entre lesión residual y trombo agudo en caso de nueva sospecha de TEP66.
Recomendaciones actuales sobre el seguimiento de la tromboembolia pulmonar aguda mediante pruebas de imagenLa guía clínica de la ESC de 20145 y la normativa SEPAR8 recomiendan, por consenso de expertos, no realizar seguimiento sistemático de la TEP con pruebas de imagen, e indican evaluar una posible HPTC en los pacientes con embolia previa solo si presentan disnea persistente. La guía de la ESC y la European Respiratory Society (ESR) sobre diagnóstico y tratamiento de la hipertensión pulmonar también recomienda considerar la HPTC en los supervivientes de una TEP aguda con disnea de ejercicio (IIaC)67. La prueba no invasiva para reconocer esta posible hipertensión es la ecocardiografía transtorácica; si se detecta hipertensión, la siguiente técnica a realizar es la gammagrafía V/Q pulmonar por su alto valor predictivo negativo de trombosis crónica. La angio-TC pulmonar puede ser de gran utilidad si la gammagrafía es indeterminada, pero su papel principal es valorar la localización y la extensión de la trombosis residual con vistas a cirugía o tratamiento endovascular.
ConclusionesEn pacientes con sospecha de TEP, las guías clínicas recomiendan una estrategia basada en la probabilidad clínica pretest, el dímero D y la angio-TC pulmonar. La gammagrafía V/Q y la ecografía venosa de MMII son útiles en pacientes con riesgo de efecto adverso al MC yodado empleado, probabilidad clínica pretest alta con TC negativa para TEP y en caso de trombos subsegmentarios aislados. Los algoritmos propuestos en gestantes buscan evitar la radiación mamaria y apoyan el uso de la gammagrafía frente a la TC si la radiografía de tórax normal, pero muestran diferencias respecto al empleo del DD y a la primera prueba de imagen que debe realizarse.
Las guías clínicas aconsejan no seguir sistemáticamente con pruebas de imagen un episodio de TEP. Sí recomiendan el cribado de HTPC con ecocardiografía en pacientes que presentan posteriormente disnea.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.