La apendicitis aguda es la urgencia quirúrgica abdominal más frecuente en el mundo y un motivo de consulta habitual en nuestros servicios de Urgencia.
En las últimas décadas, la imagen diagnóstica ha desempeñado un papel fundamental, lo que ha contribuido a disminuir tanto el índice de laparotomías en blanco, como los costes hospitalarios.
Debido a los ensayos clínicos que defienden el uso de antibioterapia frente al tratamiento quirúrgico convencional, debemos conocer los criterios diagnósticos de la apendicitis aguda complicada de cara a ofrecer la mejor opción terapéutica.
Esta revisión tiene como objetivo no solo definir los criterios diagnósticos de la apendicitis en las diferentes modalidades de imagen, ecografía, tomografía computarizada y resonancia magnética, sino también abordar los protocolos diagnósticos, las presentaciones atípicas y la enfermedad apendicular simuladora.
Acute appendicitis is the most common indication for emergency abdominal surgery throughout the world and a common reason for consultation in emergency departments.
In recent decades, diagnostic imaging has played a fundamental role in identifying acute appendicitis, helping to reduce the rate of blind laparotomies and hospital costs.
Given the results of clinical trials supporting the use of antibiotic therapy over surgical treatment, radiologists need to know the diagnostic criteria for complicated acute appendicitis to be able to recommend the best treatment option.
This review aims not only to define the diagnostic criteria for appendicitis in different imaging modalities (ultrasonography, computed tomography, and magnetic resonance imaging), but also to explain the diagnostic protocols, atypical presentations, and other conditions that can mimic appendicitis.
La apendicitis aguda (AA) es la urgencia quirúrgica abdominal más frecuente en el mundo, con una incidencia anual de 96,5 a 100 casos por 100.000 adultos1. La imagen se ha convertido en el eje diagnóstico fundamental2. La apendicectomía, primero abierta y desde la década de los 80 laparoscópica, es el tratamiento estándar de la AA, ya que se asocia con menos dolor postoperatorio y una recuperación más rápida1. Sin embargo, ensayos clínicos recientes indican que la AA no complicada puede tratarse solo con antibióticos en un 60% de los pacientes, siendo la imagen diagnóstica fundamental para discriminar qué pacientes pueden ser tratados sin cirugía3.
Fisiopatología de la apendicitis agudaLa mayor incidencia de enfermedad de Crohn, colitis ulcerosa o infección por Clostridium difficile tras una apendicectomía indica que el microbioma apendicular tiene un importante papel inmunológico4. Clásicamente, se ha considerado que la obstrucción de la luz era el desencadenante fundamental de la AA junto con la hiperplasia linfoide en pacientes jóvenes, pero teorías recientes consideran factores genéticos, ambientales o infecciosos en el origen de este proceso5. Cuando el apéndice está obstruido sigue secretando moco, se dilata y produce un aumento de la presión endoluminal que, si supera la presión capilar de la pared, evoluciona a isquemia y necrosis mural. Paralelamente a este proceso, las bacterias endoluminales proliferan y cuando se altera la barrera mucosa, se produce una infección transmural y finalmente periapendicular1,5.
Diagnóstico de la apendicitis aguda. Escalas clínicasEl diagnóstico de la AA se basa en la historia clínica, el examen físico, las pruebas de laboratorio y de imagen5. Las escalas de predicción clínica permiten estratificar el riesgo de AA, identificando a aquellos pacientes con riesgo intermedio que necesitan una prueba de imagen para llegar a un diagnóstico. Las escalas que han mostrado más utilidad son la escala de apendicitis en adultos, la escala de respuesta inflamatoria en adultos y la escala RIPASA, superiores en cuanto a precisión diagnóstica a la más conocida escala de Alvarado modificada6. Sin embargo, la utilidad de estas escalas es controvertida. En las guías de World Society of Emergency Surgery (WSES) de Jerusalem 2020 no hubo consenso entre los defensores de estas escalas y los que defendían hacer pruebas de imagen siempre7. De hecho, un estudio reciente plantea la pérdida de precisión diagnóstica de la tomografía computarizada (TC) tras su uso, planteando de nuevo interrogantes sobre su utilidad8.
Diagnóstico de la apendicitis aguda. Técnicas de imagenEn las últimas décadas, el uso de la imagen ha crecido exponencialmente contribuyendo a un descenso de las apendicectomías negativas y de los costes hospitalarios9. Un estudio retrospectivo reciente de nuestra institución comparó las pruebas de imagen y las apendicectomías negativas en 2 periodos (2007 y 2015), constatando que la tasa de apendicetomías negativas había pasado del 9,6% en el año 2007 al 5% en el año 201510. La utilización de pruebas de imagen se había incrementado de forma muy significativa, ya que en el año 2007 el 40,1% de los casos no tenía prueba de imagen, mientras en el 2015 el porcentaje de pacientes sin prueba de imagen era solo del 13,2%10.
EcografíaLa ecografía con compresión gradual es una técnica de imagen inicial excelente que se emplea en muchas instituciones10,11 (fig. 1). Además de la ausencia de radiación, es accesible, no requiere contraste y su alta resolución permite valorar las capas apendiculares12,13. Según un metaanálisis de 14 estudios, la sensibilidad (S) y la especificidad (E) de la ecografía es del 86 y el 81%, respectivamente14, con menor precisión diagnóstica que la TC (S=91% y E=90%)15. Probablemente, la menor precisión diagnóstica de la ecografía esté influida por ser una exploración dependiente del operador. Cuando la ecografía no es concluyente, un metaanálisis reciente demuestra que se puede hacer una TC, una resonancia magnética (RM) o incluso repetir la ecografía sin diferencias significativas entre las 3 técnicas16. Una segunda ecografía tras la observación clínica se basaría en que los signos ecográficos de la AA se hacen más evidentes con el tiempo y a que la podría hacer un radiólogo con más experiencia.
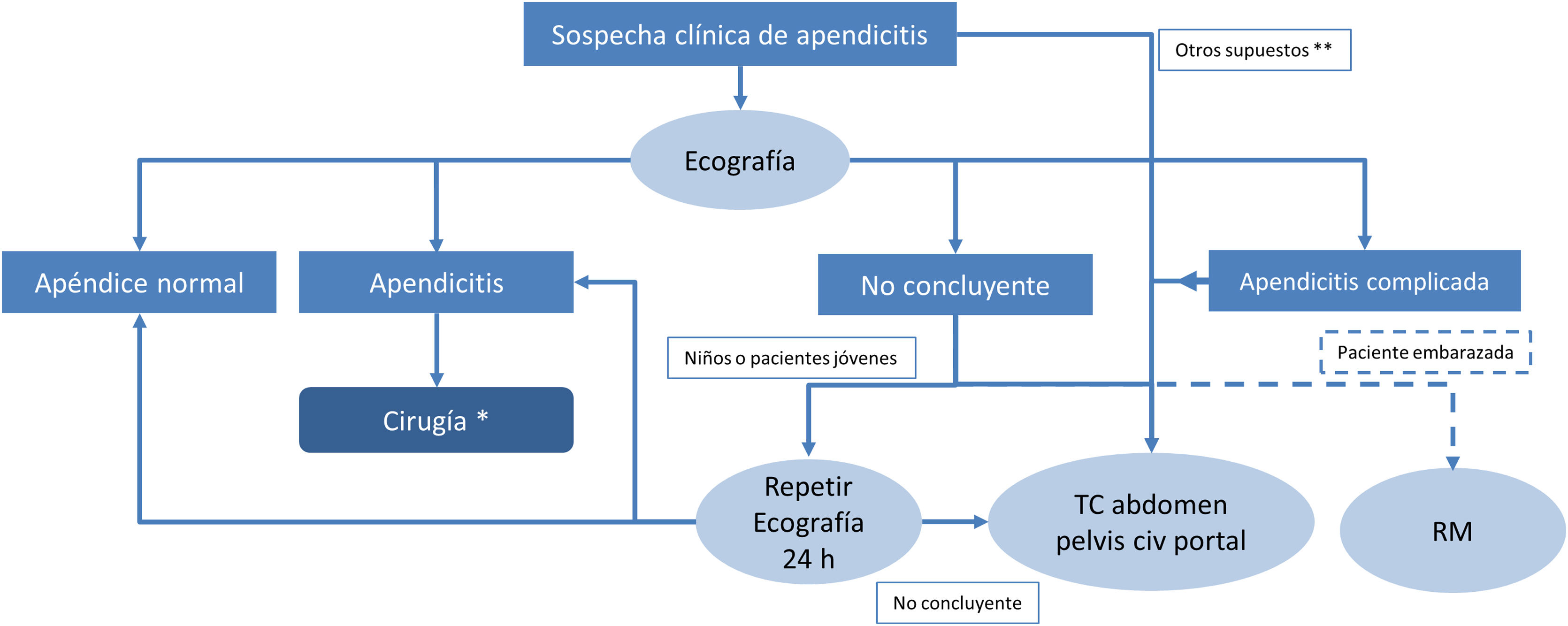
Algoritmo diagnóstico de la apendicitis aguda propuesto en nuestro centro.
* Según las guías WSES de Jerusalén de 2020 en casos de apendicitis agudas no complicadas se puede optar por el tratamiento médico en vez de la cirugía urgente.
** Pacientes obesos, pacientes ancianos con otras enfermedades asociadas que pueden complicar el diagnóstico de apendicitis aguda, pacientes con peritonismo o sospecha de apendicitis aguda complicada pueden requerir hacer una TC como primera prueba diagnóstica.
La TC es una herramienta excepcional en el diagnóstico de la AA típica, atípica y complicada17,18; el American College of Radiology (ACR) sigue recomendando la TC con contraste por vía intravenosa como la técnica de elección en el diagnóstico de la AA en adultos, por su alta sensibilidad y especificidad19. Sin embargo, la exposición a la radiación ionizante no es un tema banal, ya que se ha descrito que una TC puede alcanzar hasta 10 mSv y algunos autores han estimado que podría inducir cáncer en un paciente por cada 2.000 exploraciones20. Estudios recientes muestran que la dosis de radiación se puede reducir a 2 mSv sin afectar a los resultados clínicos, lo que podría prevenir en el futuro la aparición de neoplasias asociadas a la radiación21. Para evitar la exposición a la radiación ionizante, en 2020 la WSES recomendó hacer primero ecografía en pacientes jóvenes con sospecha de AA y solo recurrir a la TC después de una ecografía negativa o no concluyente7. En cuanto a la TC de energía dual, se ha visto que mejora la diferenciación de apendicitis simple y gangrenosa respecto a la TC convencional22. El protocolo de la TC ha sido objeto de controversia sobre si debía utilizarse o no contraste por vía oral o venosa, si hacer estudios de todo el abdomen o solo de la pelvis y si debe usarse TC convencional o con dosis de radiación baja18,23–26. Hay consenso en explorar todo el abdomen para incluir apéndices de localizaciones atípicas y otras causas de dolor abdominal. El contraste por vía intravenosa mejora la sensibilidad, pero la TC de baja dosis en determinados casos ha demostrado ser equivalente a la TC con dosis estándar21,27,28. Por otra parte, el contraste por vía oral o rectal, aunque puede ser útil en pacientes delgados, no está exento de complicaciones y el ACR lo considera opcional según preferencia institucional19,29. En nuestro centro se hace TC de abdomen completo en fase portal salvo contraindicación y sin contraste oral, y estudios con baja dosis en pacientes jóvenes. La TC solo la realizamos tras una ecografía no concluyente y de forma excepcional hacemos TC como primera línea diagnóstica en pacientes obesos30, muy ancianos o con sospecha de apendicitis complicada y peritonismo que impida la valoración ecográfica (fig. 1).
Resonancia magnéticaEl tiempo largo de exploración y su escasa accesibilidad la alejan de la primera línea diagnóstica en urgencias, pero el ACR la recomienda en niños y embarazadas para evitar la exposición a la radiación19, estando indicada después de una ecografía no concluyente. Su precisión diagnóstica es similar a la de la TC30. El protocolo incluye secuencias de apnea con supresión grasa en T1 y T2 (planos axial y coronal), difusión en caso de sospecha de complicación15,18,31 y no se administra gadolinio.
Criterios diagnósticos de imagen en apendicitis agudaEl apéndice normal es una estructura tubular aperistáltica con extremo ciego. Su pared tiene un espesor menor de 3mm y su diámetro transverso máximo es inferior a 6mm. Su longitud media es de 8-10cm, pero hay formas largas que miden hasta 35cm20,32. Los diferentes criterios de imagen se resumen en tabla 1.
Resumen de los hallazgos radiológicos en la apendicitis aguda según las diferentes técnicas
| Criterios diagnósticos | Ecografía | TC | RM |
|---|---|---|---|
| Aumento de diámetro apendiculara | ≥ 7mm con técnica de compresión gradualApéndice no comprimible | ≥ 10mm al ser sin compresión | |
| Engrosamiento y estratificación de la pared | Pérdida de la estratificación mural con predominio de la capa submucosa | > 3 mm | |
| Inflamación y vascularización de la pared | Aumento de la señal Doppler por hiperemia. Ausente en gangrenosas | Realce de la pared con CIVMayor sensibilidad en TC dual | Hiperintensidad de señal en T2, restringida la difusión |
| Inflamación de la grasa periapendicular | Grasa hiperecogénica | Aumento de atenuaciónEngrosamiento de planos fasciales | Hiperintensidad de señal T2 |
| Contenido apendicular | Gas: en la luz sin otros signos de AA indica permeabilidad y apéndice normal | ||
| Asociado a otros signos de AA indica probable AA gangrenosa | |||
| Apendicolito: no sinónimo de AA | |||
| Apoya el diagnóstico y asocia más complicaciones | |||
| Engrosamiento del ciego | Puede ser difuso o focal coincidiendo con la salida del apéndice (más específico) | ||
| Adenopatías | En la región ileocecal y menores de 1cm, si mayores o centro necrótico pensar en otras enfermedades | ||
a Algunos autores consideran que unos diámetros entre 6-8mm en la ecografía y 6-10mm en la TC son dudosos y sería necesario apoyarse en otros signos radiológicos para el diagnóstico de apendicitis.
Se ha considerado clásicamente el criterio más importante, pero es un error considerarlo de forma aislada. Los impactos fecales o el gas aumentan el diámetro apendicular sin AA, debiendo valorar siempre signos asociados. En la ecografía el apéndice se mide en su eje axial de serosa a serosa y se considera patológico si es mayor de 7mm 33. Este rango de corte tiene un valor predictivo positivo mejor que el criterio de 6mm sugerido originalmente por Jeffrey et al.34. Aun así, un apéndice de 6-8mm debería considerarse dudoso según algunos autores y apoyarse en signos asociados35. En la TC y RM, el rango debe ser más alto al ser una medida sin compresión apendicular, considerándose patológico cuando es superior a 10mm. Un calibre entre 7 y 10mm es dudoso, debiendo apoyarse en signos asociados, como el engrosamiento y el realce de la pared del apéndice o la afectación de la grasa periapendicular2,24.
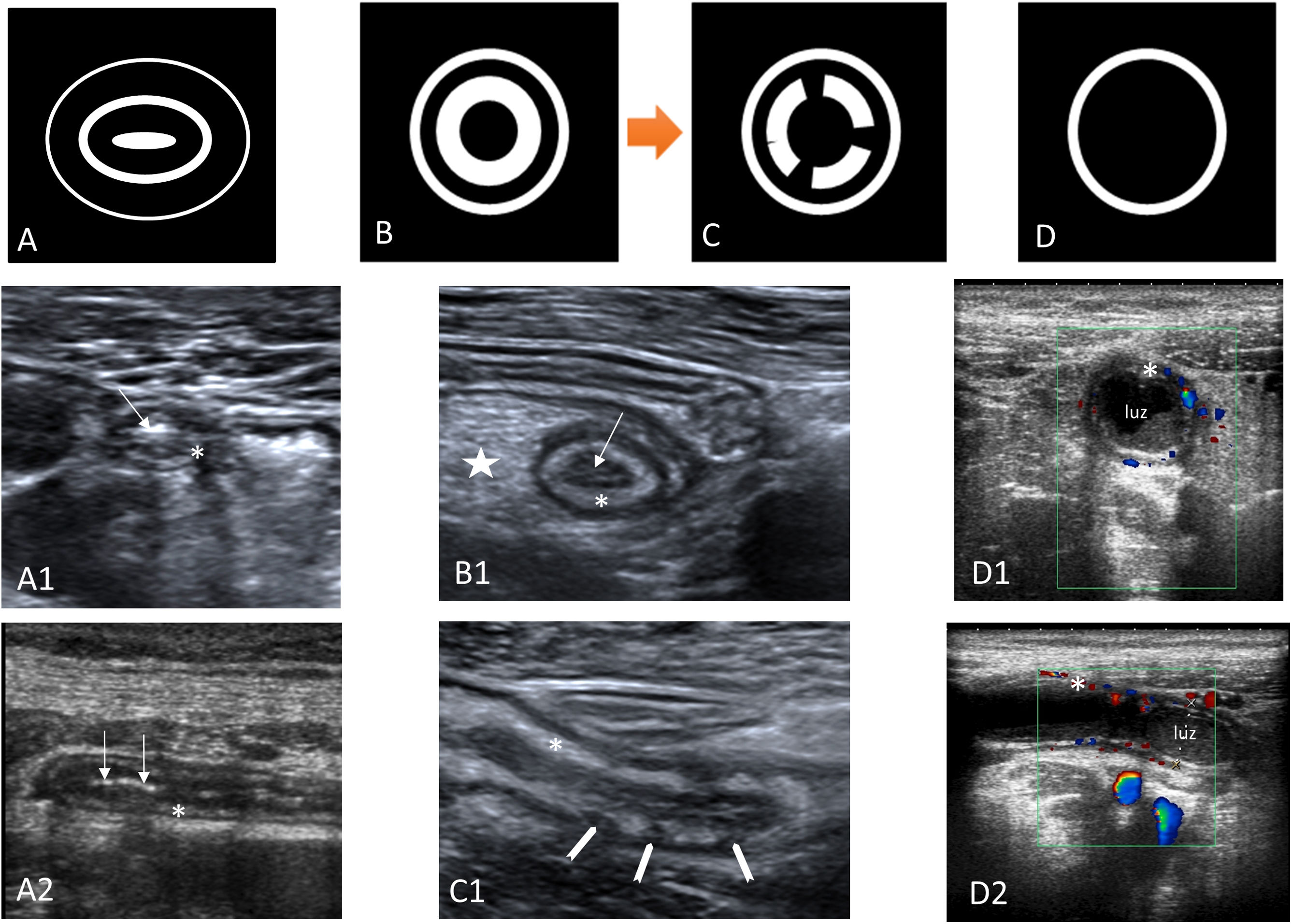
Engrosamiento y estratificación de la paredEn todas las técnicas de imagen se considera que el grosor de la pared del apéndice está aumentado cuando mide más de 3mm. En la TC y la RM la medición a veces es difícil por el escaso espesor y en la ecografía debe medirse desde la superficie mucosa hasta la serosa, excluyendo el contenido endoluminal. En la ecografía, la valoración de las capas apendiculares es más útil que el grosor de la pared, ya que estas son un importante marcador de inflamación apendicular (fig. 2). El apéndice, como el resto del tubo digestivo, tiene 5 capas alternantes, 3 hiperecogénicas, que son (de dentro a afuera) la superficie mucosa, la submucosa y la serosa, y entre ellas 2 capas hipoecoicas, que tienen fibra muscular y que son la muscularis mucosa y la muscular propia12,13,36,37. Con la inflamación del apéndice hay una pérdida de la estructura de las capas que comienza con la desaparición de la capa central (superficie mucosa), seguida de un aumento de la capa intermedia hiperecogénica (submucosa). Conforme evoluciona la inflamación, se observa discontinuidad y finalmente desaparición de la capa submucosa, que es un signo indicativo de inflamación transmural y de AA complicada32,38. Hay otros patrones ecográficos de afectación en la AA en los que predomina el contenido endoluminal del apéndice, quedando las capas apendiculares rechazadas hacia la periferia36.
Inflamación y vascularización de la pared apendicularEn la ecografía se traduce en un incremento del flujo Doppler en la pared del apéndice39. Es un signo específico, pero de sensibilidad limitada, ausente en la apendicitis gangrenosa y que se puede detectar sin necesidad de que el apéndice esté inflamado con los equipos de alta gama (fig. 2). En la TC hay realce de la pared del apéndice, que se ve mejor con los equipos de TC de energía dual, que detectan mejor la inflamación aguda con las imágenes monoenergéticas a 50kV 40. En la RM se ve hiperintensidad de señal en T2 con restricción en la difusión15.
Apéndice no comprimibleEl dolor coincidiendo con la presión del transductor sobre el apéndice (signo de Mc Burney positivo) o la presencia de un apéndice que no se puede comprimir son signos de AA en la ecografía36,37.
Inflamación de la grasa periapendicularEs el mejor criterio diagnóstico de AA. En la ecografía se ve como un aumento de la ecogenicidad de la grasa periapendicular37,41,42 (figs. 2-4), en la TC como un aumento de la atenuación y en la RM se ve como una hiperintensidad de señal en T2, sobre todo en secuencias de supresión grasa.
Esquema de las capas apendiculares en la ecografía. Representación esquemática de las capas apendiculares en la ecografía. A) Esquema del apéndice normal. Las capas con fibra muscular (muscularis mucosa y muscular propia) son hipoecogénicas y la superficie mucosa, submucosa y serosa se muestran hiperecogénicas. El apéndice normal habitualmente presenta una morfología ovalada en los cortes axiales. A1-A2) Imágenes de ecografía en cortes axial y longitudinal del apéndice normal. La superficie mucosa presenta gas que sugiere permeabilidad (flecha). La capa submucosa es fina (asterisco). B-B1) Esquema e imagen axial de una apendicitis aguda. Engrosamiento de la capa submucosa (asterisco), pérdida de la capa mucosa y colapso de la luz apendicular (flecha), e hiperecogenicidad de la grasa del mesoapéndice (estrella). C-C1) Esquema e imagen sagital de una apendicitis aguda con discontinuidad de la capa submucosa (cabezas de flecha), que indica una probable apendicitis gangrenosa. D) Esquema de una apendicitis aguda donde predomina el contenido endoluminal. D1-D2) Imágenes axial y sagital con modo Doppler color. Apéndice en el que predomina el contenido endoluminal. Submucosa hiperémica (asterisco) rechazada hacia la periferia.
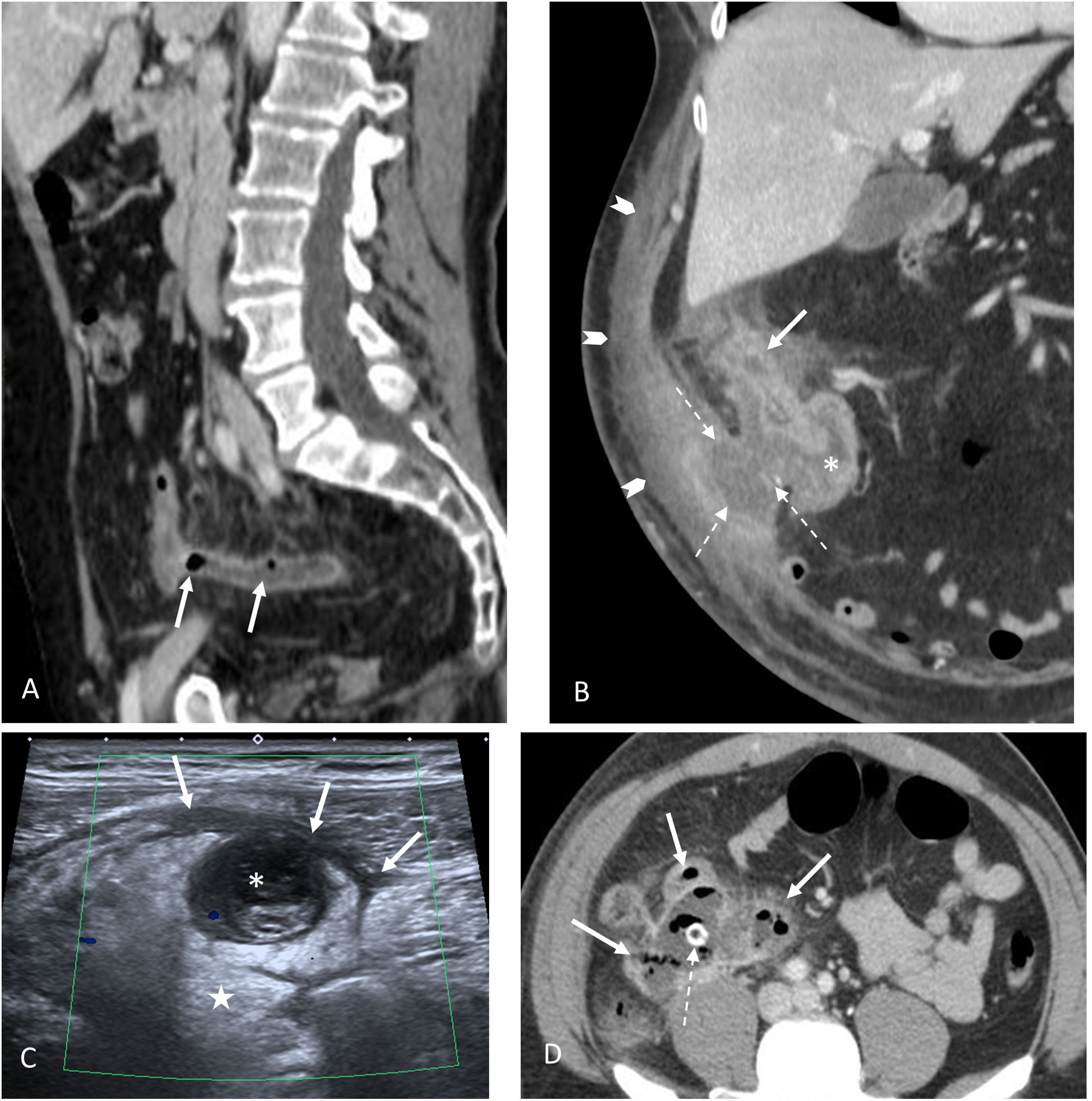
Apendicitis aguda complicada. A) Apendicitis gangrenosa. Imagen sagital de TC con CIV. La presencia de gas (flechas) en el seno de un apéndice inflamado es altamente indicativa de una apendicitis gangrenosa. B) Apendicitis complicada con fístula a la pared abdominal. Imagen coronal de TC con CIV. Apéndice desestructurado en localización subhepática (flecha continua) con marcados cambios inflamatorios en el ciego (asterisco). Asocia una fístula hacia la pared abdominal anterior y un absceso (flechas discontinuas). Extensa celulitis de la pared abdominal anterior (cabezas de flecha). C) Apendicitis perforada. Ecografía abdominal. Pérdida completa de las distintas capas apendiculares. Luz ocupada por contenido ecogénico (asterisco) en continuidad con láminas de líquido libre (flechas) y marcados cambios inflamatorios en la grasa periapendicular (estrella). D) Absceso de origen apendicular. Gran absceso abdominal con burbujas aéreas en su interior (flechas continuas). Aunque el apéndice no es distinguible la presencia de un apendicolito en su interior (flecha discontinua) delata su origen apendicular.
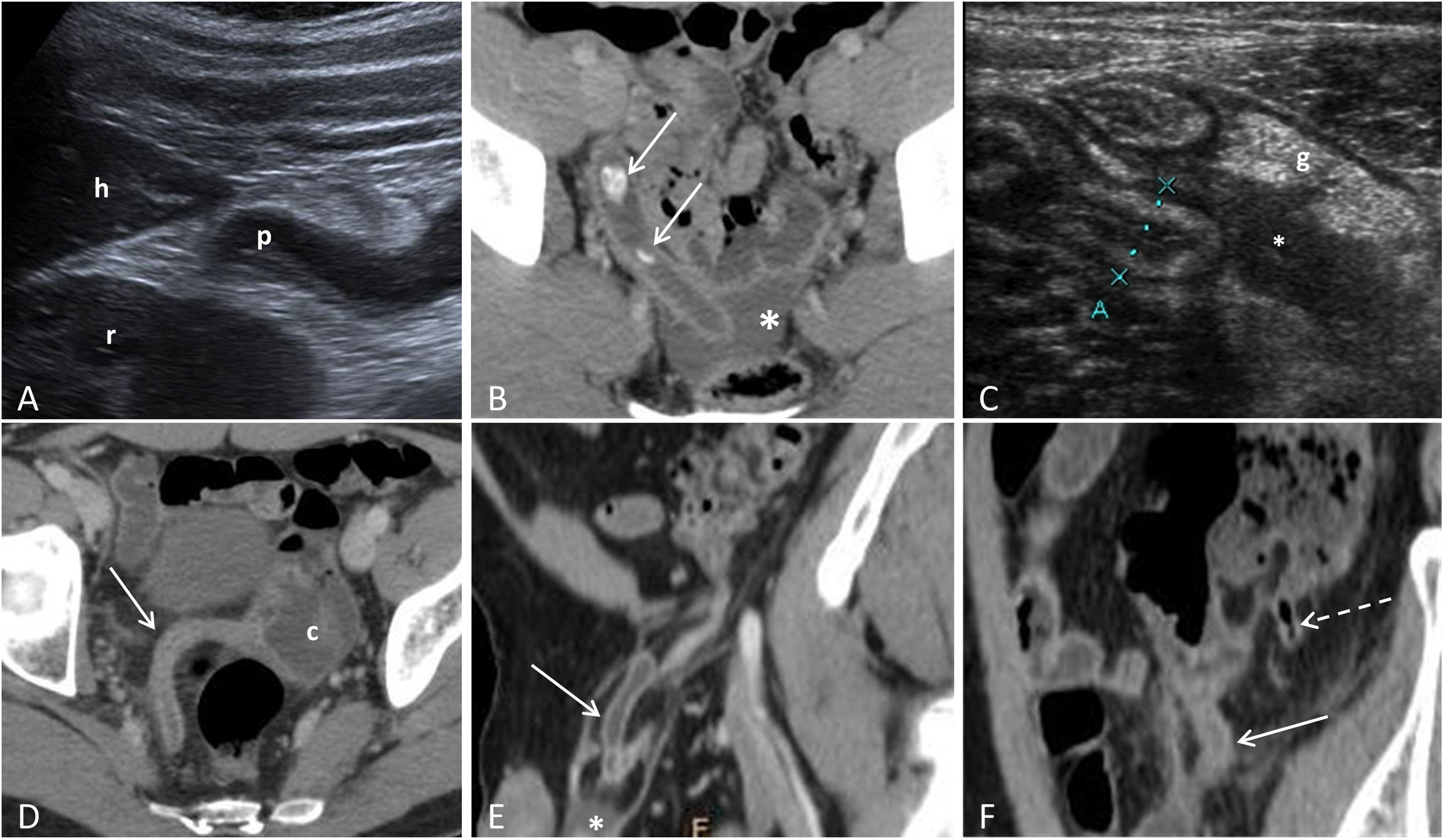
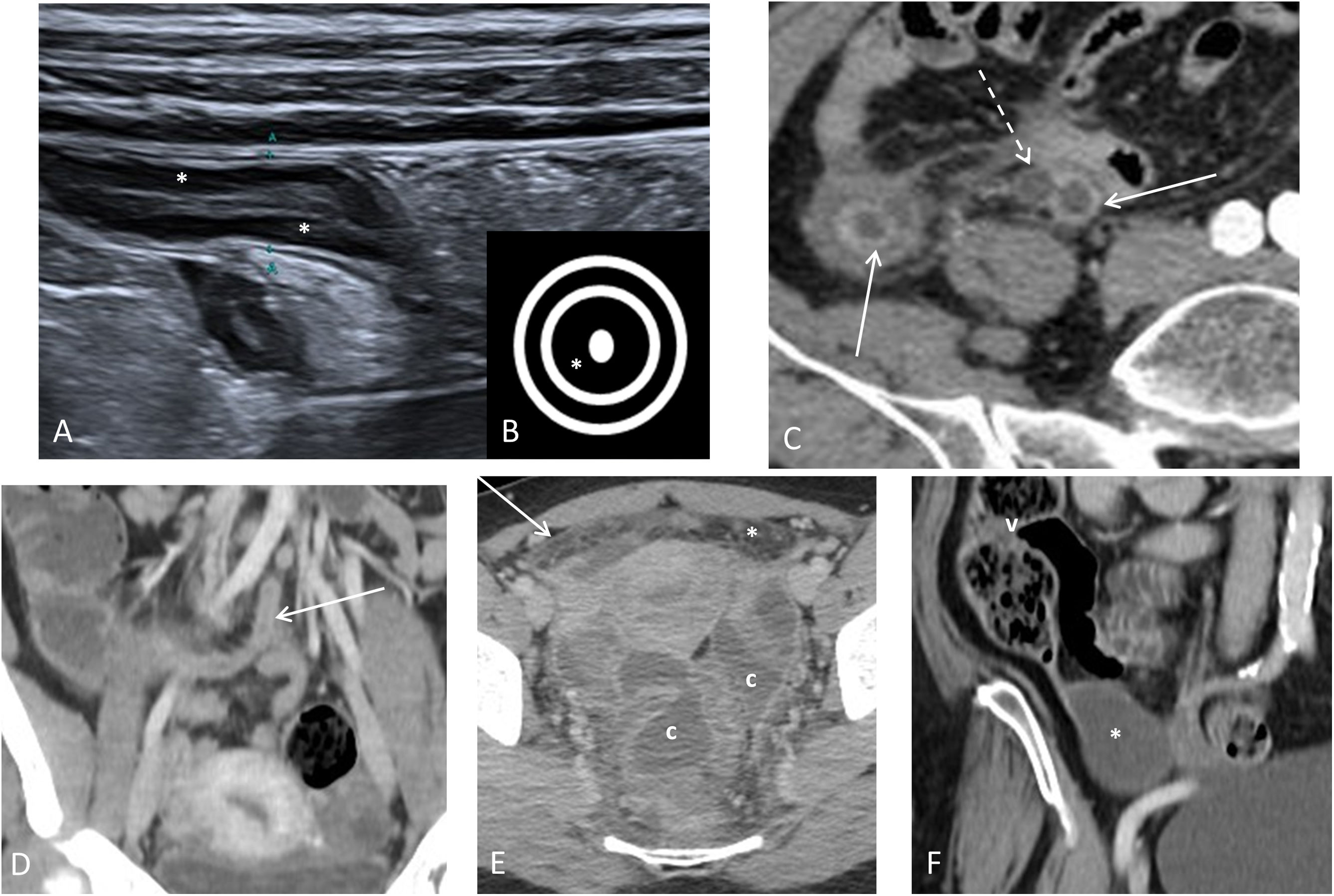
Presentaciones atípicas de la apendicitis aguda. A) Apendicitis subhepática: imagen sagital de ecografía donde identificamos la punta apendicular (p) adyacente al borde hepático inferior (h) y al riñón derecho (r). B) Apendicitis aguda pélvica: TC con CIV, donde se observa el apéndice con punta en localización presacra con líquido libre adyacente (asterisco) y 2 apendicolitos (flechas) en su interior. C) Apendicitis del muñón apendicular: corte sagital de ecografía mostrando el muñón apendicular (marcado por los cursores) con engrosamiento parietal con predominio de la submucosa. Asocia líquido libre (*) e hiperecogenicidad de la grasa periapendicular (g). D) Apendicitis aguda en un paciente con malrotación intestinal: TC con CIV, en el que observamos el ciego (c) en la hemipelvis izquierda y el apéndice cecal inflamado (flecha). E) Apendicitis aguda en una hernia de Amyand: TC con CIV que muestra el apéndice inflamado dentro de una hernia inguinal derecha (flecha), así como una pequeña cantidad de líquido libre (*). F) Apendicitis aguda en un paciente con duplicidad apendicular: TC con CIV donde vemos 2 apéndices vermiformes, uno con signos de apendicitis aguda (flecha continua) y el otro normal (flecha discontinua).
Clásicamente, el gas ha sido considerado un criterio de exclusión de AA, siendo sinónimo de permeabilidad. Sin embargo, el gas asociado a otros signos de AA es un fuerte indicador de apendicitis gangrenosa (fig. 3)43. Los apendicolitos por sí solos no son sinónimo de apendicitis. En un trabajo reciente se detectaron en el 4% de los pacientes asintomáticos y en el 40% de los pacientes con AA, asociándose a una mayor tasa de complicaciones (figs. 3 y 4)44.
Engrosamiento del ciegoPuede ser difuso o focal. Si el engrosamiento coincide con la salida del apéndice, es más específico de AA. El engrosamiento del íleon terminal en las AA es poco frecuente y suele ser leve, con escasa hiperemia. Si predomina la afectación del íleon hay que valorar la posibilidad de enfermedad de Crohn45.
Ganglios reactivosNormalmente son menores de 5mm en la región ileocecal. Si son mayores de 1cm o tienen centro necrótico, hay que pensar en otros procesos patológicos46.
Presentaciones atípicas de la apendicitis agudaLocalizaciones atípicasEl apéndice es un órgano intraperitoneal libre, solo unido al colon adyacente por el mesoapéndice. Esto hace que su ubicación con relación al ciego pueda variar: retrocecal ascendente (65%), pélvico (31%), retrocecal transverso (2,5%), paracecal ascendente preileal (1%) y paracecal ascendente postileal (0,5%)2. También puede ubicarse en lugares atípicos como el espacio subhepático, pélvico, dentro de una hernia inguinal (hernia de Amyand), dentro de una hernia femoral (hernia de Garengeot) o incluso en casos raros de malrotación, localizarse en el cuadrante inferior izquierdo2 (fig. 4). La variabilidad de su ubicación explica que su identificación sea más difícil con ecografía47. La clave diagnóstica para localizar el apéndice en las distintas modalidades de imagen es identificar el complejo íleon/válvula ileocecal, ya que la salida del apéndice es constante y normalmente se sitúa 3 o 4cm caudal a la válvula ileocecal, en el mismo lado del íleon terminal.
Apendicitis de la puntaPuede comenzar con obstrucción luminal a distancia de su orificio de salida, por lo que la inflamación puede limitarse solo a la punta del apéndice, siendo normal su base y cuerpo. Es fundamental explorar todo el apéndice en la ecografía y considerar completar con TC cuando el apéndice no se ve en toda su longitud en pacientes clínicamente sospechosos48.
Duplicación apendicularAunque es rara, la duplicación apendicular es una de las anomalías congénitas del apéndice más frecuentes. La clasificación más utilizada es la de Cave-Wallbridge modificada (fig. 4)49. En estos casos, se recomienda la apendicectomía de ambos apéndices, aunque solo uno presente apendicitis.
Apendicitis del muñónEs la inflamación del tejido apendicular remanente tras una apendicectomía incompleta (fig. 4). Puede ocurrir desde 2 semanas hasta varias décadas después de la cirugía. Se considera un factor de riesgo un muñón apendicular mayor de 5mm. La sintomatología es la de una AA, pero su diagnóstico y tratamiento se retrasan, dado el antecedente de apendicectomía previa, por lo que son más frecuentes las complicaciones50,51.
Patología apendicular imitadora de apendicitisAumento de calibre del apéndice sin apendicitisCualquier contenido dentro del apéndice, como el gas o el contenido fecal, pueden aumentar su diámetro y es importante valorar otros signos asociados de AA. El mucocele apendicular es una distensión del apéndice por moco que es secundario a una obstrucción crónica, hiperplasia mucosa o neoplasia subyacente. Suele ser asintomático y no hay afectación de la grasa periapendicular52 (fig. 5). La hiperplasia linfoide, frecuente en niños y adolescentes, típicamente asociada con procesos inflamatorios, puede presentar un apéndice no compresible con un leve aumento del diámetro apendicular. En la ecografía no hay desestructuración de las capas y presenta un predominio relativo de la capa central hipoecogénica que corresponde a la lámina propia o muscularis mucosa, en lugar de estar engrosada la submucosa, que es lo que ocurre en la AA53.
Patología apendicular imitadora de apendicitis. A) Hiperplasia linfoide: imagen de ecografía del apéndice en su eje longitudinal, con leve aumento de su diámetro por engrosamiento de la capa muscularis mucosa que es hipoecogénica (*). B) Representación esquemática de la hiperplasia folicular del apéndice en un corte transversal con engrosamiento de la muscularis mucosa (*). C) Diverticulitis apendicular: TC con CIV que muestra un engrosamiento parietal del apéndice con hiperrealce (flechas continuas); en su porción distal se observa el divertículo (flecha discontinua). D y E) Enfermedad inflamatoria pélvica (EIP) con afectación inflamatoria del apéndice por contigüidad: TC con CIV en un corte coronal (D). El apéndice se muestra levemente engrosado e hipercaptante; corte axial (E) en la pelvis de la misma paciente, muestra signos de EIP: hiperdensidad y trabeculación de la grasa pélvica (*), realce fino del peritoneo (flecha) y colecciones con realce periférico (c). F) Mucocele apendicular: TC con CIV. Dilatación quística del apéndice (*) compatible con un mucocele, sin cambios inflamatorios periapendiculares. Válvula ileocecal (v).
La presencia de divertículos en el apéndice cecal es rara (< 3%) y generalmente adquirida. Es asintomática salvo que se produzca la inflamación/perforación de alguno de estos divertículos (fig. 5). Suele presentarse en individuos de mayor edad (> 30 años) y con mayor duración de los síntomas (1-13 días). Es 4 veces más frecuente la perforación que en la AA54.
Endometriosis apendicularLa endometriosis apendicular afecta al 0,4-1% de las mujeres, mientras que su prevalencia entre las pacientes con endometriosis es del 4 al 22%. La clínica es inespecífica, siendo el dolor pélvico cíclico crónico el más típico. En la ecografía se ve como un engrosamiento nodular hipoecoico del cuerpo o punta del apéndice que se origina de la serosa e invade la capa muscular sin alterar la estructura de capas intestinales55. El diagnóstico también puede sospecharse con la RM, apareciendo el apéndice hiperintenso en secuencias T1 y T1 con supresión grasa, compatible con una señal hemorrágica. En la TC, puede verse como un nódulo realzado en la pared sin ninguna característica específica56.
Tumores apendicularesSon raros, aproximadamente el 0,5-1% de las piezas de apendicectomía51, siendo el carcinoide el más frecuente (32-57% de los tumores apendiculares)52. La mayoría se encuentra en el tercio distal del apéndice, como un pequeño nódulo o engrosamiento focal en la TC. La mayor parte constituye un hallazgo incidental en la pieza de apendicectomía. Del resto de los tumores, se deben destacar las neoplasias epiteliales (adenoma, neoplasias apendiculares mucinosas), cuya manifestación fundamental es el mucocele (fig. 5), que debemos sospechar ante la presencia de calcificaciones lineales o cuando el diámetro apendicular sea mayor de 15mm 57,58.
Apendicitis reactivaEs secundaria a otros procesos inflamatorios abdominales y no requiere apendicectomía, ya que la causa de la inflamación no se origina en el apéndice. Ocurre en casos de enfermedad próxima al apéndice (ciego e íleon), pero puede ser secundaria a otros procesos más difusos como la enfermedad inflamatoria pélvica (fig. 5) o la peritonitis. La afectación del apéndice en la enfermedad de Crohn supone un importante reto diagnóstico. En un trabajo publicado por Ripollés el al.45 el apéndice se encuentra inflamado en un 21% de los pacientes con enfermedad de Crohn e incluso puede mostrar una leve hiperemia en la ecografía. Un engrosamiento de la pared del íleon terminal mayor de 5mm y la presencia de flujo Doppler color en la pared del íleon apoyan el diagnóstico de enfermedad de Crohn frente a AA.
Apendicitis complicadaLa imagen diagnóstica ha contribuido a un importante descenso de las apendicectomías negativas, pero no ha habido una disminución de las apendicitis complicadas. Quizás la apendicitis simple y complicada son procesos patológicos distintos, con causa y comportamientos diferentes5,10.
Es importante describir en nuestro informe si la AA es complicada ya que:
- -
El tratamiento médico puede considerarse como una opción terapéutica en algunas apendicitis no complicadas3.
- -
Las complicaciones graves pueden necesitar laparotomía abierta en lugar de laparoscopia.
- -
Los abscesos pueden requerir drenaje percutáneo antes de la cirugía.
Aunque hay diferentes trabajos que asocian signos ecográficos indicativos de apendicitis complicada como la pérdida de la morfología normal con colecciones y líquido complicado periapendicular (fig. 3)59, en general, la apendicitis complicada se valora mejor con TC60,61. Además de los signos de AA complicada se han descrito signos que predicen un fracaso del tratamiento antibiótico (como presencia de apendicolitos o un apéndice dilatado> 13mm1).
Signos de apendicitis complicada- -
Flemón: masa inflamatoria de partes blandas que rodea el apéndice.
- -
Absceso (fig. 3): un absceso apendicular muestra una pared periférica realzada en la TC con contraste intravenoso o un anillo hiperémico periférico con Doppler color en la ecografía. Es el signo más específico de perforación y representa la complicación más frecuente de la apendicitis perforada. La presencia de un apendicolito dentro de la colección es casi patognomónica de un absceso apendicular.
- -
Defectos de realce de la pared: este signo tiene una precisión diagnóstica del 96%.
- -
Aire extraluminal: burbujas de gas fuera del apéndice. Signo muy específico (98%), pero con baja sensibilidad (22-35%).
- -
Apendicolito extraluminal: muy específico (100%), pero poco sensible (32%) (fig. 3).
- -
Apendicitis gangrenosa. La presencia de gas asociado a otros signos de AA es un importante marcador de apendicitis gangrenosa43 (fig. 3).
- -
Pileflebitis: infección ascendente a través del drenaje venoso portomesentérico, que puede producir trombosis venosa y absceso hepático.
- -
Fístulas: complicación rara de la AA perforada y puede afectar al intestino, vejiga, vagina o a la pared abdominal adyacente (fig. 3).
- -
Peritonitis difusa: poco frecuente y ocurre cuando no hay adherencias locales tras la perforación del apéndice que contengan la infección. Es más frecuente en niños y se ve como líquido libre ecogénico o con realce peritoneal en la TC.
- -
Otras complicaciones: la AA complicada puede producir uropatía obstructiva u obstrucción intestinal secundaria a la afectación del uréter derecho y del íleon terminal, respectivamente.
La imagen es fundamental en el diagnóstico de la AA. En niños y embarazadas debe hacerse primero ecografía, seguida de la RM en casos dudosos. En adultos, la estrategia de ecografía inicial y TC solo en ecografías no concluyentes ha demostrado tener alta precisión diagnóstica con importante disminución de la radiación. El radiólogo, además de conocer los criterios diagnósticos, debe saber reconocer las presentaciones atípicas, la enfermedad apendicular simuladora de la AA, e incluir en su informe los signos de AA complicada, debido a que los abscesos pueden requerir drenaje antes de la cirugía y al cambio de paradigma que plantea la posibilidad de un manejo no quirúrgico en casos no complicados.
AutoríaTodos los autores declaran haber contribuido sustancialmente en todos los aspectos de elaboración del manuscrito:
1.En la concepción y el diseño del estudio, o la adquisición de datos, o el análisis y la interpretación de los datos;
2. En la elaboración del borrador del artículo o la revisión crítica del contenido intelectual, y
3. en la aprobación definitiva de la versión que se presenta.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.