Editado por: Dr. José Luis del Cura Rodríguez - Servicio de Radiodiagnóstico, Hospital Universitario Donostia, Donostia-San Sebastián, España
Más datosLa ablación por radiofrecuencia (ARF) es un método bien conocido, seguro y eficaz para tratar los nódulos tiroideos benignos, los cánceres tiroideos recurrentes, así como los adenomas de paratiroides, con resultados prometedores en los últimos años. Los dispositivos empleados y las técnicas básicas para la ARF fueron introducidos por la Sociedad Coreana de Radiología de Tiroides (KSThR) en 2012, si bien la ARF se ha aprobado en todo el mundo, con avances posteriores tanto en dispositivos como en técnica.
El objetivo de esta revisión es instruir a los radiólogos intervencionistas que pretendan realizar, o que ya estén realizando, intervenciones de ARF, así como especialistas en tiroides y paratiroides que brinden atención pre y postoperatoria, acerca de la capacitación, la ejecución y el control de calidad de la ARF de los nódulos tiroideos y adenomas paratiroideos, para optimizar la eficacia del tratamiento y la seguridad del paciente.
Radiofrequency ablation is a well-known, safe, and effective method for treating benign thyroid nodules and recurring thyroid cancer as well as parathyroid adenomas that has yielded promising results in recent years. Since the Korean Society of Thyroid Radiology introduced the devices and the basic techniques for radiofrequency ablation in 2012, radiofrequency ablation has been approved all over the world and both the devices and techniques have improved.
This review aims to instruct interventional radiologists who are doing or intend to start doing radiofrequency ablation of thyroid and parathyroid lesions, as well as thyroid and parathyroid specialists who provide pre- and post-operative care, in the training, execution, and quality control for radiofrequency ablation of thyroid nodules and parathyroid adenomas to optimize the efficacy and safety of the treatment.
Los nódulos tiroideos (NT) son lesiones definidas dentro de la glándula tiroides, radiológicamente distinguibles del parénquima tiroideo circundante. Su incidencia ha aumentado en las últimas décadas al hacerlo, el uso de las pruebas de imagen diagnósticas. Estas lesiones están presentes en el 20-76% de la población general adulta cuando se evalúan mediante ecografía1–4.
Estos NT pueden deberse a diversas enfermedades tiroideas y extratiroideas, pero, en general, se deben a enfermedad tumoral de carácter benigno o maligno, siendo la causa más frecuente de NT benigno el nódulo coloide, mientras que el hallazgo de un nódulo maligno (5%) corresponde principalmente a un carcinoma papilar3.
La mayoría de los NT son benignos y asintomáticos, y no requieren tratamiento, únicamente seguimiento para su manejo. Sin embargo, algunos nódulos requieren tratamiento por el crecimiento sintomático de los mismos, problemas estéticos o posibilidad de transformación maligna4–10.
Hasta hace poco tiempo, las opciones de tratamiento se limitaban a la cirugía para los NT benignos sintomáticos y la terapia con yodo radiactivo, el carbimazol o la cirugía para el tratamiento de los NT con funcionamiento autónomo (AFNT)7–14.
Con respecto a los adenomas paratiroideos, suponen la causa más común de hiperparatiroidismo primario (pHPT), con una incidencia del 80-85%15. El pHPT es un trastorno endocrino primario del metabolismo mineral, con una prevalencia del 0,1 al 0,4%, siendo más frecuente en el sexo femenino16,17. Este trastorno endocrino es causado por la síntesis y la secreción excesiva de hormona paratiroidea (PTH), con el consecuente aumento del calcio sérico16–20.
Casi el 20% de los pacientes con pHPT son asintomáticos detectados durante las pruebas bioquímicas de rutina16,20. Los órganos dianas centrales de los niveles anormalmente altos de la PTH son el hueso y los riñones, presentando una alta incidencia de complicaciones tales como cálculos renales, enfermedad ósea grave, fracturas, deterioro neurocognitivo o enfermedad cardiovascular, requiriendo en estos casos tratamiento15,21,22.
Las pautas de tratamiento actuales recomiendan la paratiroidectomía como tratamiento «gold standard» para los pacientes con pHPT17,19,21, siendo curativa en el 95% de los casos cuando es llevada a cabo por un cirujano experto4. Sin embargo, aunque es generalmente segura, en pacientes de 65 años o más se ha reportado un aumento de la morbimortalidad postoperatoria asociado a complicaciones como infección de la herida, hemorragia postoperatoria, lesión del nervio laríngeo recurrente, hipocalcemia e hipoparatiroidismo persistente12,21.
Durante la última década, se han propuesto varias técnicas guiadas por ecografía mínimamente invasivas para el tratamiento de los NT y los adenomas paratiroideos en aquellas situaciones en las que el paciente rechaza el abordaje quirúrgico o en las que la cirugía está contraindicada11.
La ablación por radiofrecuencia (ARF) es una técnica mínimamente invasiva con acceso percutáneo que se ha utilizado para tratar los nódulos benignos de las glándulas tiroides y paratiroides17, considerándose al principio una alternativa a la cirugía, pero progresivamente la importancia de la ARF como una opción de tratamiento está creciendo, tanto para los nódulos benignos sólidos y parcialmente quísticos como para el cáncer de tiroides recurrente4.
Se ha demostrado que la ARF es una técnica eficaz para disminuir el volumen medio del nódulo, con pequeñas tasas de complicaciones y una marcada mejoría de los síntomas relacionados con los nódulos4.
Esta revisión describe y analiza los dispositivos actuales y las técnicas avanzadas para la ARF de la enfermedad endocrina tiroidea y paratiroidea.
IndicacionesLas principales indicaciones se encuentran en las directrices y declaraciones emitidas por las siguientes entidades1:
- 1.
Sociedad Coreana de Radiología de la Tiroides (KSThR), 2009, directriz del 2011 y del 201723,24.
- 2.
Declaración de opinión de los expertos italianos del 201525.
- 3.
Guía de 2016 de la Asociación Estadounidense de Endocrinólogos Clínicos (ACCE).
- 4.
Guía de 2016 del American College of Endocrinology (ACE).
- 5.
Directriz de 2016 de Associazone Medici Endocrinology (AME)26.
- 6.
Directriz de 2016 del Instituto Nacional para la Excelencia en la Salud y la Atención (NICE) (https://www.nice.org.uk/guides/ipg562).
- 7.
Declaración oficial de la Asociación Austríaca de Tiroides 2016 (https://www.kup.at/kup/pdf/13399.pdf).
A grandes rasgos, las principales indicaciones son:
Nódulos tiroideos benignosLa ARF está indicada en pacientes con NT benignos mayores de 2cm, que se quejan de problemas estéticos o síntomas compresivos relacionados con el tamaño del nódulo, tales como presión en el cuello, dolor, disfagia, sensación de cuerpo extraño, malestar, abultamiento del cuello y tos5.
En términos de tamaño o volumen del nódulo, no se han establecido aún criterios definidos para la ARF tiroidea4–6. En estos casos, la ARF está indicada para mejorar los problemas clínicos al reducir el tamaño del nódulo6.
La necesidad de tratamiento de los NT va a depender de los síntomas o los problemas estéticos de cada paciente, que varían según la circunferencia del cuello o la ubicación del nódulo tiroideo. Los pacientes con una circunferencia del cuello más pequeña tienden a quejarse de problemas cosméticos mucho antes que aquellos con cuellos más gruesos.
Nódulos tiroideos tóxicosAlrededor del 5-10% de los NT benignos pueden experimentar un desarrollo progresivo hasta convertirse en NT tóxicos o AFTN y secretar una cantidad anormalmente alta de hormonas tiroideas27.
Los AFTN es la segunda causa más común de hipertiroidismo, que ocurre con mayor frecuencia en mujeres mayores, ya que estos nódulos degeneran con la edad27.
Muchos ensayos han demostrado la eficacia y la seguridad del tratamiento de los nódulos tóxicos con ARF. En un gran ensayo multicéntrico, Sung et al.28 demostraron una mejoría significativa de los síntomas de hipertiroidismo junto con niveles de TSH normalizados en el 81,8% de los pacientes del estudio, sin el desarrollo de hipotiroidismo después de la ARF.
Desde las directrices coreanas en 2012, el consenso para ARF de AFTN ha evolucionado. Actualmente, en el tratamiento de los nódulos tóxicos, es mejor reservar la ARF como tratamiento de segunda línea en pacientes que rechazan la terapia convencional o cuando está contraindicada, pudiendo considerarse como tratamiento de primera línea en nódulos de pequeño tamaño, ya que se observa una respuesta óptima (mejoría de los síntomas y normalización de la TSH) cuando el nódulo se reduce de tamaño en más del 80%27.
Nódulos tiroideos malignos y cáncer tiroideo recurrenteLa ARF se puede realizar con fines curativos o paliativos en los cánceres de tiroides recurrentes según las últimas directrices establecidas por la KSThR en 20174. La ARF curativa para el cáncer recurrente alude al tratamiento completo de cualquier tumor recurrente visible en la ecografía. La ARF paliativa se puede aplicar cuando se considera que la reducción de tamaño por ARF puede reducir los síntomas y mejorar la calidad de vida de un paciente, incluso si no es posible la extirpación radiológicamente completa4,5.
Para el cáncer de tiroides primario, la cirugía es el tratamiento primordial; sin embargo, la guía del 2017 recomienda considerar la ARF en pacientes seleccionados (es decir, en pacientes que rechazan la cirugía o que no pueden someterse a una operación por sus comorbilidades); aun así, sigue siendo una herramienta experimental que requiere más investigación debido a la insuficiente literatura publicada hasta hoy4–6.
Afectación ganglionar tumoralCon respecto a los ganglios linfáticos cervicales metastásicos en el diagnóstico inicial de cáncer de tiroides, el tratamiento de elección a día de hoy es la extirpación quirúrgica29. Aunque el tratamiento quirúrgico sigue considerándose el tratamiento «gold standard» para la recurrencia del cáncer de tiroides y la afectación ganglionar tumoral, existen pautas o consensos que consideran la ablación térmica como tratamiento de rescate, en las que se deben cumplir las siguientes condiciones29:
- –
Afectación ganglionar cervical tumoral recurrente después de un tratamiento quirúrgico radical.
- –
Las pruebas de imagen diagnósticas sugieren metástasis y se confirma mediante punción aspiración con aguja fina (PAAF).
- –
El paciente no es candidato óptimo para tratamiento quirúrgico o rechaza este tratamiento.
- –
El tratamiento con yodo 131 es ineficaz para los ganglios linfáticos metastásicos o los pacientes se niegan a tomar dicho tratamiento.
Algunos pacientes con pHPT sintomático rechazan la cirugía o son candidatos inadecuados para la intervención quirúrgica por sus comorbilidades asociadas, siendo en estos casos los tratamientos mínimamente invasivos guiados por ultrasonido una opción terapéutica alternativa para el tratamiento de las lesiones paratiroideas accesibles por ecografía21,22.
Evaluación previa al procedimientoLa ecografía es la modalidad de diagnóstico por imágenes más común para evaluar las lesiones nodulares tiroideas y paratiroideas, planificar el diagnóstico del paciente y guiar el tratamiento mínimamente invasivo4.
Los pacientes, antes del procedimiento, deben estar correctamente informados sobre los objetivos a alcanzar con esta técnica y, en caso de nódulos grandes, el operador debe alertar al paciente sobre la posibilidad de retratamiento2.
Los NT deben confirmarse como benignos en al menos 2aspiraciones con aguja fina guiadas por ecografía (PAAF) o biopsia con aguja gruesa (BAG) antes de la ARF5,6. Sin embargo, el diagnóstico benigno único en la PAAF o la BAG es suficiente cuando el nódulo tiene características ecográficas muy específicas de benignidad, como son el nódulo espongiforme isoecoico o los nódulos parcialmente quísticos con artefacto de cola de cometa intraquístico, los cuales tienen un riesgo de malignidad muy bajo6.
Con respecto al protocolo de estudio previo al procedimiento de los adenomas paratiroideos, incluye prelocalizar dichas lesiones mediante pruebas de imagen, resaltando el papel de los ultrasonidos en primera línea, pero, sobre todo, el papel de la gammagrafía de paratiroides con tecnecio-99m sestamibi15,30,31, que se realiza de rutina para la localización de los adenomas, con una sensibilidad elevada (80-100% en el caso de los adenomas únicos). En casos dudosos o de difícil diagnóstico, disponemos en segunda línea de la tomografía computarizada (TC) por emisión de fotón único sestamibi marcado con tecnecio 99-m (99mTc-sestamibi SPECT), el Octreoscan y la TC con contraste IV, que nos dan una visión anatómica más precisa, permitiendo una mejor localización de las glándulas paratiroideas anormales de ubicación ectópica18,22,30,31.
Es importante recalcar que dicho tejido paratiroideo anormalmente funcional debe ser visible por ultrasonidos para poder llevar a cabo la ARF el operador especialista. Las glándulas paratiroides normales suelen tener un tamaño aproximado de 5mm, difícilmente evidenciables por ecografía al ser isoecogénicas con respecto al tiroides. Ahora bien, en el caso del adenoma paratiroideo se hace evidente por la ecogenicidad alterada y el aumento de tamaño, observándose típicamente como estructuras sólidas, ovaladas, bien circunscritas, hipoecoicas con respecto al tejido tiroideo adyacente. Además, suelen estar separados del tiroides por una banda hiperecoica de tejido conectivo.
Procedimiento de ablación por radiofrecuenciaEl tratamiento, generalmente de forma ambulatoria, tiene lugar en un quirófano con una mesa rígida articulada o bien en salas de ecografías acondicionadas que dispongan de pantalla de monitorización de los signos vitales del paciente durante toda la intervención.
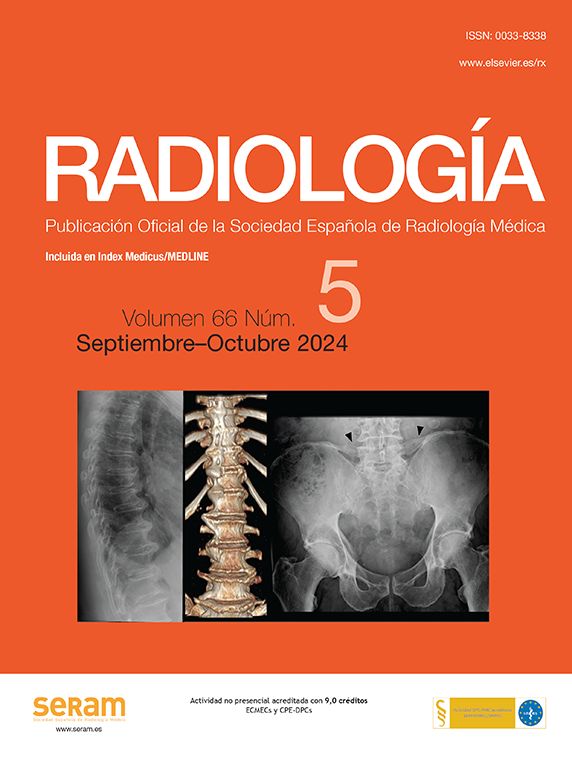
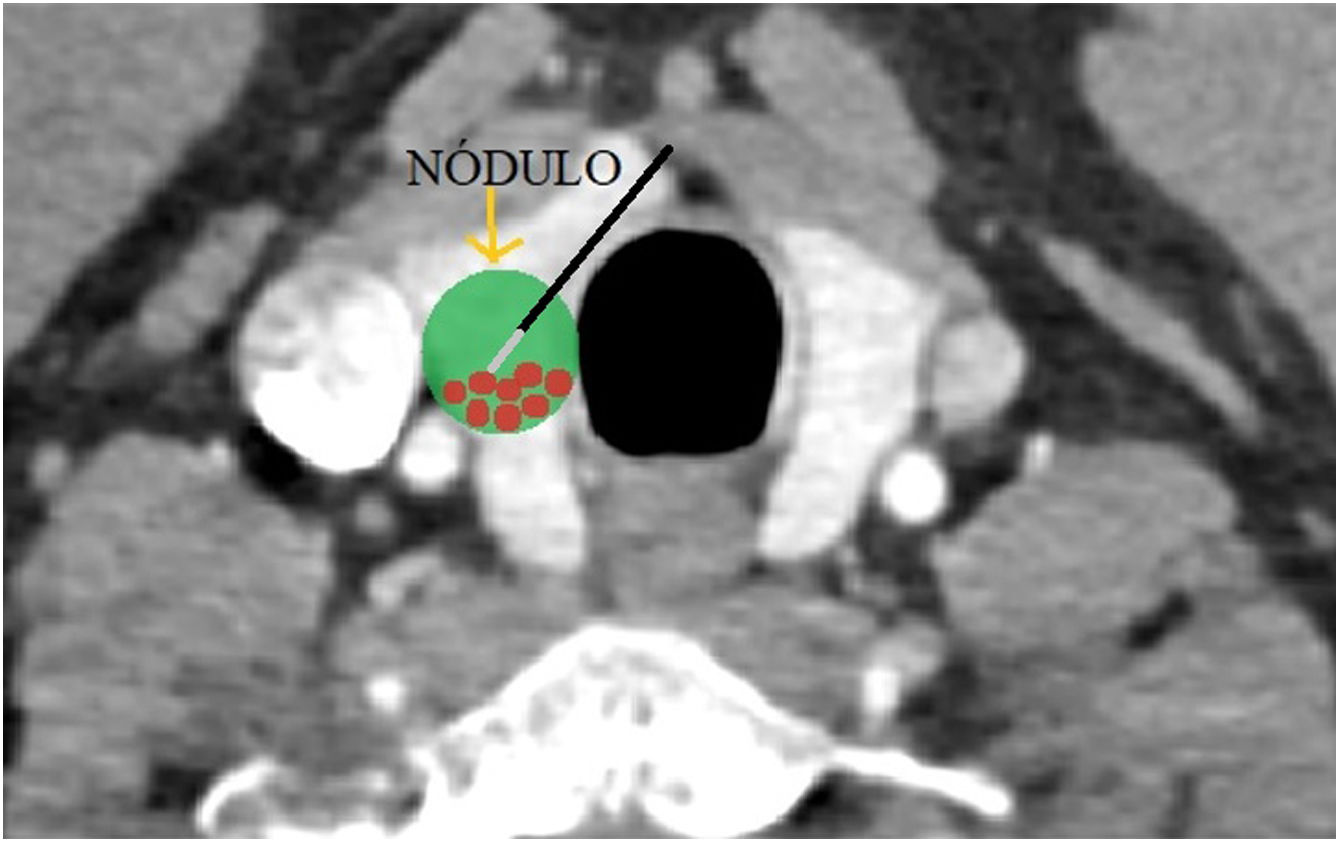
El paciente se coloca en decúbito supino con extensión del cuello y el operador, situado a la cabecera del mismo, evalúa la posición del nódulo y selecciona el abordaje más adecuado utilizando una sonda lineal de alta frecuencia para monitorizar y guiar el procedimiento de ablación, en todo momento bajo estrictas condiciones de asepsia3,19,22 (fig. 1).
Este procedimiento tiene lugar con anestesia local y opcionalmente sedación consciente, ya que es condición indispensable la colaboración del paciente durante toda la intervención mediante la monitorización de la voz para poder identificar posible lesión del nervio laríngeo recurrente.
Después de la esterilización adecuada, se identifican los vasos ubicados a lo largo del trayecto de acceso y se inyecta anestesia local en el sitio de la punción cutánea21.
La ARF de las lesiones de cuello es más segura de ejecutar mediante abordaje transístmico e hidrodisección.
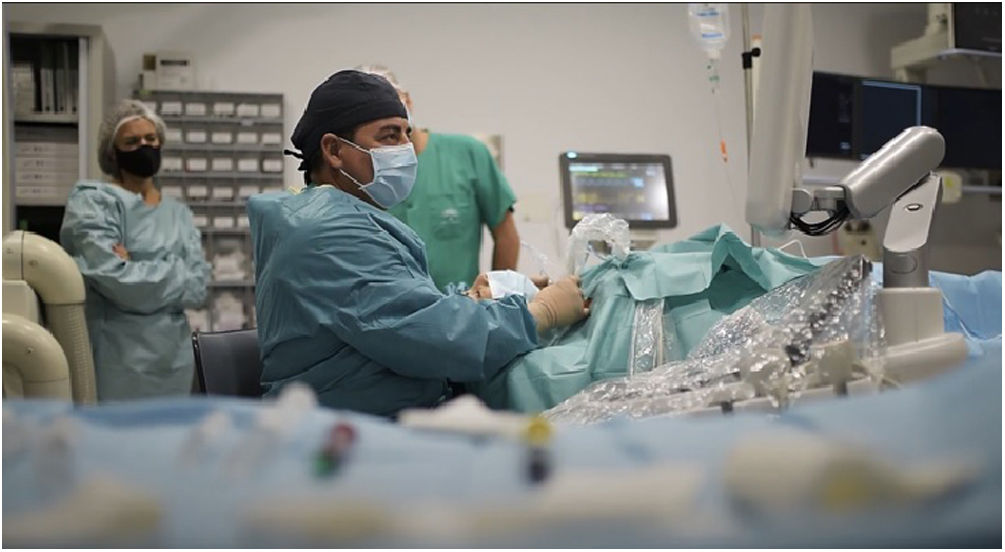
En este abordaje transístmico el electrodo de RF se inserta a través del istmo tiroideo, desde la línea media, siguiendo una dirección lateral para el tratamiento de la lesión objetivo3,19 (fig. 2).
Existen varias ventajas a través de este abordaje transístmico. En primer lugar, la posición del electrodo a través del istmo da soporte y estabilidad incluso cuando el paciente habla o mediante la deglución. En segundo lugar, con este abordaje se busca minimizar la exposición al calor del nervio laríngeo recurrente, ya que el operador puede controlar la relación entre el electrodo, la lesión objetivo y el nervio, el cual se encuentra en el llamado «triángulo de peligro», espacio entre la tráquea y la glándula tiroides. El control constante por ultrasonidos de la relación de la punta activa del electrodo y el nervio laríngeo recurrente es de vital importancia para prevenir posibles lesiones térmicas durante el procedimiento. Por último, el parénquima ístmico normal entre el nódulo diana y el sitio de abordaje del electrodo evita la fuga de líquido caliente en el área peritiroidea, que también es causa de dolor3,21.
De la misma manera, la comprensión de la anatomía del cuello es esencial para mejorar la eficacia de la ablación por RF en el tratamiento de lesiones tiroideas y paratiroideas. El cuello es relativamente estrecho y contiene muchas estructuras críticas, entre ellas, el nervio laríngeo recurrente, la arteria carótida, el esófago y la tráquea; por lo tanto, en determinadas ocasiones es difícil tratar una lesión por completo3. La técnica de hidrodisección (fig. 3) consiste en la inyección de un suero glucosado frío al 5%, ya que la solución salina normal es un fluido iónico y es capaz de conducir la electricidad, entre la lesión objetivo a tratar y las estructuras adyacentes, creando un margen de seguridad para aislar el nódulo y evitar lesiones térmicas en las estructuras críticas circundantes9,15,17,19,20.
Aspectos técnicos del equipo de radiofrecuenciaCaracterísticas de la ablación por radiofrecuenciaLa ARF consiste en la inserción percutánea de un electrodo en un nódulo. Esta técnica utiliza como principio físico el calor generado por la formación de una corriente eléctrica alterna de alta frecuencia, que oscila entre 200kHz y 1.200kHz, transmitida desde la punta del electrodo que se encuentra conectado a un generador de radiofrecuencia externo. Estas ondas de RF pasan a través del electrodo, agitan los iones de los tejidos de alrededor de la punta activa y, en consecuencia, se produce un aumento de temperatura. La resistencia eléctrica del tejido al ser mayor que la del metal del electrodo, produce calor denominado «calor por fricción» (efecto Joule), con la consecuente necrosis coagulativa y daño celular irreversible cerca del electrodo a temperatura entre 50-100°C2.
Es importante tener en cuenta que, a la hora de administrar la RF, además del calor por fricción, la conducción del calor provoca necrosis tardía en zonas más distales. Con todo esto, se puede predecir el tamaño de la necrosis que va a depender del tamaño de la punta activa del electrodo, de la potencia seleccionada y del tiempo de tratamiento2.
DispositivosHa habido numerosos avances en los dispositivos de ARF para el tratamiento de NT y paratiroideos.
Existen múltiples sistemas de RF, pero todos constan básicamente de un generador eléctrico, un electrodo y una placa de retorno. El generador posee un detector que registra la resistencia e impedancia de los tejidos, de esta forma destruye la lesión objetivo con gran precisión (fig. 4).
Este generador eléctrico de radiofrecuencia va conectado a un electrodo refrigerado internamente. Los primeros estudios de ARF en NT se realizaron con una aguja de electrodo recta de 17 G, enfriada internamente con una punta activa de 1cm o con electrodos expandibles de múltiples dientes de calibre 14 G para obtener un área de ablación más amplia. Posteriormente se desarrollaron agujas para electrodos de múltiples puntas (0,5, 1 y 1,5cm) más delgadas (18 G o 19 G), enfriadas internamente, específicamente para lesiones tiroideas, para facilitar el control de la aguja y minimizar la lesión tisular normal29.
En nuestro centro, debido a que tanto la glándula tiroides como aún más las glándulas paratiroides son relativamente pequeñas y están situadas superficialmente, utilizamos generalmente electrodos modificados más cortos y delgados que los electrodos convencionales utilizados para otros órganos, de 7cm de longitud y calibre 18 G, con múltiples puntas activas de 0,5 a 1,5cm, que se enfrían mediante una bomba peristáltica de circulación de agua32. Estas pequeñas puntas activas permiten un tratamiento más preciso con un daño tisular colateral mínimo de las estructuras adyacentes.
Este dispositivo cuenta, además, con al menos una placa de retorno, que generalmente se coloca en el muslo del paciente, para maximizar la superficie de contacto y poder crear un circuito eléctrico cerrado, en el caso de sistemas monopolares.
Técnicas de ablación térmicaLa ARF de los NT fue desarrollada desde el 2002 por el profesor Baek, un radiólogo intervencionista del Centro Médico Asan en Seúl1.
La ARF puede ser utilizada por tecnología mono o bipolar, siendo la técnica monopolar la más comúnmente usada.
Ablación por RF monopolar1Para este procedimiento se necesitan una o 2placas de retorno, según el procedimiento, colocadas ventralmente en los muslos del paciente, que actúan como un gran electrodo dispersivo que permite que la corriente pase a través del paciente, activando el electrodo como un circuito1. Estas placas de retorno no suponen ninguna molestia para el paciente.
El daño térmico causado por la RF depende de la temperatura conseguida en el tejido y la duración del calentamiento. Cuando una corriente alterna alcanza los 460-500kHz fluye desde el generador, entre el electrodo y las placas, por lo que ocurre una agitación iónica en el tejido, siendo esto convertido por medio de la fricción en calor, resultando una lesión termal focal en el tejido alrededor de la punta activa del electrodo.
Los generadores de RF actuales pueden automáticamente ajustar el poder de salida para poder optimizar la energía depositada durante el tratamiento de ablación. Cuanta mayor densidad de corriente rodea la aguja del electrodo, más energía es depositada en el tejido, incrementando, por lo tanto, la cantidad de ablación. Cuando la temperatura alcanza los 46°C se produce un daño celular irreversible en la lesión objetivo, pero no necrosis. Cuando la temperatura alcanza los 50-52°C, solo 4 a 6min son necesarios para inducir un efecto citotóxico, con la consecuente necrosis de coagulación y un daño termal irreversible a las células debido a la pérdida de la actividad enzimática citosólica y mitocondrial.
Ablación por RF bipolarLa ARF bipolar es una técnica comparativamente nueva, apareciendo los primeros estudios publicados desde 20163, que simplifica el procedimiento respecto a la ARF monopolar, ya que no se requieren almohadillas de conexión a tierra. Estas almohadillas son necesarias en los dispositivos de ARF monopolar, ya que la corriente eléctrica recorre el cuerpo del paciente. En contraposición, en la ARF bipolar se emplea un electrodo que contiene polos positivos y polos negativos en la punta y que dirige el flujo de corriente únicamente a través del tejido de la lesión a tratar, eliminando así la condición de disipación de corriente1.
De esta manera, la corriente de alta frecuencia que se crear entre ambos polos origina un campo de calor relativamente esférico dentro del cual el tejido se sobrecalienta y a medida que disminuye la cantidad de agua del tejido del nódulo a tratar, aumentan la resistencia eléctrica y la potencia del dispositivo se regula hacia abajo. Así limita la corriente eléctrica al área que rodea el electrodo bipolar dando como resultado un tamaño y una forma más predecibles de la zona de ablación3.
Respecto de esta técnica, aunque parece más fácil de dominar, ya que la punta del electrodo solo necesita colocarse en unas pocas ubicaciones dentro del nódulo, también de manera dirigida, en la actualidad aún faltan resultados a largo plazo1.
Trucos y claves técnicas en la termoablaciónEn todo procedimiento de ARF se produce una serie de efectos sobre la lesión objetivo y hay una serie de características propias de la zona donde se debe realizar la ablación que pueden alterar este procedimiento. Dichas alteraciones pueden ser beneficiosas o perjudiciales y las podemos utilizar para controlar zonas sensibles. Cabe destacar:
- 1.
El enfriamiento que provoca el flujo sanguíneo de un vaso adyacente a la zona a ablacionar es protector, por lo que, por una parte, puede dejar una estructura sin quemar completamente, y por otro lado puede proteger una estructura sensible. Este fenómeno se observa fácilmente a la hora de la ablación de NT porque tenemos la arteria carótida contigua; nos podemos acercar a este vaso debido al enfriamiento por el flujo sanguíneo, si bien hay que controlar el nervio vago y, en caso de que esté cerca, llevar a cabo hidrodisección mediante la instilación de suero glucosado.
- 2.
La transmisión de la RF se hace a través de líquidos o tejidos ionizados, porque se trata de electricidad, por lo que la interposición de suero glucosado, como hemos explicado anteriormente, protege por aumento de distancia y por aislamiento eléctrico y no conducción (doble protección), en contraposición, por ejemplo, con la ablación con microondas, que solo protege por distancia.
En conclusión, estas situaciones físicas las debemos de tener en cuenta y usarlas a nuestro favor para evitar posibles lesiones.
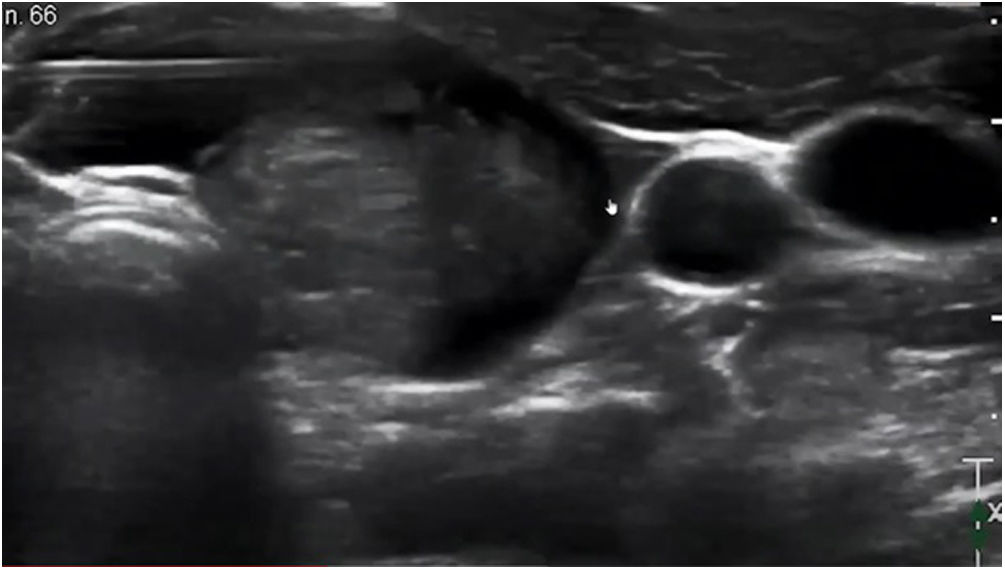
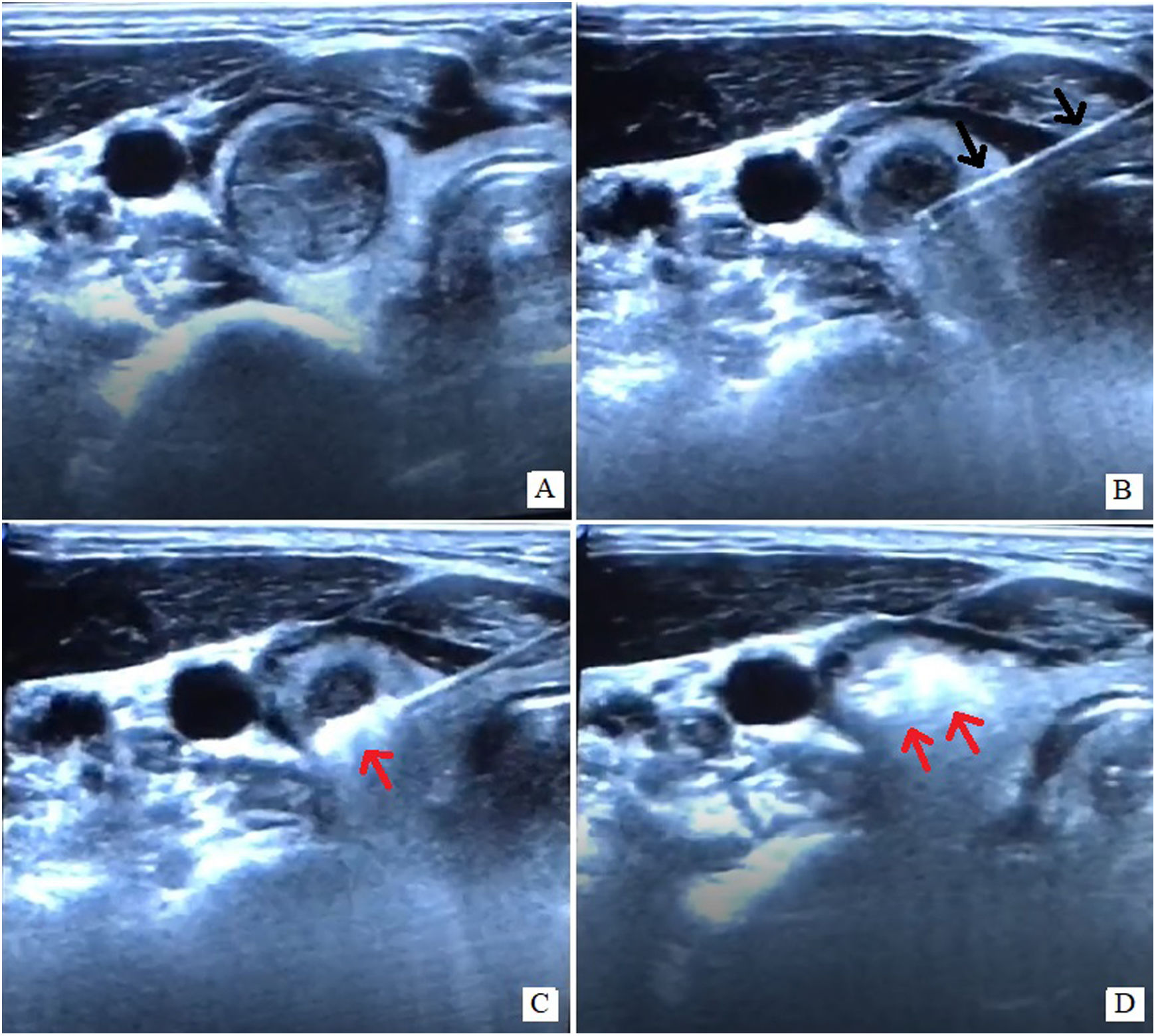
Monitorización de la aguja durante el procedimientoDurante la RF de tiroides y paratiroides la técnica primordialmente utilizada es la denominada «moving shot» (fig. 5); es un método seguro y eficaz, que consiste en la ablación de múltiples áreas secuenciales dentro de la lesión objetivo, unidad por unidad, moviendo la punta del electrodo, partiendo del área más profunda de la lesión y retrocediendo a zonas más centrales y de allí a la más superficial3.
Esta técnica puede ser difícil para los principiantes, ya que requiere una monitorización constante de la ubicación de la punta, mientras que sincrónicamente se mueve y se mantiene el electrodo dentro del nódulo objetivo durante la ablación. Hay varios motivos por los que la monitorización de la punta podría resultar difícil durante el procedimiento, siendo uno de ellos la zona hiperecoica transitoria con sombra acústica posterior causada por el gas generado por el calor durante la ablación que interfiere con la ventana sónica1,3 (fig. 6).
Imágenes ecográficas representativas de un procedimiento de ablación por radiofrecuencia. Nódulo tiroideo sólido de 2,5cm de eje mayor (A). Inserción percutánea del electrodo de RF (flechas negras) mediante abordaje transístmico con la punta de la aguja en el polo inferior y posterior del nódulo (B). Se inicia la radiofrecuencia, tras la cual aparece una nube hiperecogénica transitoria (flechas rojas) que nos indica la correcta ablación (C), llevando a cabo una ablación secuencial dentro de la lesión objetivo mediante la técnica de «moving shot» hasta asegurarnos la completa ablación (D).
El desvío de la punta del electrodo fuera del nódulo objetivo podría causar una lesión térmica a las estructuras vulnerables adyacentes, dando lugar a complicaciones graves, por ello la vital importancia de la correcta monitorización de la punta del electrodo durante el procedimiento.
Seguimiento del pacienteSe considera un éxito del procedimiento la obtención de una ablación completa tras someterse a una intervención adecuada según el protocolo16.
Tanto en el seguimiento de la enfermedad tiroidea como paratiroidea, el protocolo de seguimiento funcional desde el punto de vista endocrino es el mismo que el protocolo posquirúrgico.
Los exámenes ecográficos de seguimiento generalmente se llevan a cabo a 1, 3, 6 y 12 meses, y cada 6 a 12 meses después. La mayoría de las revisiones bibliográficas consideran un seguimiento de 3 a 6 meses y de un año. Se ha evidenciado una reducción del volumen medio del 47-84% a los 3 meses y del 62-93% al año. Si bien la mayor parte de la reducción del volumen de la lesión ablacionada se observa en los 3 a 6 primeros meses, el tamaño del nódulo sigue disminuyendo gradualmente hasta un año33.
Basándonos en nuestra experiencia personal, en el caso de los NT benignos se busca una disminución del tamaño del nódulo ablacionado para controlar fundamentalmente la sintomatología compresiva. Para ello, en una primera instancia en nuestro centro se valoraba a cada paciente al mes, a los 6 meses y al año postablación, pasando hoy en día a realizarse una ecografía de control a los 6 meses y al año, ya que hemos verificado en nuestros seguimientos que no es hasta los 6 meses tras la intervención cuando se evidencia una disminución significativa del volumen del nódulo tratado con obtención de una curación completa o cuando se objetiva que dicha lesión no está totalmente tratada con la necesidad de una nueva reablación.
De la misma manera, en el seguimiento de tumores de tiroides recurrentes y NT tóxicos se busca una ablación completa desde el punto de vista funcional, mientras que en el seguimiento por imagen se busca una ablación completa de la zona ablacionada pudiendo evidenciarse en ecografías de control de tejido residual, pudiendo ser necesaria una nueva ablación de control.
Con respecto a la estrategia evaluación tras la ablación de un adenoma paratiroideo, es fundamentalmente bioquímica; no se sigue por ecografía, y solo se completa con pruebas de imagen funcionales según la evolución.
En nuestro centro consiste en un control analítico precoz, en las primeras 24h postablación, de la PTH y el calcio sérico, donde se demuestra una corrección de ambos parámetros en caso de un adecuado tratamiento y, posteriormente, control analítico de los niveles séricos de PTH, calcio, albúmina corregida y vitamina D al mes, a los 3 meses, a los 6 meses y al año.
Es importante resaltar que al mes postintervención es factible la evidencia de una PTH sérica persistentemente elevada o en el rango alto de la normalidad con un calcio sérico corregido. Este hallazgo que podría estar en relación con la activación del resto de las glándulas paratiroideas, hasta ahora latentes por dicho adenoma hiperfuncionante, considerándose un efecto rebote tras la caída del calcio sérico postablación que condiciona un aumento de la PTH.
ComplicacionesGeneralmente, la ARF es una técnica segura y tiene una baja incidencia de complicaciones (2%). Para lograr mejores resultados en términos de reducción de volumen de la lesión objetivo, así como bajas tasas de complicaciones, es fundamental la experiencia del operador2,19.
Es importante reconocer las posibles complicaciones de esta técnica, las cuales se subdividen en eventos menores y mayores4,14.
Entre las complicaciones menores notificadas se incluyen hematomas, vómitos, quemaduras en la piel, edema y dolor. El dolor durante el procedimiento es el efecto secundario más comúnmente reportado2,4,5, existiendo varios grados de dolor en la parte inferior del cuello, que a veces el paciente refiere que se irradia a la cabeza, las orejas, el hombro, el pecho, la espalda o los dientes. La mayoría de los pacientes toleran bastante bien el dolor y se alivia rápidamente6.
El hematoma, causado por una lesión mecánica de los vasos debido a la inserción del electrodo, puede desarrollarse en las localizaciones peritiroidea, subcapsular e intranodular; sin embargo, por lo general se puede tratar con una simple compresión del cuello durante 30min a 2h y aplicación de hielo, y la mayoría de los hematomas desaparecen en 1 o 2 semanas6.
Entre las complicaciones consideradas mayores se incluyen lesiones nerviosas, como lesión del nervio laríngeo recurrente, ganglio simpático cervical, plexo braquial y nervio espinal accesorio, así como, entre otras, rotura de nódulos e hipotiroidismo/hipoparatiroidismo permanente5,14.
La rotura del nódulo es la segunda complicación más importante de la ARF, que se presenta como un abultamiento súbito del cuello y dolor en el sitio de ablación durante el seguimiento. Se considera que el mecanismo de rotura se debe a la expansión aguda del volumen de un nódulo debido a una hemorragia tardía o un desgarro en la pared de la lesión. La ecografía o la TC generalmente muestran una rotura de la cápsula tiroidea, con un abultamiento del tumor hacia la parte anterior del cuello. En la mayoría de los casos se tratan de manera conservadora, con antibióticos o analgésicos, pero puede requerirse tratamiento quirúrgico en caso de formación de abscesos6.
Se deben destacar, entre dichas complicaciones mayores postablación, los cambios en la voz transitorios o permanentes, como consecuencia de la lesión térmica del nervio laríngeo recurrente, considerándose unas de las complicaciones más graves y más comúnmente reportadas después de la ARF, según el estudio de Kim et al6. La lesión térmica directa del nervio, el estiramiento del nervio sobre la inflamación del tiroides o el hematoma en el nervio contra la tráquea podrían ser posibles mecanismos que causan cambios en la voz durante el procedimiento6. Como hemos detallado anteriormente, se recomienda el enfoque transístmico y el aislamiento líquido mediante la técnica de hidrodisección, ya que desempeña un papel clave en la protección del nervio laríngeo recurrente y sus tejidos circundantes, y el establecimiento de una barrera reduce significativamente la incidencia de complicaciones6.
De esta manera, para evitar complicaciones es obligatoria la monitorización continua y cautelosa guiada por ecografía de la punta del electrodo durante todo el procedimiento.
ConclusiónEn definitiva, este trabajo proporciona un resumen de la literatura actual planteándose la ARF como una posible alternativa cada vez más eficiente, segura y eficaz con respecto a las terapias tradicionales en pacientes con enfermedad tiroidea y paratiroidea que no son candidatos a la cirugía o que rechazan la misma.
FinanciaciónNo se han recibido subvenciones ni otras fuentes de ayuda en la realización del trabajo.
Autoría- 1.
Responsable de la integridad del estudio: FGP
- 2.
Concepción del estudio: PPN
- 3.
Diseño del estudio: PPN
- 4.
Obtención de los datos: PPN
- 5.
Análisis e interpretación de los datos:: al tratarse de un estudio de revisión fue necesario el análisis e interpretación de los datos.
- 6.
Tratamiento estadístico: N/A
- 7.
Búsqueda bibliográfica: FGP
- 8.
Redacción del trabajo: PPN
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: FGP
- 10.
Aprobación de la versión final: FGP y PPN
Los autores declaran no tener ningún conflicto de intereses.