La enfermedad periodontal, especialmente la periodontitis crónica, es una enfermedad infecciosa crónica caracterizada por un proceso destructivo inflamatorio que afecta a los tejidos de soporte del diente, produce reabsorción del hueso alveolar, formación de bolsas periodontales, y finalmente pérdida de los dientes1. Se han aislado numerosas especies de bacterias en la placa subgingival, y se piensa que algunas de ellas están estrechamente asociadas con la presentación y progreso de la enfermedad2. Como la mayoría de las bacterias periodontopatógenas residen en las bolsas periodontales y no invaden el tejido periodontal, el sistema inmunitario no puede eliminarlas nunca de forma eficiente. Esta situación única conduce a inflamación crónica y a una respuesta continua y excesiva del huésped, lo que finalmente causa destrucción tisular3. La respuesta local del huésped frente a estas bacterias incluye reclutamiento de leucocitos y la consiguiente liberación de mediadores de la inflamación y citoquinas. Esto parece jugar un papel crucial en la patogénesis de la enfermedad periodontal4-6 y puede a su vez dar lugar a una sobrerregulación de las metaloproteinasas de matriz (MMPs), lo que conduce al fracaso de los tejidos periodontales3.
Son muchas las evidencias que han demostrado que las MMPs juegan un papel vital en la destrucción del tejido periodontal7-9. En extractos tisulares y cultivos de tejidos de encías humanas inflamadas se ha observado una mayor actividad de la colagenasa que en encías humanas sanas. También se ha visto que la actividad de la colagenasa en el fluido gingival (FG) está aumentada y que esto correlaciona con la gravedad de la enfermedad periodontal. En gingivitis y periodontitis experimental también aumenta la actividad de la colagenasa en las encías enfermas y en el FG10. Por otro lado, las MMPs pueden sufrir una sobrerregulación por distintas citoquinas proinflamatorias, factores de crecimiento y factores de virulencia bacterianos10-12. Sin embargo, sigue siendo dudoso el mecanismo exacto que subyace en la manifestación anómala de las MMPs en las zonas de destrucción periodontal.
Además de por las citoquinas, las MMPs podrían sufrir también una sobrerregulación por acción del inductor de las metaloproteinasas de la matriz extracelular3,13,14 (EMMPRIN). El EMMPRIN es una glicoproteína de transmembrana que pertenece a la familia de las inmunoglobulinas. Su peso molecular oscila entre 44 y 66 kilodaltons (KD) de acuerdo con los diferentes patrones de glicosilación15. El EMMPRIN presenta una amplia distribución en los tejidos y se ha demostrado su expresión en células de tumores malignos15, células T activadas16, diferentes macrófagos17 y el epitelio pigmentario de la retina18, así como en el endometrio19 y en los queratinocitos humanos normales20. El EMMPRIN está involucrado en la invasión de tumores y en las metástasis, en el desarrollo y reparación de los tejidos, en la artritis reumatoide, en las enfermedades cardiovasculares y en la inflamación mediante la sobrerregulación de la expresión de las MMPs14,21,22.
Teniendo en cuenta que se ha demostrado que las MMPs juegan un papel crucial en el proceso patológico de la periodontitis8,9 y que el EMMPRIN puede funcionar como un simulador de MMPs14, se planteó la hipótesis de que el EMMPRIN podría estar involucrado en la sobrerregulación de la expresión de las MMPs, facilitando así la degradación de la matriz extracelular en la periodontitis23.
Los experimentos en este estudio se centraron en investigar la expresión del EMMPRIN en tejidos gingivales humanos sanos e inflamados y en evaluar si el nivel de EMMPRIN sufre una sobrerregulación en la encía enferma.
Método y materiales
Sujetos y especímenes
Se recogieron especímenes gingivales inflamados en 21 sujetos que presentaban periodontitis crónica y que estaban siendo sometidos a cirugía periodontal en el Departamento de Periodoncia del Hospital Estomatológico de la Universidad de Wuhan. De estos sujetos, 8 eran mujeres y 13 hombres, con una edad media de 48,6 años (rango de 35,2 a 58,6 años). Como control se empleó encía de sujetos sanos. El grupo sano se constituyó con 5 varones y 4 hembras (edad media de 22,3 años; rango de 17,8 a 36,4 años) que presentaban profundidades de bolsa al sondaje menores de 3 mm, sin pérdida de inserción clínica, ni sangrado al sondaje ni signos radiológicos de pérdida de hueso. Estos individuos sanos eran voluntarios del departamento de Cirugía oral y Maxilofacial que estaban siendo sometidos a extracciones dentales por motivos ortodóncicos.
Todos los sujetos implicados eran no fumadores y presentaban al menos 20 dientes. Ninguno presentaba antecedentes de enfermedad sistémica ni había recibido tratamiento antibiótico u otras medicaciones, así como tampoco tratamiento periodontal en los últimos 4 meses. El estudio fue autorizado por el Comité de Ética en Investigación de la Escuela y Hospital de Estomatología, de la Universidad de Wuhan. Se aseguró a los sujetos que su tejido gingival sería empleado únicamente para esta investigación, y no para ninguna otra investigación biológica, incluyendo clonación humana o ingeniería tisular. También se les aseguró que toda la información concerniente al estudio que pudiera identificarles permanecería confidencial y sólo podría revelarse obteniendo previamente su permiso. Los voluntarios tuvieron libertad para abandonar el estudio en cualquier momento sin perjuicios. Todos los pacientes dieron su consentimiento informado antes de que fueran tomadas las muestras.
Preparación de los tejidos
Todos los tejidos gingivales recogidos se cortaron por la mitad; una mitad se almacenó a -70 ºC para el análisis Western blot, y la otra mitad se fijó inmediatamente en paraformaldehído al 4% disuelto en suero salino tamponado con fosfato (PBS), de pH 7,4, deshidratado en series de etanol, y embebido en parafina. Se obtuvieron cortes seriados (5 µm) mediante un microtomo. A continuación se retiró la cera de los cortes con xileno y se rehidrataron en etanol seriado.
Tinción inmunohistoquímica
Para bloquear los enlaces inespecíficos, se incubaron inicialmente los cortes en suero equino normal diluido 1:50 en solución salina tamponada con fosfato (PBS) conteniendo albúmina sérica bovina al 0,1% (Zhongstan) durante 20 min a temperatura ambiente. Los cortes se incubaron durante toda la noche a 4 ºC con anticuerpos monoclonales EMMPRIN (Zymed; prediluidos). A continuación se incubaron los cortes con inmunoglobulina G anti conejo de ratón biotinilada (IgG; Zhongstan) durante 30 min a 37 ºC. Esto fue seguido de incubación con un complejo avidita-biotina-peroxidasa (Zhongstan) durante 30 min a 37 ºC y una combinación de 3,3´tetrahidrocloruro de diaminobencidina (DAB) (Zhongstan) durante 5 min a temperatura ambiente. Entre cada paso, se lavaron los cortes con PBS 3 veces durante 5 min. Finalmente, se contratiñeron los cortes con hematoxilina Mayer, se deshidrataron en series de etanol, se aclararon en xileno y se montaron con su cubreobjetos.
Se sustituyeron el suero de ratón no inmunizado y el PBS por anticuerpos primarios en los cortes control negativos. Se emplearon tejidos de carcinoma de células escamosas orales como control positivo para comprobar la precisión de la tinción de los anticuerpos EMMPRIN.
Análisis de imagen
Se empleó el software Imagine Pro Plus (IPP) 5.02 (Media Cybernetics) para facilitar el análisis estadístico de los resultados de la inmunohistoquímica. El área se representó como las áreas de expresión positiva, y la densidad óptica integrada (DOI) como nivel de expresión. El área e IOD de cada corte se cuantificaron con la herramienta Macro del IPP.
Western blot
La proteína total se aisló de la encía con T-PER Tissue Protein Extraction Reagent (Pierce) siguiendo las instrucciones del fabricante. Brevemente, tras pesar las muestras de tejido, se añadieron 10 µm de reactivo T-PER por cada 1 mg de tejido y se homogeneizaron. Los tejidos homogeneizados se centrifugaron a 14.000 rpm a 4 ºC durante 10 min hasta conseguir bolitas de tejido. Se recogió el sobrenadante en un tubo Eppendorf. Se cuantificó la concentración de proteínas con un kit de ácido bicinconícico (BCA) (Sangon). Cada muestra de proteína (50 µm/línea) se sometió a gel de electroforesis de poliacrilamida dodecil sulfato sódica al 10% (SDS-PAGE) a 70 V durante 2 h. Se empleó PageRuler Prestained Protein Ladder (Fermentas) para las determinaciones de peso molecular. Después se aplicó electroblott sobre una membrana de transferencia de difluoruro de polivinilideno de Hybond (Amersham Biosciences) a las proteínas separadas, empleando un blotter humidificado. A continuación se lavaron las membranas una vez con 10 mmol/l de Tris-HCL (cloruro de hidrógeno), conteniendo 150 mmol/l de cloruro sódico y 0,1% de Tris-Buffered Saline Tween-20 (TBST), y se bloquearon durante 2 h en TBST conteniendo leche desnatada al 5% (peso/vol). Las membranas se incubaron con β-actina diluida al 1:1.000 (Pierce) o 2 µg/ml de anticuerpos EMMPRIN (Zymed) en TBST durante toda la noche a 4 ºC y a continuación se lavaron tres veces durante 10 min cada una con TBST para eliminar los anticuerpos sobrantes no unidos. Después se incubaron las membranas con una dilución de peroxidasa de cabra anti conejo (HRO) conjugada con anticuerpos IgG (Pierce) en TBST durante 2 h a temperatura ambiente. Después se lavaron las membranas y se colocaron encima.
Se detectaron anticuerpos empleando el sistema Western blot mejorado con quimioluminiscencia (Santa Cruz Biotechnology) siguiendo las instrucciones del fabricante. Los blots fueron expuestos a continuación a películas fotográficas (Kodak, Eastman Kodak); se cuantificó la densidad óptica de cada pista con el software Quantity One (Bio-Rad). El nivel de expresión relativa de EMMPRIN se representó como ODEMMPRIN/ODβ-actina.
Estadísticas
Todos los experimentos fueron realizados por triplicado. Se calcularon las medias y desviaciones estándares. Se examinó la significación estadística de las diferencias del nivel de la proteína EMMPRIN entre los 2 grupos mediante la prueba t de Student. Los resultados se consideraron significativos cuando el valor p fue menor de 0,05.
Resultado
Inmunohistoquímica
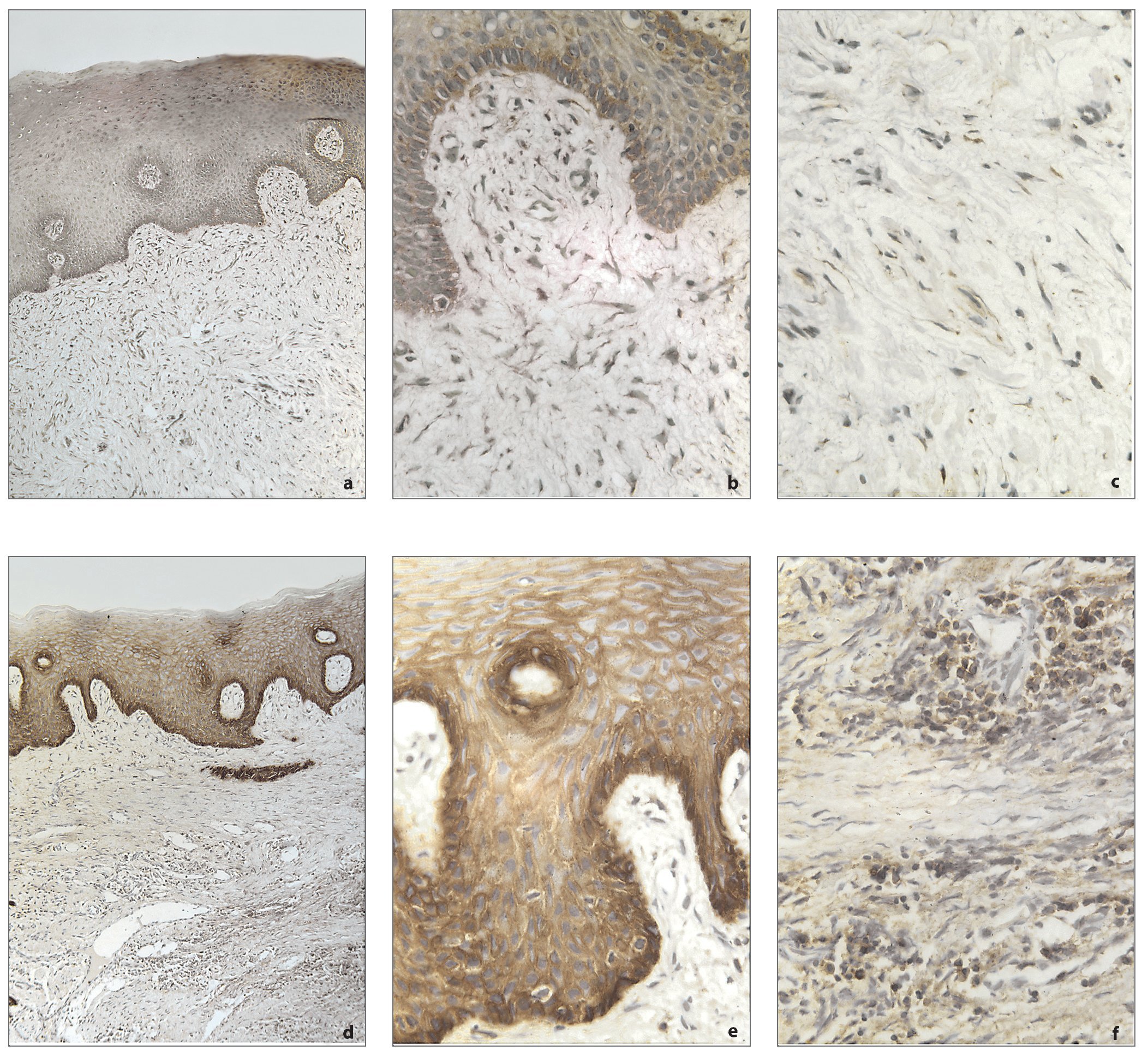
En encía normal, EMMPRIN se localizó fundamentalmente en las células epiteliales con un ligero incremento en el estrato basal, y la tinción positiva pudo observarse también en los fibroblastos del tejido conectivo adyacente (figs. 1a a 1c). En los cortes tisulares de la encía inflamada, los anticuerpos anti-EMMPRIN reaccionaron fundamentalmente frente a la membrana celular en todo el epitelio, mostrando una disminución gradual del nivel de expresión desde el estrato basal hasta el estrato córneo. EMMPRIN se expresó también ampliamente en el tejido conectivo bajo el epitelio, incluyendo los fibroblastos, células inflamatorias, células epiteliales vasculares y estroma (figs. 1d a 1f). Los controles negativo y positivo verificaron la especificidad del resultado de la tinción (datos no mostrados).
Figuras 1a a 1f. Distribución de EMMPRIN en encía humana sana (a a c) e inflamada (d a f). En encía sana, EMMPRIN se localizó fundamentalmente en los queratinocitos del epitelio (a, b); en el tejido conectivo adyacente, se observó también tinción positiva en los fibroblastos (c). En los cortes de tejidos gingivales inflamados, los anticuerpos anti-EMMPRIN reaccionaron principalmente contra la membrana celular del estrato basal y del estrato espinoso (d, e), y el nivel de expresión disminuyó gradualmente del estrato basal al estrato espinoso. En la figura 1e, puede observarse la expresión positiva de EMMPRIN en la membrana celular. En el tejido conectivo (f) EMMPRIN se expresó ampliamente en los fibroblastos y en las células inflamatorias. (10 aumentos originales en la figs. 1a y 1d; 40 aumentos en las figuras 1b, 1c, 1e y 1f).
El área e IOD medias, respectivas, de manifestación EMMPRIN tras el análisis IPP fueron 59,5 ± 5,7 y 3.000,6 ± 117,2 para la encía normal y 146,9 ± 22.661,2 ± 1.002,6 para la encía inflamada. La diferencia de área e IOD entre la encía normal y la encía inflamada fue estadísticamente significativa (p < 0,05 por área; p < 0,01 por IOD).
Western blot
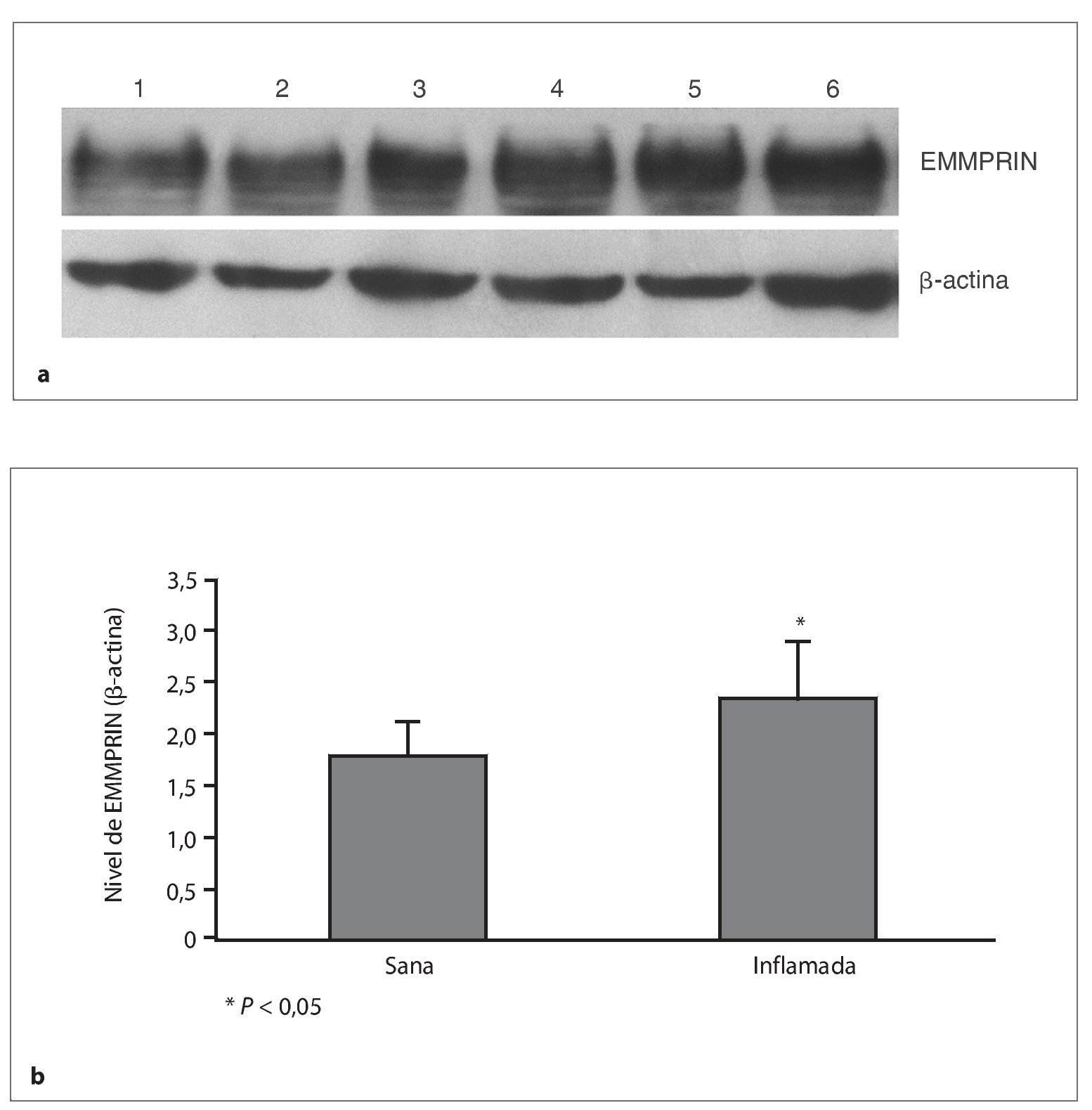
Se conjugó una banda de aproximadamente 55 KD con anticuerpos anti-EMMPRIN en encía humana sana y encía humana inflamada. En encía sana, el nivel de manifestación de EMMPRIN fue 1,81 veces mayor que el de β-actina, mientras que el nivel en encía inflamada fue significativamente más elevado (2,34 veces el de la β-actina; p = 0,032; fig. 2).
Figuras 2a y 2b. Expresión de EMMPRIN en encía humana sana e inflamada detectada por el Western blot. (a) Una banda de aproximadamente 55 KD se puede conjugar con anticuerpos anti-EMMPRIN tanto en encía sana (pistas 1 y 2) como en encía inflamada (pistas 3 a 6). (b) En encía sana, el nivel de expresión de EMMPRIN fue 1,81 veces mayor que el de β-actina; el nivel fue significativamente más elevado en la encía inflamada (p = 0,032).
Discusión
EMMPRIN se purificó originalmente a partir de la membrana plasmática de células cancerígenas en forma de glicoproteína y fue designada a continuación como factor estimulante de la colagenasa derivado de células tumorales24 (TCSF). Biswas et al, en 1995, le pusieron el nombre de metaloproteinasa de matriz celular, por su habilidad para estimular la síntesis de MMPs en el fibroblasto15.
Las especies homólogas de EMMPRIN incluyen la gp42/ basigina de ratón25, la 5A11/HT7/neurotelina de pollo16 y el antígeno M6 humano16. EMMPRIN se encuentra involucrado en numerosos sistemas fisiológicos y patológicos y exhibe varias características celulares y moleculares26, aunque una de las principales funciones de EMMPRIN es la sobrerregulación de varias MMPs27,28. Varios estudios han demostrado que la integridad de la matriz extracelular y de la membrana basal es importante para mantener la estabilidad de los tejidos periodontales29-31. La integridad tisular se mantiene por el complicado equilibrio entre la degradación de la matriz y su producción, que es regulada en gran parte mediante la acción de las MMPs tanto en el tejido normal en remodelación como en el tejido patológico9,32. La actividad de las MMPs se mantiene por medio de varios mecanismos de regulación, como la sobrerregulación a partir de sus inductores, los EMMPRIN14,33.
En el presente estudio, la proteína EMMPRIN se expresó principalmente en la membrana celular del epitelio gingival con un ligero aumento de la reactividad en el estrato basal. También se expresó en el tejido conectivo. Los resultados del Western blot probaron también la presencia de EMMPRIN en encía humana sana. Estos hallazgos fueron similares a los encontrados en muchos otros estudios anteriores20,34,35. La presencia de EMMPRIN en el epitelio gingival y tejido conectivo sanos probablemente refleja su capacidad para mantener el recambio normal de la matriz en estos tejidos normales, así como para iniciar el remodelamiento postraumático como inductor MMP.
El rasgo histopatológico más característico de la periodontitis es la destrucción de las fibras de colágeno y de otros componentes de la matriz extracelular en los tejidos periodontales. Es muy probable que en cierto grado esta destrucción esté mediada por las MMPs derivadas de las células del huésped, que son consideradas como iniciador clave de la degradación del colágeno en estas respuestas inflamatorias31,36. Se han demostrado elevados niveles de MMPs en el fluido gingival y en el tejido gingival de pacientes con enfermedad periodontal37-39. Los fibroblastos gingivales, las células más predominantes en el tejido gingival, participan en la respuesta inflamatoria local produciendo interalia MMPs40,41.
El mecanismo exacto de la sobrerregulación de las MMPs sigue siendo desconocido, pero la asociación física de EMMPRIN y la integrina podrían ayudar al aumento de producción de MMPs26,28,42. Se ha reseñado que, en las hiperplasias gingivales, EMMPRIN se expresa en las células basales del epitelio gingival43. Emingil et al encontraron también que se podía detectar EMMPRIN soluble en el fluido gingival de encías sanas y que, asimismo, se encontraba significativamente elevado en el fluido gingival de encías inflamadas44. En el presente estudio, EMMPRIN se expresó ampliamente en las células epiteliales, los fibroblastos, y en las células inflamatorias de tejidos gingivales humanos enfermos. Además, se encontró extremadamente aumentado en encías inflamadas cuando se comparó con sujetos sanos. El nivel de proteína EMMPRIN evaluado por el Western blot en encía humana inflamada también aumentó mucho. Como hemos señalado antes, los especímenes de encía inflamada empleados en el presente estudio procedían de sujetos que estaban siendo sometidos a cirugía periodontal, lo que significa que la inflamación periodontal se había controlado de forma efectiva. Por lo tanto, era razonable creer que el nivel de manifestación de EMMPRIN sería mucho más elevado durante la progresión avanzada de la periodontitis.
En la investigación previa, EMMPRIN se identificó en las células del epitelio basal de tejidos gingivales de pacientes con hiperplasia gingival, así como en el fluido gingival de pacientes con periodontitis43,44. Sin embargo, por primera vez, el presente estudio encontró que EMMPRIN se expresaba tanto en tejidos gingivales sanos como inflamados, con un nivel de expresión en tejidos gingivales humanos inflamados significativamente mayor al de tejidos provenientes de encías sanas.
Conclusión
Los resultados del presente estudio sugieren que EMMPRIN podría jugar un papel crucial en el remodelamiento de los tejidos periodontales, así como en la progresión patológica de la enfermedad periodontal.
Los autores han llevado a cabo recientemente estudios para demostrar la relación entre EMMPRIN y las MMPs en la periodontitis, y han cribado MMPs y péptidos cíclicos en tejido conectivo periodontal en busca de nuevos inhibidores de MMP. El desarrollo de intervenciones terapéuticas efectivas dirigidas hacia los EMMPRIN podría representar una alternativa novedosa y potencialmente muy efectiva a los actuales tratamientos de la periodontitis.
Agradecimientos
Este estudio fue subvencionado por becas del National Natural Science Fundation de China (n.º 30471887).
Correspondencia: Prof. Chengzhang Li.
Department of Periodontology. School and Hospital of Stomatology. Wuhan University, 237 Luoyu Road, Hongshan District, Wuhan, 430079, China.
Correo electrónico: bobshung@163.com
También contribuyeron a este trabajo Junbo Xiang y Zhengguo Cao.