La bibliografía existente sobre el tema de la endodoncia y la salud general es fragmentaria y muy poco sistemática. Sin embargo, en vista del creciente número de pacientes de edad avanzada con múltiples problemas médicos, el tema está adquiriendo cada vez mayor importancia. Los problemas endodónticos pueden tener repercusiones sistémicas que deben tenerse en cuenta durante el tratamiento endodóntico. A la inversa, las enfermedades sistémicas también pueden interactuar con tratamientos de conductos radiculares, por lo que respecta básicamente a la tasa de éxito, la terapia y la necesidad de una protección antibiótica profiláctica. Por regla general, no obstante, la existencia de dolencias sistémicas no constituye una contraindicación del tratamiento endodóntico.
(Quintessenz. 2012;63(2):171-80)
Endodoncia y diabetes mellitusAproximadamente del 9 al 10% de los adultos padecen diabetes, una compleja enfermedad metabólica con segregación reducida de insulina o resistencia a la insulina en el hígado y los músculos. La diabetes mellitus conduce a trastornos en el sistema inmunitario, microangiopatía, disminución de la función granulocítica, alteración del metabolismo tisular y retardo de la cicatrización. Cabe distinguir entre el tipo I (insuficiencia absoluta de insulina, el 5% de los casos de diabetes mellitus) con poliuria, polidipsia, cetoacidosis y pérdida de peso como síntomas característicos, así como el tipo II (tipo independiente de la insulina, 95% de los casos de diabetes mellitus), el cual se suele diagnosticar casualmente en el marco del síndrome metabólico26.
Los pacientes con diabetes del tipo II presentan una prevalencia considerablemente superior de dientes endodonciados y también de lesiones periapicales7,21,40,58. Los pacientes con diabetes del tipo I presentan hallazgos similares16. La diabetes mellitus se reveló como factor con una mayor incidencia de extracciones postendodónticas. Los diabéticos presentan un mayor número de síntomas perioperatorios («flare-ups») frente a los no diabéticos, sobre todo en presencia de una periodontitis apical18.
Las probabilidades de éxito de los tratamientos endodónticos en dientes con periodontitis apical están muy limitadas en los pacientes de diabetes18,19. En un estudio posterior de 10 años con más de 2.000 personas en un grupo de población indio (con una prevalencia de diabetes de 2,8) se reveló que los pacientes con diabetes presentaban una mayor tasa de pérdida de dientes endodonciados y una mayor incidencia de tratamientos de revisión45. Todavía no se ha esclarecido concluyentemente si también es responsable de ello la mayor presencia de determinadas especies bacterianas en la pulpa necrótica de los diabéticos18.
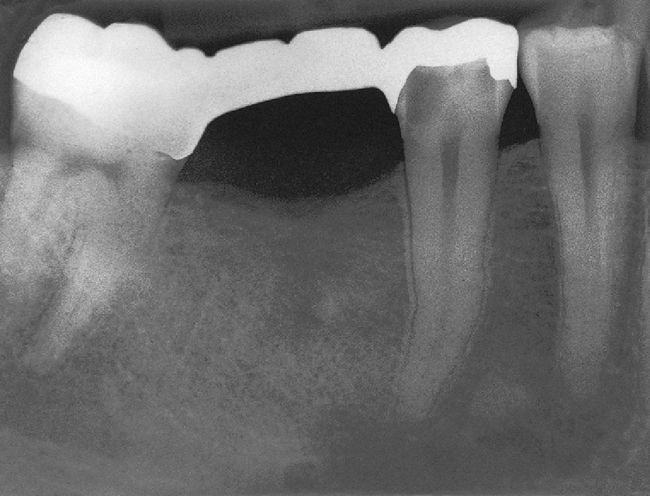
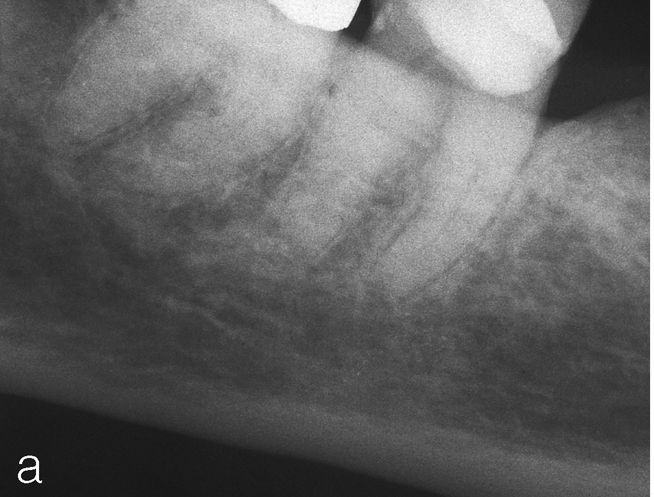
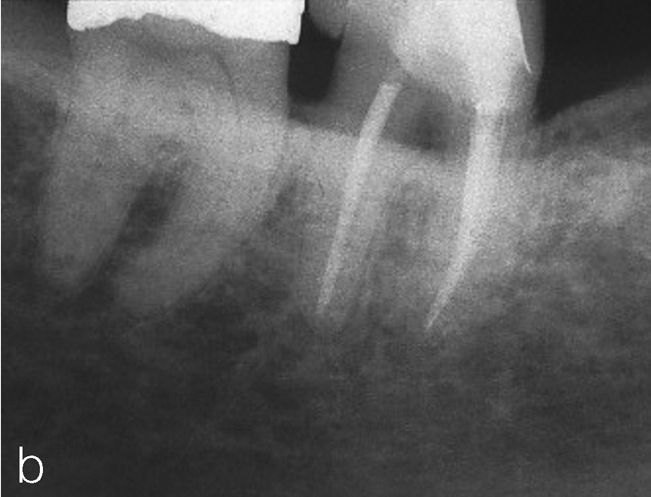
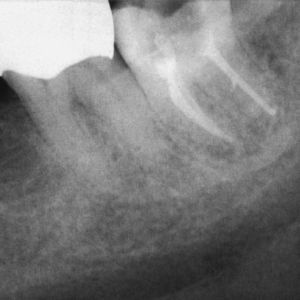
No obstante, también existen estudios en los que no se han observado para pacientes diabéticos diferencias en cuanto a las tasas de éxito en comparación con los pacientes sanos15. Caplan9 observó, en un estudio de 540 dientes de diabéticos de los tipos I y II así como de pacientes sanos, que no existían diferencias entre los tres grupos en cuanto a la tasa de éxito global, pero que en presencia de una periodontitis apical las perspectivas de curación de los diabéticos son peores (figs. 1a a 1c). También Bender et al.4 informaron de resultados igualmente satisfactorios en relación con tratamientos endodónticos en diabéticos bien estabilizados (n=33) y en no diabéticos.
No existe contraindicación para el tratamiento endodóntico de pacientes con diabetes. Las tasas de éxito de tales tratamientos (incluidos los recubrimientos pulpares directos) están posiblemente reducidas, especialmente en diabéticos del tipo I mal estabilizados. El tratamiento endodóntico no presenta particularidades, tan solo están contraindicados los analgésicos con contenido en ácido acetilsalicílico debido a posibles interacciones con antidiabéticos orales.
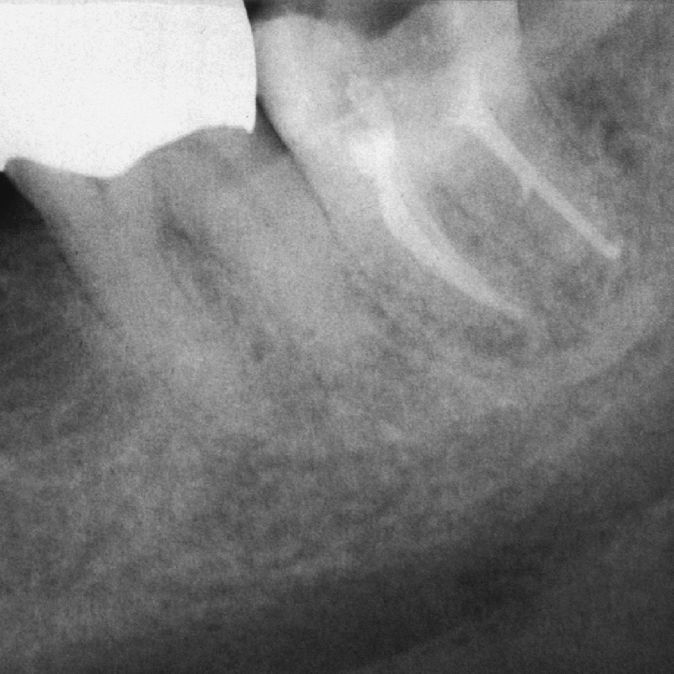
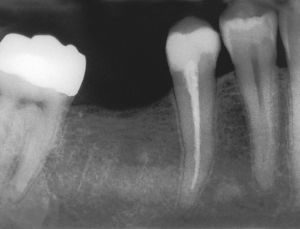
Imagen preoperatoria del diente 45 con una caries que se extiende hasta las proximidades de la pulpa. Se llevó a cabo una endodoncia (extraído de Georgi y Hülsmann21).
Radiografía de control una vez concluida la endodoncia (extraído de Georgi y Hülsmann21).
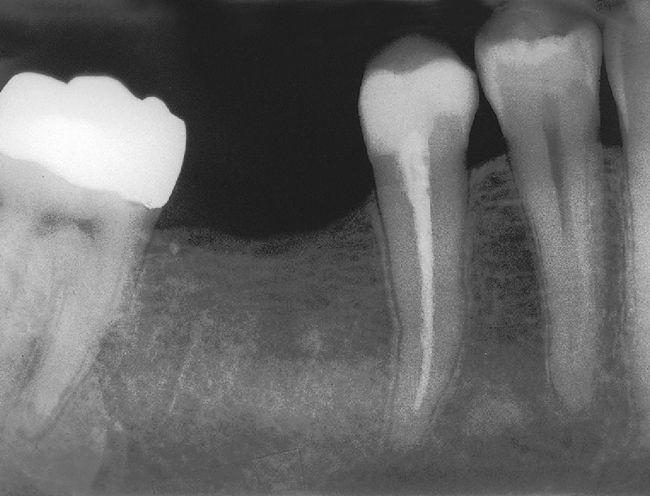
Tras el fracaso del tratamiento primario se procedió a una apicectomía, la cual presenta una curación satisfactoria un año después de la operación (extraído de Georgi y Hülsmann21).
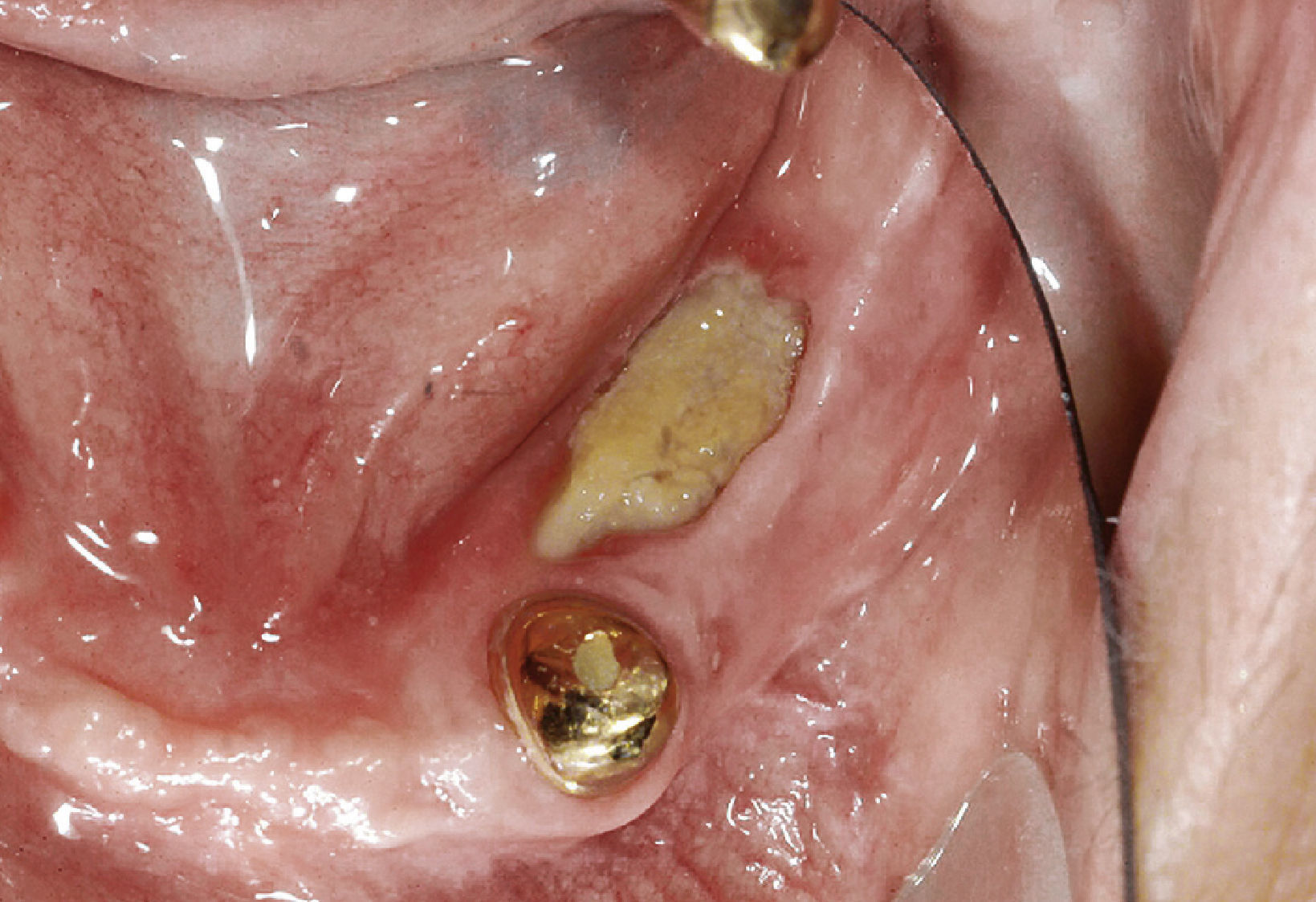
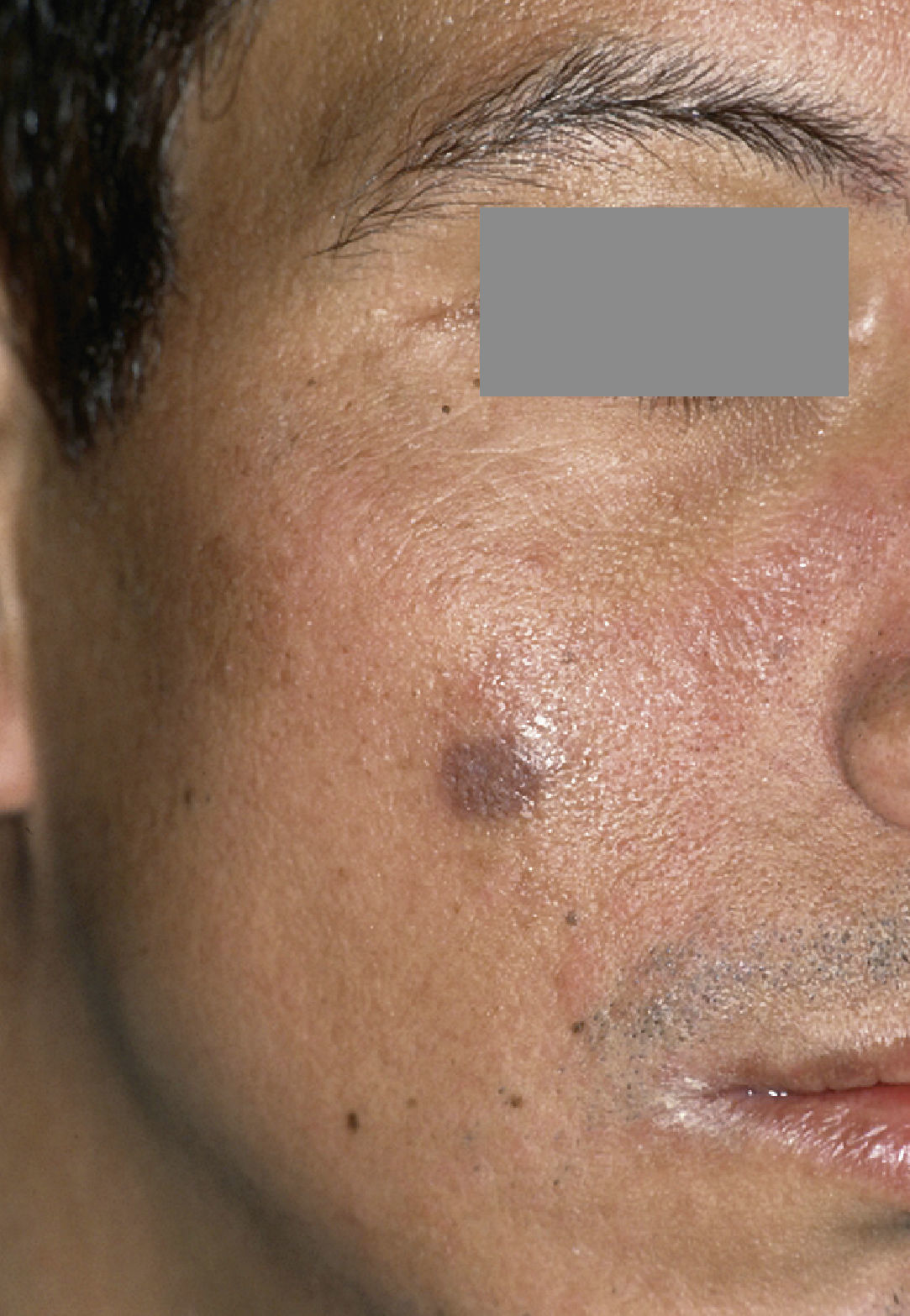
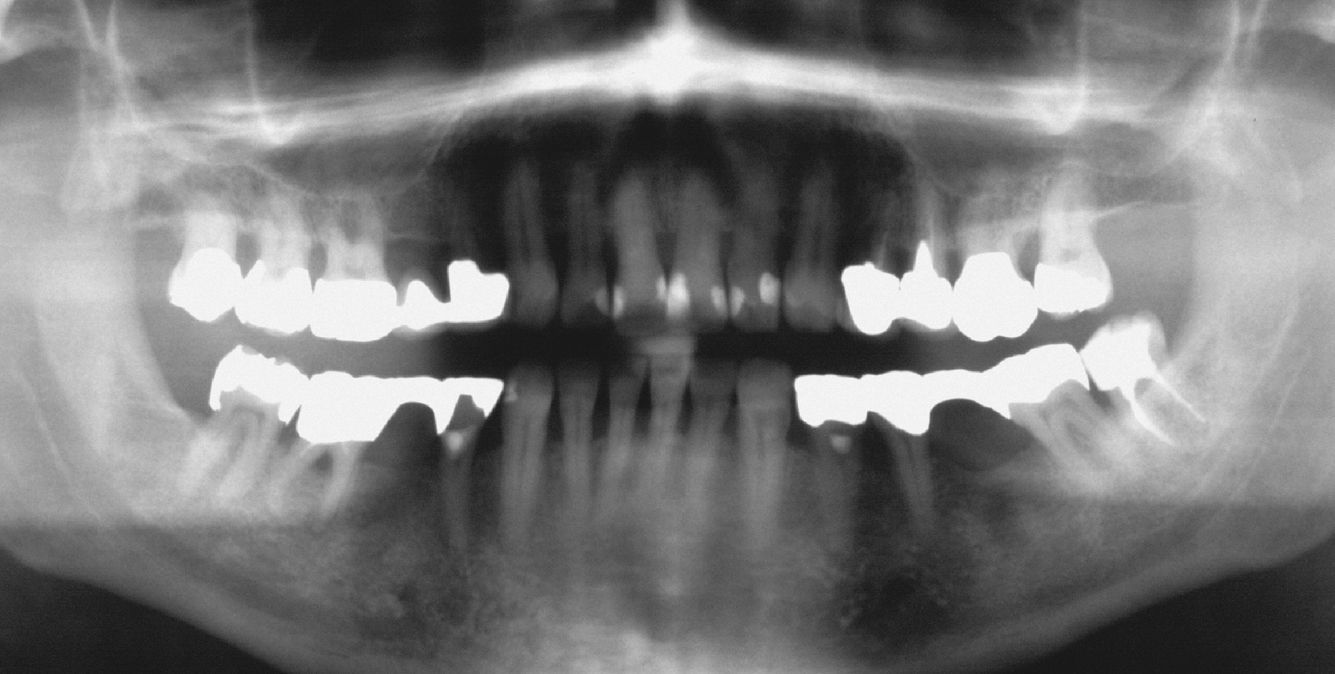
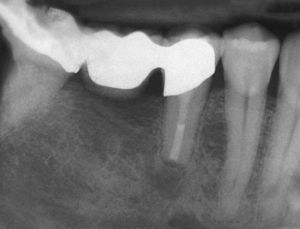
Los bifosfonatos se utilizan para el tratamiento de reabsorciones óseas inducidas por malignomas y de la osteoporosis. Impiden la reabsorción ósea (y por ende también la regeneración ósea) y pueden administrarse tanto por vía oral como intravenosa. Su utilización resulta en una mayor frecuencia de necrosis óseas difícilmente tratables tras intervenciones dentales invasivas tales como extracciones o tratamientos de cirugía oral3 (fig. 2). Especialmente la administración intravenosa y el tratamiento de larga duración con bifosfonatos orales constituyen factores de riesgo52. Las tasas de complicación se incrementan en aproximadamente un 9% por cada año de tratamiento con bifosfonatos39. Los pacientes con administración intravenosa presentan, tras intervenciones quirúrgicas dentoalveolares, un riesgo de 5 a 21 veces mayor de padecer una BRONJ (osteonecrosis maxilar asociada al uso de bifosfonatos)29. La incidencia de la BRONJ es del 0,8 al 12%, y entre el 65 y el 70% de los casos afectan a la mandíbula43. Las repercusiones de la medicación con bifosfonatos sobre la pulpa y los tejidos perirradiculares todavía no están completamente esclarecidas: En el ensayo con animales, el bifosfonato inhibió la reabsorción ósea y redujo el número de osteoclastos en dientes con periodontitis apical, sin perjudicar a la irrigación vascular de la región65,66.
En 119 casos de osteonecrosis por bifosfonatos existía como comorbilidad un tratamiento de conductos radiculares con periodontitis apical detectable radiológicamente en el 10,9% (n=13) y un absceso en el 13,4% (n=16)44. En uno de los casos, la aparición de las necrosis estaba asociada en el tiempo a una apicectomía, pero en ningún caso a un tratamiento de conductos radiculares.
En un estudio retrospectivo de tratamientos de conductos radiculares en 43 dientes con periodontitis apical en pacientes con tratamiento mediante bifosfonatos orales, la tasa de éxito alcanzó el 73,5%, mientras que 38 dientes de control con periodontitis apical en pacientes sin tratamiento mediante bifosfonatos arrojaron una tasa de éxito del 81,6%; sin embargo, la diferencia no resultó significativa28. En descripciones de casos aislados se informa de la aparición de osteonecrosis después de tratamientos de conductos radiculares durante el tratamiento con bifosfonatos31,53. Asimismo se describen tratamientos endodónticos exitosos y sin problemas56.
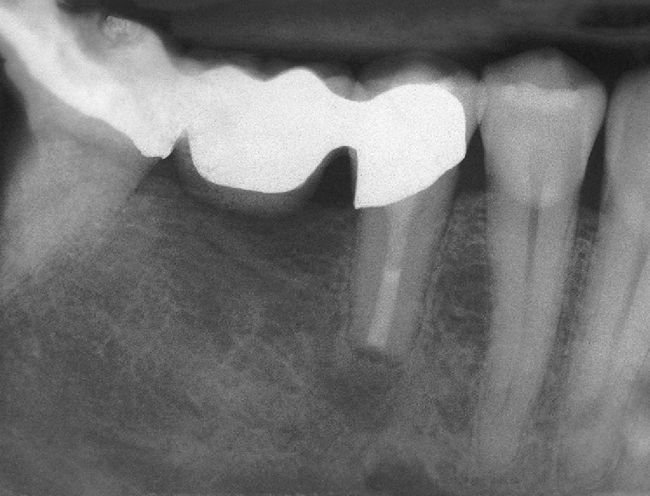
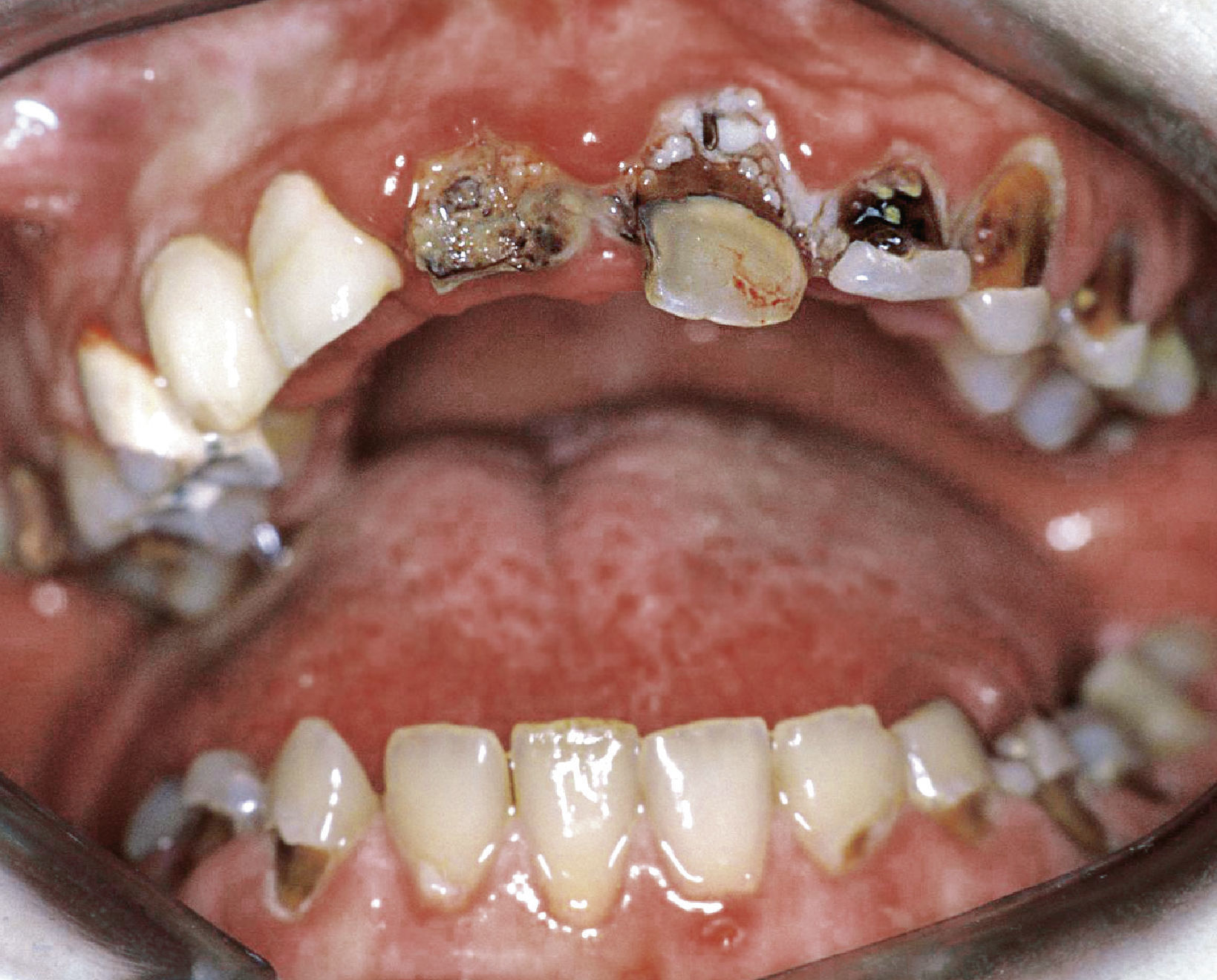
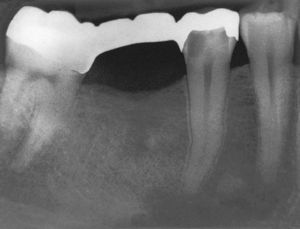
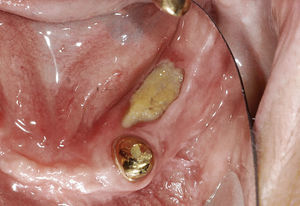
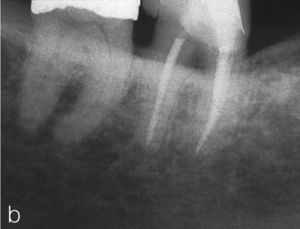
El tratamiento endodóntico no quirúrgico es preferible a las intervenciones endodóntico-quirúrgicas o a las extracciones, siendo este principio aplicable también al tratamiento de dientes no restaurables en caso de administración intravenosa de bifosfonato2. Durante el tratamiento endodóntico deberían evitarse las irritaciones marginales (ganchos del dique de goma) así como apicales (sobreinstrumentación, sobreobturación) de la mucosa y del hueso3,55 (figs. 3a y 3b).
Una terapia con bifosfonatos no constituye contraindicación alguna para un tratamiento de conductos radiculares. Las medidas endodónticas son más respetuosas que las quirúrgicas y deben preferirse en la medida de lo posible, puesto que van asociadas a un menor riesgo de necrosis óseas y arrojan unas tasas de éxito satisfactorias. Deberían evitarse lesiones del hueso. No es necesario un tratamiento con antibióticos.
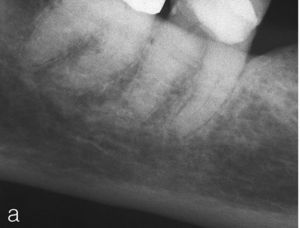
La irradiación en la zona de la cabeza y el cuello puede conducir a alteraciones de las propiedades del tejido dental duro, así como a alteraciones tisulares de la pulpa en forma de fibrosis o atrofia y en última instancia a la necrosis pulpar (fig. 4). Se producen lesiones inducidas por la radiación de los vasos en regiones capilares, que pueden llegar al cierre capilar total32,55. No obstante, las alteraciones de la saturación de oxígeno en la sangre y de la microcirculación de la pulpa debidas a la radioterapia se han revelado como reversibles30. Debido al riesgo de osteorradionecrosis, el tratamiento de conductos radiculares constituye el tipo de terapia más respetuoso y seguro en comparación con la extracción. La opción más segura es un tratamiento de los conductos radiculares antes de la radioterapia, siendo conveniente un establecimiento generoso de la indicación de la extracción de dientes fuertemente destruidos o pronósticamente cuestionables13,17,32,55. Especialmente en el maxilar inferior, la capacidad regenerativa del hueso irradiado parece estar fuertemente limitada.
Durante los tratamientos endodónticos tras la irradiación deberían evitarse estrictamente la sobreinstrumentación y la contaminación del hueso. En todos los casos es aconsejable llevar a cabo un tratamiento antibiótico durante los tratamientos endodónticos55.
La tasa de éxito de los tratamientos endodónticos tras la radioterapia es objeto de controversia: De 22 casos que pudieron someterse a seguimiento a lo largo de un promedio de 19 meses, 20 (91%) fueron calificados como éxitos, mientras que los dos fracasos afectaron a casos con necrosis pulpar infectada38. En estudios anteriores, al cabo de 18 meses tan solo fueron exitosos 2 de 11 (18%) tratamientos42. Al cabo de un promedio de 22 meses, 15 de 46 (33%) dientes tratados endodónticamente antes o después de la radioterapia no presentaron periodontitis apical ni otros trastornos. 11 de los 46 dientes no pudieron conservarse60.
En pacientes durante y después de una radioterapia, el tratamiento de los conductos radiculares constituye una terapia más respetuosa y segura que las medidas quirúrgicas. Antes de una radioterapia debería establecerse rigurosamente la indicación de las medidas endodónticas. No es posible cuantificar exactamente las tasas de éxito. En caso de respuesta negativa a la prueba de sensibilidad durante o poco después de la radioterapia, no existe indicación de un tratamiento de los conductos radiculares.
Como consecuencia de una terapia citostática se debilita la respuesta inmunitaria de los pacientes afectados. Los dientes con necrosis pulpar o periodontitis apical deberían tratarse o extraerse antes de la terapia como focos de inflamación potenciales55. No se conocen otras interacciones.
Endodoncia y VIHCabe distinguir tres estadios de la infección por VIH: la infección primaria, la fase de latencia clínica y el SIDA manifiesto55 (figs. 5a y 5b). La defensa inmunológica comprometida de este grupo de pacientes comporta un mayor riesgo de exacerbación aguda de inflamaciones perirradiculares, por lo cual conviene tratar éstas siempre inmediatamente después de diagnosticarlas. En la misma medida se incrementa el riesgo de problemas agudos y trastornos de la cicatrización tras una extracción, de modo que el tratamiento de conductos radiculares suele constituir la intervención más respetuosa. Tomando en consideración el grado de destrucción y las posibilidades de restauración del diente, así como el estado general del paciente, debe decidirse si un intento de conservación es aconsejable y tiene perspectivas de éxito.
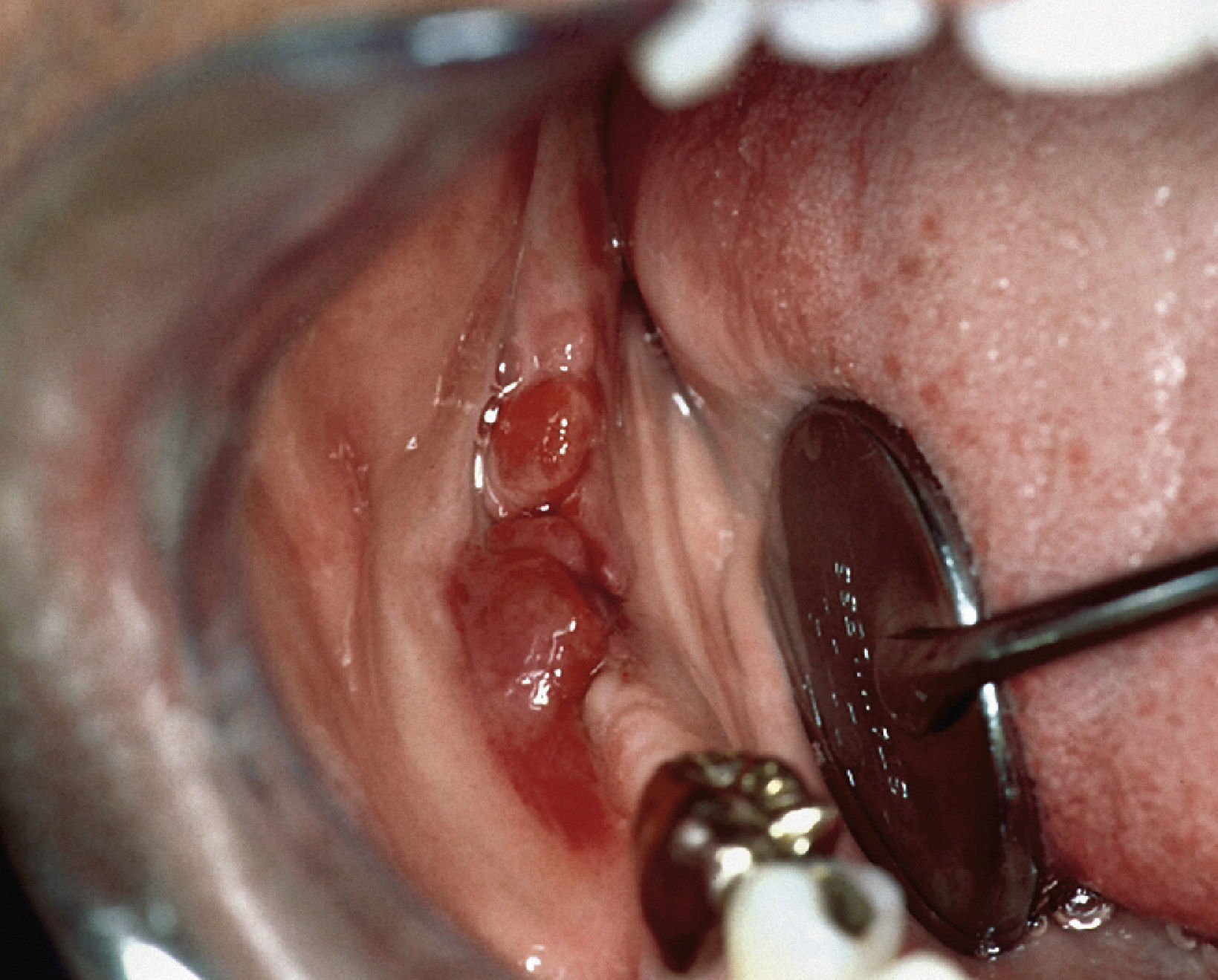
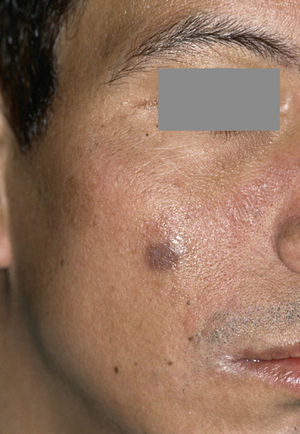
Sarcoma de Kaposi extraoral como dolencia definitoria del SIDA (extraído de Schäfer55).
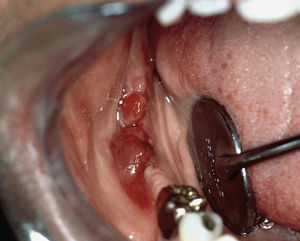
En el paciente se observa además un sarcoma de Kaposi intraoral (extraído de Schäfer55).
Un estudio de 166 pacientes infectados por VIH en Brasil arrojó que el 14,5% necesitaban un tratamiento endodóntico. La necesidad de tratamiento era significativamente mayor en personas infectadas con menos de 500 células T CD4+/mm3. No se pudo demostrar una correlación con la necesidad de tratamiento para la carga vírica global de los pacientes14. Los pacientes VIH positivos que se encontraban en tratamiento odontológico regular requirieron un 36% menos tratamientos endodónticos que los pacientes que consultaban al odontólogo tan solo esporádicamente27.
La existencia de una infección por VIH no constituye contraindicación alguna para un tratamiento de conductos radiculares47. A partir del recuento de granulocitos en la sangre puede decidirse si es necesario y conveniente un tratamiento antibiótico preoperatorio: Si el valor se sitúa por encima de 500/μl sangre no es necesario un tratamiento antibiótico, mientras que en caso de SIDA manifiesto o de un recuento de granulocitos inferior a 500/μl sangre debería procederse a una protección antibiótica. Además, durante el tratamiento se debe tener en cuenta que pueden aparecer trastornos de la coagulación sanguínea debido a la reducción del número de trombocitos, algo que también debe considerarse al prescribir la medicación (¡analgésicos con contenido en ácido acetilsalicílico!)57.
Hasta la fecha apenas se dispone de datos clínicos acerca del tratamiento y el pronóstico de éxito de pacientes VIH positivos, si bien Bürklein y Schäfer8 presentan una sinopsis de la bibliografía actual. La tasa de complicaciones en tratamientos endodónticos se sitúa, con un 2%, claramente por debajo que en las extracciones (3 al 22%)50. El examen de los historiales clínicos de 331 pacientes con VIH arrojó una frecuencia de complicaciones del 0,9%23. En un control de seguimiento clínico de un año a 32 pacientes con VIH no se describieron fracasos tras el tratamiento de conductos radiculares, mientras que en un caso se produjeron dolores postoperatorios11. Alley et al.1 no observaron ninguna diferencia en la tasa de éxito del tratamiento endodóntico en pacientes con VIH/SIDA y un grupo de control con 50 dientes tratados en ambos grupos. En un estudio posterior se analizó retrospectivamente, al cabo de un tiempo de control mínimo de seis meses, el resultado de tratamientos endodónticos de 60 dientes de pacientes infectados con VIH, el 88% de los cuales presentaban menos de 500 células T CD4+. El estudio clínico arrojó una tasa de éxito del 88%, y el examen radiológico reveló en el 80% de los casos un estado periapical sano o bien una reducción sustancial de la lesión periapical62. Tan solo en el 2% de los casos se había desarrollado una nueva lesión62. Shetty et al.61 realizaron tratamientos de conductos radiculares en 157 pacientes VIH positivos. Los controles a 6 meses arrojaron una cuota de éxito, esto es, la inexistencia de síntomas clínicos y la reducción o la ausencia de una lesión apical detectable radiológicamente, del 90%. También Quesnell et al.51 obtuvieron las mismas tasas de éxito de tratamientos endodónticos en 32 pacientes con VIH y 33 pacientes sanos. Los autores atribuyen estos resultados al hecho de que, desde la introducción de nuevos medicamentos (terapia antiretroviral altamente activa, HAART) en el tratamiento del VIH, el número de células T CD4+ es prácticamente normal. La enfermedad se desarrolla con menos complicaciones, dado que la defensa inmunológica no está comprometida hasta el punto de que ello pudiera perjudicar al éxito del tratamiento y a la curación. Sin embargo, durante la fase inicial de la HAART muchos participantes desarrollan infecciones intraorales, lo cual podría constituir uno de los motivos de la mayor necesidad de tratamiento de este grupo de pacientes14.
En cambio, en descripciones de casos aislados se informa sobre tratamientos endodónticos complicados: Gerner et al.22 presentaron un caso con múltiples problemas endodónticos, en el que las medidas endodónticas en dientes vitales, los tratamientos endodóntico-quirúrgicos y las extracciones se desarrollaron sin complicaciones en la misma medida; sin embargo, en el caso de un tratamiento de revisión se observó una abscesificación aguda (figs. 6a y 6b).
Durante el tratamiento de personas infectadas por VIH adquiere una importancia capital la protección del personal. Los virus VIH se encuentran no solo en la saliva y la sangre de los pacientes, sino también en el tejido pulpar y en el tejido de granulación periapical22–24. No se debe denegar el tratamiento a pacientes infectados por VIH haciendo alusión a la enfermedad. El tratamiento propiamente dicho no presenta particularidades.
Endodoncia y alergiasEntre los alérgenos más extendidos que se utilizan también en la endodoncia se cuenta el látex, contenido en los guantes de goma y en el dique de goma10. Además de reacciones alérgicas sistémicas del tipo I (alergia a proteínas del látex mediada por IgE), puede aparecer una dermatitis de contacto alérgica localizada (tipo IV, hipersensibilidad) y una dermatitis de contacto no alérgica (irritaciones cutáneas). En caso de determinarse anamnésicamente la existencia de una alergia al látex, debería recurrirse a guantes y diques de goma sin látex.
Si bien la gutapercha presenta similitudes estructurales con el látex, no existen –salvo en dos informes de casos6,20– indicios de alergias cruzadas a la gutapercha12,25,34,54. Por lo tanto es posible la obturación de conductos radiculares con gutapercha aunque exista una alergia al látex35,36,54.
Además de al látex y en casos aislados a la gutapercha, durante un tratamiento endodóntico pueden aparecer reacciones alérgicas o intolerancias a otros materiales utilizados, tales como anestésicos, eugenol, preparados con contenido en yodo o formaldehído, resinas epoxídicas o metacrilatos55. Las sustancias con contenido en cloro, tales como NaOCl o la clorhexidina, pueden provocar reacciones de intolerancia (cloracné). No se han descrito alergias al níquel contenido en los instrumentos de níquel-titanio, y tampoco cabe esperar que lo sean en virtud del firme enlace del átomo de níquel al titanio64, pese a que se han hallado trazas de níquel-titanio en el tejido periapical de dientes tratados endodónticamente48.
Endodoncia y tabaquismoEn un estudio de más de 600 personas seleccionadas al azar en Aarhus (Dinamarca) se identificó el tabaquismo como uno de varios indicadores de riesgo de una periodontitis apical, si bien su influencia era débil33. En un estudio de control de 811 varones, los fumadores presentaron una probabilidad 1,7 veces mayor de un tratamiento de conductos radiculares que las personas que nunca habían fumado37. En un estudio español se demostró una fuerte asociación entre el tabaquismo y la periodontitis apical59. El 74% de los fumadores, pero tan solo el 41% de los no fumadores, presentaron una lesión apical como mínimo en un diente. También en relación con la proporción de dientes endodonciados se reveló una diferencia significativa del 2,5% frente al 1,5%, que se aplicó también a la proporción de dientes con periodontitis apical en el número global de dientes (5 frente al 3%).
Se obtuvieron resultados controvertidos en cuanto a la relación entre el tabaquismo y la periodontitis apical en los estudios de Bergström et al.5, quienes no pudieron demostrar la influencia del consumo de tabaco sobre la frecuencia de las lesiones periapicales (1,9 a 1,0 lesiones por persona). Según Marending et al.41, el tabaquismo no constituye un predictor del éxito o el fracaso de los tratamientos endodónticos.
Hasta ahora no se ha demostrado concluyentemente una relación entre el tabaquismo y las enfermedades endodónticas en forma de una mayor incidencia de tratamientos de los conductos radiculares y una mayor prevalencia de periodontitis apicales, pero no se puede negar una sospecha inicial. Se desconoce si el tabaquismo influye negativamente en la curación de lesiones apicales y en qué medida lo hace.
En todos los estudios sobre la relación entre la salud general y la epidemiología o la tasa de éxito de los tratamientos endodónticos debe tenerse en cuenta que por medio de radiografías convencionales no puede diagnosticarse una parte considerable de las lesiones periapicales, puesto que éstas no son detectables hasta que existe una afectación del hueso compacto. De ahí que posiblemente se infravaloren las repercusiones sistémicas de las enfermedades endodónticas49.
Marending et al. observaron una tasa de éxito reducida de los tratamientos endodónticos en pacientes con función restringida de la defensa inmunitaria inespecífica, que incluía diabetes, cáncer de mama con terapia cistostática, gastritis, colitis y artritis reumática.
A partir de una evaluación de base de datos, Wang et al.63 comprobaron en Taiwán casi 50.000 tratamientos de conductos radiculares a lo largo de 2 años a en busca de una correlación entre la frecuencia de extracción y la diabetes mellitus, cardiopatías coronarias e hipertensión arterial. Durante los dos años se extrajeron en total el 3,2% de los dientes tratados endodónticamente. Los pacientes con diabetes, cardiopatía coronaria e hiper tensión arterial perdieron un número significativamente mayor de dientes que los pacientes sanos. En caso de presencia de dos o más de estas enfermedades se incrementaba aún más el riesgo de pérdida de dientes endodonciados.
Los pacientes con enfermedades sistémicas múltiples presentaron, en un estudio de control de 10 años con sujetos de estudio indios, una tasa de retención de dientes endodonciados inferior a la de las personas sanas45.
En una evaluación sistemática de estudios sobre la tasa de éxito de tratamientos endodónticos, Ng et al.46 constataron que los datos publicados sobre la correlación entre la tasa de éxito y el estado general de los pacientes no permiten extraer conclusiones. Tan solo un estudio habría abordado esta cuestión, sin llegar a determinar diferencias significativas en la comparación entre pacientes sanos y pacientes con enfermedad general conocida.