«La bondad no existe, salvo si se practica» (Erich Kästner)
Introducción
Esta revisión se basa en la publicación seriada del Grupo de Trabajo suizo del proyecto «Fumar - Intervención en la consulta odontológica»1-6. Además del aumento demostrado del riesgo de padecer un carcinoma de células escamosas oral, actualmente ya se dispone de pruebas científicas fundadas del papel esencial que desempeña el tabaquismo en el desarrollo y la progresión de enfermedades periodontales y enfermedades periimplantarias. En este artículo se explican algunos efectos patogénicos asociados al tabaco y se comenta su relevancia en la práctica odontológica diaria. Una de las funciones esenciales de la consulta odontológica es proporcionar a los pacientes fumadores información médico-odontológica acerca de los riesgos de este hábito para la salud, así como recomendar su abandono. En este artículo se explican algunos procedimientos fáciles de aplicar en la consulta odontológica. Esta revisión bibliográfica se divide en los apartados siguientes:
a) Aspectos relacionados con el tabaco
b) Epidemiología y medidas de política sanitaria generales
c) Tabaquismo y patologías de la mucosa oral
d) Tabaquismo y enfermedades periodontales/enfermedades periimplantarias
e) Oportunidades del equipo de la consulta odontológica para la intervención breve
f) Conclusión
Aspectos relacionados con el tabaco
Tabaco inhalado
Fumar es la forma más popular de consumir tabaco. Las explicaciones siguientes también son aplicables, con algunas excepciones, al hábito de fumar puros o fumar en pipa.
El humo de los cigarrillos es una mezcla compleja de más de 4.000 sustancias conocidas. Además de la nicotina, de gases irritantes y alquitranes, el humo también contiene monóxido de carbono, ácido cianhídrico y arsénico. Está científicamente demostrado que al menos 50 de las sustancias que componen el humo del tabaco son cancerígenas, es decir, provocan cáncer principalmente de pulmón, laringe, mucosa oral, vejiga y riñón. La nicotina, una molécula psicoactiva, tiene un efecto estimulante y posee todas las características de una droga7. Las propiedades físicas del filtro del cigarrillo sólo consiguen atenuar mínimamente la absorción de estas sustancias nocivas. La industria no ha hecho ningún esfuerzo por modificar la mezcla de las variedades de tabaco en beneficio de los consumidores8. La dosis de sustancias nocivas absorbidas por el fumador depende de la forma de consumo del producto. Las variables que influyen en este caso son el número de caladas por cigarrillo, la profundidad de la inhalación, la longitud de la colilla, la existencia de un filtro y la marca de cigarrillos9. Los consumidores de 'cigarrillos light', una expresión improcedente después de la revisión del Decreto sobre el Tabaco de 2004 (Suiza), parece ser que suelen realizar inhalaciones más profundas. Por lo tanto, inhalan aproximadamente la misma cantidad de nicotina que si consumieran cigarrillos normales10.
Determinación del consumo de tabaco
La cantidad de tabaco consumida se expresa en 'pack years', es decir, años-paquete (lo que indica el número de cigarrillos fumados al día durante un año). Dado que inicialmente el paquete original contenía 20 cigarrillos, se ha mantenido esta cifra para el cálculo de la cantidad de tabaco consumida. Es decir, 10 años-paquete equivale a fumar diariamente 20 cigarrillos durante un período de 10 años. Una alternativa más moderna para el cálculo del consumo de tabaco es lo que se denomina actualmente el Comprehensive Smoking Index11 (CSI). Este índice permite determinar, por ejemplo, el tiempo necesario de recuperación de los tejidos periodontales después de que una persona deje de fumar.
Fumar pasivamente
Sólo alrededor de un 30% del humo generado por los productos del tabaco penetra en las vías respiratorias del fumador. La mayor parte del humo permanece flotando en el aire ambiente, de modo que las personas que comparten el mismo espacio con el fumador aspiran inevitablemente una cantidad notable de sustancias nocivas. El fumador pasivo inhala hasta una tercera parte de la nicotina de un cigarrillo fumado. Por lo tanto, fumar pasivamente representa un riesgo para la salud que no debe subestimarse.
Tabaco sin humo
Se distinguen dos tipos de tabaco sin humo12: el tabaco de mascar y el tabaco en polvo o rapé. El rapé es una mezcla finamente molida de uno o varios tipos de tabaco que se consume mediante la aspiración por la nariz. Es una forma de consumo de tabaco que se conoce en Europa desde hace más de 400 años. La nicotina ejerce su efecto después de su absorción a través de la mucosa nasal en la parte anterior de la nariz. La aspiración excesivamente enérgica del rapé puede llegar a provocar dolor, sobre todo en los consumidores inexpertos.
Otro tipo de tabaco es el que se mezcla con sales y se coloca detrás del labio superior (muy popular en Suecia y en el resto de Europa), detrás del labio inferior o en un surco yugal (sobre todo en Estados Unidos) y que se conoce como snus (sinónimos: snus sueco, rapé oral húmedo, rapé oral). Con esta forma de consumo se absorbe aproximadamente la misma cantidad de nicotina que al fumar un cigarrillo13. Las sales conservan la humedad del tabaco y 'asperizan' la mucosa bucal, por lo que los principios activos pasan directamente a la circulación sanguínea. La creencia prácticamente generalizada de que se añaden esquirlas de vidrio finas al snus para conseguir un paso más rápido de la nicotina a la sangre es errónea y surgió como consecuencia de que las sales contenidas en el snus suelen cristalizar después de un período de conservación demasiado largo y en un lugar demasiado seco. El snus se comercializa en bolsitas de celulosa o se prepara usando los dedos o algún instrumento a partir de tabaco en polvo envasado en latas, y se introduce en la boca. La costumbre de masticar nuez de betel (Areca catechu L) es una peculiaridad geográfica y cultural ampliamente difundida en el sur y el sudoeste asiático, sobre todo en la India, Pakistán, Indonesia y Taiwán, y en menor medida en Tailandia. Los habitantes de estos países suelen presentar alteraciones características de color rojo parduzco en la mucosa oral, sobre todo en la zona yugal, con una superficie irregular, áspera y parcialmente descamada14.
Epidemiología y medidas de política sanitaria generales
El tabaco es un producto de gran consumo. En Alemania se fuman una media de 305 millones de cigarrillos al día (Nota de prensa n.º 238 de la Oficina Federal de Estadística del 30/5/2005). Esto corresponde a aproximadamente 4 cigarrillos por habitante al día. Además de lo anterior, se consumen diariamente 10 millones de puros, 60 toneladas de picadura y 2 toneladas de tabaco para pipa. Según datos de 2005, el 27% y el 19% de la población alemana encuestada de 15 años de edad y más admitió ser fumadora activa y exfumadora, respectivamente (Nota de prensa n.º 249 de la Oficina Federal de Estadística de 22/6/2006). La proporción de fumadores es máxima a edades más jóvenes. En la franja de edad entre los 15 y los 39 años, el 39% de los hombres era fumador frente al 30% de las mujeres de este mismo grupo de edad. Estas cifras son comparables, en general, con las de otros países de dentro o de fuera de Europa, situándose el porcentaje de población fumadora masculina ligeramente por encima de la femenina a nivel mundial15. Este estudio y también otros estudios epidemiológicos, sobre todo procedentes de Estados Unidos y países en vías de desarrollo, pusieron de manifiesto que el porcentaje de fumadores era más alto en las capas socioeconómicas más desfavorecidas que en las más privilegiadas16.
Este consumo tan extendido de productos de tabaco se asocia a una mortalidad y a una morbilidad claramente aumentadas en relación con múltiples enfermedades, sobre todo del aparato respiratorio y del sistema cardiocirculatorio. Por otra parte, el consumo de productos de tabaco está claramente relacionado con numerosos procesos oncológicos. Por lo tanto, el consumo de tabaco es la principal causa de muerte evitable en todo el mundo5,6.
Por este motivo se han implantado en muchos países programas de prevención del tabaquismo de gran alcance. Las principales medidas de política sanitaria por tomar y que han demostrado ser eficaces son:
1. Aumento de la carga impositiva sobre los cigarrillos y otros productos del tabaco.
2. Las restricciones y la prohibición de fumar en lugares públicos y en las empresas.
3. La optimización de la información para el consumidor a través de campañas informativas públicas, reportajes en los medios de comunicación y la publicación de resultados de estudios científicos.
4. La prohibición global de publicitar y promover la venta de todo tipo de productos del tabaco, de los logos relacionados con el tabaco y de las marcas comerciales.
5. Advertencias sanitarias rotundas de gran formato en los paquetes de cigarrillos y otros productos del tabaco (fig. 1).
Figura 1. Imágenes de advertencia en los paquetes de cigarrillos presentadas en la Conferencia Europea sobre Tabaco o Salud 2007, celebrada en Basilea, Suiza.
6. Tratamientos de deshabituación con ayuda farmacológica si procede.
El uso de la 'escala de control del tabaco' permite comprobar la implantación de estas seis condiciones. Se puede obtener una puntuación máxima de 100 puntos. En una comparación entre 30 países europeos, el grupo que encabezaba la clasificación alcanzó una puntuación de 65 puntos o más en el período de 2005-2007. De este grupo formaron parte Gran Bretaña (95 puntos), Irlanda, Islandia y Noruega. Suiza obtuvo 47 puntos y se situó en el lugar 18. Países como Austria, Luxemburgo, Grecia y Alemania (37 puntos) quedaron relegados a las últimas posiciones.
Tabaquismo y patologías de la mucosa oral
Las secuelas del tabaquismo en la cavidad oral son tinciones de los dientes17 y de las restauraciones dentales18, alteraciones olfatorias y gustativas19, retrasos y alteraciones de la cicatrización después de intervenciones de cirugía oral, como extracciones20. Por otra parte, se considera que el hábito de fumar es un indicador de riesgo importante de una mayor actividad cariogénica21 y se relaciona también con una mayor predisposición a padecer una candidiasis oral22 (infección micótica por una levadura).
El consumo crónico de tabaco provoca en la mucosa oral alteraciones benignas (melanosis del fumador y paladar del fumador) o patologías potencialmente fatales (cáncer oral). La presencia de lesiones benignas, sobre todo si se trata de lesiones manifiestas, ofrece al equipo odontológico una oportunidad única para hablar con el paciente de las ventajas de dejar de fumar23, ya que algunas de estas lesiones se pueden resolver espontáneamente.
Melanosis del fumador
Es una alteración que aparece en grandes fumadores y se manifiesta por hiperpigmentaciones irregulares, parduzcas y en ocasiones difusas, localizadas predominantemente en la encía queratinizada vestibular del sector anteroinferior. La hipermelanosis se encuentra en el 25,5%-31% de los fumadores y puede afectar también otras zonas de la cavidad oral, como la mucosa vestibular, el paladar duro o el paladar blando24. No se trata de una lesión premaligna, y puede remitir si el paciente deja de fumar definitivamente25.
Paladar del fumador (sinónimos: leucoqueratosis del fumador, leucoqueratosis nicotínica, estomatitis nicotínica)
Los principales afectados son los fumadores de pipa que desarrollan en el paladar duro, y en ocasiones también en el paladar blando, alteraciones hiperqueratósicas de color blanco, superficiales, de aspecto adoquinado y que muestran a menudo un punteado rojizo. Éste corresponde a los conductos excretores inflamados y ligeramente tumefactos de las glándulas salivales menores del paladar que no resultan afectados por la queratosis. Por regla general, las zonas palatinas cubiertas con prótesis no presentan alteraciones en pacientes afectados. Creemos que se debe dar preferencia al término 'paladar del fumador' frente al concepto 'leucoqueratosis nicotínica palatina' de uso más difundido en regiones de habla alemana, dado que las alteraciones que aparecen en el paladar del fumador no se deben a la nicotina, sino a la presencia de sustancias nocivas en el tabaco y también en menor medida al efecto térmico. El paladar del fumador no es una lesión precancerosa y, en general, suele remitir espontáneamente si el paciente deja de fumar26.
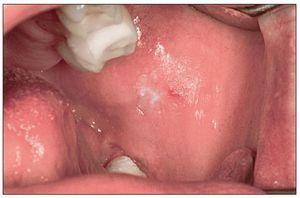
Leucoplasia oral
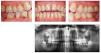
Se considera que la leucoplasia oral es la lesión precancerosa más importante en la mucosa oral (fig. 2). La prevalencia en la población de Europa Occidental y de Estados Unidos varía entre el 0,42% y el 0,9%27,28, observándose en todo el mundo claras diferencias regionales y también diferencias sexuales, lo que se debe sobre todo a las respectivas formas de consumo del tabaco26.
Figura 2. Leucoplasia en una paciente de 42 años con periodontitis de fumador crónica. Los resultados histopatológicos de la biopsia por escisión no mostraron signos de malignidad. La paciente fuma 15 cigarrillos al día desde hace varios años.
En las leucoplasias orales existe una clara relación dosis-efecto entre la cantidad de tabaco consumida y la incidencia de las leucoplasias23. Según datos de estudios, las leucoplasias son 6 veces más frecuentes en fumadores que en no fumadores26. Curiosamente, se observó una tasa de prevalencia general mayor de leucoplasias orales en los fumadores de pipa que en consumidores de otros productos del tabaco, como de puros o cigarrillos29.
En un estudio actual realizado en Estados Unidos30 se analizaron los factores de riesgo clínicos de desarrollo de una leucoplasia oral en una muestra representativa de la población estadounidense. Para este estudio, se evaluaron los datos de 15.811 participantes del estudio NHANES III (US National Health and Nutrition Examination Survey). Se identificó el hábito de fumar como el factor de riesgo más importante: la odds ratio (OR) fue de 3,0 para un consumo de < 10 cigarrillos al día, mientras que para un consumo de > 20 cigarrillos al día, la OR aumentó a 6,01. Es decir, las personas consumidoras de la cantidad indicada de cigarrillos tienen un riesgo 3 y 6 veces superior, respectivamente, de desarrollar una leucoplasia que las personas no fumadoras. Dietrich et al describieron el perfil característico del paciente que desarrolla una leucoplasia como el de una persona mayor, predominantemente varón, de raza blanca (no hispano/caucásico), fumador actual de cigarrillos o puros o fumador de pipa, consumidor de tabaco sin humo, bebedor habitual y diabético. Otras características adicionales son pertenecer a un grupo socioeconómico bajo, tener un nivel de formación bajo y una cifra de años-paquete alta30.
Carcinoma de células escamosas de la cavidad oral
El carcinoma de células escamosas oral es una enfermedad muy poco conocida por el público en general, por lo que se ha llegado a denominar «la enfermedad olvidada»31, aunque es uno de los diez tumores más frecuentes en todo el mundo y el cáncer más frecuente en la región oral, maxilar y facial. Se observan diferencias geográficas considerables, también dentro del ámbito europeo32. Esto es atribuible esencialmente a la forma de consumo del tabaco (fumar, masticar o inhalar), en muchos casos en combinación con diferentes grados de alcoholismo.
El cáncer de cavidad oral afecta sobre todo a hombres de mediana o avanzada edad y su incidencia aumenta claramente con el envejecimiento33, si bien en las últimas dos décadas se ha registrado una mayor incidencia en varones y mujeres más jóvenes34. Los médicos y sobre todo los odontólogos son protagonistas indiscutibles en la detección precoz y la prevención del carcinoma de células escamosas oral. De ahí la importancia de realizar cribados oportunistas, es decir, examinar las mucosas orales en todas las visitas médicas u odontológicas. Esta exploración está especialmente justificada en presencia de factores de riesgo establecidos, como el tabaquismo y el alcoholismo1,35. Se ha constatado la existencia de una relación dosis-efecto clara entre el tabaco consumido y el riesgo de desarrollo de un carcinoma de cavidad oral. La incidencia media de cáncer oral es de 2 a 4 veces mayor en fumadores que en no fumadores23,36. El riesgo de desarrollar un cáncer de cavidad oral es incluso 7-10 veces mayor que en personas que no han fumado nunca37. Así mismo, el riesgo se duplica en personas que fuman más de 20 cigarrillos al día. El humo de los cigarrillos, de los puros o del tabaco de pipa es comparable en lo que al efecto sobre la mucosa oral se refiere21. Por lo tanto, en cuanto al desarrollo de un carcinoma de cavidad oral, es indiferente si se inhala o no el humo.
Tabaquismo y enfermedades periodontales/enfermedades periimplantarias
Las enfermedades periodontales son procesos inflamatorios crónicos multifactoriales que provocan una destrucción del aparato periodontal y llevan, a la larga, a la pérdida de piezas dentarias38,39 (fig. 3). Las causas principales son la infección por bacterias virulentas de la película biológica oral, así como numerosos factores de riesgo no modificables y factores de riesgo modificables, como la carga hereditaria o el tabaquismo40. Algunas medidas de eficacia reconocida para el tratamiento de las periodontitis incluyen la eliminación supragingival y subgingival de la placa y del cálculo dental, la cirugía periodontal en determinadas variantes anatómicas y el tratamiento periodontal de apoyo de por vida41 (TPA). Hace décadas que se considera que la optimización de la higiene bucodental en el hogar es una condición indispensable para conseguir resultados terapéuticos satisfactorios a largo plazo. El hecho de comprender cada vez mejor el papel esencial que desempeña el tabaquismo en la patogénesis de las enfermedades periodontales ha llevado a un cambio de paradigmas. El tratamiento de deshabituación tabáquica forma parte actualmente, junto con las instrucciones para una higiene bucal correcta, del plan de tratamiento integral de las periodontitis con base científica42. En el pasado no se ha prestado la debida atención a las repercusiones clínicas del tabaquismo sobre el periodonto. Quedaron ocultas por la elevada prevalencia de las periodontitis crónicas o por la «superposición» de un factor de riesgo tan importante como la higiene bucal. Los métodos de análisis periodontales, como el registro del nivel de inserción en poblaciones de pacientes con una buena higiene bucodental en estudios a largo plazo, pusieron de manifiesto las consecuencias devastadoras de consumir tabaco durante años.
Figura 3. Situación actual de los conocimientos en relación con la patogénesis de las enfermedades periodontales con modificaciones de Page y Kornmann (1997). Las distintas interacciones entre la infección, los factores genéticos y los factores de riesgo modificables ponen de manifiesto el carácter multifactorial de estas enfermedades. El efecto del tabaquismo sobre la respuesta inmunitaria del huésped afectado y sobre los distintos tejidos del periodonto da lugar al cuadro clínico característico de la periodontitis inducida por el tabaco.
Fumar cigarrillos
Numerosos estudios transversales y estudios prospectivos a largo plazo han confirmado que fumar cigarrillos es un factor de riesgo de desarrollo y progresión de la destrucción periodontal43-58. En un estudio epidemiológico de gran envergadura realizado en Estados Unidos se pudo relacionar el 42% de las periodontitis crónicas con un hábito tabáquico actual y el 11% con un hábito tabáquico superado58. En un metaanálisis que incluyó a 2.361 pacientes, se confirmó mediante una odds ratio de 2,82 que el tabaquismo supone un factor de riesgo estadísticamente significativo para el desarrollo de una periodontitis crónica59. Se comprobó también la existencia de una relación dosis-efecto para el hábito de fumar cigarrillos58,60-63.
Fumar en pipa y fumar puros
Un estudio prospectivo realizado durante un período de 23 años en 690 pacientes constató que los fumadores de pipa y los fumadores de puros presentaban un riesgo claramente mayor de sufrir una reabsorción de hueso alveolar y una pérdida dentaria en comparación con los no fumadores64. En un estudio transversal, Albandar et al comprobaron que los fumadores de pipa y los fumadores de puros mostraban un riesgo comparativamente alto de presentar pérdidas de inserción, recesiones gingivales y valores altos de sondaje65.
Fumar pasivamente
Se estudiaron las repercusiones de fumar pasivamente sobre el periodonto en un grupo de 273 trabajadores japoneses. Se comprobó mediante las profundidades de sondaje periodontales y los niveles de inserción, y también con la determinación del producto del metabolismo de la nicotina, cotinina, en la saliva que los fumadores y los fumadores pasivos con odds ratios de 4,91 y 2,87, respectivamente, presentaban una incidencia significativamente mayor de periodontitis que los no fumadores66.
Tabaco sin humo
Algunos estudios transversales antiguos realizados en adultos jóvenes no lograron mostrar una relación clara entre los productos de tabaco sin humo y la periodontitis crónica67,68. En un estudio epidemiológico estadounidense (National Health and Nutrition Examination Survey, 1988-1994) se observó en una población de 12.932 pacientes que los consumidores de tabaco de mascar sufrían dos veces más periodontitis crónica que los no consumidores69.
Periodontitis crónica
En comparación con los no fumadores, los fumadores presentan las características siguientes:
Valores de sondaje periodontal más altos y un número mayor de puntos con profundidades de sondaje superiores a 3 mm63,70,71
Mayor pérdida de inserción y mayores recesiones gingivales47,72,73
Mayor pérdida de hueso alveolar62,74-78
Mayor pérdida dentaria79-81
Menos signos de gingivitis y menos hemorragias al sondaje70,73,82-84
Más dientes con afectación de furca85,86
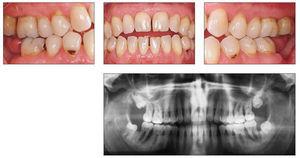
El cuadro clínico característico de la periodontitis del fumador incluye una encía marginal relativamente pálida con pocos signos inflamatorios y profundidades de sondaje superiores a 4 mm, sobre todo en zonas interproximales que, sin embargo, muestran poca tendencia al sangrado durante el sondaje periodontal (figs. 4a-4d).
Figuras 4a-4d. Imagen clínica intraoral e imagen radiológica de una periodontitis de fumador crónica avanzada. Llama la atención la encía marginal con hipertrofia fibrosa que muestra una respuesta pobre al estímulo bacteriano, y los signos radiológicos de una pérdida ósea marcada en el sector posterior. El paciente tiene 46 años y fuma 10-20 cigarrillos al día desde hace aproximadamente 25 años, lo que corresponde a alrededor de 20 años-paquete. Las imágenes intraorales se obtuvieron después de la extracción de los dientes 37 y 47 practicada de urgencia (abscesos periodontales).
Al estudiar la distribución intraoral de los signos radiológicos visibles de la periodontitis crónica, Haffajee y Socransky pudieron comprobar una mayor incidencia de defectos óseos alveolares sobre todo en el sector anterosuperior y en la región de los molares en los fumadores73.
Periodontitis agresiva
Apenas existe información acerca de la influencia del tabaquismo en el desarrollo de periodontitis agresivas (PA). En un estudio transversal realizado en 612 pacientes latinoamericanos de edades comprendidas entre 14 y 29 años, Susin y Albandar examinaron la prevalencia de la PA y la relación con posibles factores de riesgo. El 5,5% de los pacientes de este estudio mostró una periodontitis agresiva relacionada de forma estadísticamente significativa con las variables nivel socioeconómico, tabaquismo y cálculo dental. Se observó que los fumadores de más de 10 cigarrillos al día tenían un riesgo 3,1 veces superior de padecer una PA87. En otro estudio transversal, Levin et al hallaron una periodontitis agresiva en el 5,9% de un total de 642 pacientes de edades comprendidas entre 18 y 30 años. También en este estudio la prevalencia de la PA fue significativamente mayor en los fumadores88.
Resultados terapéuticos en pacientes fumadores con periodontitis
Los resultados terapéuticos del tratamiento periodontal conservador89, del tratamiento quirúrgico90,91 o de la cirugía periodontal regenerativa92-96 y también de la cirugía plástica periodontal68,91,96-98 son peores en los fumadores. En comparación con los no fumadores, los fumadores experimentan una menor «retracción de las bolsas»99-102 y consiguen una menor ganancia de inserción clínica99,100,103,104. En general, la cicatrización después de una intervención de cirugía periodontal suele ser más lenta105,106.
Evaluación del riesgo periodontal
El esquema desarrollado por la Universidad de Berna bajo la dirección del Prof. N.P. Lang para evaluar el riesgo periodontal (http://www.dental-education.ch/ risikobeurteilung) es una buena herramienta para estimar la posible progresión de la enfermedad periodontal.
La evaluación del riesgo se basa en seis parámetros: 1) sangrado al sondaje, 2) número de puntos con una profundidad de sondaje superior a 5 mm, 3) cantidad de dientes perdidos, 4) pérdida de hueso alveolar, 5) factores sistémicos (como la diabetes mellitus) y 6) factores ambientales (como fumar: cantidad de cigarrillos fumados).
Los fumadores de más de 20 cigarrillos al día reciben una calificación de alto riesgo en el instrumento de evaluación del riesgo periodontal de Lang y Tonetti, lo que está plenamente justificado por la abundancia de evidencia científica disponible en la bibliografía. Por tanto, en los fumadores de más de 20 cigarrillos al día se recomienda un intervalo de 3 meses entre las visitas de revisión para un correcto seguimiento clínico.
Implantes dentales en fumadores
La rehabilitación con implantes sólo proporciona resultados satisfactorios si previamente se lleva a cabo, en los casos en que haga falta, un tratamiento periodontal para conseguir un periodonto sin sintomatología inflamatoria o para evaluar la respuesta del huésped a las intervenciones terapéuticas. En el paciente fumador con periodontitis es especialmente preferible conservar los dientes naturales en lugar de recurrir a los implantes. Del mismo modo que el tejido periodontal, los tejidos periimplantarios también están expuestos a la película biológica oral y a otros posibles agentes nocivos, como los componentes del humo del tabaco. En pacientes propensos, esto puede provocar una mucositis periimplantaria y, posteriormente, una periimplantitis. Sin tratamiento, el proceso evoluciona en una primera fase a la destrucción del hueso periimplantario y, en muchos casos, culmina con la pérdida del implante correspondiente. Durante los últimos 20 años, se ha estudiado la influencia del tabaquismo sobre diferentes criterios de éxito de los implantes orales. En un análisis retrospectivo de 2.194 implantes orales realizados en 540 pacientes durante un período de 6 años, Bain y Moy observaron significativamente más fracasos de implantes en los pacientes fumadores107. Con una tasa global de fracasos del 5,9% en todos los pacientes, la tasa de fracasos en los fumadores es del 11,3% en comparación con los no fumadores, en los que sólo fracasa el 4,8% de los implantes. Las diferencias entre fumadores y no fumadores fueron estadísticamente significativas en todas las regiones maxilares y mandibulares salvo en el sector posteroinferior. Estos resultados han sido confirmados por varios estudios retrospectivos en los que se utilizaron sistemas de implante distintos108,109. Wilson y Nunn indicaron un factor de riesgo de 2,5 para el fracaso de un implante en fumadores110. En un estudio de revisión en tres partes, Roos-Jansaker et al sometieron a seguimiento 1.057 implantes en 218 pacientes durante un período de 9 a 14 años111,112. También en estos estudios a largo plazo se constató que la probabilidad de desarrollar una periimplantitis era claramente superior en los pacientes fumadores que en los pacientes no fumadores113. Otros estudios analizaron específicamente el efecto del tabaquismo sobre los tejidos duros y los tejidos blandos periimplantarios. Se logró establecer una relación evidente entre fumar cigarrillos y una pérdida ósea periimplantaria significativa114,115, así como una mayor incidencia de inflamación del tejido blando114,116. Karoussis et al comprobaron en un estudio retrospectivo de 10 años de duración que los fumadores habían perdido aproximadamente 1 mm más de hueso alveolar que los no fumadores117. La gravedad de la pérdida de hueso alveolar se correlaciona con la cantidad de cigarrillos fumados al día115.
La tasa de fracaso de los implantes en los fumadores es especialmente alta en tratamientos con técnicas de aumento en los que se utiliza hueso y materiales de sustitución ósea118,119. Esta tasa puede ser del 13-22% en los fumadores en comparación con el 5-13% en los no fumadores120.
Posibles aspectos patogénicos de la mayor predisposición de los fumadores a la periodontitis y la periimplantitis
Las enfermedades del aparato periodontal y de los tejidos periimplantarios muestran una etiología multifactorial parecida. El tabaquismo desempeña un papel esencial en la patogénesis de ambas enfermedades. Sin embargo, no se trata de un efecto unidimensional manifiesto, como un efecto antiinflamatorio asociado al tabaco, sino más bien de una influencia compleja sobre diferentes funciones celulares y tisulares. Hasta ahora, se han realizado estudios experimentales de laboratorio sobre todo de los efectos específicos de la nicotina y de sus productos de degradación sobre los tejidos periodontales. Sin embargo, para averiguar hasta qué punto los resultados de estos estudios son extrapolables a los tejidos periimplantarios harán falta nuevos estudios centrados específicamente en los implantes. Los niveles de nicotina son altos en el suero, la saliva y el líquido crevicular de los fumadores121,122. Por lo tanto, los tejidos periodontales o los tejidos periimplantarios están expuestos continuamente a la nicotina. Se barajan diferentes mecanismos patogénicos.
Mecanismos oxidativos
Las especies reactivas de oxígeno (ROS) forman parte del grupo de los radicales libres. Se trata de compuestos químicos con electrones desapareados liberados por el organismo huésped en determinadas circunstancias, como al fumar un cigarrillo. Así, por ejemplo, los radicales hidróxido (OH-) y peroxilo (HOO-) son responsables de numerosas alteraciones tisulares como resultado de la destrucción del ADN del huésped, de la peroxidación lipídica de la membrana celular, del daño de las células endoteliales y de la inducción del crecimiento de la musculatura lisa vascular123 (VSMC). Además, las ROS activan la síntesis de mediadores proinflamatorios esenciales para la patogénesis de las enfermedades periodontales y las enfermedades periimplantarias, como la interleucina 6, el factor de necrosis tumoral alfa (TNF-a) o la interleucina-1b124 (IL-1b).
Microbiología oral
La composición microbiológica de las lesiones periodontales y de las lesiones periimplantarias es parecida. Es probable que el hábito de fumar modifique el medio subgingival. Se crearían de este modo condiciones favorables al crecimiento de distintas especies bacterianas patógenas, lo que fomenta la selección de una flora patógena compuesta por gérmenes anaerobios125. Algunos patógenos potenciales, como Agregatibacter actinomycetemcomitans (antes Actinobacillus actinomycetemcomitans) o Porphyromonas gingivalis, tienen una mayor capacidad de colonización de células epiteliales dañadas por la nicotina126.
Metabolismo del tejido conjuntivo y del tejido óseo
En estudios en animales de experimentación se pudieron demostrar diversos efectos de la nicotina sobre el metabolismo óseo106,127,128. En los fumadores se observó una menor mineralización ósea en comparación con los no fumadores y también se midieron niveles más altos de calcio en la saliva129. Se observó así mismo una menor absorción intestinal de calcio130. Parece existir además un efecto aditivo de los lipopolisacáridos (LPS), un componente de la pared celular de las bacterias gram negativas, y de la nicotina sobre el metabolismo de los osteoblastos y de los osteoclastos131 (células formadoras y células destructoras de hueso, respectivamente). Ésta podría ser una posible explicación del efecto potenciador recíproco del control deficiente de la placa dental y del tabaquismo.
Irrigación
Diversos estudios científicos describieron los posibles efectos patogénicos del tabaquismo sobre la perfusión tisular o la función celular endotelial. En algunos estudios, por ejemplo, se observaron reacciones inflamatorias vasculares menos marcadas en los fumadores en modelos experimentales clásicos de gingivitis o en relación con la tendencia al sangrado durante el sondaje periodontal83,84.
No obstante, hasta ahora, no se han logrado encontrar alteraciones tisulares microscópicas claras en los tejidos periimplantarios y en los tejidos periodontales que expliquen los signos clínicos.
Sistema inmunitario
La nicotina y otros componentes del humo del tabaco influyen en los procesos defensivos del organismo afectado132-134. Dado que la respuesta inmunitaria del huésped al estímulo bacteriano es responsable de gran parte de los daños periodontales y también de los daños periimplantarios, se deduce que la influencia del tabaco sobre el sistema inmunitario es muy importante desde el punto de vista patogénico.
Interacciones entre el tabaquismo y posibles factores de riesgo genéticos
Tiene que existir una predisposición de origen genético para desencadenar la aparición o la progresión de enfermedades periodontales o de enfermedades periimplantarias135-137. Parece existir un efecto sinérgico de determinados polimorfismos (existencia de múltiples alelos de un gen) y factores ambientales, como el tabaquismo, que es característico de las enfermedades multifactoriales.
La interleucina-1b es una citocina producida por los macrófagos y los neutrófilos polimorfonucleares, entre otros. Esta citocina induce la producción de otras citocinas proinflamatorias, como la prostaglandina E2, y también la secreción de enzimas catabólicas, como las metaloproteinasas de matriz. De forma similar a las posibles interacciones sinérgicas de los factores de riesgo adquiridos y de los factores de riesgo hereditarios en las enfermedades periodontales, existen indicios en este sentido también para el riesgo de complicaciones en los implantes orales138,139.
Oportunidades del equipo de la consulta dental para la intervención breve
Organización en la consulta
A diferencia del personal de la consulta de medicina general, el equipo de la consulta dental suele tener un contacto periódico con el paciente y, si se trabaja con un enfoque preventivo, dicho contacto es más frecuente. Por esa razón, la consulta dental es la plataforma ideal para motivar a sus pacientes fumadores para que dejen de fumar a través de diversas intervenciones a lo largo de meses o incluso años. Todos los miembros de la consulta odontológica desempeñan una labor específica en el equipo que guía al paciente en el proceso de deshabituación del tabaco. Un reparto organizado de funciones permite dar un recibimiento profesional al paciente en la consulta odontológica, abordar con él periódicamente el problema del tabaquismo (fig. 5) y proporcionarle un seguimiento sin fisuras si decide iniciar un tratamiento de deshabituación. El personal auxiliar y el personal administrativo de la consulta odontológica pueden apoyar al equipo encargándose de solicitar material informativo sobre deshabituación tabáquica para distribuir en la sala de espera, de gestionar las hojas de anamnesis del consumo de tabaco o de codificar las historias clínicas de los pacientes correspondientes. En el sitio web del Grupo de Trabajo suizo www.dental-education.ch/smoking, se puede descargar gratuitamente a través de «Downloads» todo el material administrativo necesario para la consulta odontológica en cuatro idiomas.
Figura 5. Se deberá entregar la anamnesis del hábito tabáquico a todos los pacientes antes de iniciar el tratamiento odontológico. Este documento servirá de base para la sesión informativa relativa a las repercusiones orales y sistémicas del tabaquismo en aquellos pacientes que declaren ser fumadores.
El método de las «5A»
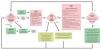
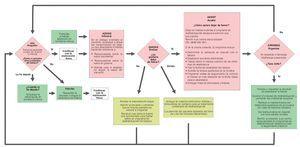
En el primer Seminario Europeo sobre Prevención y Deshabituación del Tabaquismo para odontólogos celebrado en otoño de 2005 en Suiza se adaptó el método de las «5A», como modelo basado en la evidencia, para su aplicación en la consulta odontológica140 (fig. 6).
Figura 6. Esquema para la prevención y la deshabituación del tabaco en la consulta odontológica elaborado en el primer Seminario Europeo sobre Prevención y Deshabituación del Tabaquismo para odontólogos celebrado en otoño de 2005 en Suiza.
Este método sencillo consiste en combinar un tratamiento sustitutivo de la nicotina con un asesoramiento profesional para un cambio de conducta según el procedimiento de las «5A»:
Ask (preguntar): anamnesis del hábito tabáquico en cada paciente.
Advise (informar): información sobre los riesgos del tabaco para la salud en general y la salud oral en particular, mostrar las ventajas de dejar de fumar.
Assess (evaluar): ¿existe, en este momento, la voluntad para dejar de fumar?
Assist (ayudar): ¡ofrecer ayuda! Asesoramiento profesional para fumadores, folletos, tratamientos sustitutivos de la nicotina.
Arrange (organizar): programar visitas de revisión, ponerse de acuerdo con el paciente para abordar nuevamente el tema del tabaquismo o del abandono del hábito de fumar en una próxima sesión.
Las tasas de éxito del asesoramiento para dejar de fumar dependen del tiempo invertido. Con sesiones con una duración de 1-3 min, 4-30 min, 31-90 min y > 90 min, se obtienen tasas de éxito del 14,0%, 18,8%, 26,5% y 28,4%, respectivamente141. La presencia de síntomas de abstinencia de nicotina puede complicar considerablemente el proceso de deshabituación. Los síntomas más frecuentes son cefalea, trastornos digestivos, trastornos del sueño, depresiones o un aumento del apetito que, a su vez, provoca un aumento de peso no deseado. Estos síntomas pueden aparecer poco después de haber fumado el último cigarrillo y pueden persistir durante varios días o semanas en caso de continuar la situación de abstinencia. Todos estos síntomas se pueden controlar en gran medida mediante un tratamiento farmacológico específico, es decir, con un tratamiento sustitutivo de la nicotina. Este tratamiento puede ayudar a los exfumadores a abandonar el hábito de fumar e incorporar las medidas sustitutivas previstas como un nuevo hábito a su vida diaria sin ceder al anhelo físico de obtener la nicotina a través del tabaco.
Conversación: entrevista motivacional (breve), EMB
Diversos estudios de investigación conductual confirman los buenos resultados obtenidos con una entrevista motivacional (EM) realizada según las reglas del arte, es decir, un método de entrevista centrado en el paciente destinado a apoyar los esfuerzos de asesoramiento para dejar de fumar. Para la intervención breve en el marco de la consulta odontológica parece ser suficiente una «versión breve» de esta entrevista, la entrevista motivacional breve (EMB). El objetivo de esta entrevista es averiguar, en un período de tiempo relativamente corto (menos de 5 min) y de forma discreta, el grado de motivación existente para cambiar de conducta, la confianza del paciente en su capacidad para lograr cambiar de conducta y conseguir un acuerdo para abordar de nuevo este tema en una próxima sesión.
Conclusión
El tabaquismo puede provocar, en función de la dosis y de la duración del consumo, algunas enfermedades orales potencialmente mortales. Con un cribado oportunista mediante una exploración sencilla, los odontólogos pueden contribuir a la detección precoz del carcinoma de células escamosas oral.
Las enfermedades periodontales inducidas por el tabaco difieren de las periodontitis en pacientes no fumadores por la etiopatogenia, el diagnóstico y el tratamiento de la enfermedad. Los fumadores suelen presentar un cuadro clínico característico con una encía marginal fibrosa, relativamente pálida, que muestra pocos signos inflamatorios clásicos en respuesta a un estímulo bacteriano, así como una escasa tendencia al sangrado. Independientemente del método de tratamiento periodontal elegido, las perspectivas de éxito a largo plazo en los fumadores son poco prometedoras, igual que las de un eventual tratamiento rehabilitador con implantes. Además, en los fumadores, el tratamiento periodontal de apoyo es más complejo y requiere intervalos más cortos entre sesiones. Los conocimientos etiopatogénicos actuales, la clínica característica en muchos casos y la evolución especial de los tratamientos en los fumadores parecen justificar el uso del término «periodontitis del fumador» en combinación con la clasificación actual vigente de las enfermedades periodontales. Por lo tanto, además del plan terapéutico periodontal convencional, se debería integrar en el tratamiento de la «periodontitis del fumador» un programa de deshabituación del tabaco que tiene por objetivo el abandono definitivo del hábito de fumar142-144.
El tabaquismo es un factor de riesgo importante de fracaso de un implante o de una periimplantitis. La prevención de la periimplantitis y la selección crítica de los pacientes adecuados para una rehabilitación con implantes son dos factores esenciales a tener en cuenta en la planificación terapéutica, dado que el tratamiento de esta enfermedad sigue siendo extremadamente complejo y no existen enfoques terapéuticos predecibles.
Todavía no se conocen todos los detalles de las múltiples formas de influencia del tabaquismo en las enfermedades orales. Sin embargo, se supone que el tabaco interfiere en la función fisiológica de la mayoría de los tejidos del organismo humano. De forma similar al choque frontal que supusieron las «ideas revolucionarias» sobre higiene bucodental a mediados del siglo pasado, muchos compañeros de profesión evalúan de forma muy crítica el asesoramiento del fumador en la consulta odontológica. Sin embargo, gracias al elevado ritmo de visitas que reciben, estos centros asistenciales parecen estar especialmente predestinados a las intervenciones breves, cuyo objetivo es conseguir que el paciente deje de fumar. En un seminario internacional se adaptó el método de deshabituación de las «5A», una técnica de fácil implantación, para el uso en la consulta odontológica. Este método constituye un instrumento práctico para el asesoramiento de los fumadores.
Webs recomendadas
www.dental-education.ch/smoking
www.dental-education.ch/risikobeurteilung
www.at-schweiz.ch
www.who.int/tobacco/global_data/country_profiles/en
Correspondencia: Dr. med. dent. Clemens Walter.
Director médico.
Universitätskliniken für Zahnmedizin Basel. Klinik für Parodontologie, Endodontologie und Kariologie.
Hebelstrasse 3, 4056 Basilea, Suiza.
Correo electrónico: clemens.walter@unibas.ch
Separata modificada a partir de: Walter C, Bornstein MM, Ramseier CA. Der Stellenwert des Tabakkonsums für die orale Gesundheit. Wissen Kompakt. 2008;2(4):27-42, Springer Berlin, Heidelberg, Nueva York.