Valorar la utilidad de la determinación del pH vaginal en el primer control del embarazo para el diagnóstico de vulvovaginitis y su relación con la patología obstétrica.
Material y métodosHemos realizado el estudio en 200 embarazadas de bajo riesgo. Efectuamos el pH vaginal en el primer control del embarazo a las gestantes. Independientemente de su sintomatología, tomamos cultivo de exudado vaginal (CEV) a 103 pacientes; a las otras 97 pacientes lo realizamos si tenían síntomas y/o un pH > 4,5. Solo pusimos tratamiento si eran sintomáticas. Seguimos la evolución de sus embarazos para valorar su patología obstétrica y sus partos.
ResultadosLa media de pH en la muestra fue 4,41 (4,04–4,78). Encontramos una asociación estadísticamente muy significativa entre la elevación de pH vaginal superior a 4,5 y el aislamiento mediante cultivo de Gardnerella vaginalis (G. vaginalis) (p<0,000), con un OR de 35,15 (4,67–730,39). La mayoría de los cultivos fueron normales, y los gérmenes aislados por orden de frecuencia fueron: Candida albicans (C. albicans) (17,5%), G. vaginalis (7,8%) y Streptococcus agalactiae (7,8%), siendo más del 85% de las gestantes portadoras asintomáticas. La patología obstétrica registrada en nuestra muestra ha sido: amenazas de parto prematuro (2%), roturas prematuras de membranas (2%), partos pretérmino (4,5%) y abortos espontáneos (6%).
ConclusionesEl pH vaginal puede ser una buena prueba de cribado para el diagnóstico de vaginosis bacterianas. El germen más prevalente en nuestra muestra ha sido C. albicans siendo la mayoría de gestantes portadoras asintomáticas. No hemos encontrado relación entre la patología obstétrica registrada y los gérmenes aislados en los cultivos de exudado vaginal.
To assess the usefulness of vaginal pH determination in the first prenatal visit in the diagnosis of vulvovaginitis and its association with obstetric abnormalities.
Material and methodsWe determined vaginal pH in the first prenatal visit in 200 low-risk pregnancies. In 103 women, vaginal secretions were cultured, independently of their symptoms. In the remaining 97 women, culture was performed only if symptoms were present and/or pH was >4.5. Treatment was prescribed in symptomatic women only. The pregnancies were followed up to evaluate obstetric abnormalities and data on deliveries.
ResultsThe mean pH in the study sample was 4.41 (4.04–4.78). We found a statistically significant association (P<.000) between an increase in vaginal pH over 4.5 and isolation through culture of Gardnerella vaginalis (G. vaginalis), with an OR of 35.15 (4.67–730.39). Most cultures were normal. In order of frequency, the identified microorganisms were Candida albicans (C. albicans) (17.5%), G. vaginalis (7.8%) and Streptococcus agalactiae (7.8%). More than 85% of the carriers were asymptomatic. Obstetric pathology in our sample consisted of preterm labor (2%), premature rupture of membranes (2%), preterm delivery (4.5%) and miscarriage (6%).
ConclusionsVaginal pH determination might be an effective screening test for the diagnosis of bacterial vaginosis. The most prevalent microorganism in our sample was C. albicans and most carriers were asymptomatic. We found no relationship between obstetric pathology and the microorganisms isolated in cultures of vaginal secretions.
A pesar de todos los avances científicos seguimos sin conocer cuál es la principal causa de los partos pretérmino. Existen múltiples factores relacionados, pero quizás uno de los más importantes1 sean las infecciones vulvovaginales.
Existen diferentes programas de detección y tratamiento de las infecciones del aparato genital para prevención del parto prematuro2,3, pero existen muy pocos estudios sobre la determinación del pH vaginal durante el embarazo como prueba de cribado en el diagnóstico de vulvovaginitis4,5.
El pH se considera uno de los cuatro criterios clínicos descritos por Amsel desde 19836 para el diagnóstico de vaginosis bacteriana.
Las causas de las vulvovaginitis7 en la población general son en un 90% infecciosas y los gérmenes implicados por orden de frecuencia son: gardnerella (40-50%), cándida (20-25%) y tricomonas (15-20%). Pero existen variaciones según la población estudiada y hay muchos menos estudios de su prevalencia durante el embarazo8–11.
Por otra parte, no todos los gérmenes se han relacionado con la patología obstétrica, los más estudiados han sido las vaginosis bacterianas y, sin embargo, no se han relacionado con esta patología las candidiasis12.
Los objetivos de nuestro estudio han sido, por un lado, valorar la utilidad de la determinación del pH vaginal en embarazadas de bajo riesgo de nuestro medio para el diagnóstico de vulvovaginitis y, por otra parte, determinar la influencia de la infección vaginal en el desarrollo de la patología obstétrica.
Material y métodosHemos efectuado el estudio a 200 embarazadas de un ambulatorio de Bilbao. Durante el primer control de embarazo, normalmente entre las semanas 11 y 14, e independientemente de su sintomatología, efectuamos el pH (mediante tira de pH vaginal) junto con el cultivo de exudado vaginal (CEV) en las 103 primeras pacientes. En las 97 restantes, realizamos el pH y únicamente tomamos CEV si tenían un pH > de 4,5 y/o clínica de vulvovaginitis.
Siguiendo las recomendaciones actuales del Centers for Disease Control and Prevention (CDC)12, Sociedad Española de Ginecología y Obstetricia (SEGO)13 y la revisión bibliográfica efectuada14, en ambos grupos indicamos tratamiento solamente si las pacientes eran sintomáticas.
En cada gestante recogimos los siguientes datos: edad, paridad, antecedentes obstétricos y ginecológicos, sintomáticas o asintomáticas, citología, pH, CEV, tratamiento, patología obstétrica (amenaza de parto prematuro [APP], rotura prematura de membrana [RPM], abortos) y datos del parto (semanas de gestación y tipo de parto).
Para la realización del estudio estadístico descriptivo en variables cuantitativas se emplearon las medidas de tendencia central y de dispersión habituales (media, mediana, varianza y desviación típica) y el cálculo de las distintas frecuencias observadas en las variables cualitativas. Se estudió la asociación entre los resultados de los cultivos obtenidos y la medición del pH vaginal mediante un test exacto de Fisher. Todos los cálculos estadísticos fueron llevados a cabo mediante los programas EpiInfo v. 2.3 (CDC, Atlanta, EE.UU.) y PASW Statistics v. 18 (IBM Corp., Somers, EE.UU.).
ResultadosLa media de pH en nuestra muestra de 200 gestantes fue de 4,41 (4,04-4,78) coincidiendo con los valores normales de pH reflejados en la literatura en las mujeres en edad fértil5. La edad media registrada ha sido de 32,3 (16-47) años, siendo 107 gestantes multíparas. Con respecto a los datos del parto, la media fue de 39 semanas (31-42s), con el 64,4% de partos eutócicos, 15,2% de cesáreas, 13,6% de partos instrumentales y 6,8% de abortos.
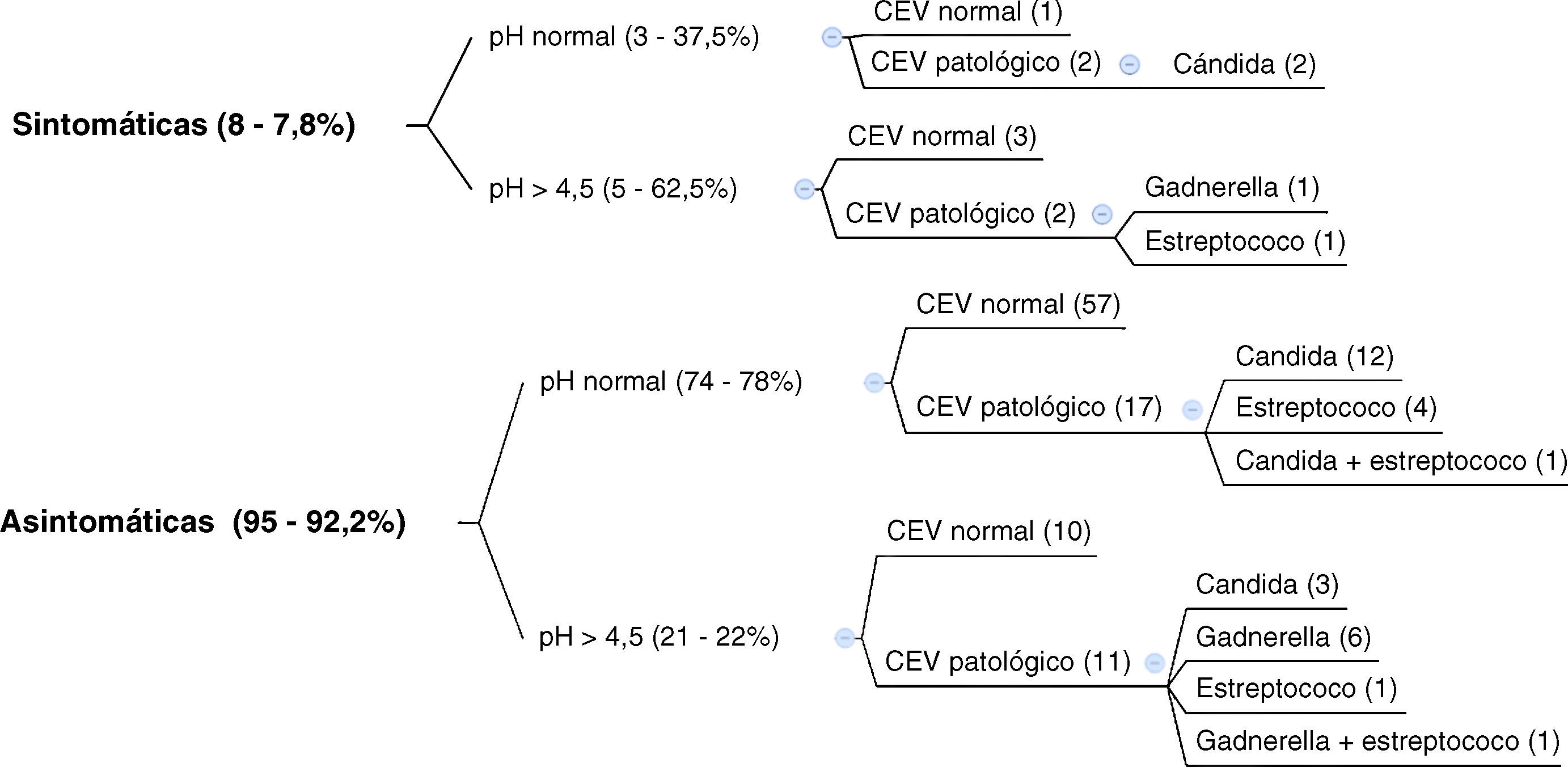
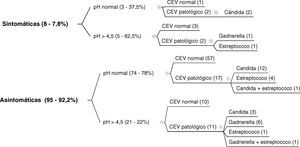
Para relacionar la sintomatología clínica con el valor del pH y el resultado del CEV, dividimos los datos en dos grupos: el primero de 103 gestantes a las que realizamos el pH y el CEV independientemente de su sintomatología (fig. 1).
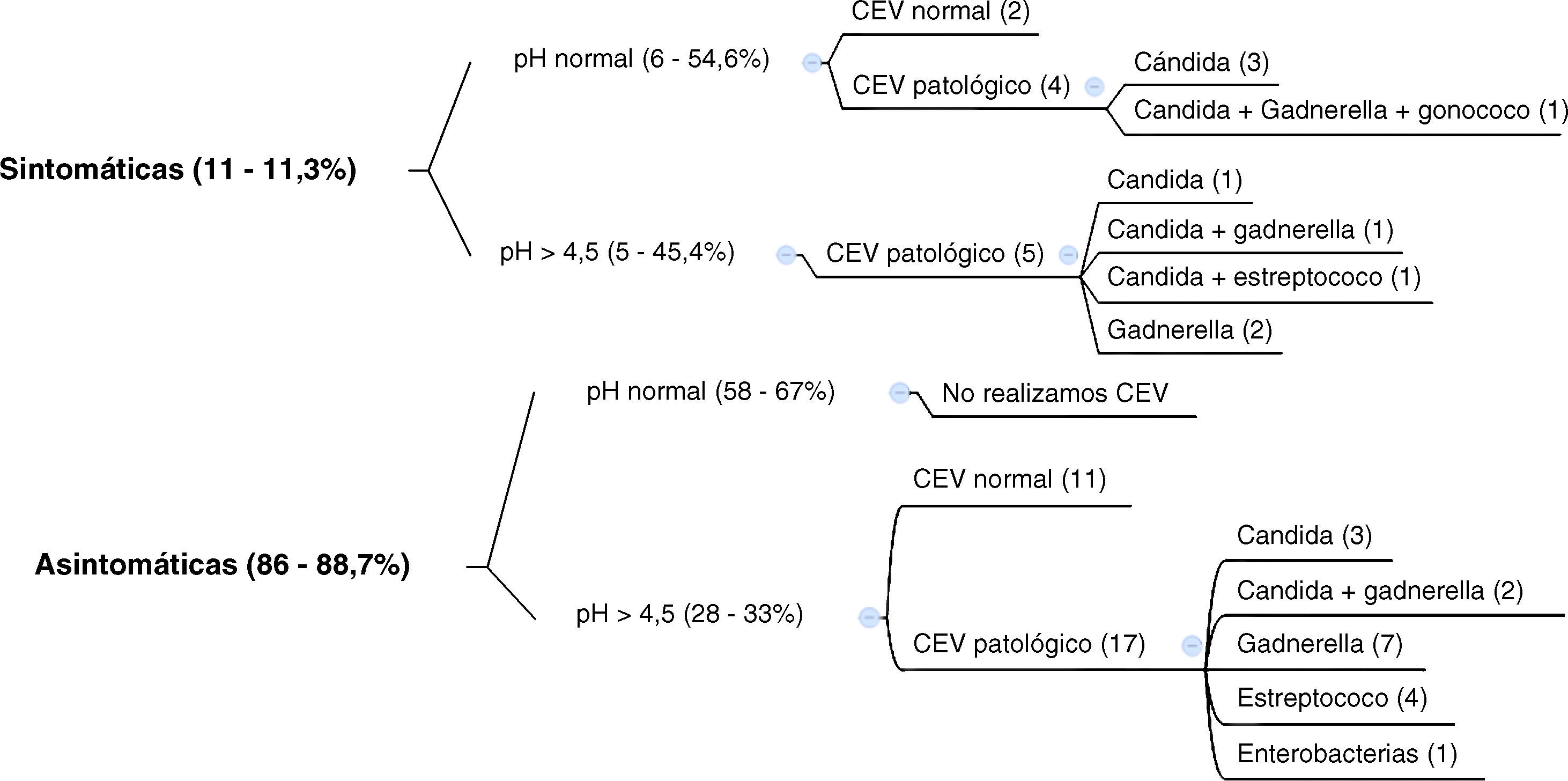
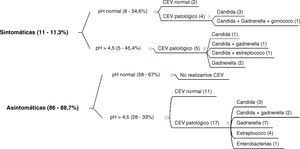
En el segundo grupo de 97 embarazadas (fig. 2) efectuamos el pH a todas las gestantes, pero únicamente recogimos el CEV si el pH era > 4,5 y/o tenían sintomatología de vulvovaginitis. Esto lo hemos realizado teniendo en cuenta que no hemos tenido ningún caso de vaginosis bacteriana en pacientes asintomáticas con un pH normal, y que en las portadoras asintomáticas de estreptococo y/o cándida durante el embarazo no se recomienda su tratamiento.
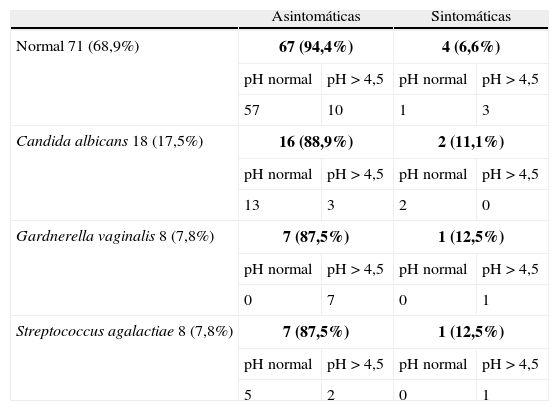
Para poder estudiar las portadoras asintomáticas, analizamos los resultados de los cultivos (tabla 1), centrándonos en el primer grupo de gestantes, en el que realizamos pH y CEV a todas las gestantes.
Resultados de los CEV y su relación con los síntomas y el pH vaginal
| Asintomáticas | Sintomáticas | |||
| Normal 71 (68,9%) | 67 (94,4%) | 4 (6,6%) | ||
| pH normal | pH > 4,5 | pH normal | pH > 4,5 | |
| 57 | 10 | 1 | 3 | |
| Candida albicans 18 (17,5%) | 16 (88,9%) | 2 (11,1%) | ||
| pH normal | pH > 4,5 | pH normal | pH > 4,5 | |
| 13 | 3 | 2 | 0 | |
| Gardnerella vaginalis 8 (7,8%) | 7 (87,5%) | 1 (12,5%) | ||
| pH normal | pH > 4,5 | pH normal | pH > 4,5 | |
| 0 | 7 | 0 | 1 | |
| Streptococcus agalactiae 8 (7,8%) | 7 (87,5%) | 1 (12,5%) | ||
| pH normal | pH > 4,5 | pH normal | pH > 4,5 | |
| 5 | 2 | 0 | 1 | |
Negrita: el número de casos (y su porcentaje) encontrados para cada combinación fila-columna.
Si valoramos los cultivos de toda la muestra de 200 gestantes, los resultados globales han sido: 58 (29%) no realizados por pH normal y estar asintomáticas, normales 84 (42%) y patológicos 58 (29%), con 30 (15%) de cándidas, 21 (10,5%) de gadnerella (todas menos una con pH > 4,5), 13 (6,5%) de estreptococo y una (0,5%) caso de gonococo. En 7 (3,5%) casos se aislaron varios gérmenes.
Se observó una asociación estadísticamente muy significativa entre la elevación de pH vaginal y el aislamiento mediante cultivo de Gardnerella vaginalis (G. vaginalis) (p<0,000), lo que sugiere que el aumento del pH pudiera estar ligado con el sobrecrecimiento de dicho microorganismo. Calculando la OR entre los valores de pH vaginal superiores a 4,5 y el aislamiento de G. vaginalis en cultivo obtuvimos un valor de 35,15 (4,67-730,39) lo que nos indica que tenemos una posibilidad 35 veces mayor de aislar dicho microorganismo en una muestra vaginal con un pH mayor de 4,5 respecto a aquellas con un pH inferior a este punto de corte.
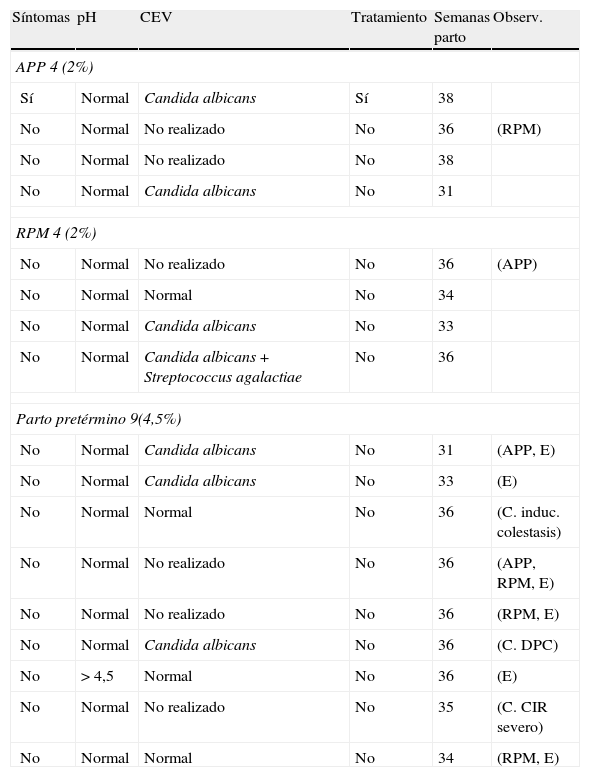
Otro objetivo de nuestro estudio ha sido relacionar los resultados de los cultivos con la patología obstétrica (tabla 2) para lo que seguimos la evolución del embarazo en todas las pacientes.
Patología obstétrica y su relación con la clínica, el pH, los CEV y datos del parto
| Síntomas | pH | CEV | Tratamiento | Semanas parto | Observ. |
| APP 4 (2%) | |||||
| Sí | Normal | Candida albicans | Sí | 38 | |
| No | Normal | No realizado | No | 36 | (RPM) |
| No | Normal | No realizado | No | 38 | |
| No | Normal | Candida albicans | No | 31 | |
| RPM 4 (2%) | |||||
| No | Normal | No realizado | No | 36 | (APP) |
| No | Normal | Normal | No | 34 | |
| No | Normal | Candida albicans | No | 33 | |
| No | Normal | Candida albicans + Streptococcus agalactiae | No | 36 | |
| Parto pretérmino 9(4,5%) | |||||
| No | Normal | Candida albicans | No | 31 | (APP, E) |
| No | Normal | Candida albicans | No | 33 | (E) |
| No | Normal | Normal | No | 36 | (C. induc. colestasis) |
| No | Normal | No realizado | No | 36 | (APP, RPM, E) |
| No | Normal | No realizado | No | 36 | (RPM, E) |
| No | Normal | Candida albicans | No | 36 | (C. DPC) |
| No | > 4,5 | Normal | No | 36 | (E) |
| No | Normal | No realizado | No | 35 | (C. CIR severo) |
| No | Normal | Normal | No | 34 | (RPM, E) |
APP: amenaza de parto prematuro; C: cesárea; CIR: crecimiento intrauterino retardado; DPC:desproporción pélvico cefálica; E: eutócico; RPM: rotura prematura de membrana.
Hemos tenido 4 (2%) amenazas de parto prematuro. En una de ellas, sintomática en el primer control de embarazo y con un pH normal, aislamos Candida albicans (C. albicans), por lo que la tratamos, siendo el parto a las 38 semanas. Las otras tres gestantes estaban asintomáticas, y tenían un pH normal (dos de ellas no tenían recogido CEV en el primer control del embarazo). Una de éstas tuvo un RPM y parto a las 36 semanas; en la otra, se había aislado C. albicans, pero no se puso tratamiento por estar asintomática, teniendo un parto pretérmino a las 31 semanas.
Hemos tenido 9 casos (4,5%) de parto pretérmino. Uno de ellos fue un caso de prematuridad severa a las 31s; otro, un caso de prematuridad moderada, que era asintomática, con pH normal y CEV (cándida) en la primera consulta, y que tuvo RPM y parto prematuro a las 33s. La gran mayoría, 7 pacientes, presentaron prematuridad leve, siendo todas ellas asintomáticas en el primer control (6 tenían un pH normal y una un pH > de 4,5 con CEV normal). Entre los 9 partos pretérmino tres fueron espontáneos y 6 inducciones (4 de las cuales tras rotura prematura de membranas). Realizamos en estas pacientes tres cesáreas todas ellas después de inducciones por diferentes motivos: una por colestásis, otra por crecimiento intrauterino retardado (CIR) + preeclampsia ambas finalizaron en cesárea por riesgo de pérdida de bienestar fetal y la tercera cesárea fue por detención secundaria de la dilatación tras inducción debido a RPM.
Si analizamos las 4 (2%) roturas prematuras de membranas, todas eran asintomáticas y tuvieron un pH normal en el primer control del embarazo. Una de ellas no se hizo CEV, y corresponde con el caso anteriormente comentado de la APP y RPM con parto a las 36 semanas; en otra, el CEV fue normal, pero tenía un útero polimiomatoso y rompió la bolsa a las 32+5s con parto en la 34s; en la tercera se aisló cándida, no se puso tratamiento y el parto fue a las 33s; y por último, en la cuarta, se aisló cándida + estreptococo, no se realizó tratamiento y el parto fue a las 36s.
Además tuvimos 12 (6%) abortos: 6 tenían un aborto previo, dos de ellas cirugía uterina anterior y todas ellas estaban asintomáticas. El pH fue normal en 9 de las gestantes con CEV: 5 no realizados, tres normales, una cándida y un estreptococo (único caso de coriamnionitis postamiocentesis) y en tres pacientes el pH fue > de 4,5 con dos CEV normales y una G. vaginalis.
Para terminar solo tuvimos un caso de feto muerto intrauterino a las 33s después de intento de drenaje de derrame pleural severo. Esta paciente tuvo todo el control del embarazo normal (pH, CEV, serologías, estudio cromosómicos) sin encontrarse ninguna causa del derrame.
DiscusiónActualmente las infecciones se consideran uno de los factores patogénicos15 del parto pretérmino susceptible de ser diagnosticado y tratado. Dentro de ellas se encuentran las vulvovaginitis. Aunque se han relacionado con diferentes gérmenes, no es tan fácil encontrar su relación causal, y su tratamiento muchas veces es controvertido. No parecen existir dudas en cuanto al tratamiento de las pacientes sintomáticas12,13 y, sin embargo, no se recomienda su tratamiento en mujeres asintomáticas, aunque podrían beneficiarse algunas gestantes de alto riesgo obstétrico con vaginosis bacteriana.
Las vaginosis bacterianas se han relacionado en múltiples estudios18–23 con el parto pretérmino. Para su diagnóstico se deben cumplir tres de los 4 criterios clínicos de Amsel6: flujo homogéneo, blanco-grisáceo que cubre suavemente las paredes vaginales, pH > 4,5, test de aminas positivo (fuerte olor a pescado al añadir KOH al 10%, que también sucede con las relaciones sexuales al contacto con el semen), y células clave en el frotis en fresco. El cultivo vaginal no se recomienda para su diagnóstico porque aparece la G. vaginalis hasta en el 50% de las mujeres asintomaticas12.
En nuestro estudio hemos intentado valorar la utilidad de la determinación del pH para el diagnóstico de las vulvovaginitis teniendo en cuenta la facilidad de realización de la prueba y su bajo coste. Los valores del pH vaginal considerados normales en una mujer fértil se sitúan entre 4-4,5 debido a los lactobacilos productores de peróxido de hidrogeno y ácido láctico de la flora vaginal que acidifican el flujo protegiéndoles de infecciones. Sin embargo, en la premenarquia y postmenopausia el pH es > 4,7 ya que, debido al déficit estrogénico, se produce menos glucógeno, que es el sustrato para el crecimiento de los lactobacilos7. También en algunas infecciones vaginales, como las vaginosis bacterianas y las tricomoniasis, el pH es > 4,5. No sucede lo mismo en las candidiasis, que coinciden con valores normales (4-4,5) por lo que la determinación del pH vaginal no es útil para su diagnóstico.
Los valores de pH que aparecen en la literatura han sido confirmados en nuestras gestantes, con un valor medio medido de 4,41. La mayoría, 19 de los 30 casos de cándida aislados tuvieron un valor normal de pH, y de las 11 en las que el pH fue > 4,5, en 4 aislamos varios gérmenes. Encontramos 13 casos de Streptococcus agalactiae (S. agalactiae), 5 con un pH normal y 8 con pH > 4,5.
Lo más llamativo de nuestros resultados ha sido que de los 21 casos de G. vaginalis todos menos una han tenido un pH > de 4,5. Esto corroboraría el valor diagnóstico del pH para el diagnóstico de las vaginosis bacterianas, como ya fue descrito por Amsel en 19836 considerándolo uno de los 4 criterios clínicos para su diagnóstico.
Para poder analizar las portadoras asintomáticas reflejaremos los datos del primer grupo de 103 gestantes a las que realizamos pH junto con CEV. Los cultivos fueron normales en el 68,9% de las gestantes, de las cuales el 94,4% estaban asintomáticas. En el 17,5% aislamos C. albicans (88,9% asintomáticas); G. vaginalis apareció en el 7,8% de gestantes (87,5% asintomáticas) y S. agalactiae en el 7,8% (87,5% asintomáticas). Nuestros datos difieren con los encontrados en la literatura7,8,13 que aíslan la cándida en el 20-25% de las vulvovaginitis (10-50% asintomaticas); gadnerella en el 40-50% (hasta más del 50% asintomaticas) y tricomonas en el 15-20% (5-15%). Estas variaciones en los datos recogidos probablemente tengan que ver con las diferencias existentes según la población estudiada9–11 debiéndose tener en cuenta que nuestra muestra contiene solo mujeres embarazadas de bajo riesgo.
En cuanto al tratamiento de las vulvovaginitis durante el embarazo existe consenso en tratar a las gestantes solo si tienen clínica, siendo las pautas recomendadas por el CDC12 y la SEGO13: para las candidiasis, derivados azólicos locales en pauta larga, 7 días (nosotros utilizamos el clotrimazol o fenticonazol); en los casos de vaginosis bacteriana metronidazol o clindamicina (utilizamos metronidazol gel durante 5 días); y en las tricomonas se recomienda metronidazol oral 2 g dosis única (no tuvimos ningún caso en nuestra muestra). Tampoco se deben tratar las candidiasis en embarazadas sin clínica, ya que no se han relacionado con resultados adversos durante el embarazo17. Sin embargo, el diagnóstico y tratamiento de la gestante asintomática con una vaginosis bacteriana es controvertido 3,18–23. Según el CDC12, y apoyándose en múltiples estudios14-22, podría reducir el riesgo de prematuridad en gestantes de alto riesgo por parto pretérmino previo, pero existen datos insuficientes para hacer una recomendación como práctica rutinaria.
Ya que la población estudiada era en principio de bajo riesgo obstétrico, únicamente tratamos a las pacientes sintomáticas, pero seguimos la evolución de los embarazos de toda la muestra.
La patología obstétrica recogida en nuestras gestantes ha sido:
Cuatro casos (2%) de APP. Este dato es difícil de comparar con la literatura ya que muchas corresponden con falsas amenazas de parto prematuro. Lo que sí se recoge en los trabajos consultados son los partos pretérmino, que suelen suponer entre un 8-10%24, aunque en nuestra muestra ha sido algo inferior: 9 casos, lo que supone un 4,5%. Probablemente, esta disparidad tenga que ver con que nuestras gestantes son de bajo riesgo obstétrico. No tuvimos ningún caso de prematuridad extrema (< 28s), y en la mayoría de casos, 7 (77,7%), los partos se produjeron entre la 34-36 + 6s, lo que constituye un grado de prematuridad leve, coincidiendo con los datos recogidos en la literatura24.
Hemos tenido otros 4 casos de RPM, lo que supone un 44,4% de los partos pretérmino, siendo algo más alto en nuestra muestra que en la bibliografía revisada, que habla de un 20-30%15,24.
También hemos registrado los abortos espontáneos: 12 casos (6%). La mitad de las pacientes tenía al menos un aborto previo (dos de éstas tenían cirugía uterina previa). La prevalencia es más baja que la reflejada en la literatura de entre el 10-20% de los embarazos25.
En nuestra muestra, C. albicans ha sido el germen más prevalente en las gestantes con patología obstétrica (APP, parto pretérmino, RPM y abortos), lo que posiblemente se explique porque ese ha sido el germen más frecuentemente aislado. Sin embargo, no podemos relacionar las vaginosis bacterianas con la patología obstétrica según los datos recogidos. Esto apoyaría la recomendación actual de grado 1A: no existe evidencia de que el cribado y el tratamiento de las vaginosis bacterianas reduzca el riesgo del parto pretérmino26.
ConclusionesEn nuestro estudio, el pH vaginal ha resultado de gran utilidad para el diagnóstico de vaginosis bacteriana. Además, tenemos que tener en cuenta la facilidad de obtención de la muestra y el bajo coste de la prueba. Con estos datos creemos que sería interesante incorporarlo más frecuentemente a nuestro arsenal diagnóstico.
Existen importantes diferencias en los gérmenes implicados en las vulvovaginitis según la población estudiada, siendo en nuestra muestra C. albicans la más prevalente.
Entre las posibles etiologías del parto pretérmino queda por determinar la relación de las vulvovaginitis con la patología obstétrica.
Actualmente, y con un grado de recomendación 1A, no existe evidencia de que ni el cribado ni el tratamiento de las vaginosis bacterianas en gestantes asintomáticas de bajo riesgo disminuyan el parto pretérmino, tal como lo hemos podido confirmar en nuestra muestra de 200 gestantes.
Sería interesante realizar un estudio con mayor número de pacientes y adecuadamente randomizado para confirmar nuestros resultados y poder aplicarlos a la práctica clínica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A nuestra enfermera, M. Ángeles Okamika, por su ayuda incondicional para poder realizar este artículo y su apoyo a nuestra labor clínica diaria.