Analizar las discordancias entre la estadificación pre- y posquirúrgica en los cánceres de endometrio operados en nuestro servicio.
Material y métodoEstudio retrospectivo de los cánceres de endometrio operados por vía laparoscópica entre el 1 de enero de 2005 y el 31 de agosto de 2014. Se han calculado la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo de la resonancia nuclear magnética y la biopsia de endometrio realizadas antes de la intervención quirúrgica, así como el porcentaje de mujeres que podrían haber sido infra- y sobretratadas en el caso de no haber realizado biopsia intraoperatoria de la pieza de histerectomía.
ResultadosHemos operado 174 cánceres de endometrio. La sensibilidad de la resonancia nuclear magnética para el diagnóstico de tumores en estadio I fue del 95,09%, la especificidad de 63,33%, el valor predictivo positivo de 93,37% y el valor predictivo negativo de 70,37%. Para la biopsia preoperatoria la sensibilidad para detectar tumores de grado 1 fue del 90,91%, la especificidad del 65,38%, el valor predictivo positivo de 74,77% y el valor predictivo negativo de 86,44. De no haber realizado biopsia intraoperatoria 21 mujeres (12,65%) de las 166 en estadio I hubiesen sido infratratadas y un 3,61% hubiesen sido sobretratadas.
ConclusiónEn los estadios iniciales del cáncer de endometrio la biopsia intraoperatoria de la pieza quirúrgica resulta imprescindible para evitar sobre e infratratamientos.
To analyse differences between preoperative and postoperative staging in a series of patients with endometrial cancer who underwent surgery in our department.
Material and methodsWe conducted a retrospective study of malignant endometrial tumours treated by laparoscopic surgery between January 1st 2005 and August 31st 2014. We calculated the sensitivity, specificity, positive predictive value and negative predictive value of magnetic resonance imaging and biopsy performed before the intervention. We estimated the percentage of women at risk of over- and under-treatment if intraoperative biopsy had not been performed.
ResultsWe included 174 malignant endometrial tumours. The sensitivity, specificity, positive predictive value and negative predictive value of magnetic resonance imaging was 95.09, 63.33, 93.37 and 70.37%, respectively. For preoperative biopsy, the results were sensitivity (90.91%), specificity (65.38%), positive predictive value (74.77%) and negative predictive value. (86.44%). If intraoperative biopsy had not been performed, 12 of 166 (12.65%) women in stage 1 would have been undertreated and 3.61% would have been overtreated.
ConclusionIntraoperative biopsy should be mandatory in the early the stages of endometrial cancer to avoid under- and over-treatment.
A pesar de que el cáncer de endometrio es el cáncer ginecológico más frecuente entre las mujeres1 y, por tanto, forma parte de la actividad clínica rutinaria de muchos hospitales, todavía existen controversias sobre su tratamiento. Habitualmente, el cáncer de endometrio se diagnostica en estadios precoces y la tasa de supervivencia a los 5 años en los casos en los que la enfermedad está confinada al útero es del 96%1.
En los estadios iniciales, el tratamiento es quirúrgico y la profundidad de la invasión biometría, el tipo histológico del tumor y su grado histológico son los factores más importantes para decidir realizar una linfadenectomía2.
Una revisión de la Cochrane del año 20103 que incluyó el estudio ASTEC4 y el ensayo clínico de Panici5 concluyó que no hay evidencia para recomendar la linfadenectomía en los estadios I del cáncer de endometrio. El problema estriba en cómo podemos determinar que realmente se trata de un estadio I antes o durante la intervención quirúrgica.
De acuerdo con la Oncoguía Cáncer de Endometrio de la Sociedad Española de Ginecología y Obstetricia del año 2010, se recomienda la realización de linfadenectomía pélvica y aortocava en estadios avanzados, pudiendo obviarse en los estadios IA G1-G26. Según la misma Oncoguía, la decisión de realizar o no la linfadenectomía puede realizarse en base a los hallazgos preoperatorios de extensión basados, básicamente, en la biopsia de endometrio y una prueba de imagen que valora el grado de infiltración miometrial (ecografía o resonancia nuclear magnética [RNM]) o en el estudio intraoperatorio de la pieza de histerectomía.
Una encuesta realizada entre 406 ginecólogos oncólogos de EE. UU. y publicada en el año 2010, puso de manifiesto que el 53% de los que respondieron nunca, o rara vez, utilizaban el análisis intraoperatorio de la pieza de histerectomía para la toma de decisiones respecto a la estadificación quirúrgica completa7.
La cuestión principal radica en que un determinado número de pacientes tendrán un diagnóstico final de enfermedad más avanzada que el diagnóstico pre- e intraquirúrgico y, con ello, un mayor riesgo de afectación metastásica ganglionar. Estas pacientes serán, probablemente, infratratadas de su enfermedad lo que puede incidir negativamente en su supervivencia global8. La importancia de realizar una linfadenectomía radica en la posibilidad de poder estadiar adecuadamente la enfermedad y, por ello, poder ofrecer terapias adyuvantes que mejoren la supervivencia. Parece claro que la linfadenectomía tiene un valor pronóstico pero su valor terapéutico está en entredicho.
Conscientes de este problema hemos querido analizar nuestros casos de cáncer de endometrio operados por vía laparoscópica para evaluar las diferencias entre la estadificación prequirúrgica y la posquirúrgica y entender qué hubiese ocurrido si no se realiza un estudio intraoperatorio de la pieza quirúrgica.
Material y métodosHemos analizado, de manera retrospectiva, las historias clínicas de las pacientes de nuestro centro operadas por vía laparoscópica, por presentar un cáncer de endometrio en el periodo comprendido entre el 1 de enero del año 2005 y el 31 de agosto del año 2014. La variable principal en nuestro estudio fue el porcentaje de discrepancias entre el estadio prequirúrgico y el estadio posquirúrgico final de estas pacientes. Como variable secundaria nos planteamos calcular la sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) de la RNM y la biopsia de endometrio preoperatorias.
El estudio prequirúrgico de estas pacientes incluyó la realización de una biopsia endometrial para obtener el tipo y grado histológico del carcinoma, así como la realización de RNM para determinar el grado de infiltración del tumor. Cuando el estadio prequirúrgico era superior al estadio I (FIGO 2009), las pacientes fueron programadas para histerectomía total, doble anexectomía, citología de lavado peritoneal y linfadenectomía pélvica, y en ocasiones paraaórtica. En los casos en que el estudio prequirúrgico concluía que la enfermedad se encontraba en estadio inicial, estadio I, se realizó análisis intraoperatorio de la pieza de histerectomía para determinar la necesidad, o no, de realizar linfadenectomía pélvica y/o paraaórtica. En nuestro protocolo, de acuerdo a las recomendaciones de la Oncoguía de la SEGO, no realizamos linfadenectomía en los casos de adenocarcinoma endometrioide en estadios IAG1 y IAG2. En el resto de estadios realizamos cuanto menos una linfadenectomía pélvica.
Debido a que la FIGO modificó los estadios del cáncer de endometrio en el año 2009, en todos aquellos casos diagnosticados y tratados antes de esa fecha hemos convertido la clasificación previa a la actual, de forma que todos los estadios IA y IB de la clasificación antigua han sido convertidos en IA de la actual y los IC en IB.
En todos los casos la cirugía se realizó bajo anestesia general, con abordaje laparoscópico mediante cuatro trócares y, en algunos casos se realizó una histerectomía total y doble anexectomía asistida por laparoscopia y en otros una histerectomía total laparoscópica y doble anexectomía. Tras realizar la histerectomía la pieza quirúrgica se envió a anatomía patológica para su estudio intraoperatorio. En los casos en los que la infiltración miometrial fue superior al 50% se procedió a realizar linfadenectomía pélvica mientras que la linfadenectomía paraaórtica se reservó para los casos con tumor no endometrioide.
Para el estudio hemos utilizado una base de datos Excel en la que se han recogido los siguientes parámetros: estadio clínico prequirúrgico, grado histológico del tumor, tipo histológico, estadio posquirúrgico definitivo, tipo de intervención quirúrgica realizada, número y tipo de linfadenectomías, número de ganglios linfáticos obtenidos y tasa de complicaciones intra- y postoperatorias.
Los datos se presentan en forma de números absolutos y porcentajes con el intervalo de confianza (IC) del 95%.
Al tratarse de un estudio retrospectivo en el que no se facilita información de las pacientes no se ha solicitado el consentimiento informado de las mismas.
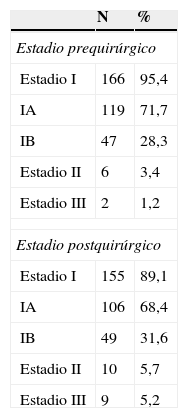
ResultadosEn nuestra serie, de los 174 cánceres de endometrio operados, en 166 casos (95,4%) el estadio prequirúrgico fue I, en 6 (3,4%) casos el estadio fue II mientras que los 2 casos restantes (1,2%) fueron catalogados como estadio III por imagen de RNM compatible con afectación de la serosa uterina. De todos los casos en estadio I, 119 (71,7%) se catalogaron, prequirúrgicamente, mediante RNM como estadio IA, con infiltración de menos del 50% del miometrio. De ellos 95 (79,8%) fueron también clasificados como estadio IA en el diagnóstico final, 16 (13,5%) fueron finalmente estadios IB, 3 (2,5%) fueron estadios II y 5 (4,2%) fueron estadios III (tabla 1). Los resultados muestran que en un 20,2% de las ocasiones en las que se clasificó el tumor en estadio IA hubo un infradiagnóstico en la evaluación preoperatoria.
Distribución de los 174 cánceres de endometrio clasificados por estadio (FIGO 2009) de acuerdo a la RNM
| N | % | |
|---|---|---|
| Estadio prequirúrgico | ||
| Estadio I | 166 | 95,4 |
| IA | 119 | 71,7 |
| IB | 47 | 28,3 |
| Estadio II | 6 | 3,4 |
| Estadio III | 2 | 1,2 |
| Estadio postquirúrgico | ||
| Estadio I | 155 | 89,1 |
| IA | 106 | 68,4 |
| IB | 49 | 31,6 |
| Estadio II | 10 | 5,7 |
| Estadio III | 9 | 5,2 |
Especificidad de la RNM:63,33; sensibilidad de la RNM: 95,09; VPP de la RNM: 93,37; VPN de la RNM: 70,37.
Cuarenta y siete de los estadios I fueron clasificados como estadio IB (28,3%). El diagnóstico final en estos casos fue de IA en 8 ocasiones (17%), IB en 31 (65,9%), II en 3 casos (6,4%) y III en 5 (10,6%) (tabla 2). El porcentaje de infradiagnósticos en este grupo de pacientes estadiadas inicialmente como IB fue del 17% al igual que el porcentaje de sobrediagnósticos, que también fue del 17%. En nuestra experiencia la sensibilidad de la RNM para el diagnóstico de tumores en estadio I fue del 95,09% (IC 95%: 90,23-97,7), la especificidad de 63,33% (IC 95%: 43,91-79,40), el VPP de 93,37% (IC 95%: 88,16-96,48) y el VPN de 70,37% (IC 95%: 49,66-85,50).
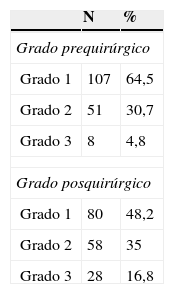
La biopsia endometrial preoperatoria encontró un tumor de grado histológico 1 en 107 de los 166 cánceres en estadio I (64,5%), grado histológico 2 en 51 (30,7%) y grado histológico 3 en 8 casos (4,8%). El diagnóstico final fue de tumor grado 1 en 80 casos (48,2%), grado 2 en 58 (35%) y grado 3 en 28 (16,8%). Para la biopsia preoperatoria la sensibilidad para detectar tumores de grado 1 fue del 90,91% (IC 95%: 82,38-95,71), la especificidad del 65,38% (IC 95%: 53,68-75,56), el VPP de 74,77% (IC 95%: 65,28-82,44) y el VPN de 86,44 (IC 95%: 74,47-93,55).
En nuestro protocolo realizamos linfadenectomía pélvica y/o paraaórtica en todos los casos en estadios superiores al IAG2. En nuestra serie, tuvimos 114 mujeres en estadios IAG1 y IAG2 prequirúrgicos y por lo tanto no candidatas, de inicio, a linfadenectomía. El estudio final de la pieza mostró que solo 93 de estas mujeres presentaban realmente un cáncer de endometrio en estadios IAG1 y IAG2, por lo que de no haber realizado biopsia intraoperatoria 21 mujeres (12,65%) de las 166 en estadio I hubiesen sido infratratadas. Por el contrario, de las 52 mujeres que inicialmente presentaban criterios clínicos para la realización de una linfadenectomía, en 6 casos el análisis intraoperatorio mostró que esta no era necesaria, habiéndose evitado un 3,61% de sobretratamientos. La sensibilidad para la combinación de la RNM y el grado histológico previos a la intervención quirúrgica fue del 93,94% (IC 95%: 86,76-97,51), la especificidad de 68,66% (IC 95%: 56,03-79,13), el VPP de 81,58% (IC 95%: 72,99-87,99) y el VPN de 88,46% (IC 95%: 75,87-95,22).
DiscusiónEn nuestro estudio el porcentaje de infradiagnósticos en los casos etiquetados como IA fue del 20,2%, mientras que en aquellos clasificados inicialmente como IB encontramos un 17% de infradiagnósticos y un 17% de sobrediagnósticos. En total, los diagnósticos preoperatorios podrían haber condicionado un 12,65% de infratratamientos quirúrgicos. El papel de la linfadenectomía en el tratamiento del cáncer de endometrio está en revisión y continua discusión y las guías de práctica clínica varían entre diferentes países.
El estudio prospectivo del Gynecologic Oncology Group demostró que la información obtenida durante la cirugía era el punto clave para determinar el pronóstico de la enfermedad y la supervivencia y, por ello, se recomendó realizar, de manera sistemática, el estudio de las cadenas ganglionares pélvicas y paraaórticas9. Esta mismo grupo definió los cánceres de endometrio de alto riesgo en función del grado de diferenciación del tumor, la presencia de invasión del espacio linfovascular y la profundidad de la invasión miometrial10.
Los resultados del estudio ASTEC, que incluyó de forma prospectiva y randomizada más de 2.000 mujeres no pudieron demostrar la ventaja, en términos de supervivencia, de realizar linfadenectomía4. El estudio ASTEC no acabó por aclarar la controversia sobre el papel de la linfadenectomía y al poco tiempo de su publicación un editorial de Gynecologic Oncology ponía de manifiesto las limitaciones del estudio concluyendo que la evidencia que se puede obtener de este estudio no es de suficiente calidad como para modificar el estándar de tratamiento quirúrgico basado en la realización de linfadenectomía11. A pesar de las críticas, los autores del estudio ASTEC siguen persistiendo en su recomendación de no realizar linfadenectomía de manera sistemática a las mujeres con cáncer de endometrio12.
El problema radica en que los criterios o factores de riesgo que pueden aconsejar la realización de una linfadenectomía son muy difíciles de determinar antes de la intervención quirúrgica. Algunas instituciones hacen uso de guías clínicas de decisión basadas en el análisis intraoperatorio de la pieza de histerectomía, considerando el grado histológico, la profundidad de la invasión y el tamaño del tumor2,13.
Ha habido otros intentos de pronosticar el riesgo de afectación ganglionar y algunos autores han diseñado escalas o herramientas predictivas basadas en el estudio clínico prequirúrgico. Así Todo et al., en el año 2007 propusieron una escala de riesgo basada en volumen del tumor, los niveles de Ca 125, grado y tipo histológico del tumor y profundidad de la invasión valorada mediante RNM14. Utilizando su herramienta estos autores estimaron que el riesgo de ganglios positivos era del 3% en el grupo de bajo riesgo, 30% en el de alto riesgo y 79% en el de muy alto riesgo.
Ahora bien, la evaluación prequirúrgica como único elemento decisor ha sido puesta en entredicho en otros estudios. Al igual que en nuestra experiencia, Leitao et al., publicaron una serie de 490 casos de cáncer de endometrio en estadio I en los que, tras el análisis anatomopatológico final de la pieza quirúrgica, en el 15% hubo un infradiagnóstico15.
Un estudio concluyó que cuando se combinan la biopsia prequirúrgica (grado y tipo histológico) con el tamaño del tumor evaluado en la biopsia intraoperatoria las pacientes pueden ser clasificadas, de manera efectiva, en pacientes de bajo, intermedio o alto riesgo16. Utilizando estos criterios los autores consideran que la probabilidad de invasión linfática en pacientes con tumores grado 1 o 2 de la FIGO, tamaño del tumor<2cm y enfermedad limitada al útero es menor al 1%. En un estudio retrospectivo de 349 pacientes diagnosticadas de cáncer de endometrio en estadio I y sometidas a cirugía (histerectomía total y linfadenectomía pélvica con al menos ocho ganglios) se calculó la incidencia de ganglios pélvicos positivos en función del grado histológico y la profundidad de la invasión miometrial17. En los tumores grado 1 no se encontró en ningún caso afectación linfática; en los tumores grado 2, se hallo afectación ganglionar en el 14% de los tumores IA y el 17% de los IB; en los tumores grado 3 los ganglios pélvicos fueron positivos en el 7% de los estadios IA y el 28% de los IB. Por ello, los autores de este estudio recomiendan realizar linfadenectomía pélvica en los tumores en estadio IAG2. A pesar de que existe controversia sobre el papel terapéutico de la linfadenectomía, se ha podido demostrar que en otro tipo de cánceres, como el de mama o el de ovario, el número de ganglios afectados se correlaciona con la evolución y supervivencia de las pacientes18.
Case et al.19 realizaron un estudio prospectivo, ciego en el que evaluaron la precisión de la biopsia intraoperatoria en la estadificación del cáncer de endometrio. Incluyeron 60 pacientes y encontraron que hubo correlación entre la biopsia intraoperatoria y el análisis diferido de la pieza quirúrgica en el 67% de los casos, en lo relativo a la invasión miometrial y en el 58% en lo referente al grado histológico, con 11 pacientes (18%) en las que la infraestadificación tuvo consecuencias clínicas relevantes. Los autores concluyeron su estudio recomendando la realización de linfadenectomía en todos los casos de cáncer de endometrio. De manera similar a la de Case, nuestros resultados demuestran que en lo referente a la invasión miometrial, el porcentaje de correlación positiva es del 79,8% para aquellos tumores clasificados como estadio IA y del 66% para los catalogados como estadio I.
Otra de las cuestiones en debate es el nivel anatómico de la linfadenectomía: ¿pélvica, paraaórtica, ambas? En este sentido conviene destacar que el estado de los ganglios linfáticos pélvicos es considerado un marcador subrogado de la afectación de los ganglios paraaórticos con un valor predictivo negativo muy elevado20. En un estudio realizado con 253 mujeres diagnosticadas de adenocarcinoma de endometrio de riesgo intermedio o elevado se realizó, en 82 pacientes, linfadenectomía pélvica y paraaórtica. Solo en un caso (1,2%) se encontró afectación ganglionar paraaórtica con ganglios pélvicos negativos, por lo que los autores del estudio concluyen que no está justificado realizar linfadenectomía paraaórtica, de manera sistemática, a las mujeres con cáncer de endometrio, incluso de alto riesgo de recidiva21.
La controversia sobre la linfadenectomía se plantea en base a sus beneficios y riesgos en un momento de nuestra especialidad en el que nos hemos decantado, firmemente, por la cirugía mínimamente invasiva. Al igual que en otro tipo de cánceres los esfuerzos de algunos autores e instituciones han ido encaminados a desarrollar técnicas predictivas menos invasivas con alta sensibilidad y especificidad que permitan minimizar el número de linfadenectomías pélvicas y paraaórticas. Entre estas técnicas el uso de pruebas de imagen como la RNM, el PET-TAC o la difusión de la identificación del ganglio centinela están cobrando especial interés.
Con la finalidad de ser más precisos en el diagnóstico preoperatorio de los cánceres de endometrio y planificar mejor la intervención quirúrgica a realizar, en el año 2007 un grupo de investigadores franceses propuso la utilización de un algoritmo y fórmula matemática, basados en cinco parámetros (edad, raza, subtipo histológico, grado del tumor y porcentaje de infiltración miometrial), para evaluar el riesgo de afectación ganglionar en mujeres con cáncer de endometrio en estadios I y II22. Recientemente este algoritmo para el cálculo de porcentaje de riesgo de tener ganglios afectados ha sido evaluado en la práctica clínica con resultados alentadores y podría aportar una ayuda fundamental para la toma de decisiones en el tratamiento del cáncer de endometrio23. En una revisión sistemática planeada para obtener información sobre la sensibilidad, especificidad y valores predictivos negativo y positivo de tres formas diferentes para evaluar la afectación de los ganglios en el cáncer de endometrio (RNM, tomografía axial computarizada y ganglio centinela) los resultados demostraron que la RNM y el ganglio centinela presentan una sensibilidad del 72 y 79%, respectivamente y especificidad del 97 y 96%, en ambos casos, superiores a las de la tomografía axial computarizada (45 y 88%, respectivamente) y por ello, y dado que es una prueba menos invasiva, los autores de la revisión recomiendan la utilización sistemática de la RNM24. En nuestra experiencia, la sensibilidad de la RNM en los casos en estadio I fue superior (95,09%) y la especificidad fue menor (63,33%). La explicación podría radicar en que la RNM es una prueba diagnóstica observador dependiente y por ello los diferentes criterios de las diferentes instituciones e investigadores pueden llegar a ser determinantes en estas diferencias.
Según se desprende de los resultados de trabajos muy recientes, la biopsia intraoperatoria de la pieza de histerectomía, con el análisis del tipo histológico, grado histológico y profundidad de la invasión miometrial, parece ser la mejor herramienta para la toma de decisiones25. Esta herramienta de decisión está condicionada por la capacidad y entrenamiento de los patólogos involucrados26 y su precisión diagnóstica se incrementa si se asocia al uso de la RNM prequirúrgica27.
De acuerdo a la Oncoguía de la SEGO6, en algunos casos la linfadenectomía podría ser sustituida por la realización de una tomografía con emisión de positrones. Un reciente metaanálisis realizado con el objetivo de evaluar la efectividad de la tomografía con emisión de positrones en la estratificación del riesgo en este tipo de pacientes concluyó que la tomografía con emisión de positrones no tiene suficiente sensibilidad ni especificidad para ser utilizada en la evaluación prequirúrgica de las pacientes con cáncer de endometrio28.
ConclusiónLa linfadenectomía parece ser beneficiosa para la mayoría de las pacientes con cáncer de endometrio en estadios avanzados o de alto riesgo histológico. Si no realizamos linfadenectomía estas pacientes serán infradiagnosticadas y, por consiguiente, infratratadas. Al mismo tiempo, la linfadenectomía permite evitar tratamientos posteriores a pacientes que hubiesen sido sobreestadiadas. Para evitar, en la medida de lo posible tanto los infra- como los sobretratamientos, parece razonable basar la decisión de realizar una estadificación completa tras la evaluación pre- e intraquirúrgica. En estadios I parece imperativo realizar el análisis intraoperatorio de la pieza quirúrgica.
ComentarioPara evitar los infra- y sobretratamientos en el cáncer de endometrio, parece razonable basar la decisión de realizar una estadificación completa en la evaluación intraquirúrgica de la pieza de histerectomía.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.