El objetivo del estudio es valorar el tratamiento con metotrexato en una gestación intersticial.
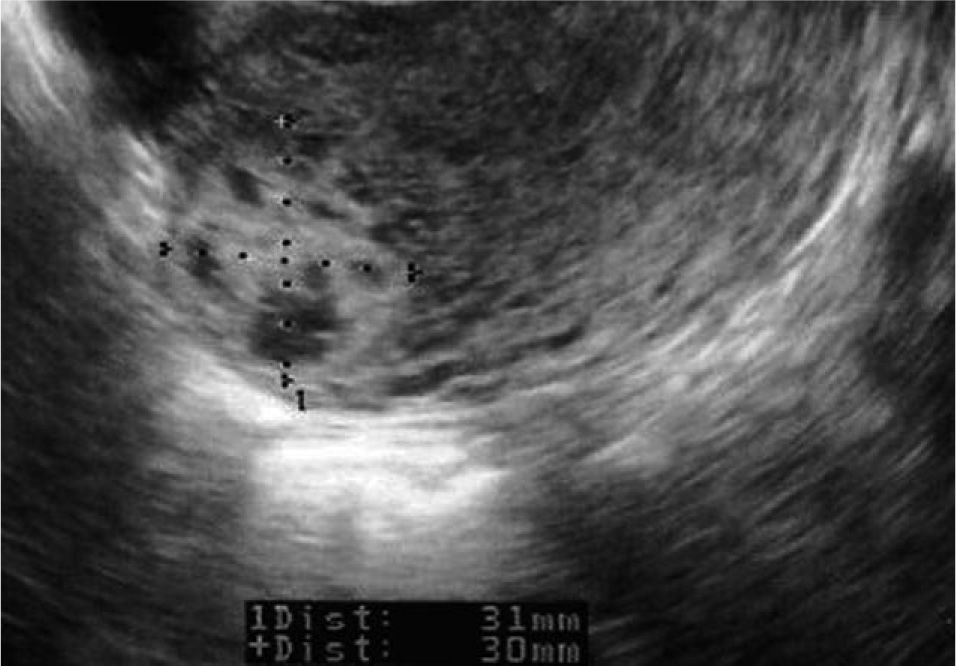
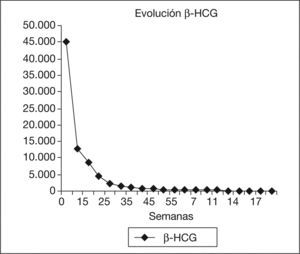
Presentamos el caso de una mujer de 28 años con un embarazo implantado en la región cornual uterina derecha. Presentaba 9 semanas de amenorrea. El nivel inicial de gonadotropina coriónica humana beta (β-HCG) era de 45.617 mU/ml y el tamaño del saco gestacional era de 31 × 30 mm. Tras la administración local por laparoscopia del metotrexato, junto con 3 dosis sistémicas del mismo fármaco, cursó una evolución favorable, negativizándose la hormona en 18 semanas, tiempo durante el cual no mostró prácticamente clínica. Esta modalidad terapéutica parece ser efectiva y segura como tratamiento del embarazo ectópico intersticial, evitando procedimientos más agresivos.
To evaluate methotrexate treatment in an interstitial pregnancy.
We report the case of a 28-year-old woman with a 9-week history of amenorrhea and a pregnancy implanted in the right uterine cornu. The β-human chorionic gonadotropin (HCG) level was 45.617 mU/ml and the size of the gestational sac was 31 × 30 mm. After local methotrexate injection by laparoscopy and three systemic doses of this drug, the patient showed optimal outcome. After 18 weeks, β-HCG was undetectable and the patient showed no symptoms of importance during this period.
This therapeutic modality seems to be safe and effective for the conservative management of interstitial ectopic pregnancy, avoiding more aggressive procedures.
El embarazo ectópico intersticial es aquel que se implanta en la porción intersticial de la trompa, hecho que permite que el embarazo pueda expandirse y no se rompa hasta la semana 7–16, ocasionando entonces una importante hemorragia debido a la rica vascularización de esta zona. Los factores que predisponen a tener una gestación ectópica intersticial son similares a los relacionados con la gestación ectópica en general. La salpingectomía ipsolateral es un factor de riesgo del embarazo ectópico intersticial1. El intervalo entre la salpingectomía y el embarazo posterior va desde los 6 meses hasta los 13 años.
El embarazo ectópico constituye el 1,6% de todas las gestaciones, de las cuales solamente del 2 al 4% son intersticiales. Su incidencia ha aumentado debido a un incremento del uso de técnicas de reproducción asistida, que se asocia a una mayor tasa de gestaciones intersticiales y heterotópicas. La mortalidad materna por embarazo ectópico es del 0,14%2; en cambio, ésta aumenta y alcanza de un 2 a un 2,5%3 cuando hablamos de una gestación ectópica intersticial.
Es el que mayor dificultad diagnóstica presenta y por ello tiene una mayor repercusión clínica. La sospecha diagnóstica viene determinada por la clínica, el valor sérico de gonadotropina coriónica humana beta (β-HCG) y la ecografía4. Timor-Tritsch et al5 establecieron una serie de criterios ecográficos distintivos del ectópico intersticial:
- 1.
La cavidad uterina vacía.
- 2.
El saco gestacional a más de 1cm del borde lateral de la cavidad uterina.
- 3.
Una fina capa de miometrio rodeando el saco gestacional.
Estos parámetros tienen una buena especificidad (~90%), pero una sensibilidad baja (~40%). Se describe también la existencia del «signo de la línea intersticial», que se refiere a la visualización de una línea ecogénica que se extiende a la región cornual y llega a la porción medial de la masa intersticial o saco gestacional, y representa el canal endometrial6.
Finalmente, la laparoscopia permitirá observar un engrosamiento de uno de los cuernos uterinos, donde se localice el embarazo ectópico. También se puede emplear la histeroscopia en su diagnóstico, en ésta se vería una dilatación masiva del ostium de la trompa con tejido gestacional difuso en su porción intersticial7.
El tratamiento del ectópico intersticial puede ser médico o quirúrgico. El tratamiento médico está constituido fundamentalmente por el metotrexato, fármaco quimioterápico antagonista del ácido fólico, que se puede administrar por vía sistémica, intramuscular, con una o varias dosis, o con inyección local, con guía ecográfica, laparoscópica o histeroscópica. También existe la posibilidad de combinar ambas vías. La otra opción del tratamiento es la cirugía, fundamentalmente la por vía endoscópica. Existen algunos casos publicados de resección histeroscópica8, pero en la mayoría de las pacientes se practica una resección cornual o cornuostomía por vía laparoscópica. Finalmente se pueden encontrar publicados casos de pacientes en las que se ha realizado una embolización de las arterias uterinas como tratamiento del embarazo intersticial9-12.
En este trabajo presentamos el caso de una mujer con una gestación ectópica intersticial resuelta con la administración combinada de metotrexato y cuyo interés radica en los altos valores iniciales de hormona, junto con un tamaño considerable del saco. Además, existió la limitación de repetición de dosis del fármaco por los controles analíticos, y la negativa de la paciente a someterse a un tratamiento más agresivo. A pesar de esto, pudimos observar una evolución favorable.
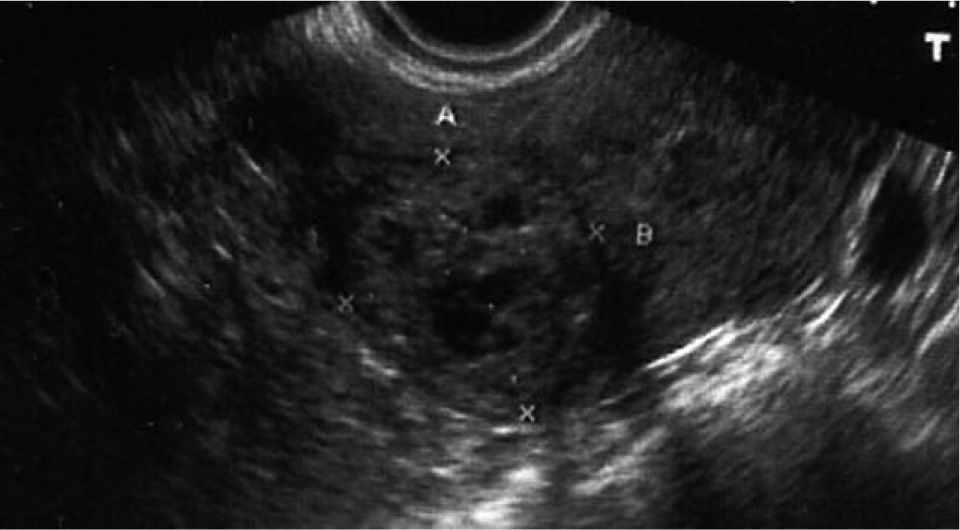
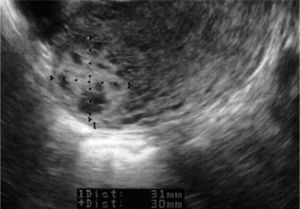
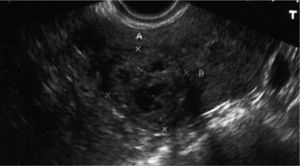
CASO CLÍNICOMujer sana de 28 años, G3A3, con 2 abortos espontáneos y una interrupción voluntaria de embarazo. Fue ingresada en otro hospital con el diagnóstico de aborto diferido en la semana 9+3 para realizar un legrado evacuador (día 0), previa preparación con misoprostol. En la ecografía transvaginal realizada se describía un endometrio de 23mm, heterogéneo, sin evidencia de saco gestacional y con una imagen sugestiva de mioma intramural de 25mm con focos hipoecoicos en su interior, en la cara posterolateral de fundus uterino, con anexos normales y sin líquido libre. La β-HCG era de 45,617mU/ml. Tras el legrado, fue sometida a un control clínico y de β-HCG. La paciente permanecía con dolor abdominal leve, sin signos de peritonismo y presentó los siguientes valores de β-HCG: en el día 2, 27.354mU/ml; en el día 4, 24.591mU/ml; en el día 6, 22.459mU/ml, y en el día 8, 22.389mU/ml. Este día se realizó un control ecográfico, en el que se evidenció un endometrio fino y una persistencia de la imagen anteriormente informada como mioma, de 30 × 31mm (fig. 1), anexos normales y ausencia de líquido libre. Ante la evolución del cuadro y las pruebas analíticas y de imagen, se sugirió el posible diagnóstico de gestación ectópica cornual y se planteó la realización de una laparoscopia, que la paciente rechazó. Por motivos personales, firmó el alta voluntaria y se trasladó de ciudad.
El mismo día ingresó en el Hospital Universitario Doctor Peset de Valencia para estudio y tratamiento. Se obtuvieron los resultados del legrado evacuador, que fueron informados como no concluyentes, y se tomó una biopsia endometrial, informada posteriormente como endometrio con reacción decidual del estroma y fenómeno de Arias-Stella, sin evidencia de vellosidades coriales.
Tras discutir las diferentes opciones de tratamiento, se decidió un tratamiento combinado con metotrexato, local y sistémico. Se realizó una laparoscopia el día 9, en la que se evidenció una tumoración a nivel del cuerno derecho, compatible con la gestación ectópica. La punción del saco gestacional se efectuó con control ecográfico (ecografía transvaginal); se realizó un lavado-aspiración del saco para intentar obtener vellosidades coriales, que después el análisis anatomopatológico no confirmó. Se administraron 50mg de metotrexato intrasacular junto con 75mg de metotrexato por vía intramuscular.
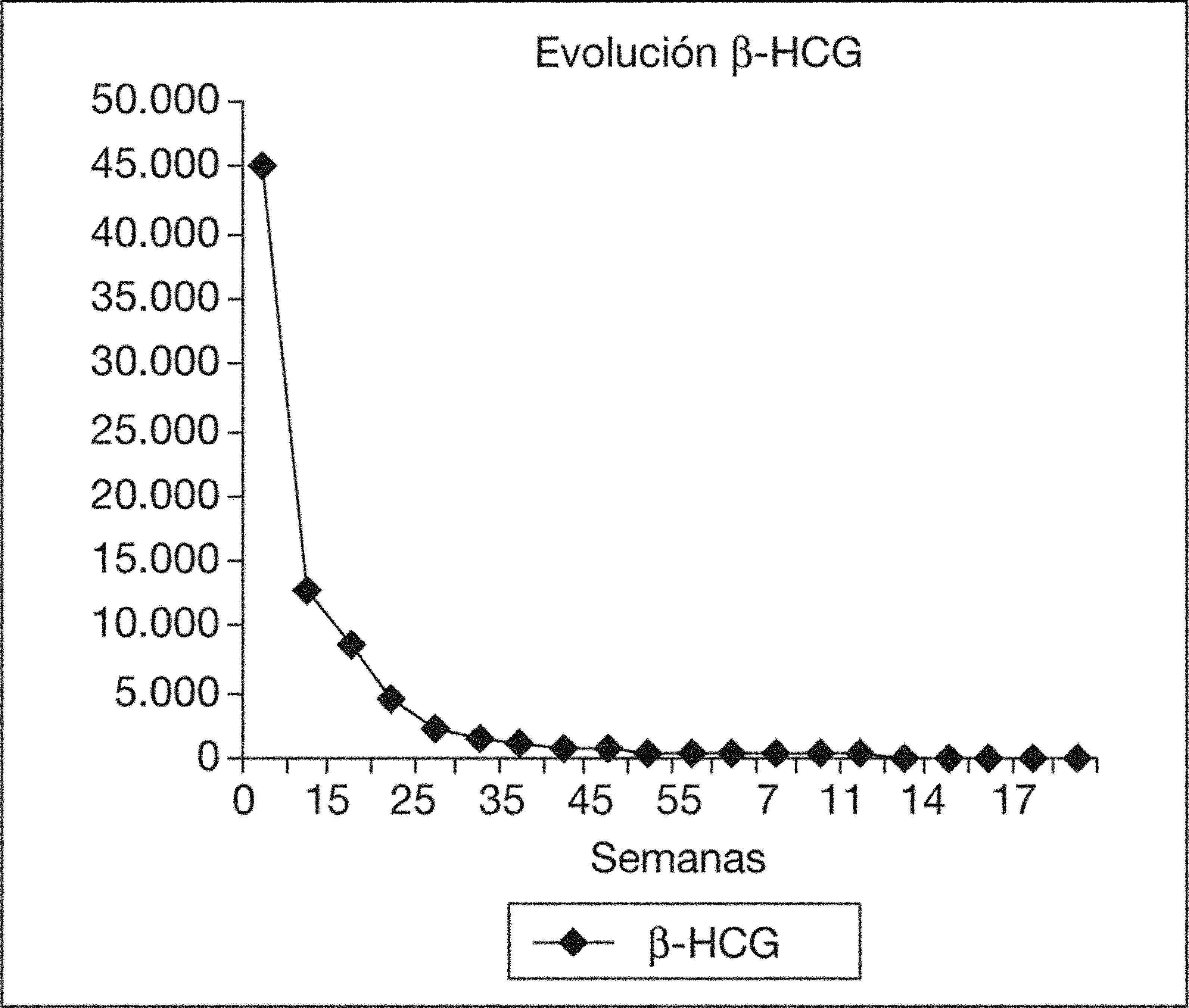
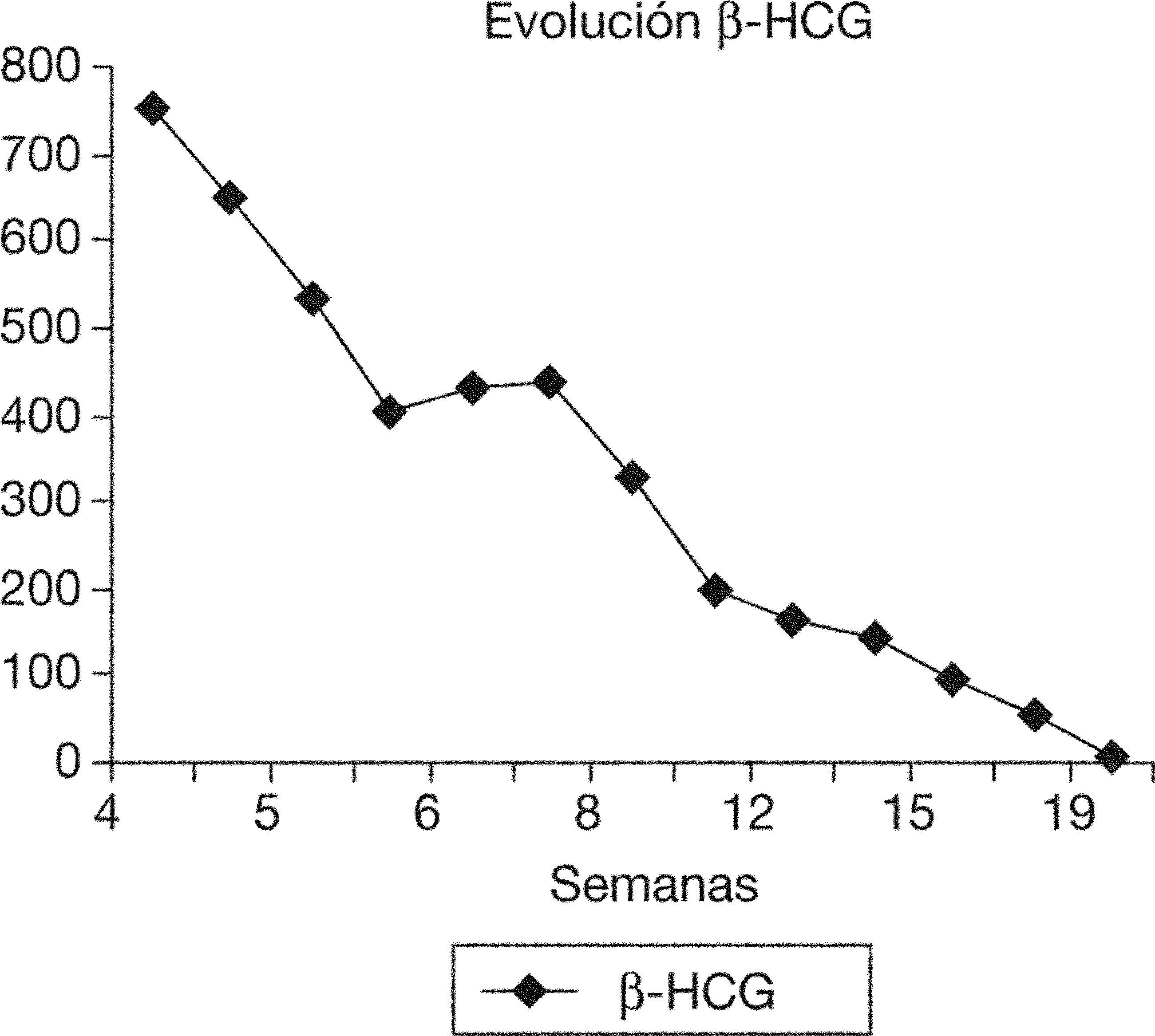
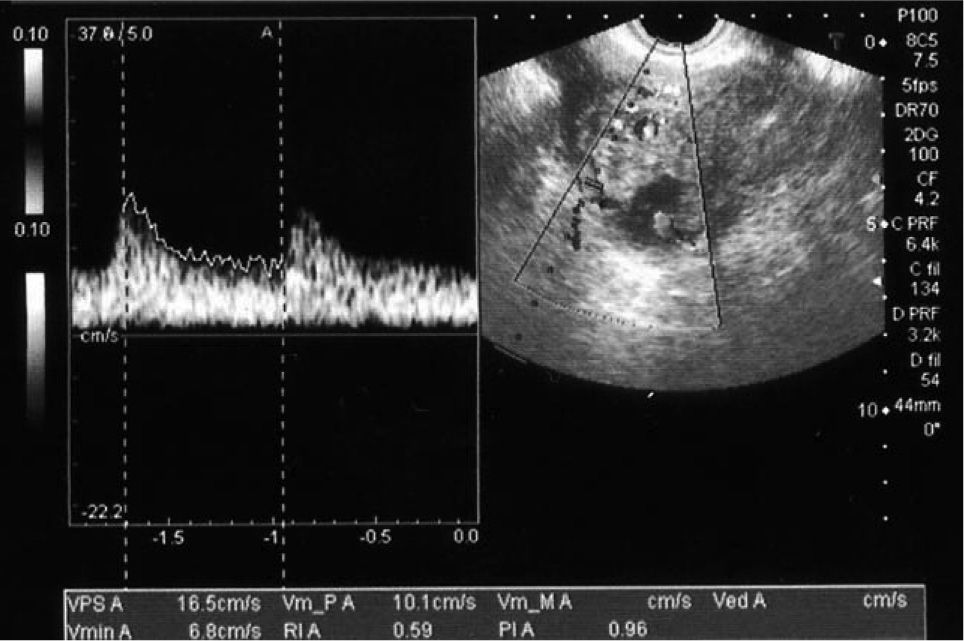
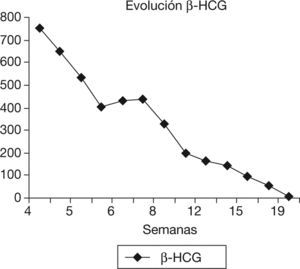
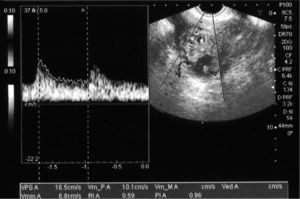
Después del tratamiento quirúrgico, la paciente permaneció hospitalizada durante 15 días con un control clínico, ecográfico y analítico. Tras este tiempo, se dio de alta a la paciente, pautando un control domiciliario. Durante el seguimiento, permaneció con dolor en la fosa ilíaca derecha y en el hipogastrio, sin signos de peritonismo y con un spotting continuo. El valor de β-HCG tuvo un descenso progresivo. En el día 17, con un valor de β-HCG de 8.576mU/ml, se decidió repetir la dosis sistémica de metotrexato, y en el día 42, con un valor estacionario de β-HCG de 437mU/ml, se administró otra dosis del fármaco (figs. 2 y 3). La paciente estuvo en tratamiento con ácido folínico hasta 2 semanas después de la última dosis de metotrexato; aun así, en las analíticas de control presentó cifras límite de leucocitos en sangre (4.000 leucocitos/dl), que desaconsejaban la administración de más dosis de metotrexato por su toxicidad medular. La imagen ecográfica del embarazo ectópico aumentó y alcanzó un tamaño de 53 × 35mm. En ella se podía ver el saco gestacional de 21 × 26mm, rodeado por una estructura heterogénea muy vascularizada, con resistencias vasculares bajas propias de las arterias peritrofoblásticas (fig. 4). Finalmente, el día 130 presentó un valor de β-HCG < 5mU/ml y en la ecografía se objetivó una disminución del tamaño del embarazo ectópico, de 34 × 33mm, sin presencia de vascularización arterial (fig. 5).
Imagen obtenida por ecografía transvaginal el día 115, en la que se evidencia la gestación ectópica de 50 × 34mm en el cuerno uterino derecho, en un corte transversal del útero, cuyos vasos presentan, en el estudio Doppler, un índice de resistencia de 0,58 y una morfología de la onda típica de las arterias peritrofoblásticas.
Imagen obtenida por ecografía transvaginal el día 130, en la que se evidencia la imagen de la gestación de 31 × 34mm en el cuerno uterino derecho, en un corte transversal del útero, en que, además de apreciar una disminución significativa del tamaño, en el estudio Doppler ya no se identifican las ondas arteriales. En estos momentos el valor de gonadotropina coriónica humana beta es < 5mU/ml.
Tradicionalmente, el tratamiento del embarazo intersticial ha sido la histerectomía o la resección cornual por laparotomía. En la actualidad, gracias a la posibilidad de un diagnóstico más temprano y la posibilidad de tratamiento médico, este tipo de tratamiento se restringe a un número mucho menor de pacientes en las que, por la gravedad del cuadro clínico, no existe otra opción terapéutica. Así, en nuestro caso, a pesar de presentar una evolución lenta y tener relativamente restringida la administración de más dosis de metotrexato, la estabilidad clínica de la paciente permitió adoptar este tipo de tratamiento conservador, llegando finalmente la resolución del cuadro.
El metotrexato, utilizado comúnmente en el embarazo ectópico, puede ser utilizado aplicando un régimen sistémico, inyección local, o una combinación de ambos. Tanaka et al13 son los primeros que presentan un caso de ectópico intersticial tratado con éxito con múltiples dosis sistémicas de metotrexato. Desde entonces, existen descritas muchas pautas de tratamientos; la más común es la que incluye una o dos tandas de 1mg/kg por día de metotrexato, administrado por vía intramuscular o intravenosa los días 1, 3, y 7, con 7 días entre las tandas, aunque hay muchos casos tratados con éxito que no siguen esta misma pauta, por lo que es necesaria la administración de una segunda dosis o generalmente en los casos en los que el valor de la β-HCG es mayor14-17.
En una revisión sobre las diferentes opciones en el tratamiento del ectópico intersticial se objetiva que con este régimen existe una tasa de curación del 80%. El tiempo medio ± desviación estándar de amenorrea era de 57 ± 22 días y el diámetro mayor del saco era de 23 ± 12mm. La media ± desviación estándar de β-HCG era de 14.141 ± 19.201mU/ml, y se volvía indetectable en 64 ± 43 días18. Cabe señalar que el fracaso del tratamiento no se relacionaba con el valor de β-HCG ni el tiempo de amenorrea. En cuanto al tratamiento con inyección local de metotrexato por laparoscopia, histeroscopia o guía ecográfica, la tasa de éxito era del 86%. Estas pacientes tenían una amenorrea de 54 ± 17 días y un valor de β-HCG de 9.007 ± 15.396mU/ml, indetectable a los 17 ± 5 días. La tasa de éxito global del tratamiento local, sistémico o combinado fue del 83%.
En nuestro caso se decidió tratamiento combinado, aplicando una dosis local y sistémica en el mismo momento, y posteriormente otras 2 dosis de rescate. Hay que tener en cuenta que el valor de β-HCG inicial era de 45.617mU/ml, un nivel mucho mayor a la media anteriormente nombrada, y posterior al legrado al que se sometió inicialmente fue de 22.389mU/ml, valor que continua siendo muy elevado. El tiempo de amenorrea fue de 66 días y el diámetro mayor del saco gestacional al diagnóstico era de 31mm. Todo ello podría explicar el mayor tiempo de resolución de la β-HCG (130 días). Hay que tener en cuenta que en la paciente no se tuvo la posibilidad de administrar un mayor número de dosis de metotrexato debido a las cifras límite de leucocitos en sangre que presentaba en las analíticas de control. Además la estabilidad clínica y la negativa de la paciente a someterse a un tratamiento quirúrgico permitieron adoptar una actitud más conservadora, rechazando otras opciones de tratamiento como la embolización de arterias uterinas, la resección cornual o la cornuostomía.
Finalmente, debemos señalar que la resolución ecográfica del cuadro puede llegar a demorarse más de 64 semanas5. Esto nos obliga a realizar un seguimiento de la paciente en el tiempo en caso de decidir un tratamiento médico. Hay que tener también en cuenta que tras la resolución del cuadro, y ante un nuevo embarazo, está aumentado el riesgo de rotura uterina. Se han descrito incluso casos de rotura a las 20 semanas de gestación19 tras un tratamiento quirúrgico, pero también una rotura uterina a las 24 semanas en un embarazo posterior a la resolución espontánea de un ectópico intersticial20. Por tanto, embarazos posteriores deberían seguirse de forma más exhaustiva a la habitual, planteando incluso la posibilidad de cesárea electiva.
CONCLUSIÓNEl tratamiento de la gestación cornual con metotrexato es efectivo en casos con valores elevados de β-HCG. Una disminución lenta de ésta no implica un fracaso en su tratamiento.