El síndrome de insensibilidad a los andrógenos es el más frecuente de los trastornos del desarrollo sexual con cariotipo XY y fenotipo femenino. Se debe a una mutación en el gen del receptor de andrógenos, situado en el cromosoma X. El diagnóstico suele realizarse en la infancia por hernias inguinales o en la pubertad por amenorrea primaria. Hay riesgo de malignización de las gónadas, por lo que es necesaria su extirpación. Presentamos una paciente de 25 años con amenorrea primaria diagnosticada de síndrome de insensibilidad a los andrógenos que refiere 4 familiares con el mismo diagnóstico.
Androgen insensitivity syndrome is the most frequent of the sexual development disorders with 46,XY karyotype and female phenotype. This syndrome is due to a mutation in the androgen receptor gene, which lies on the X-chromosome. Diagnosis is usually made in childhood due to inguinal hernias or during puberty due to primary amenorrhea. Gonadal extirpation is required because of the risk of malignant transformation. We present a 25-year-old patient with primary amenorrhea diagnosed with androgen insensitivity syndrome, who reported four relatives with the same diagnosis.
El síndrome de insensibilidad a los andrógenos (SIA), también conocido como síndrome de Morris o feminización testicular, es el más frecuente de los trastornos del desarrollo sexual con cariotipo XY, antes denominados seudohermafroditismos masculinos1–3. Son individuos con sexo cromosómico y gonadal masculino pero con fenotipo femenino en el caso de SIA completo y con virilización variable en el caso de SIA parcial. Está causado por diversas mutaciones que causan pérdida funcional en el gen que codifica para el receptor de andrógenos, provocando resistencia periférica a los andrógenos4. Se transmite por medio de un gen recesivo ligado al cromosoma X materno, responsable del receptor intracelular de andrógenos.
Caso clínicoPaciente de 25 años, de origen paraguayo, que consulta por amenorrea primaria. Como antecedentes personales presenta retraso psicomotor secundario a hipoxia perinatal y epilepsia en tratamiento. No refiere antecedentes familiares de interés en el momento de la anamnesis.
A la exploración física, se trata de una paciente con desarrollo sexual femenino normal para su edad, excepto ausencia de vello axilar y vello pubiano algo escaso (etapa de Tanner 4). Desarrollo mamario normal (etapa de Tanner 5). Mide 170cm y pesa 60 kg. Los genitales externos femeninos son de aspecto normal, se objetiva: el himen íntegro, con orificio central que permite el paso de una torunda. Se palpan 2 pequeñas hernias inguinales bilaterales en cuyo seno se aprecian sendas formaciones nodulares, de unos 2-3cm.
Se solicita un perfil analítico hormonal en el que destaca un nivel de testosterona elevado, 49nmol/l (intervalo de referencia 0,22-2,9), discreta elevación de la Δ-4-androstendiona, 4,38 ng/ml (intervalo de referencia 0,3-3,3), LH elevada (14 mUI/ml), FSH normal (6,71 mUI/ml), estradiol normal (50 pg/ml) y sulfato de dihidroepiandrosterona (S-DHT) normal (7,84μmol/l). Un segundo análisis confirma el resultado de testosterona elevada (52 nmol/l).
La ecografía ginecológica transabdominal informa de la ausencia de genitales internos, con sospecha de vagina ciega (6cm). La ecografía abdominal es normal. Se practica una ecografía de partes blandas del canal inguinal que objetiva 2 nódulos bilaterales de estructura homogénea, sin lesiones focales, que en el contexto clínico/bioquímico de la paciente serían compatibles con gónadas masculinas. Se realiza una resonancia magnética pelviana que muestra ambos canales inguinales ocupados por sendas estructuras nodulares bien delimitadas y de señal intermedia y homogénea, compatibles con testículos normodesarrollados. También informa de hallazgos radiológicos sugestivos de genitales internos femeninos rudimentarios y no se identifican alteraciones morfológicas a nivel renal.
El estudio citogenético en sangre periférica confirmó la existencia de un cariotipo normal 46,XY.
Con la recopilación de la información clínica y las pruebas complementarias, proponemos el diagnóstico de síndrome de insensibilidad a los andrógenos completo.
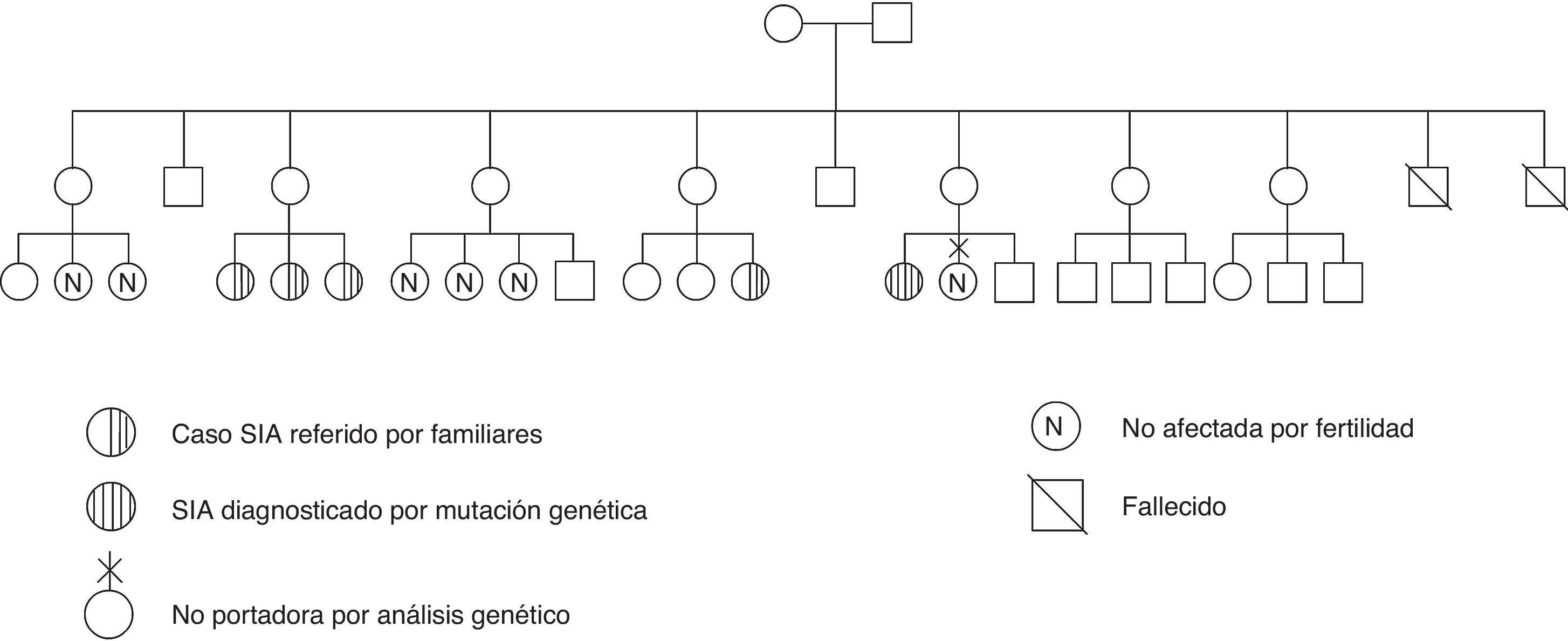
En la visita informativa de los resultados obtenidos, reinterrogamos a la madre de la paciente, quien explica que existen otros casos similares en la familia; con dicha información diseñamos el árbol genealógico (fig. 1). Llama la atención que en la generación de la madre de la paciente son 7 hermanas y que ninguna de ellas está afectada por el SIA; sin embargo, son portadoras al menos 3 de ellas, ya que tienen hijas con amenorrea primaria, y alguna de ellas intervenidas de «hernias inguinales», según refiere su tía.
Para completar el estudio se cursó el análisis genético para el gen del receptor de andrógenos (RA). Se hallaron 2 mutaciones puntuales: en el exón 1 se encuentra una mutación R210R silente, en el exón 7 se encuentra un cambio de G por A a nivel del codón 866 que predice en la proteína el cambio del aminoácido 866 (valina por metionina), mutación V866M. Se efectuó el análisis genético a la hermana, siendo el resultado de ausencia de mutación a nivel del gen del RA. Se recomendó el estudio genético de las tías y primas de la paciente.
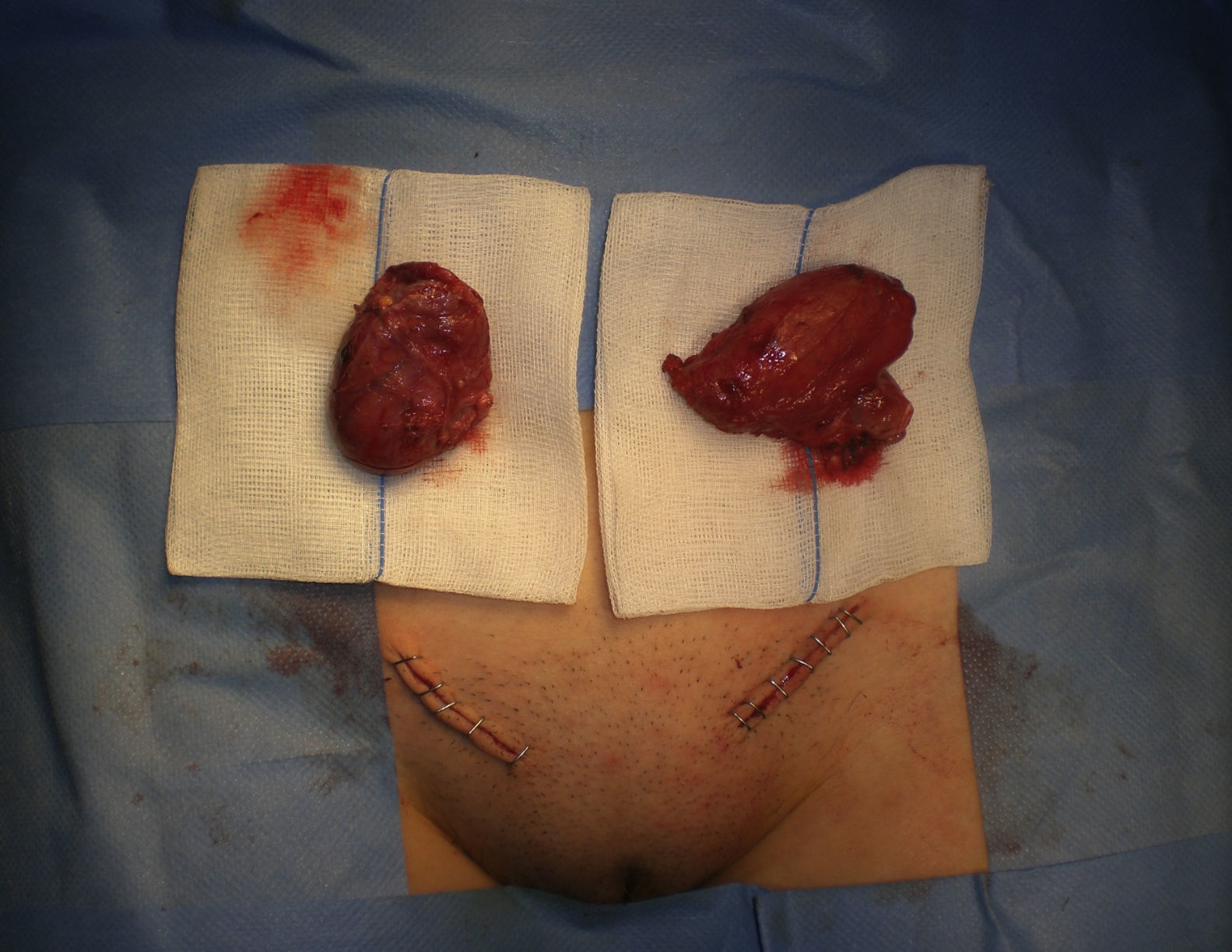
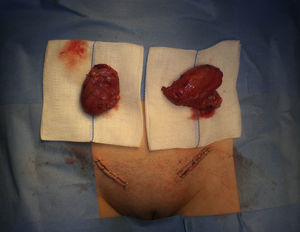
Dada la edad de la paciente, se le propuso una orquiectomía inguinal bilateral (fig. 2). La técnica quirúrgica consistió en la disección del cordón inguinal, la ligadura del conducto deferente y de los elementos vasculares por separado y la posterior sección del cordón.
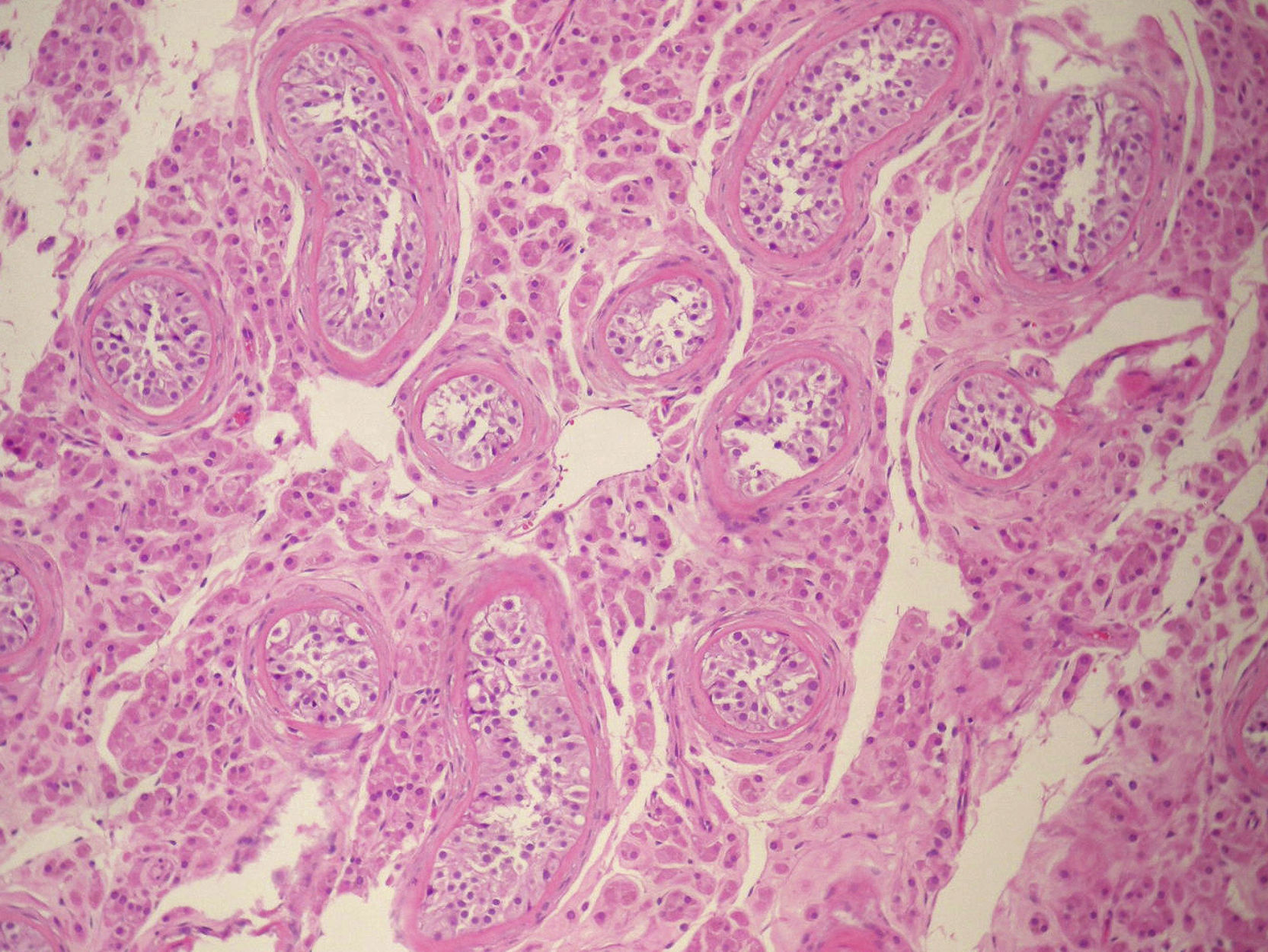
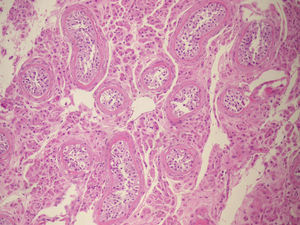
El estudio anatomopatológico confirma el diagnóstico de parénquima testicular bilateral (derecho 6×4×2cm, izquierdo 5×4×1,8cm), sin signos de malignización (fig. 3).
Se prescribe tratamiento hormonal sustitutivo combinado continuo con estradiol 20 μg y norestisterona 250 μg por vía transdérmica.
DiscusiónEl SIA es la tercera causa de amenorrea primaria después de la disgenesia gonadal y la ausencia congénita de vagina, y constituye el 10% del total de los casos de amenorrea primaria1. Tiene una incidencia de 1/25.000-65.000 recién nacidos varones5-7. El motivo de consulta más habitual es una amenorrea primaria con desarrollo de caracteres sexuales normal, o en prepúberes al encontrar hernias inguinales bilaterales. En algún caso el diagnóstico es prenatal ante un cariotipo XY y visualización de genitales externos femeninos por ecografía.
Su etiología deriva de diversas mutaciones en el gen responsable del receptor intracelular de andrógenos8,9, que conllevan una resistencia congénita total o parcial del efecto de los andrógenos circulantes en los órganos diana10,11. El gen que codifica para el RA se localiza en el brazo corto del cromosoma X (Xq11-12)12, lo que explica la presencia de un patrón hereditario ligado a X, recesivo, en los 2 tercios de los casos8,10. El tercio restante parece corresponder a mutaciones de novo10,13. Se han identificado alrededor de 200 mutaciones individuales.
En el SIA no se produce la inducción androgénica del desarrollo de los conductos wolffianos (epidídimo, vaso deferente y vesículas seminales) estimulados por la testosterona. Tampoco se produce el desarrollo de la próstata ni de los genitales externos masculinos, ya que requieren del estímulo de la dihidrotestosterona (DHT). Tanto la testosterona como la DHT requieren de la presencia del RA en los tejidos diana. Sin embargo, hay actividad de la hormona antimülleriana (AMH) y el individuo no experimenta desarrollo mülleriano (trompas de Falopio, útero y parte superior de la vagina). Los testículos suelen descender al anillo inguinal porque la AMH media su descenso transabdominal, pero no llegan al pliegue labioescrotal en ausencia de estímulo androgénico. La vagina es corta y tiene un extremo ciego, ya que únicamente se desarrolla la parte inferior que deriva del seno urogenital. El desarrollo de las mamas es normal y hay ausencia o disminución de vello axilar y pubiano1. Las pacientes con SIA tienen un fenotipo femenino normal.
Encontramos SIA parcial o leve hasta en el 10% de los individuos afectados14. En estos casos, la virilización en el momento de la pubertad se puede dar en mayor o menor grado dentro de un gran espectro. Actualmente, se llama síndrome de Reifenstein a todas estas formas intermedias1.
En la forma completa no hay respuesta a los andrógenos, por lo tanto, el desarrollo externo femenino es normal y los recién nacidos deben ser criados como mujeres1. Actualmente, se considera una buena actuación informar del diagnóstico real a la paciente; además, las pacientes desean comprender su realidad y aprecian esta información. Estas pacientes son estériles, pero su identidad sexual es absolutamente femenina y esta debe ser reforzada, no cuestionada1,15. En algunas mujeres con SIA completo es necesaria la elongación vaginal para la penetración; en cambio, otras tienen una longitud normal y refieren relaciones sexuales satisfactorias16,17. Hay estudios que describen que las mujeres con SIA pueden alcanzar el clímax sexual, lo que indica que los andrógenos no son el único factor que interviene en este aspecto de la sexualidad5,16,18,19, si bien se describe disminución de la libido en algunas mujeres con SIA19,20.
En nuestro caso, el perfil hormonal es típico: LH elevada, niveles de testosterona masculina normales o ligeramente elevados, niveles elevados de estradiol (para un varón) y FSH de normal a elevada1. Los niveles elevados de LH indican resistencia a nivel hipotálamo-hipofisario a la retroalimentación negativa para la secreción de gonadotrofinas mediada por andrógenos. El aumento de LH estimula la producción de esteroides por las células de Leydig, resultando en un aumento de testosterona y estradiol. La aromatización periférica de la testosterona produce un aumento considerable de los estrógenos que, sin llegar a los niveles plasmáticos de una mujer normal en período fértil, son suficientes, en combinación con la resistencia a los andrógenos, para condicionar el desarrollo de los caracteres sexuales secundarios hacia un patrón femenino en la edad puberal. En las pacientes con SIA, las concentraciones de la AMH y de la inhibina son normales, ya que la función de las células de Sertoli no se ve afectada, por lo que, junto a la presencia de estrógenos, los niveles de FSH no se elevan o solo se elevan ligeramente10,21,22.
Los testículos presentan una histología similar a los testículos criptorquídicos, siendo estos azoospérmicos, con células de Leydig hiperplásicas, lo que condiciona un elevado riesgo de degeneración neoplásica. Si bien en estos casos los tumores gonadales son relativamente tardíos, rara vez se detectan antes de los 25 años, y la incidencia es aproximadamente un 5-10%14,23. Los tumores más frecuentes son los benignos y entre ellos el adenoma de células de Sertoli24. El tumor maligno más frecuente es el seminoma23,24.
La práctica habitual es la gonadectomía después de la pubertad, aproximadamente a los 16-18 años, para permitir la feminización completa de una forma fluida1,4. Sin embargo, se han encontrado algunos casos de neoplasia en edades tempranas25–27, por lo que actualmente hay una tendencia a realizar la orquiectomía bilateral profiláctica en el momento del diagnóstico. Se indica la gonadectomía prepuberal en los casos en los que las gónadas inguinales son física o estéticamente incómodas, si es necesaria una herniorrafia inguinal o en los casos de SIA parcial ante las primeras manifestaciones clínicas de virilización. De esta manera, también se previene el trauma psicológico que se produciría en la adolescente al someterla a una castración y se evita el riesgo que conllevaría una pérdida de seguimiento de la paciente antes de la gonadectomía28. Por otro lado, hay procedimientos de cirugía plástica que alargan la vagina usando injertos de piel, secciones de intestino, etc. Estos métodos tienen inconvenientes y solo deben ser usados cuando los procedimientos menos invasivos no hayan dado resultado. La vaginoplastia en la infancia tiene normalmente poco éxito y no debe ser practicada.
La detección de este síndrome requiere de un estudio minucioso de otros miembros de la familia por el riesgo de malignización que conlleva si no se realiza la gonadectomía profiláctica. El 60% de las pacientes tiene algún familiar afectado29. La probabilidad de que las supuestas hermanas de los individuos afectados sean XY es 1 de cada 3. La probabilidad de que las hijas de una hermana normal de un individuo afectado sean XY es 1 entre 61.
En los casos de SIA es necesaria la terapia hormonal sustitutiva en el momento de iniciar la pubertad, si se realizó gonadectomía prepuberal, o inmediatamente después de la cirugía si ya se completó el desarrollo puberal30.
ConclusiónEl síndrome de insensibilidad a los andrógenos es de herencia recesiva ligada a X y tiene riesgo de neoplasia gonadal, por lo que se debe estudiar a los familiares cercanos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.