El objetivo de este estudio es conocer la capacidad que tiene la histeroscopia para diagnosticar el tamaño tumoral en el adenocarcinoma de endometrio.
Material y métodosEstudio prospectivo de cohortes de 34 pacientes con diagnóstico de sospecha de adenocarcinoma o de adenocarcinoma realizado en la consulta externa de histeroscopia del Hospital Donostia, en el que se analizan los hallazgos histológicos de los tumores diagnosticados histeroscópicamente como igual o menor de 2cm, como mayor de 2cm, o como difusos.
ResultadosLa prevalencia de tumores mayores de 2cm fue del 85,29% (intervalo de confianza del 95%, 68,1-94,4). Se diagnosticaron correctamente el 79,41% de las lesiones (IC del 95%, 61,5-90,6). La sensibilidad de la histeroscopia para detectar tumores de más de 2cm fue del 86,21% (IC del 95%, 67,4-95,4), pero su especificidad fue tan solo del 40% (IC del 95%, 7,2-82,9). La razón de probabilidades diagnósticas positivas fue del 89,29% (IC del 95%, 70,6-97,1), multiplicándose por 1,44 la posibilidad de tener un tumor mayor de 2 cm si la prueba era positiva (IC del 95%, 0,69-2,98), mientras que se multiplicaba por 0,34 si la prueba resultaba negativa (IC del 95%, 0,08-1,41). La razón de probabilidades diagnósticas negativa del 33,33% (IC del 95%, 6-75,8).
ConclusionesLa histeroscopia tiene un alto valor predictivo positivo para el diagnóstico del tamaño tumoral cuando la lesión es mayor de 2 cm y cuando afecta de manera difusa a la cavidad uterina. Además, no añade coste ni complicaciones en el protocolo diagnóstico del cáncer de endometrio. La histeroscopia puede ser de utilidad en la planificación quirúrgica de la paciente.
The aim of this study was to assess the value of hysteroscopy in determining tumoral size in endometrial adenocarcinoma.
Material and methodsWe carried out a prospective cohort study of 34 patients with suspected endometrial adenocarcinoma who underwent outpatient hysteroscopy in Hospital Donostia. Tumors were classified as larger or smaller than 2cm, or diffuse. These classifications were compared with subsequent histopathological results.
ResultsIn our series, 85.29% (95% CI 68.1-94.4) of tumors were>2cm. Hysteroscopy correctly classified 79.41% of the lesions (95% CI 61.5-90.6). The sensitivity of hysteroscopy in correctly classifying tumors>2cm was 86.21% (95% CI 67.4-95.4), but specificity was only 40% (CI 95% 7.2-82.9).
The positive diagnostic likelihood ratio was 89.29% (95% CI 70.6-97.1%). The chance of having a tumor>2cm was multiplied by 1.44 if hysteroscopy classified it as such (95% CI 0.62-2.98), and by 0.34 if it did not (95% CI 0.08-1.41). The negative likelihood ratio was 33.33% (95% CI 6-75.8%).
ConclusionHysteroscopy has a high positive predictive value in diagnosing tumors larger than 2cm or with diffuse involvement of the uterine cavity. This procedure does not involve additional costs or complications to the diagnostic protocol for endometrial cancer and can be highly useful in surgical planning.
El adenocarcinoma de endometrio es el cáncer más frecuente del tracto genital de la mujer en el mundo desarrollado. En general, se presenta después de la menopausia, y entre sus factores de riesgo están la hipertensión, la diabetes y la obesidad. El tratamiento primario es la cirugía, vía laparotómica o laparoscópica. Se debe de practicar una toma para citología peritoneal tras el lavado con suero de la pelvis, aunque desde el año 2010 no forma parte de la estadificación FIGO1, visualización completa de la cavidad abdominal y biopsia de toda lesión sospechosa de implante metastásico, histerectomía total con doble anexectomía, y linfadenectomía pélvica y paraaórtica. Desde 19882 el estadio del adenocarcinoma de endometrio se establece después de la cirugía, siempre que esta sea posible. En el año 2010 se ha modificado el sistema clasificatorio conjunto FIGO/TNM1. Se establece con los datos obtenidos durante la cirugía y con el informe anatomopatológico del material enviado para estudio histológico. Se tiene que valorar: el tipo tumoral (endometrioide, seroso papilar, células claras…), el grado de diferenciación del tumor, la invasión miometrial (infiltración mayor o menor del 50%), si hay o no infiltración del canal endocervical o de los anejos, la presencia de implantes tumorales en la cavidad abdominal y la existencia de enfermedad ganglionar, dato este último que solo es posible conocer de forma fehaciente tras la linfadenectomía. Actualmente, es muy controvertida la realización de linfadenectomía en los adenocarcinomas de bajo riesgo, y se consideran así los tumores endometrioides G1 y G2 con infiltración miometrial inferior al 50%, y sin enfermedad extrauterina, ya que la tasa de afectación ganglionar de estas pacientes es baja, y la linfadenectomía no está exenta de morbilidad y riesgos. Además, alarga el tiempo quirúrgico en pacientes, muchas veces con patología de base, por su edad avanzada, obesidad, hipertensión y diabetes.
En los últimos años parece haber evidencia de que el tamaño tumoral puede relacionarse con la enfermedad ganglionar3-7. En los tumores de bajo riesgo de 2cm o menores, algunos autores refieren no encontrar enfermedad ganglionar3-6 y no ven necesaria la práctica de linfadenectomía.
ObjetivoEl objetivo principal de este estudio es conocer la capacidad que tiene la histeroscopia para conocer el tamaño tumoral en el adenocarcinoma de endometrio.
Material y métodosEn el año 2010 se ha realizado la medición del tamaño de la tumoración durante la histeroscopia diagnóstica en un total de 51 mujeres con diagnóstico de sospecha de adenocarcinoma o diagnóstico de adenocarcinoma que acudieron a la consulta externa de histeroscopia del Hospital Donostia de San Sebastián. El total de histeroscopias realizadas en el año 2010 fue de 1.216. El histeroscopio utilizado es el Olympus, con visión foroblicua de 30°, y calibre de 5 French, con camisa de 4,5 o 5,5mm. Hemos utilizado suero fisiológico como medio de distensión. La medición del tamaño tumoral se ha hecho de forma intuitiva, valorando el tamaño de la tumoración según la extensión que ocupa en la cavidad uterina en relación con el tamaño de las pinzas histeroscópicas. Nos hemos limitado a señalar si la tumoración nos parece mayor o menor de 2cm, o si es difusa. Suponemos que es menor de 2cm cuando la tumoración ocupa un solo cuerno uterino o una zona del fondo o de las paredes uterinas inferior a 4 veces el tamaño de la boca de unas pinzas de biopsia histeroscópicas; en los demás casos, consideramos que es mayor. Solo cuando el tumor afecta a toda la cavidad no quedando endometrio residual normal la consideramos como difuso. Tras efectuar la histerectomía a estas pacientes, en anatomía patológica miden el tamaño del tumor durante el examen macroscópico de la pieza quirúrgica, dejando constancia del dato en el informe anatomopatológico.
Se ha realizado una búsqueda de toda la bibliografía publicada al respecto en la base de datos PubMed con los términos «tumor size» e «hysteroscopy», rescatando un total de 105 referencias analizadas. Ninguna de ellas estudiaba la capacidad histeroscópica de medición del tamaño tumoral.
Se han obtenido datos de prevalencia, sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo, razón de probabilidades diagnósticas positiva y negativa con sus intervalos de confianza.
ResultadosSe incluyen 34 casos en el estudio; el resto de ellos (17 casos) se han excluido porque no han sido operadas, no consta el tamaño tumoral en el informe histeroscópico o en el informe anatomopatológico de la pieza de histerectomía.
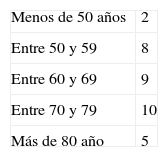
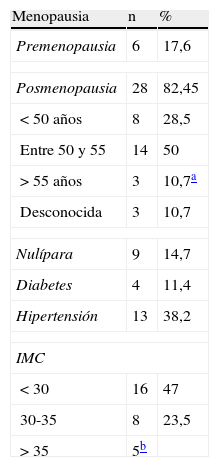
La edad media del grupo es de 66,35 años, con un rango entre 47 y 87 años. En la tabla 1 se puede ver la edad por grupos. En la tabla 2 se pueden ver los factores de riesgo: diabetes, hipertensión, índice de masa corporal, paridad… Solo una paciente había tenido cáncer de mama y no había sido tratada con tamoxifeno; 13 pacientes tenían un familiar de primer grado (madre, padre, hermano) con algún tipo de cáncer.
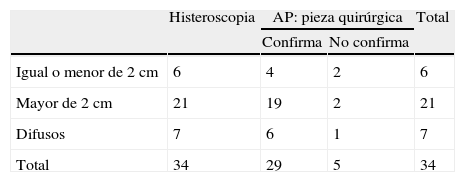
Por histeroscopia, el tamaño tumoral era igual o menor de 2cm en 6 casos y en la pieza de histerectomía se confirmó en 4 casos. Los otros 2 casos midieron 2,5 y 3,3cm, respectivamente (tabla 3).
De los 28 en que la histeroscopia informó que el tamaño tumoral era mayor de 2cm, solo en 2 la pieza de histerectomía no confirmó el tamaño, siendo en estos 2 casos el tamaño tumoral menor de 2cm (1,5 y 2cm) (tabla 3).
En 7 casos el tumor era difuso por histeroscopia, confirmándose en 6; en el séptimo caso el examen histológico reflejó un tumor de 15mm; revisado el video a posteriori, el tumor se revaluó como mayor de 2cm, pudiendo haber sido el motivo de que el resto correspondiera con una hiperplasia endometrial o que se hubiera resecado parcialmente durante la biopsia dirigida por histeroscopia (tabla 3).
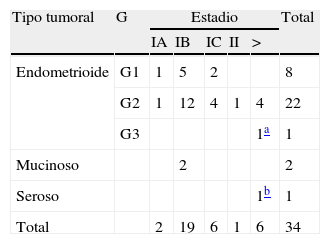
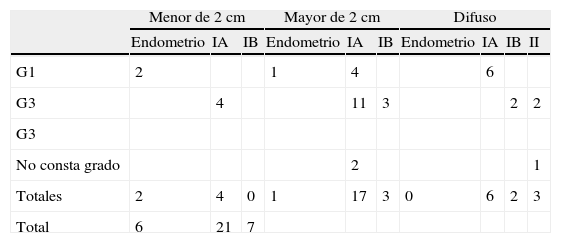
En la tabla 4 se pueden ver el tipo tumoral, el grado de diferenciación y el estadio. En la tabla 5 se presenta la correlación del tamaño tumoral con el estadio y el grado.
La prevalencia de tumores mayores de 2cm fue del 85,29% (intervalo de confianza del 95%, 68,1-94,4). Se diagnosticaron correctamente el 79,41% de las lesiones (IC del 95%, 61,5-90,6). La sensibilidad de la histeroscopia para detectar tumores de más de 2cm fue del 86,21% (IC del 95%, 67,4-95,4), pero su especificidad fue tan solo del 40% (IC del 95%, 7,2-82,9). La razón de probabilidades diagnósticas positivas fue del 89,29% (IC del 95%, 70,6-97,1), multiplicándose por 1,44 la posibilidad de tener un tumor mayor de 2 cm si la prueba era positiva (IC del 95%, 0,69-2,98), mientras que se multiplicaba por 0,34 si la prueba resultaba negativa (IC del 95%, 0,08-1,41), con una razón de probabilidades diagnósticas negativa del 33,33% (IC del 95%, 6-75,8) (tabla 6).
Resultados estadísticos: Capacidad de la histeroscopia para diagnosticar tumores > 2 cm
| Sensibilidad | 86,21% (IC del 95%, 67,4-94,4) |
| Especificidad | 40% (IC del 95%, 7,2-82,9) |
| Valor predictivo positivo | 89,29% (IC del 95%, 70,6-97,1) |
| Valor predictivo negativo | 33,33% (IC del 95%, 6-75,8) |
| Razón probabilidades diagnósticas (+) | 1,44 (IC del 95%, 0,69-2,98) |
| Razón probabilidades diagnósticas (−) | 0,34 (IC del 95%, 0,08-1,41) |
El cáncer de endometrio es el cáncer más frecuente del tracto genital inferior en los países desarrollados. En 2004 se estimó que en EE. UU. se identificarían 40.320 nuevos casos de cáncer de endometrio que causarían 7.090 muertes (17,5%)7. Este tumor es la séptima causa de muerte por cáncer en la mujer. Esto se debe a que la metrorragia, que es un síntoma precoz de la enfermedad, permite diagnosticarla cuando el tumor está limitado a la cavidad uterina sin infiltrar más del 50% del miometrio, estadio IA en la nueva clasificación de la FIGO, con una supervivencia entre 86 y el 98%7. De las mujeres de nuestro estudio, un 60% (21/35) cumplen estos parámetros. El tipo endometrioide es el más frecuente, en general, y en concreto, en nuestro estudio, el 88,2% (30/34) pertenecían a este tipo, y todos, menos un G3, fueron G1 y G2. Los tumores endometrioides G1 y G2 tienen mejor pronóstico que otros subtipos, como son el seroso papilar y el de células claras. Encontramos 2 tumores mucinosos que se considera que tienen un pronóstico similar a la forma endometrioide (tabla 4).
Varios autores han definido como tumores de bajo riesgo los adenocarcinomas endometrioides G1 y G2, localizados a la cavidad uterina, con una infiltración miometrial inferior al 50%4,6. Desafortunadamente, continuamos sin conocer antes o durante la cirugía cuáles son las características tumorales que condicionan la enfermedad ganglionar, objetivo de la linfadenectomía8. El tamaño tumoral es un factor pronóstico bien definido de metástasis ganglionares en el cáncer de mama y de cérvix6, y también lo ha sido en el cáncer de endometrio3,5–7,9.
En general, se acepta que la histerectomía total con doble anexectomía es el tratamiento mínimo necesario para el cáncer de endometrio. La necesidad de linfadenectomía pélvica y paraaórtica para adenocarcinomas de bajo riesgo está todavía debatida10-12. Los que la defienden lo hacen fundamentándose en que el diagnóstico de los factores pronóstico (tipo tumoral, grado de diferenciación, infiltración miometrial, enfermedad ganglionar…) antes o durante la cirugía no es seguro, y que el conocimiento de estos es de suma importancia para establecer el estadio clínico de la enfermedad y el tratamiento médico definitivo. Los que se oponen lo hacen apoyándose en la baja tasa de enfermedad ganglionar que tienen los tumores de bajo riesgo y en el aumento de complicaciones que conlleva la linfadenectomía en estas mujeres, que muchas veces se asocia a alta comorbilidad médica. Tomar la decisión de practicar la linfadenectomía antes de la cirugía puede servir para optimizar la utilización de quirófanos en el servicio planificando de antemano la realización de una linfadenectomía o, según los diferentes protocolos de los diferentes grupos de autores, incluso decidir planificar hacer una linfadenectomía paraaórtica retroperitonealmente por vía laparoscópica, lo que parece que tiene beneficios para la paciente tanto a nivel de adherencias, como mejor tolerancia a la cirugía retroperitoneal, como de mayor facilidad técnica para el cirujano, sobre todo en mujeres obesas. Mariani et al.4 encuentran dificultad para seleccionar el subgrupo de mujeres con tumor de bajo riesgo que se puedan beneficiar de la linfadenectomía completa, tratando de evitar el sobretratamiento y los riesgos que ello conlleva. La invasión de los espacios vasculares por células tumorales puede ser indicativo de un tumor agresivo que es probable causa de enfermedad extrauterina, enfermedad ganglionar y de recidivas a distancia. Han comprobado que en los tumores de 2cm o menores, aunque haya presencia de células tumorales en los espacios vasculares, no encuentra nunca enfermedad ganglionar, y sí la encuentran cuando el tumor es mayor de 2cm. Por esto concluyen que en los tumores endometrioides de 2cm o menores, G1 y G2, con infiltración miometrial menor del 50% se puede evitar la linfadenectomía. El número de casos de tumores con estas características en nuestro estudio (20,5%, 7/34) es similar al comunicado por Mariani et al. A los tumores mayores de 2cm con las mismas características (endometrioides, G1 y G2, e infiltración menor del 50%) los incluyen en el grupo de riesgo intermedio y proponen hacer una linfadenectomía pélvica con estudio intraoperatorio y una linfadenectomía paraaórtica completa cuando fueran positivos. Los demás —G3, infiltración miometrial mayor del 50%, afectación cuello del útero, anexial, extrauterina y las tipos especiales (seroso-papilar, células claras…)— los incluyen dentro del grupo de alto riesgo y recomiendan hacer linfadenectomía pélvica y paraaórtica completa sistemática9.
Schink et al.7 (1991) en su estudio señalan que solo un 4% de las 142 mujeres con adenocarcinoma de endometrio en estadio I operadas con linfadenectomía pélvica y paraaórtica tenían enfermedad ganglionar, frente al 15% de las que tenían un tumor mayor de 2cm y al 35% con afectación difusa de la cavidad uterina. La supervivencia de las mujeres con tamaño tumoral menor de 2cm era del 98%, el 84% en las de más de 2cm y el 64% en los tumores con afectación difusa. En 2005, Shah et al.5 concluyen que el tamaño tumoral se correlaciona con la enfermedad extrauterina, pero no es un factor pronóstico independiente; encuentran menos del 6,3% de afectación en estas pacientes. Mariani et al., en 2000 y 20084,6, no encuentran enfermedad ganglionar en tumores de bajo riesgo cuando el tamaño tumoral es de 2cm o menos y consideran que la linfadenectomía no beneficia a estas pacientes. En 2011, Yanazume et al.3 tampoco encuentran enfermedad ganglionar en tumores con tamaño tumoral menor de 2cm, ni cuando es menor de 3cm si son pacientes de riesgo bajo.
Con todos estos datos, creemos que sería importante disponer de una prueba diagnóstica fiable que nos pudiera hacer el diagnóstico del tamaño tumoral antes de la cirugía. No hemos encontrado publicaciones con el objetivo de estimar el tamaño tumoral, ni con histeroscopia, ni con otras pruebas diagnósticas como ecografía, resonancia magnética, ni tomografía computarizada, a pesar del extenso número de publicaciones existentes con el objetivo de conocer infiltración miometrial, endocervical y ganglionar. Aunque no hemos estudiado su reproducibilidad, con nuestra experiencia pensamos que la histeroscopia puede ser útil para estimar el tamaño tumoral. Aunque se dispusiera de una prueba diagnóstica más precisa para conocer el tamaño tumoral, es necesario practicar estudio perioperatorio para decidir sobre la base del estudio histológico de la pieza quirúrgica la necesidad de efectuar una linfadenectomía confirmando el tamaño del tumor, el tipo y el grado de diferenciación, la infiltración miometrial y la afectación cervical y anexial. Aunque hay evidencia de que la precisión del estudio perioperatorio no es total, es mayor que la del estudio preoperatorio. Concretamente, Mariani et al. señalan que para conocer el tamaño tumoral la seguridad del estudio perioperatorio es del 100%. Cuando el estudio perioperatorio confirma que el tamaño uterino es de 2cm o menor y el tumor es de riesgo bajo, podemos evitar la linfadenectomía. En todos los demás casos, se debería de practicar una linfadenectomía4. Según nuestro estudio, la histeroscopia puede servir para indicar la linfadenectomía exclusivamente en estos casos, con un nivel alto de acierto. La histeroscopia es útil en nuestro servicio para la planificación quirúrgica y nos permite además ir programando el quirófano en nuestro departamento con el diagnóstico morfológico histeroscópico sin demorarnos a la espera del resultado histológico por el valor predictivo positivo de casi el 100% que tenemos en los casos de diagnóstico morfológico de adenocarcinoma (datos pendientes de publicación).
Por tanto, la histeroscopia es una prueba diagnóstica que practicamos de rutina en la mayoría de las mujeres con cáncer de endometrio, en general, para hacer el diagnóstico y confirmarlo con la biopsia de endometrio, y otras veces, las menos, para conocer factores pronósticos como la afectación del canal endocervical, el tamaño tumoral y la localización del tumor en la cavidad uterina. En general, es fácil de realizar, y no añade coste ni excesivas incomodidades a la paciente.
ConclusionesLa histeroscopia tiene un alto valor predictivo positivo para el diagnóstico de tumores mayores de 2 cm y de afectación difusa de la cavidad; además, no añade coste ni complicaciones en el protocolo diagnóstico del cáncer de endometrio.
FinanciaciónEstudio financiado por la Dirección Territorial de Osakidetza.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.