Presentamos un caso de gestación gemelar bicorial biamniótica con rotura prematura de membranas al límite de la viabilidad fetal. Se adoptó una actitud expectante, produciéndose una corioamnionitis tras un periodo de 3 semanas. Se asistió al parto de 2 niñas cuya evolución al año de vida parece ser favorable. Existen múltiples controversias no resueltas sobre la mejor conducta en estos casos, particularmente con relación a cuándo finalizar la gestación. Asimismo, cabe destacar las dificultades del diagnóstico de esta complicación en las gestaciones múltiples, así como la complejidad del seguimiento en estos casos, siendo necesario definir protocolos específicos para su manejo.
We report a case of preterm premature rupture of membranes in a diamniotic dichorionic twin pregnancy at the limit of fetal viability. Expectant management was adopted. After 3 weeks of latency the pregnancy ended in chorioamnionitis. The patient delivered two girls whose neurodevelopment seems to be satisfactory at 1 year of follow-up. There are several unresolved controversies about the optimal management of these cases, especially when rupture of membranes occurs at the limit of fetal viability. There is no agreement about the right time to end pregnancy. This case also highlights the complexity of the follow-up of this complication in multiple pregnancies and the need for specific protocols to be developed.
La rotura prematura de membranas (RPM) es la pérdida de integridad de las membranas ovulares antes del inicio del trabajo de parto. Se produce antes de las 37 semanas de gestación en un 3-18% de los casos1, siendo una de las principales causas de prematuridad. Se han realizado numerosos estudios para definir las bases de su fisiopatología, así como sus consecuencias maternas y neonatales. Sin embargo, los resultados obtenidos han sido poco concluyentes debido a la dificultad de encontrar grupos control adecuados y al escaso número de casos en algunas semanas de gestación. La falta de unanimidad y de evidencia científica que avalen la conducta a seguir obliga a individualizar las decisiones en la mayoría de los casos.
Asumir una conducta expectante conlleva un riesgo infeccioso para la madre y el feto potencialmente grave. Por contra, prolongar la gestación permite alcanzar una mayor madurez fetal, con beneficios que podrían ser decisivos para un resultado neonatal más favorable. Por otra parte, la actitud activa de finalización precoz de la gestación presenta efectos inversos: el riesgo de la prematuridad frente al beneficio de reducir la infección materno-fetal. En las gestaciones múltiples se plantea además la dificultad de discernir qué feto presenta la RPM, consideración importante para la valoración del riesgo infeccioso y pronóstico del caso. Presentamos a continuación un caso de RPM en embarazo gemelar bicorial-biamniótico en edad gestacional al límite de la viabilidad fetal.
Caso clínicoPaciente de 40 años, que consulta a las 22+1 semanas de gestación por hidrorrea. Gestación gemelar bicorial biamniótica obtenida mediante FIV-TE con donación de ovocitos por fallo ovárico secundario a quimioterapia por tumor óseo. Primigesta sin otros antecedentes médicos de interés, grupo sanguíneo A (+). Serologías negativas excepto rubéola inmune. Ecografías de primer y segundo trimestre normales.
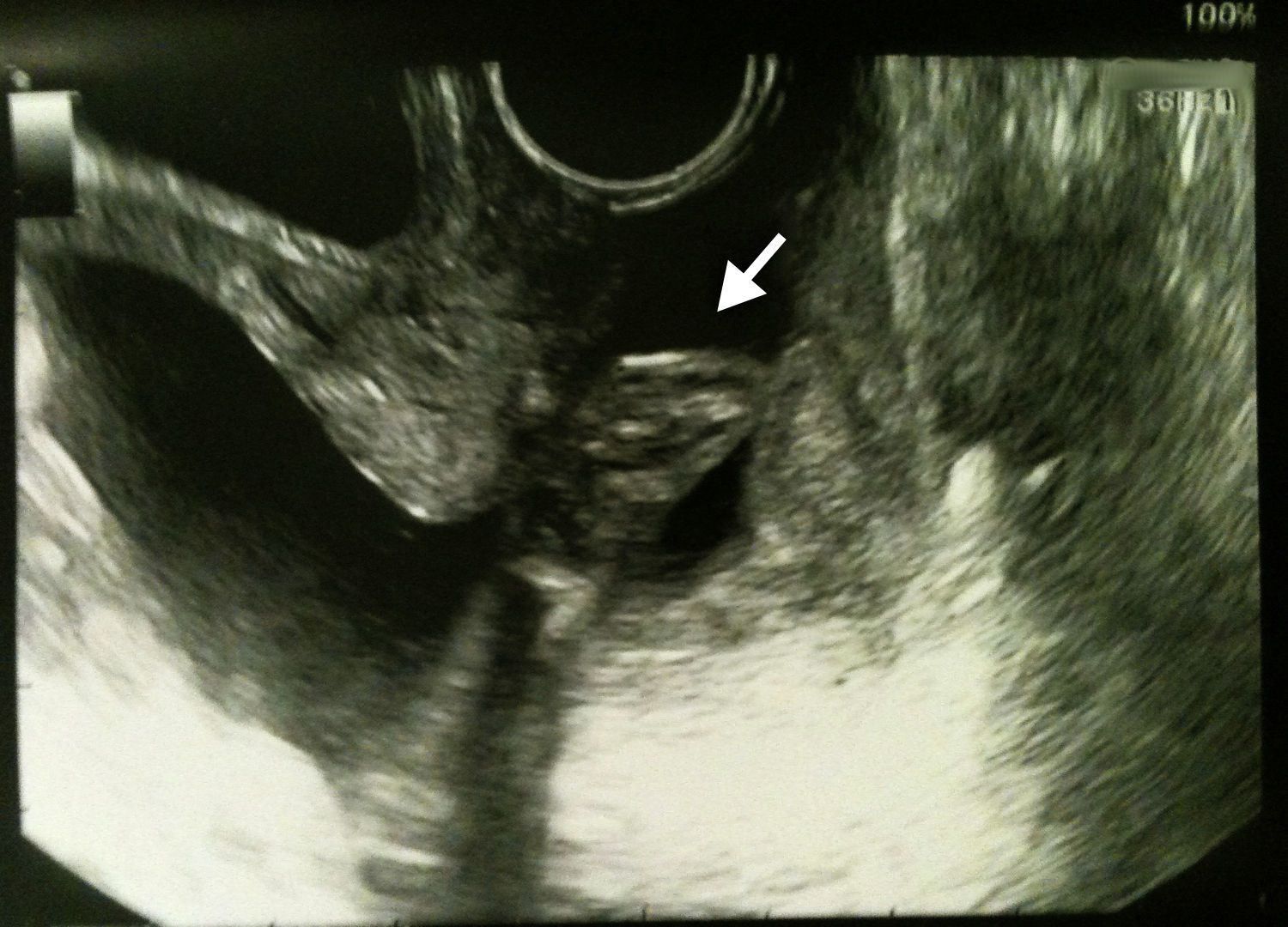
Paciente afebril a su llegada a urgencias, sin dolor abdominal ni sangrado, con escaso flujo vaginal transparente en la exploración. En ecografía transvaginal se observa longitud cervical de 26mm, con dilatación de 16mm y protusión de polo de bolsa amniótica con pie del primer gemelo en su interior (fig. 1). Ecografía abdominal: ambos fetos con frecuencia cardíaca positiva y presentación podálica. Biometrías acordes con la edad gestacional, con pesos fetales estimados de 530 y 531g respectivamente. Ambas placentas normoinsertas en cara anterior. Columna máxima de líquido amniótico (CMLA) del primer feto de 8cm, normal. CMLA del segundo feto de 4,4cm, normal. Registro cardiotocográfico: no dinámica uterina. Determinación de proteína microglobulina-α-1 placentaria (PAMG-1) para el diagnóstico de RPM: positiva. Analítica: Hb: 10,8g/dl; leucocitos: 10,88×109/l; proteína C reactiva (PCR)<5mg/l. Sedimento de orina negativo. Se ingresa a la paciente con sospecha de RPM del segundo gemelo, y se adopta de entrada una actitud expectante; profilaxis antibiótica con amoxicilina-ácido clavulánico 1g/8h. Se cursan cultivos vaginal y rectal, que son negativos. Cultivo endocervical positivo para Gardnerella vaginalis (G. vaginalis), por lo que se completa cobertura antibiótica con metronizadol 500mg/12h durante 7 días.
Durante el ingreso la paciente se mantiene afebril, con controles analíticos estables y adinamia uterina. A las 23+0 semanas, según protocolo, se inicia maduración pulmonar fetal con dexametasona 6mg/12h 4 dosis. En control ecográfico a las 24+2 semanas se observa CMLA de 2,6cm para el primer feto y normal para el segundo, confirmando finalmente RPM del primer gemelo. Crecimiento fetal dentro de la normalidad; sin cambios cervicales. A partir de las 24+5 semanas se evidencia leucocitosis progresiva hasta 18,53×109/L y PCR de 83mg/l. Dada la estabilidad clínica de la paciente y la ausencia de signos de corioamnionitis se decide control evolutivo. A las 25+2 semanas la paciente avisa por sensación de presión: a la exploración se evidencia cérvix en dilatación completa y polo cefálico en tercer plano de Hodge. Se asiste al parto espontáneo de niña de 685g, APGAR 8-9-10. Tras intento de parto vaginal del segundo gemelo, se realiza cesárea por situación transversa, amniorrexis intracesárea con aguas claras. Nace niña de 805g, APGAR 5-9-10.
Evolución materna favorable, con único pico febril de 38,4°C al tercer día, sin foco infeccioso aparente en la exploración. Cultivo microbiológico de la placenta: Pseudomonas aeruginosa (P. aeruginosa); estudio anatomopatológico que confirma corioamnionitis aguda. Se inicia tratamiento con imipenem 500mg/8h y la paciente es dada de alta al octavo día sin incidencias.
Con relación al resultado perinatal, la primera niña nace en apnea y frecuencia cardíaca correcta. A las 24h de vida se objetiva persistencia de ductus arterioso (PDA) hemodinámicamente significativo en ecocardiografía, que responde al tratamiento médico con ibuprofeno. A las 48h aparecen lesiones cutáneas descamativas eritematosas, sugestivas de ectima gangrenoso; cultivo de frotis ótico positivo para P. aeruginosa y Bacteroides. Se instaura tratamiento con meropenem, amikacina y curas tópicas, con remisión de las lesiones. Posteriormente presenta exudado conjuntival positivo para P. aeruginosa, que se trata con ciprofloxacino tópico durante 10 días. Precisa intubación orotraqueal (IOT) a los 5 días por apneas frecuentes acompañadas de hipoxemia; se extuba 3 días después y se instaura ventilación mecánica no invasiva. Hemodinámicamente estable, sin soporte vasoactivo. La paciente se mantiene estable durante el resto del ingreso, sin complicaciones gastrointestinales ni neurológicas. La niña es dada de alta a los 89 días de vida, con un peso de 2.260g y una talla de 43cm. Presenta desarrollo psicomotor correcto para su edad durante el primer año de vida.
Respecto a la segunda gemela, destaca la aparición de distensión abdominal y aumento del número de apneas a los 4 días de vida, requeriendo IOT y conexión a ventilación mecánica invasiva. La radiografía abdominal confirma neumoperitoneo por perforación intestinal única, sin impresión de enterocolitis necrotizante (NEC): se coloca drenaje peritoneal durante 10 días, con resolución del cuadro. Episodio similar 4 días más tarde, clínicamente sugestivo de NEC, precisando de nuevo IOT y tratamiento con meropenem. Coincidiendo con el proceso abdominal se realiza hemocultivo, que es positivo para Staphylococcus coagulasa (S. coagulasa) negativa multirresistente: se amplia cobertura antibiótica con vancomicina. Todos los cultivos fueron negativos para Pseudomonas. Se evidencia asimismo PDA hemodinámicamente significativo y se instaura tratamiento médico. Ecocardiografía de control: ductus restrictivo sin repercusión hemodinámica, que no requiere tratamiento. A los 60 días de vida presenta esplenomegalia y retinopatía progresiva, con estudio de CMV en orina positivo. Se realiza tratamiento con ganciclovir endovenoso 12 días y posteriormente valganciclovir oral. Mejoría de la retinopatía con el tratamiento. Sin complicaciones neurológicas. La paciente es dada de alta a los 89 días de vida, con un peso de 2.180g y una talla 43cm. Durante su seguimiento no se detectan alteraciones en el neurodesarrollo.
DiscusiónEn el caso presentado confluyen algunos de los aspectos más controvertidos de la RPM. La edad gestacional a la que se produce es uno de los principales factores pronósticos; las implicaciones y los riesgos cuando sucede en el límite de la viabilidad fetal suponen un gran reto para el obstetra.
La RPM es una de las causas más frecuentes de prematuridad, siendo responsable de hasta el 40% de los casos1. Existen diversas hipótesis para explicar su fisiopatología, contemplando múltiples causas que podrían suponer una agresión para las membranas. Entre ellas, una de las más aceptadas es la existencia de algún proceso inflamatorio o infeccioso como origen de la rotura. Así, algunos autores sugieren la existencia de una corioamnionitis subclínica como causa de hasta el 25-40% de las RPM2. Sin embargo, no existe acuerdo unánime sobre si la infección es causa o consecuencia de la rotura. Trentacoste et al. estudiaron específicamente la relación entre RPM, tiempo de latencia hasta el parto e infección en gestaciones gemelares bicoriales, concluyendo que la infección es un proceso derivado de la RPM, no su origen3.
Sin embargo, ya sea causa o efecto, el riesgo infeccioso de la RPM ha sido puesto de manifiesto en numerosos trabajos. Se estima que la incidencia de corioamnionitis en las RPM es del 10-15%4–6, y dicho riesgo es aún mayor cuanto menor es la edad gestacional a la que se produce4. Asimismo, se han estudiado las consecuencias de mantener una conducta expectante para permitir al feto alcanzar una mayor madurez, observándose una relación claramente positiva entre el tiempo de latencia hasta el parto y el riesgo de infección4. En una revisión Cochrane de 2010 en la que se comparaban los efectos de la actitud expectante y el manejo activo en las RPM pretérmino se concluyó que la finalización precoz de la gestación podría suponer un aumento en la incidencia de endometritis (RR: 2,32; IC 95%: 1,33-4,07), sin tener efecto en la de corioamnionitis (RR: 0,44; IC 95%: 0,17-1,14)7. En sus conclusiones constataron la falta de evidencia a favor de una de las 2 conductas, tanto en términos de resultado neonatal como materno, siendo necesarios más estudios para valorar los riesgos y beneficios de ambas actitudes.
Por otra parte, dado que la infección es una de las principales complicaciones de la RPM, es necesario evaluar sus posibles consecuencias para el feto. Se han formulado diversas hipótesis para explicar los mecanismos responsables del peor resultado perinatal observado en estos niños, incluso en los casos sin evidencia clínica de infección neonatal. Entre las más aceptadas se encuentra la existencia de un ambiente proinflamatorio nocivo para el feto. Melamed et al. compararon los resultados perinatales en casos de RPM y parto prematuro espontáneo sin RPM, concluyendo que, en general, existía mayor morbilidad neonatal en los casos de RPM, especialmente cuando el periodo de conducta expectante era superior a 7 días. Sin embargo, la tasa de morbilidad fetal infecciosa fue similar en los 2 grupos, y no se relacionó con el tiempo de latencia hasta el parto8. Estos mismos autores relacionaron también la severidad del oligoamnios secundario a la RPM con un peor resultado perinatal, suponiendo que la falta de líquido amniótico actuaría como potenciador de los efectos nocivos de un ambiente infeccioso subclínico. Asimismo, también se ha establecido que en caso de infección fetal manifiesta existe un mayor riesgo de parálisis cerebral y displasia broncopulmonar9. Otros autores sostienen en cambio que dicho ambiente estresante podría favorecer el proceso de maduración fetal, especialmente a nivel pulmonar. Así, Sims et al. proponen el siguiente escenario biológico: el ambiente inflamatorio estimularía la producción de glucocorticoides en el feto, potenciando a su vez la síntesis de surfactante pulmonar y mejorando el resultado respiratorio de estos niños6. De hecho, son diversos los estudios que encuentran una asociación significativa entre RPM y disminución de la incidencia del síndrome de distrés respiratorio10,11.
Por lo tanto, en este escenario de hipótesis un tanto contradictorias, adoptar una actitud expectante plantea necesariamente la siguiente pregunta: ¿hasta qué momento dicha actitud es beneficiosa y, por lo tanto, a partir de qué edad gestacional el riesgo de esperar supera al beneficio de favorecer la madurez fetal? Sims et al. concluyeron que, en los casos de RPM no complicada, el manejo expectante es globalmente beneficioso hasta las 28-33 semanas de gestación6, un margen que sigue siendo muy amplio. En un trabajo realizado para evaluar las consecuencias de la corioamnionitis clínica se encontró una mayor morbilidad neonatal en los casos de infección materna establecida, pero dichos resultados se observaron únicamente para edades gestacionales superiores a las 30 semanas4. Asimismo, al valorar la mortalidad a los 2 años de una conducta expectante inferior o superior a 48h Pasquier et al. concluyeron también que, para fetos de menos de 30 semanas, un tiempo de espera inferior a 48h se asociaba a mayor mortalidad, mientras que para fetos de más de 30 semanas la supervivencia era mayor si la latencia era menor de 48h12.
Por todo ello, la actitud expectante parece ser la opción más indicada a ciertas edades gestacionales, especialmente cuando nos encontramos en el límite de la viabilidad fetal. Algunos de los trabajos que buscan establecer el momento en que debería finalizarse una gestación con RPM señalan las 34 semanas como edad gestacional más conveniente5, mientras otros sostienen que la conducta expectante podría también aportar beneficios pasado este periodo13. Lo cierto es que las consecuencias de la prematuridad a cualquier edad siguen siendo motivo de preocupación para obstetras y pediatras. Así, publicaciones recientes destacan los resultados perinatales de los niños nacidos entre las 34+0 y 36+6 semanas, observándose una morbilidad mayor a la esperada con relación a los recién nacidos a término14,15. Será necesario esperar los resultados de los estudios en curso para valorar cuál es la mejor actitud en las RPM ocurridas entre las 34 y 37 semanas16,17.
Por último, es preciso considerar las particularidades de la RPM en las gestaciones gemelares bicoriales biamnióticas. Tanto el riesgo infeccioso como el pronóstico en estos casos son distintos según se trate de una RPM del primer o segundo feto. Sin embargo, determinar cuál de los 2 fetos presenta la RPM puede ser difícil, y no existe por el momento ningún método diagnóstico específico para gestaciones múltiples. El caso presentado se orientó inicialmente como una RPM del segundo gemelo, confirmándose durante el ingreso mediante la medición de líquido amniótico que el gemelo con rotura de membranas era el primero. En algunos casos seleccionados de RPM del primer feto se ha propuesto diferir el parto del segundo. Las medidas adoptadas incluyen tocólisis, cerclaje cervical y profilaxis antibiótica tras el parto vaginal del primer gemelo. Los estudios y casos publicados son escasos y han incluido principalmente gestaciones múltiples con RPM en edad gestacional límite para la viabilidad fetal, con el objetivo de disminuir las secuelas de la prematuridad en al menos uno de los niños. Aunque debe tenerse en consideración un posible sesgo de publicación, los resultados parecen alentadores, consiguiéndose una media de 47-48 días entre el parto del primer y segundo feto. Este manejo ha permitido obtener muy buenos resultados neonatales para el segundo gemelo, contrastando con la elevada morbimortalidad del primero18–22.
En conclusión, cuando una gestante presenta una RPM antes del término de la gestación, hay numerosos factores a considerar. En ausencia de signos de infección activa, tanto la finalización precoz como la conducta expectante parecen opciones razonables, y en la decisión adoptada influirá en gran medida la edad gestacional. Parece existir evidencia acerca del beneficio de prolongar la gestación cuanto más cerca del límite de la viabilidad fetal se produzca la RPM, pero no ha podido determinarse con exactitud hasta qué momento debe mantenerse tal medida. El rango propuesto hasta ahora es demasiado amplio.
Decidir finalizar una gestación prematuramente puede tener a su vez graves consecuencias. Los sistemas respiratorio y neurológico fetales especialmente prosiguen de forma importante su desarrollo en el tercer trimestre, y la prematuridad sigue siendo un riesgo real para estos niños. Estas 2 consideraciones son con frecuencia motivo de discrepancia entre los obstetras, por lo que es imprescindible evaluar las características individuales de cada caso. Las gestaciones gemelares biamnióticas presentan además la dificultad añadida de distinguir qué feto presenta RPM, por lo que es necesario mejorar la aproximación diagnóstica de esta complicación en estos casos y definir estrategias específicas para su manejo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.