Las infecciones vulvovaginales son un motivo muy frecuente de consulta en Atención Primaria, Especializada y Urgencias Hospitalarias, llegando a representar el 20% de las consultas ginecológicas.
El 75% de las mujeres experimentan un episodio de vulvovaginitis sintomática a lo largo de su vida y el 40-50%, al menos, un segundo episodio.
La vulvovaginitis candidiásica (VVC) es la más prevalente en Europa y la segunda en EE. UU., solo superada por la vaginosis bacteriana (VB).
ConceptoLa vulvovaginitis es la inflamación de la mucosa vaginal y de la piel vulvar. No siempre se afectan ambas áreas anatómicas de forma simultánea. Generalmente, la causa es infecciosa (micosis, vaginosis y tricomoniasis) pero puede ser de origen no infeccioso.
ClínicaSignosEritema, edema inflamatorio de piel y mucosas, aumento de secreción vaginal, en ocasiones maloliente.
SíntomasPrurito, escozor o dolor (vulvodinia). Resultan más patentes en la VVC y tricomoniasis que en la VB.
Fisiopatología. Microbiota vaginalConjunto de microorganismos que habitan en condiciones fisiológicas en la vagina. Se trata de un ecosistema complejo y dinámico hormonodependiente, con características propias y bien definidas, que se encuentra en equilibrio gracias a los mecanismos de defensa fisiológicos y a la microbiota natural existente en la vagina.
Hasta hace poco tiempo se mantenía la idea de que el feto intraútero no era portador de microorganismos; en el momento actual, se ha demostrado la presencia de lactobacilos en el líquido amniótico, la sangre de cordón umbilical y el meconio de niños sanos en los que las membranas amnióticas estaban íntegras.
El estado endocrino de la mujer condiciona microbiotas vaginales predominantes dependiendo de su edad y estado hormonal.
Acciones de la microbiota vaginalLos lactobacilos son los principales responsables del mantenimiento del ecosistema vaginal. Destacan como mecanismos de acción:
- –
Compiten con los hongos por los nutrientes disponibles.
- –
Bloquean receptores epiteliales para hongos mediante un sistema de coagregación.
- –
Generan sustancias como peróxido de hidrógeno, lactacinas y acidolinas, capaces de metabolizar la glucosa a ácido láctico, responsable de mantener el pH vaginal en rangos de acidez (entre 3,5-4,5), el cual representa el principal mecanismo de defensa frente a la colonización por patógenos.
- –
Potencian la respuesta inmunitaria mediante la secreción de interleucinas como IL-8 e IL-10, las cuales son cruciales en el aclaramiento de las VVC.
Basados en estos mecanismos de acción, y debido a que los tratamientos convencionales y las pautas establecidas han variado escasamente en las últimas décadas, recientemente se han introducido los probióticos, de administración vaginal y oral, como preventivos y coadyuvantes al tratamiento.
Micosis vulvovaginales: vulvovaginitis candidiásicaConceptoLa VVC es una enfermedad inflamatoria de la vagina y la vulva, producida por diferentes especies de hongos, fundamentalmente Candida spp., secundaria generalmente a condiciones fisiológicas alteradas que determinan disminución de la inmunidad local.
Aproximadamente el 25% de las vulvovaginitis infecciosas son candidiasis. Candida albicans (C. albicans) es la responsable del 90% de los episodios de candidiasis vulvovaginal. Otras especies menos frecuentes, también denominadas no albicans, como C. glabrata, C. tropicalis y C. krusei, representan el 10% de las candidiasis y han registrado en los últimos tiempos un aumento en prevalencia y un incremento en la resistencia al tratamiento habitual.
El 20% de las mujeres asintomáticas en edad fértil tienen Candida spp. en la microbiota vaginal normal.
La VVC puede clasificarse como:
- –
VVC no complicada.
- –
VVC recurrente.
- –
VVC por especies resistentes.
Se estima que el 75% de las mujeres presentará al menos un episodio en el transcurso de su vida. El 10-20% de VVC son complicadas (tabla 1).
Existen factores desencadenantes como:
- –
Diabetes mellitus mal controlada. Por ello se recomienda estudio del metabolismo carbohidrato a en caso de VVC recurrente.
- –
Uso de antibióticos: durante y tras el tratamiento de antibióticos de amplio espectro (tetraciclinas, ampicilina, cefalosporinas) por desequilibrio de la microbiota normal.
- –
Enfermedades inmunodepresoras, como virus de la inmunodeficiencia humana, lupus sistémico u otras.
Estas y alguna otra circunstancia pueden favorecer la multiplicación de este tipo de hongos, que hasta entonces eran asintomáticos, o la colonización de novo de la vulva y la vagina.
Cuando se produce algún cambio en la microbiota vaginal que favorece la proliferación de Candida dará lugar a unos síntomas muy característicos:
- –
Aumento de la secreción vaginal: blanquecina en grumos, aspecto de yogur.
- –
Prurito, disuria, dispareunia, sensación de escozor en genitales externos.
- –
Lesiones cutáneas en vulva y periné.
- –
Mucosa vaginal eritematosa con secreción blanca fácil de desprender.
La anamnesis tiene un papel destacado en el diagnóstico, ya que, tanto la presencia de cualquier factor desencadenante del posible cambio de la microbiota que favorezca el crecimiento de las cándidas (p. ej., la toma previa de antibióticos de amplio espectro), como la presencia de factores personales (antecedentes de diabetes o embarazo), así como la existencia de episodios previos de candidiasis, pueden ser muy orientativas.
El diagnóstico no debe basarse exclusivamente en los síntomas y deben realizarse una exploración minuciosa y exploraciones complementarias, ya que una de las causas más frecuentes del fallo terapéutico es un diagnóstico erróneo (tabla 2).
Pruebas complementarias en el diagnóstico de VVC
| pH | No suele variar con respecto al pH normal (4-4,5) |
| Frotis en fresco | |
| Con suero fisiológico al 0,9% | Se visualizan esporas o hifas (sensibilidad 50%) |
| Tinción de Gram | Se visualizan esporas e hifas (sensibilidad 65%) |
| Con unas gotas de KOH | Se ven levaduras en fase de esporas e hifas (sensibilidad 70%) |
| Cultivo vaginal | Prueba confirmatoria |
El objetivo del tratamiento es aliviar los síntomas, por lo que se debe tratar a todas las mujeres sintomáticas. La VVC no complicada tiene buenos resultados terapéuticos con tratamientos tópicos con derivados imidazólicos, poliénicos o piridinona de corta duración (tabla 3). No parecen existir diferencias relevantes entre ellos ni entre las distintas pautas de tratamiento. También se puede aplicar un tratamiento imidazólico por vía oral de corta duración, aunque se recomienda reservar el tratamiento por vía oral para infecciones recurrentes o persistentes. La administración de probióticos como adyuvantes del tratamiento ha demostrado en algunos estudios reducción de las recidivas.
Tratamiento de la VVC no complicada
| Antimicóticos tópicos |
| Imidazólicos |
| Clotrimazol 2% crema vaginal 5g/24 h 7 días |
| Clotrimazol comprimido vaginal 100mg/12-24 h, 3-7 días |
| Clotrimazol comprimido vaginal 500mg/24 h, 1 día |
| Miconazol 2% crema vaginal 5g/24 h, 14 días |
| Ketoconazol 400mg óvulo vaginal/24 h, 3-5 días |
| Econazol 150mg óvulo vaginal/24 h, 3 días |
| Fenticonazol 200mg óvulo vaginal/24 h, 3 días |
| Fenticonazol 600mg óvulo vaginal/24 h, 1 día |
| Sertaconazol 2% crema vaginal 5g/24 h, 7 días |
| Sertaconazol 500mg óvulo vaginal/24 h, 1 día |
| Poliénicos |
| Nistatina 100.000 U comprimido vaginal/24 h, 14 días |
| Piridona |
| Antimicóticos sistémicos |
| Triazólicos |
| Fluconazol 150mg/24 h, 1 día vía oral. |
| Itraconazol 200mg/12 h, 1 día, o 200mg/24 h, 3 días, vía oral |
| Imidazólicos |
| Ketoconazol 200mg 2 comprimidos/24 h, 5 días, vía oral |
| Embarazo |
| Clotrimazol 100mg óvulo vaginal/24 h durante 7 días o miconazol |
Durante el embarazo deben evitarse tratamientos por vía oral. En el tratamiento con los comprimidos vaginales durante las últimas 4-6 semanas del embarazo, se recomienda prescindir del empleo del aplicador, introduciendo el comprimido directamente con el dedo, previo lavado cuidadoso de las manos.
Vaginosis bacterianaConceptoFrente a las vaginitis floridas, la VB presenta escasa sintomatología, con un incremento de la secreción vaginal, que se hace más acuosa y maloliente.
La prevalencia es alta, aunque las cifras varían según las fuentes debido a la discreción sintomática y a la falta de especificidad de los criterios diagnósticos.
Se calcula que afecta al 8-30% de las mujeres sexualmente activas de los países industrializados.
La concepción de la vaginosis ha cambiado, pasando de considerarse una entidad monomicrobiana constituida por Gardnerella vaginalis (G. vaginalis), a polibacteriana sin componente inflamatorio, donde además los responsables son comensales habituales de la vagina, como gérmenes anaerobios gramnegativos, Mobilincus y bacilos grampositivos como el Atopium vaginae, considerado comensal habitual de la vagina. La Gardnerella se identifica en el 10% de mujeres sin patología. Hay, no obstante, patrones generales de microbiota vaginal, que tienden a diferenciarse entre mujeres con y sin vaginosis.
FisiopatologíaLa vaginosis se entiende actualmente como una variante de la microbiota vaginal. En el nivel del ecosistema vaginal, el aumento de los estrógenos supone un incremento en la producción de glucosa por el epitelio, lo que constituye el sustrato para que los bacilos de Döderlein, denominados por eso lactobacilos, generen ácido láctico y reduzcan el pH. Este condiciona la población de la microbiota, de suerte que cuando está ácido, favorece la llegada de especies de lactobacilos intestinales que, además de ácido láctico, pueden producir péptidos antibacterianos denominados bacteriocinas y otras sustancias. El aumento de la secreción y del hedor se explica como producto de la actividad enzimática de la superpoblación bacteriana.
En la vaginosis hay un desvío de este patrón, con predominio de especies comensales, que aumentan de forma extraordinaria. No se sabe con exactitud qué lleva a desarrollar este desvío del equilibrio normal de la microbiota. Una hipótesis reciente la considera una forma natural de respuesta a la relación sexual, donde la mezcla del eyaculado y el trasudado vaginal generado en el coito elevan el pH en un intento de proteger a los espermatozoides de los efectos del ácido láctico. Este nuevo microambiente favorecería la proliferación de la G. vaginalis, que podría ser la puerta para la del resto de elementos polimicrobianos.
Aspectos de interés clínico y diagnósticoSe admite que aumenta con la promiscuidad o con la adquisición de un compañero sexual nuevo en el mes previo. También con las duchas vaginales, o con la concurrencia o presentación previa de infecciones bacterianas o virales de transmisión sexual. Se ha encontrado transmisión sexual tanto en relaciones hetero como homosexuales.
La vaginosis aumenta el riesgo de amnionitis, parto pretérmino, rotura prematura de membranas o infecciones postaborto. También de infecciones de transmisión sexual, bacterianas o virales.
DiagnósticoAdemás de la anamnesis orientada a la identificación de síntomas, como aumento de secreción, olor desagradable o sensación de irritación, el diagnóstico se basa en los criterios de Amsell, que requieren la presencia de 3 de los 4 rasgos clínicos expuestos en la tabla 4. Se estima que aporta un diagnóstico correcto en el 90% de los casos de vaginosis.
Criterios de Amsell
| Rasgo clínico |
| Secreción vaginal homogénea, cuyo color y cantidad pueden variar |
| Hedor de aminas (característico a pescado) al añadir gotas de solución de hidróxido potásico a un porta con secreción vaginal. También denominado «whiff test» |
| «Clue cells» al mirar por microscopio. Se estima que deben ser positivas más de un 20% de las células |
| pH vaginal superior a 4,5 |
Posteriormente, Nugent estableció una puntuación de 1-10 sobre una tinción de Gram, donde el grado ascendía en función de la proporción de Gardnerella, anaerobios y población microbiana global identificada en la extensión.
TratamientoEn la vaginosis hay un desvío del patrón normal de la microbiota vaginal, con predominio de especies comensales, que aumentan de forma extraordinaria.
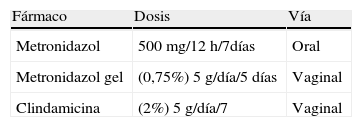
El potencial de recidiva es alto tras tratamiento antibiótico, a pesar de que este se lleve a efecto con agentes anaerobicidas, como el metronidazol o la clindamicina (tablas 5 y 6).
Parte de esta resistencia se explica por la propia de Atopobium al metronidazol, y parte por la constitución de estructuras denominadas biopelículas, o biofilm que dificulta la llegada del antibiótico. Los biofilm están presentes en una buena parte de la mucosa vaginal de las mujeres con vaginosis y se generan como resultado de la acumulación de masas de bacilos empaquetados, con muy escaso espacio entre sus membranas y la propia del epitelio. Las células «clue» serían fragmentos epiteliales descamados, cubiertos de biofilm. La estructura del biofilm proporciona una cobertura frente a la acción antibiótica, lo que favorece la transformación de la vaginosis en una entidad crónica. También opera como elemento de transmisión entre individuos. Se ha encontrado, por ejemplo, en semen de varones, en muestras criopreservadas, o en centrifugados de orina.
Nuevas formas terapéuticas que, como los probióticos, intentan reconstituir el patrón estándar de la microbiota, a partir del aporte de lactobacilos, están cobrando interés. En forma de producto liofilizado (cápsulas vaginales o tampones), o en otros sustratos, han demostrado eficacia tanto en la prevención como en el tratamiento. Lo avalan algunos estudios clínicos (Senok et al., 2009) y, en la actualidad, se considera su papel en la prevención, como adjuntos al tratamiento antibiótico, o incluso como sustitutos del mismo (McPhee et al., 2010). En cualquier caso, la solución de la vaginosis a largo plazo continúa siendo una cuestión mal resuelta, que precisa todavía de estudios clínicos de buena calidad.
Vulvovaginitis por TrichomonasConceptoCausada por Trichomonas vaginalis (TV), un protozoo unicelular parásito de la vagina, que no forma parte de la microbiota vaginal normal.
Hasta hace unos años se afirmaba que era una infección de transmisión sexual (ITS), con un elevado número de nuevos casos cada año. Sin embargo, los hallazgos clínicos de la última década demuestran que es una infección que está en franca disminución tanto en prevalencia como en incidencia, al menos en los países occidentales, manteniéndose estable en los países en desarrollo.
La infección se asocia a conductas de riesgo, como nuevos o múltiples compañeros sexuales, con antecedentes de ITS, que intercambien sexo por dinero o adictas a drogas por vía parenteral.
DiagnósticoLas manifestaciones clínicas son variables, caracterizadas por mal olor, secreción vaginal más o menos abundante de color amarillo-verdosa e irritación vulvar con prurito intenso vulvovaginal. Puede ser también asintomática.
El diagnóstico de sospecha es clínico y se confirma con el frotis en fresco, mediante observación al microscopio de la secreción vaginal, diluida en una gota de suero. Ello permite la visualización del parásito y su característico movimiento; este método tiene una sensibilidad (S) del 60-70% con una especificidad (E) del 99-100%.
Otros métodos más precisos, como el cultivo en medio de Diamond o Roiron, mejoran la S hasta un 80-90%, con una E > 99%, aunque adolecen de su falta de inmediatez.
Métodos aún más precisos y sofisticados. como la reacción en cadena de la polimerasa, se realizan en 6 h y aumentan la S a > 95%, con una E del 99-100%, pero es extremadamente más cara.
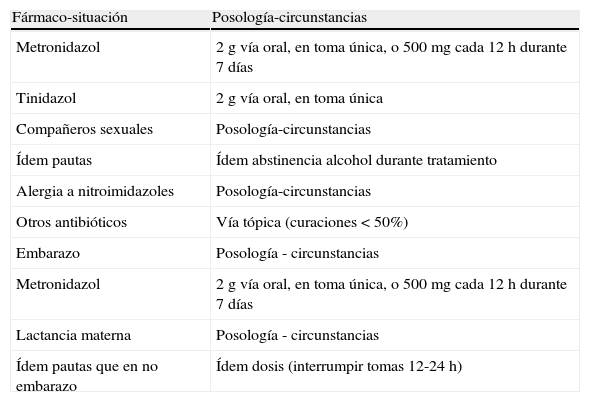
TratamientoEl tratamiento recomendado (tabla 7) es con metronidazol a la dosis de 2 g en una sola dosis por vía oral (vo) o bien tinidazol a la misma dosis y vía. Como régimen alternativo, puede emplearse metronidazol 500mg cada 12 h durante 7 días.
Tratamiento de la tricomoniasis vaginal
| Fármaco-situación | Posología-circunstancias |
| Metronidazol | 2 g vía oral, en toma única, o 500mg cada 12 h durante 7 días |
| Tinidazol | 2 g vía oral, en toma única |
| Compañeros sexuales | Posología-circunstancias |
| Ídem pautas | Ídem abstinencia alcohol durante tratamiento |
| Alergia a nitroimidazoles | Posología-circunstancias |
| Otros antibióticos | Vía tópica (curaciones < 50%) |
| Embarazo | Posología - circunstancias |
| Metronidazol | 2 g vía oral, en toma única, o 500mg cada 12 h durante 7 días |
| Lactancia materna | Posología - circunstancias |
| Ídem pautas que en no embarazo | Ídem dosis (interrumpir tomas 12-24 h) |
En ambos casos, los pacientes deben ser advertidos de la prohibición de consumir alcohol durante el tratamiento y hasta 24 h tras su finalización, en el caso de metronidazol, y 72 h para el tinidazol.
Los tratamientos tópicos con metronidazol en forma de gel intravaginal son considerablemente menos eficaces (< 50%) que los tratamientos vo; no se consiguen niveles terapéuticos suficientes ni en la uretra ni en las glándulas perivaginales.
Los compañeros sexuales deben ser tratados con similares regímenes, proponiéndose abstinencia sexual hasta completar el tratamiento.
Los pacientes con alergia a nitroimidazoles (metronidazol y tinidazol) pueden ser tratados con tratamientos tópicos de diferente grupo terapéutico, pero con tasas de curación más bajas (< 50%).
TV se ha asociado durante el embarazo a situaciones como rotura prematura de membranas, parto pretérmino o bajo peso al nacer. El tratamiento de la mujer gestante es similar a la no gestante con preferencia por metronidazol, ya que no ha sido establecida la seguridad de tinidazol en el embarazo. Durante la lactancia materna, TV puede ser tratada igualmente interrumpiendo las tomas hasta 12-24 h desde la última dosis administrada. En caso de tinidazol, el tiempo de interrupción de la lactancia materna debe ser de 3 días tras la última dosis.
Prevención de la recidiva de las infecciones vaginalesSe considera recidiva la reaparición de una enfermedad después de un periodo considerado de curación. En el caso de las infecciones vaginales, debemos distinguir esta situación de las persistencias de la infección con periodos de mejoría, atribuibles a tratamientos no eficaces.
En este aspecto, la VVC, la VB y la tricomoniasis se comportan de forma distinta.
Se considera que una VVC es recidivante cuando la paciente presenta 4 o más episodios en un año y esto ocurre en aproximadamente el 40-45% de las mujeres que presentan un primer episodio de vaginitis micótica en algún momento de su vida.
Entre los determinantes de la recidiva, se han mencionado la contaminación a partir del reservorio digestivo o las contaminaciones cruzadas con la pareja, pero ninguna ha resistido a la experimentación científica bien reglada.
Por otra parte, un número no despreciable de mujeres se autodiagnostican y tratan a partir de sus experiencias anteriores, sin que se haya probado la infección.
Vulvovaginitis candidiásica recidivanteActualmente, se considera que en un porcentaje considerable de casos el tratamiento farmacológico con azoles no elimina la presencia del hongo en la vagina y este se desarrolla de nuevo cuando se dan condiciones ambientales favorables. Estas serían consecuencia tanto de factores exógenos como del estado de la propia microbiota vaginal y de sus condiciones físicas.
Entre las primeras, incluiríamos las situaciones hiperglucémicas (diabetes i y ii), el embarazo, el uso de anticonceptivos hormonales combinados, los geles espermicidas, las situaciones de inmunodeficiencia y los tratamientos previos con antibióticos de amplio espectro. En este último caso, por eliminación o merma de la microbiota autóctona de la vagina.
En aproximadamente un tercio de las VVC de repetición el germen causante no es una candida del género C. albicans, como la C. glabrata o la C. tropicalis, que, sin embargo, son también sensibles a la mayoría de azoles usados en el tratamiento de esta entidad. La alternativa sería el terconazol, no disponible en España.
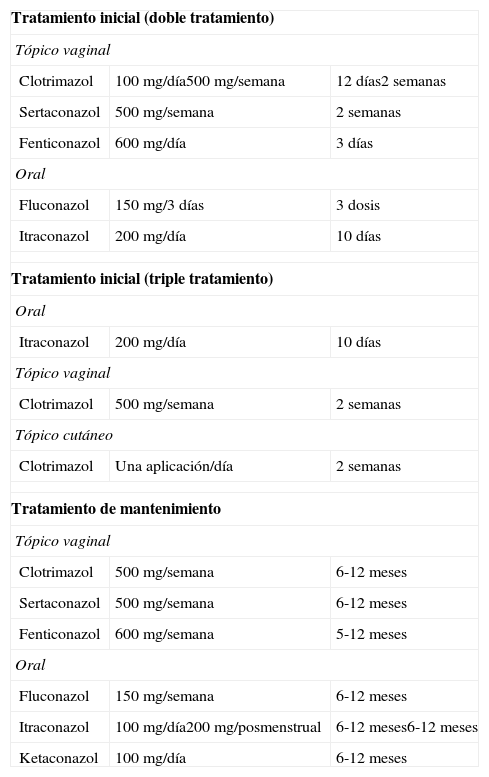
En el caso de las VVC recidivantes se aconseja prolongar el tratamiento vo durante 14 días. En casos rebeldes, se podría mantener un tratamiento de mantenimiento con la administración periódica durante 6-12 meses (tabla 8).
Tratamiento de la VVC recidivante
| Tratamiento inicial (doble tratamiento) | ||
| Tópico vaginal | ||
| Clotrimazol | 100 mg/día500 mg/semana | 12 días2 semanas |
| Sertaconazol | 500 mg/semana | 2 semanas |
| Fenticonazol | 600 mg/día | 3 días |
| Oral | ||
| Fluconazol | 150 mg/3 días | 3 dosis |
| Itraconazol | 200 mg/día | 10 días |
| Tratamiento inicial (triple tratamiento) | ||
| Oral | ||
| Itraconazol | 200 mg/día | 10 días |
| Tópico vaginal | ||
| Clotrimazol | 500 mg/semana | 2 semanas |
| Tópico cutáneo | ||
| Clotrimazol | Una aplicación/día | 2 semanas |
| Tratamiento de mantenimiento | ||
| Tópico vaginal | ||
| Clotrimazol | 500 mg/semana | 6-12 meses |
| Sertaconazol | 500 mg/semana | 6-12 meses |
| Fenticonazol | 600 mg/semana | 5-12 meses |
| Oral | ||
| Fluconazol | 150 mg/semana | 6-12 meses |
| Itraconazol | 100 mg/día200 mg/posmenstrual | 6-12 meses6-12 meses |
| Ketaconazol | 100 mg/día | 6-12 meses |
Vistos los elementos involucrados en la fisiopatología, parece adecuado, como primera medida, optimizar las situaciones de riesgo (buen control glucémico en diabéticas, prevención ante los tratamientos de antibióticos de amplio espectro, etc.). La otra alternative es favorecer la recuperación de la biota vaginal con la administración de lactobacillus
Revisada la literatura disponible de forma rigurosa se identificaron 4 ensayos clínicos aleatorizados que evaluaron la eficacia de los probióticos administrados por vía vaginal en la prevención de la VVC. Los resultados sugieren un discreto efecto que debería ser confirmado mediante nuevos estudios bien diseñados. La evidencia indirecta sugiere que lactobacillus podría ser una alternativa, prometedora, coste-efectiva y segura en comparación con antibióticos en la prevención de recurrencias en población seleccionada. Por este motivo, es razonable recomendar la prescripción de lactobacillus por vía vaginal en pacientes con alto riesgo de recurrencias, sugiriéndose la administración durante 5-10 días y repetir el tratamiento 3 meses (intra o posmenstrual).
Vaginosis bacteriana recidivanteLa VB presenta también una alta tendencia a la recidiva. Se ha observado que hasta un 50% de las mujeres diagnosticadas presentan una segunda infección durante el primer año.
No se han podido establecer los factores de riesgo para estas recidivas, no habiéndose observado relación con el estilo de higiene íntima, los hábitos sexuales, el tipo de anticonceptivo, la frecuencia del sangrado o los lavados vaginales. Tan solo se ha demostrado relación con el número de compañeros sexuales durante un periodo determinado.
Ante la recidiva, se recomienda repetir el tratamiento. En los casos de posible resistencia al metronidazol, una opción alternativa es la administración intravaginal de clindamicina.
También en este caso, y con la misma racionalidad, se ha estudiado el uso concomitante o en el intervalo de lactobacillus: 5 estudios valoraron la suplementación con lactobacillus del tratamiento antibiótico en mujeres con diagnóstico de VB. Los resultados tienden a mostrar que la adición de lactobacillus reduce la tasa de recaídas a largo plazo, especialmente en las mujeres que responden inicialmente al tratamiento antibiótico. No obstante, aunque el tratamiento con lactobacillus parece prometedor, especialmente en las pacientes con mayor riesgo de recurrencia, los resultados no son concluyentes.
El efecto favorable observado con lactobacillus sobre la flora y el pH vaginal parecería indicar un menor riesgo asociado de recurrencias.
En un ensayo clínico aleatorizado y controlado con placebo de buena calidad se evaluó la eficacia de los probióticos vía vaginal en la profilaxis de la vaginosis bacteriana en mujeres con VB recurrentes, encontrando un efecto beneficioso de los probióticos en términos de reducción de recurrencias tanto a corto (2 meses) como a largo plazo (11 meses). Las pautas recomendadas de administración son 5-10 días y repetir el tratamiento 3 meses (intra o posmenstrual).
Tricomoniasis recidivanteLos casos de recidiva de tricomoniasis suelen estar relacionados con el mal cumplimiento de la paciente o, más frecuentemente, de la pareja, al tratarse en este caso de una infección de transmisión sexual.
Vulvovaginitis no infecciosasLa causa más frecuente de vulvovaginitis no infecciosa es la atrófica, asociada a la disminución de estrógenos, propio de la peri y posmenopausia o de algunas situaciones presentes en la época fértil (puerperio y lactancia, quimioterapia, fármacos antiestrogénicos). Esta situación es tratada con detalle en otro protocolo SEGO.
Vulvitis alérgicas e irritativasSu diagnóstico requiere anamnesis, preguntando por la historia personal o familiar de eccema, psoriasis o diabetes, así como por los tratamientos utilizados previamente.
Debe consignarse la duración de los síntomas y las posibles circunstancias desencadenantes, así como la localización de las molestias (internas o externas) y su posible relación con el ciclo.
Los síntomas son similares para diversas etiologías, siendo los más frecuentes el escozor, el dolor perineal, la disuria por contacto y, raramente, el aumento de la secreción vaginal.
Suele existir mayor componente vulvar que vaginal cuando es producida por el lavado perineal deficiente (por defecto o por exceso), el uso de productos higiénicos inadecuados o protectores sanitarios utilizados de manera continuada, siendo necesario investigar el posible irritante.
En la exploración debe realizarse un examen general de la piel, especialmente en zona de pliegues, y perineal, valorando la coloración, el aspecto y la extensión de la lesión.
Los hallazgos clínicos varían en función de la causa. En algunas mujeres, a pesar de los síntomas, la vulva y la vagina tienen un aspecto normal, mientras que en otras se identifica un grado variable de inflamación o irritación, acompañado de signos de excoriación por rascado.
Es inusual la secreción vaginal aumentada y los cultivos muestran una flora normal o inespecífica.
En caso de duda, o de falta de respuesta terapéutica, la biopsia de la piel vulvar mediante un punch 3-4mm ayudará a precisar el diagnóstico.
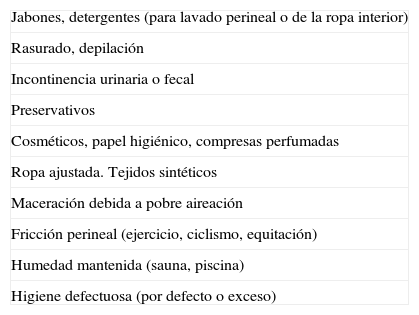
TratamientoEl tratamiento consiste en evitar los agentes irritantes (tabla 9), junto con la adopción de medidas para el alivio de los síntomas.
Irritantes vulvares
| Jabones, detergentes (para lavado perineal o de la ropa interior) |
| Rasurado, depilación |
| Incontinencia urinaria o fecal |
| Preservativos |
| Cosméticos, papel higiénico, compresas perfumadas |
| Ropa ajustada. Tejidos sintéticos |
| Maceración debida a pobre aireación |
| Fricción perineal (ejercicio, ciclismo, equitación) |
| Humedad mantenida (sauna, piscina) |
| Higiene defectuosa (por defecto o exceso) |
Son el tratamiento de elección inicial, recomendándose utilizar un corticoide tópico potente par a aliviar los síntomas más rápidamente, pudiendo después pasar al uso de un corticoide más débil (tabla 10).
La atrofia es rara con el uso durante un tiempo limitado de un corticoide potente. En cuanto a la galénica, los ungüentos son mejor tolerados que las cremas (produciendo menos picor).