Determinar las modificaciones de la proteína C reactiva y la homocisteína en menopáusicas que utilizan tibolona.
Materiales y métodosUna muestra de 45 menopáusicas que fueron tratadas con una dosis diaria de 2,5mg de tibolona por 6 meses. Se midieron las concentraciones séricas de proteína C reactiva y homocisteína.
ResultadosSe observó un aumento significativo en las concentraciones de proteína C reactiva luego de 6 meses de tratamiento (0,51±0,29mg/dl al inicio del estudio comparado con 0,95±0,34mg/dl después del tratamiento; p<0,05). Se encontró una disminución significativa en las concentraciones de homocisteína cuando se comparó luego de 6 meses de tratamiento (10,16±1,45pmol/l) con los valores iniciales (10,95±1,97pmol/l; p<0,05).
ConclusiónLa tibolona produjo aumento significativo en las concentraciones de proteína C reactiva y una disminución en las concentraciones de homocisteína luego de 6 meses de uso.
To determine modifications in C-reactive protein and homocysteine in postmenopausal women who used tibolone.
Materials and methodsWe selected a sample of 45 postmenopausal women treated with a 2.5-mg dose of tibolone daily for 6 months. Serum concentrations of C-reactive protein and homocysteine were measured.
ResultsC-reactive protein concentrations were significantly increased after 6 months of treatment (0.51±0.29mg/dl at baseline compared with 0.95±0.34mg/dl after treatment; P<.05). Homocysteine concentrations were significantly reduced after 6 months of treatment (10.16±1.45picomol/L) compared with initial values (10.95±1.87picomol/L; P<.05).
ConclusionsAfter 6 months of use, tibolone significantly increased C-reactive protein concentrations and reduced homocysteine concentrations.
Es ampliamente conocido que la incidencia de las enfermedades cardiovasculares se incrementa después de la menopausia. Se ha propuesto que la terapia hormonal de remplazo reduce el riesgo de enfermedad cardiovascular en un 50% sobre la base de estudios epidemiológicos y angiográficos1,2. Sin embargo, estudios clínicos al azar en mujeres con enfermedad cardiovascular establecida han producido dudas sobre el efecto cardioprotector de los estrógenos3. El incremento en el riesgo de la enfermedad cardiaca coronaria ha sido sorpresivo, debido a los incrementos que se observan en las concentraciones de lipoproteínas de alta densidad y la disminución de las lipoproteínas de baja densidad (LDL)4. Una posible explicación para esto es el incremento que se observa en las concentraciones de triglicéridos, proteína C reactiva (PCR) y homocisteína.
La PCR es un marcador sensible de inflamación. Las elevaciones en las concentraciones aumenta el riesgo de eventos cardiovasculares posteriores tanto en hombres como en mujeres5. Puede ser un marcador para predecir el aumento del riesgo de la aparición de enfermedades cardiovasculares o puede tener algunas propiedades proinflamatorias y aterogénicas directas, ya que está presente en la placa aterosclerótica. Se ha demostrado que induce la producción de moléculas de adhesión en las células endoteliales humanas. Estos hallazgos apoyan la teoría de que la PCR puede tener un papel directo en la promoción de los componentes inflamatorios de la aterosclerosis6,7. El tratamiento con estrógenos y progestinas puede incrementar las concentraciones de eventos cardiovasculares futuros y el incremento de las concentraciones de PCR asociado al uso de terapia hormonal de remplazo puede tener efectos proinflamatorios e incrementar la vulnerabilidad de la placa aterosclerótica8.
La homocisteína fue identificada inicialmente en 1932 como un producto de la desmetilación de la metionina. McCully et al.9 sugirieron que la elevación de las concentraciones de homocisteína es un factor de riesgo independiente en la patogénesis de la aterosclerosis. Posteriormente, estudios angiográficos confirmaron la relación entre la hiperhomocisteinemia y la enfermedad arterial coronaria y cardiovascular10. Los niveles de homocisteína total son mayores en las menopáusicas que en las premenopáusicas y se ha demostrado que la terapia de remplazo hormonal disminuye los niveles de homocisteína11,12. Los estrógenos equinos conjugados han demostrado que reducen las concentraciones de homocisteína en menopáusicas sanas1. Por otra parte, se ha reportado incrementos en la concentración de homocisteína en ratas ooforectomizadas tratadas con estrógenos equinos conjugados13.
La tibolona, un compuesto sintético con propiedades estrogénicas, androgénicas y progestagénicas, que alivia los síntomas climatéricos y previene la pérdida ósea, sin estimular el endometrio, ha demostrado ser útil14. Más aún, la tibolona no tiene efectos sobre la incidencia de cáncer de mama y el sangrado vaginal es raro comparado con la terapia hormonal de remplazo. La tibolona tienen algunos efectos benéficos, como la reducción de los triglicéridos, colesterol total, LDL y lipoproteína (a), reduciendo el riesgo de enfermedad cardiovascular15. Se ha demostrado que la tibolona mejora significativamente la respuesta vasodilatadora de la arteria braquial en una magnitud similar a lo que lo hacen las dosis convencionales de estrógenos; sin embargo, la tibolona no produce cambios significativos en la antitrombina iii4. Los estudios sobre los efectos de la tibolona en las concentraciones de homocisteína y la PCR en mujeres menopáusicas son limitados.
El objetivo de la investigación fue determinar las modificaciones de la PCR y la homocisteína en menopáusicas que utilizan tibolona.
MétodosSe seleccionaron al azar 45 menopáusicas que acudieron a la consulta de menopausia del Hospital Central Dr. Urquinaona y que fueron tratadas con una dosis diaria de 2,5mg de tibolona por vía oral. La investigación fue aprobada por el comité de ética e investigación del hospital.
Se incluyó a menopáusicas sanas, entre los 45 y los 60 años de edad, con ausencia de menstruaciones en los 12 meses previos al inicio del estudio y que presentaron valores de hormona foliculoestimulante mayor de 50 U/l y de estradiol menor de 35mg/dl. Las menopáusicas con anomalías clínicas o de laboratorio que sugieran alteraciones cardiovasculares, hepáticas o renales, con antecedentes de coagulopatías, uso de estrógenos, andrógenos o progestágenos por vía oral o transdérmica en los 6 meses previos al estudio y hábito tabáquico de más de 10 cigarrillos al día se excluyeron del estudio. Al inicio de la investigación, se realizó un cuestionario clínico donde se incluyeron los antecedentes familiares, el examen físico, los resultados de laboratorio (química y hematología) y la electrocardiograma.
A todas las participantes se les tomó una muestra inicial de suero para determinar los valores básales de homocisteína y PCR, y se repitió a los 6 meses. Las muestras de suero de todas las participantes se obtuvieron en ayunas para reducir los efectos de los alimentos. Las muestras se almacenaron a –80°C hasta el momento de la prueba. La PCR y la homocisteína se midieron usando radioinmunoensayo. Los coeficientes de variación intra e interensayos fueron menores del 5%.
Los datos se presentan como promedio±desviación estándar. Para el análisis estadístico de las diferencias en las concentraciones iniciales y después de 6 meses de tratamiento se utilizó la prueba de la t de Student para muestras dependientes o relacionadas. El porcentaje de cambio (en comparación al inicio) en las concentraciones (conc) del parámetro se calculó como: ([Conc 6 meses] B [conc inicial]/[conc inicial])×100. Se consideró p<0,05 como estadísticamente significativo.
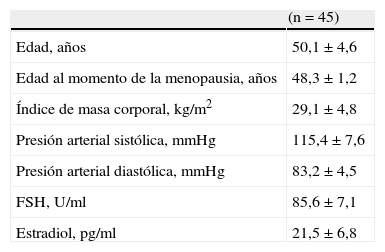
ResultadosLas características generales de las 45 menopáusicas se muestran en la tabla 1. La edad promedio de las pacientes fue de 50,1±4,6 años, con un índice de masa corporal de 29,1±4,8kg/m2, concentraciones de hormona foliculoestimulante y estradiol de 85,6±7,1U/ml y 21,5±6,8pg/ml, respectivamente.
Características generales
| (n=45) | |
| Edad, años | 50,1±4,6 |
| Edad al momento de la menopausia, años | 48,3±1,2 |
| Índice de masa corporal, kg/m2 | 29,1±4,8 |
| Presión arterial sistólica, mmHg | 115,4±7,6 |
| Presión arterial diastólica, mmHg | 83,2±4,5 |
| FSH, U/ml | 85,6±7,1 |
| Estradiol, pg/ml | 21,5±6,8 |
Promedio ± desviación estándar.
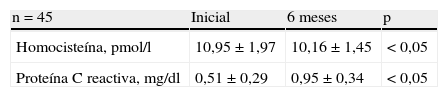
En la tabla 2 se muestran las comparaciones de los valores iniciales de homocisteína y PCR y los valores después de 6 meses de tratamiento con tibolona. Se observó un aumento significativo en las concentraciones de PCR (0,51±0,29mg/dl al inicio del estudio comparado con 0,95±0,34mg/dl luego de 6 meses de tratamiento; p<0,05). Este aumento representó una diferencia mayor del 86% del valor de los 6 meses de tratamiento comparado con el valor inicial.
Por otra parte, se encontró una disminución significativa del 7% en las concentraciones de homocisteína cuando se comparó luego de 6 meses de tratamiento (10,16±1,45pmol/l) con los valores iniciales (10,95±1,97pmol/l; p<0,05).
DiscusiónEn la presente investigación se observó que la tibolona produce una disminución significativa en las concentraciones de homocisteína luego del tratamiento. También se encontró un importante aumento en las concentraciones de PCR posterior al uso de tibolona por vía oral por 6 meses.
La tibolona es un esteroide sintético que tiene propiedades estrogénicas, androgénicas y progestagénicas. Se ha usado principalmente para la prevención de la osteoporosis y el tratamiento de los síntomas climatéricos. Por sí misma no tiene actividad biológica y sus efectos son el resultado de la actividad de sus metabolitos en varios tejidos. Las concentraciones de los metabolitos de la tibolona y la regulación metabólica de la actividad varían dependiendo del tejido, ya que tiene un efecto estrogénico en el hueso y tejido vaginal. En el tejido endometrial funciona como un progestágeno, mientras que en el cerebro y el hígado tiene un efecto androgénico14–16.
La PCR es un marcador de inflamación y existe evidencia creciente de que puede ser un factor de riesgo independiente para enfermedad cardiovascular17. Las concentraciones se incrementan después del infarto del miocardio y la expresión de factores tisulares, mientras que disminuye la expresión y la actividad de la sintetasa endotelial de óxido nítrico18. Los factores tisulares activan la cascada de coagulación extrínseca, lo cual es una conexión entre la inflamación y la presencia de alteraciones de la coagulación. Además, induce las moléculas de adhesión y el receptor tipo i de la angiotensina ii, que promueven la quimiotaxis de los monocitos, y facilita la captación de LDL por los macrófagos6,19.
Los efectos de la tibolona sobre las concentraciones de PCR son controversiales. Garnero et al.20 reportaron que la dosis de 1,25mg/día y 2,5mg día incrementaban de forma significativa las concentraciones de PCR en menopáusicas sanas. Ostberg et al.21 reportaron que las concentraciones de PCR permanecen sin cambios cuando se administra tibolona (2,5mg/día por 12 meses) a menopáusicas sometidas a hemodiálisis. Los resultados de la presente investigación demuestran que la tibolona tiene una acción inflamatoria similar a la observada para los estrógenos equinos conjugados22. Se observó un aumento de más del 80% en las pacientes que utilizaban tibolona por 6 meses.
Hasta la fecha, se desconoce por qué mecanismo la tibolona produce alteraciones en las concentraciones de la PCR y se ha propuesto que se debe a sus propiedades androgénicas. En apoyo a esta hipótesis, Wakatsuki et al.23 observaron que el acetato de medroxiprogesterona, que tiene un efecto androgénico, afecta las modificaciones en las concentraciones de PCR inducidas por los estrógenos equinos conjugados.
El aumento en los niveles de PCR puede ser debido al conocido efecto estimulador estrogénico de la síntesis hepática de proteínas. Lo más importante es que aún se desconoce si la disminución de los niveles de PCR con las estatinas y el aumento con los estrógenos y la tibolona sean fundamentales para los resultados clínicos o reflejen otros efectos. Por lo tanto, el incremento o la disminución de los niveles de PCR no necesariamente aumentarán o disminuirán el riesgo de enfermedad clínica.
La evidencia actual indica que el aumento en las concentraciones de homocisteína es un factor de riesgo importante e independiente para las enfermedades cardiovasculares. Además la hiperhomocisteinemia está asociada con factores de riesgo cardiovascular establecidos, incluyendo la elevación de las concentraciones séricas de colesterol y de la presión arterial, el hábito tabáquico, la diabetes mellitus y la función renal24. Debido a que las concentraciones de homocisteína se incrementan en la menopausia, es un factor de riesgo importante en este grupo de pacientes10.
Las elevadas concentraciones de homocisteína han demostrado ser un agente causal en la patogénesis de las enfermedades cardiovasculares, con el posible mecanismo de toxicidad endotelial, capacidad protrombótica, estimulación de la síntesis de colágeno y disminución de la biodisponibilidad de óxido nítrico25. La disminución en las concentraciones de homocisteína en esta investigación (alrededor del 7%) y en otras investigaciones (de hasta un 13%) con el uso de diferentes terapias de reemplazo hormonal puede ser explicada por los posibles cambios producidos por las hormonas en la transaminación de la metionina26. Por otra parte, la unión relativamente fuerte de la homocisteína a la LDL puede facilitar la depuración de la homocisteína por el aumento de la expresión de los receptores de LDL inducido por los estrógenos acompañado por la disminución del LDL colesterol relacionado al uso de la terapia hormonal de reemplazo.
La tibolona no cambia o disminuye la homocisteína, otra sustancia en la circulación que se ha relacionado con el riesgo de enfermedad arterial coronaria. Algunos investigadores han reportado que las propiedades androgénicas parciales de la tibolona podrían ser la causa de la escasa disminución de las concentraciones plasmáticas de homocisteína en menopáusicas comparado con otras terapias hormonales de reemplazo11,12. Sin embargo, Giltay et al.27 encontraron incrementos en las concentraciones de homocisteína en transexuales que utilizaron suplementos de testosterona. Por otra parte, aunque la actividad hormonal disminuye, la relación de la producción de estrógenos/andrógenos también disminuye en la menopausia. También se ha reportado que las concentraciones de homocisteína plasmática son mayores en los hombres28. Dadas la asociación entre la hiperhomocisteinemia y las altas concentraciones de andrógenos séricos, los efectos androgénicos y estrogénicos parciales de la tibolona pueden contrarrestarse uno al otro, resultando en un mínimo efecto sobre las concentraciones de homocisteína.
Cagnacci et al.29 demostraron que los efectos de los estrógenos sobre las concentraciones de homocisteína son dosisdependiente, ya que las concentraciones séricas de homocisteína eran más bajas en las pacientes que recibían anticonceptivos por vía oral con altas dosis de estrógenos y progestinas que en aquellas que recibían dosis bajas. El mecanismo por el cual la tibolona y los estrógenos disminuyen las concentraciones de homocisteína en las menopáusicas aún no está claro.
Los diferentes efectos de la tibolona y otras terapias de remplazo hormonal sobre algunos marcadores de riesgo cardiovascular específico tienen importantes implicaciones clínicas. Los efectos sobre la PCR y la homocisteína son dependientes de la preparación y la vía de administración. Esto podría explicar el incremento en el riesgo cardiovascular observado poco después del inicio de la terapia de remplazo en el «Estudio de reemplazo de estrógenos/progestinas y corazón»30. Los resultados de esta investigación sugieren que los cambios inducidos por la tibolona pueden incrementar aún más el riesgo de enfermedades cardiovasculares en mujeres que ya se encuentran en riesgo.
De forma colectiva, los estudios cardiovasculares con tibolona proporcionan un excelente ejemplo de la dificultad de tratar de llegar a una conclusión clínica con datos contradictorios. Los resultados de este ensayo indican un efecto neutro de la tibolona sobre el sistema cardiovascular en mujeres sanas jóvenes (entre 45 y 60 años), lo que sugiere que los efectos adversos al parecer estén equilibrados por efectos aparentemente benéficos. Solo los resultados de ensayos clínicos adecuadamente diseñados establecerán el impacto cardiovascular de la tibolona.
Se concluye que el uso de tibolona produce un aumento en las concentraciones de PCR y una disminución de las concentraciones de homocisteína luego de 6 meses de tratamiento.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.