Construir un modelo predictivo que mejore la estimación del peso del recién nacido.
Material y métodosEstudio observacional y descriptivo sobre 140 gestantes seleccionadas con muestreo bietápico en el Departamento de Salud de La Ribera (Valencia). Se clasificaron en 4 grupos dependiendo del índice de masa corporal (IMC) pregestacional. El peso fetal fue estimado por ecografía en la semana 35 a 40 de gestación por un ginecólogo.
ResultadosLas variables que se relacionaron estadísticamente con el peso al nacer para la categoría de IMC pregestacional de normopeso fueron: altura uterina medida entre la semana 35-40 de gestación, peso proyectado a la semana 40 por la ecografía del tercer trimestre (PP40s), edad gestacional, ferritina sérica del tercer trimestre y cigarrillos consumidos en el tercer trimestre (p<0,001; p<0,001; p<0,001; p=0,007; p=0,006, respectivamente). Se construyó un modelo multivariante para la categoría de normopeso para estimar el peso al nacer (PErm) obteniendo una R2=0,72 (F=47,32; p<0,001). Las diferencias de las medias obtenidas entre PP40s y PErm, con el peso del recién nacido, fueron significativas (p<0,001). El modelo multivariante infravalora el peso al nacer en 0,07g (error medio 0,54%) y la PP40s lo sobrestima en 300,89g (error medio 10,75%).
ConclusionesEl modelo multivariante construido, para la categoría de normopeso, mejora la precisión de la ecografía.
To construct a predictive model that improves birthweight estimation.
Material and methodsA comparative, descriptive study was carried out in 140 pregnant women selected through two-stage sampling in the health department of La Ribera (Spain). The women were classified in 4 groups depending on their pre-gestational body mass index (BMI). Fetal weight was estimated by ultrasound at 35-40 weeks by a gynecologist.
ResultsThe variables significantly related to birth weight in women with a normal pregestational BMI were, symphysis fundal height between 35-40 weeks, projected birth weight estimated at 40 weeks by ultrasound, gestational age, ferritin level in the third trimester, and the number of cigarettes smoked in the third trimester (P<.001, P<.001, P<.001, P<.007, P<.006, respectively). A multivariate model was created for the normal weight group to estimate birth weight, resulting in R2=.72 (F=47.32, P<.001). The differences in the means for fetal weight at week 40 and projected birth weight estimated by ultrasound at 35-40 weeks with birth weight were significant (P<.001). Birth weight was underestimated by 0.07g in the multivariate model (mean error 0.54%) and overestimated by 300.89g by projected birth weight estimated at 35-40 weeks (mean error 10.75%).
ConclusionsThe multivariate model created for the normal weight group improves the accuracy of ultrasound.
El peso al nacer es una de las variables más utilizadas y que probablemente está más estrechamente relacionada con el riesgo de muerte perinatal1. Su utilización en neonatología orienta tanto sobre la duración de la gestación como sobre la tasa de crecimiento2. La influencia del peso neonatal sobre la morbimortalidad en la etapa adulta se conoce como la programación fetal (hipótesis de Barker)3. Aunque esta idea es muy atractiva, sigue siendo necesario profundizar en los mecanismos subyacentes de esta asociación4.
La capacidad de la mujer para cubrir las necesidades del desarrollo fetal no está relacionada, de forma simple, con su alimentación actual o del pasado inmediato, sino que depende más de su salud general5. De ello se infiere que la capacidad de la madre de nutrir a su feto depende de factores distintos de la alimentación materna en la concepción y durante el embarazo. Existe un conglomerado de factores como, el estrés —ya sea psíquico o físico, causado por las presiones de sus experiencias vitales—, las infecciones y los hábitos tóxicos como el consumo de tabaco o de alcohol, que pueden afectar negativamente al estado nutricional de la mujer6,7.
El peso del recién nacido depende de múltiples factores, tanto maternos (antropométricos, nutricionales, hematológicos, tóxicos, obstétricos, psicosociales, laborales), como genéticos y ambientales. La segmentación de la población a estudio atendiendo a las distintas categorías maternas del índice de masa corporal (IMC) pregestacional ayuda a distinguir el impacto de la ganancia de peso materno en el peso del neonato, como concluye el Institute of Medicine de EE. UU.8.
La hipótesis que se plantea es si el análisis de algunos de esos factores puede permitirnos construir un modelo predictivo que mejore la estimación del peso del recién nacido.
Material y métodosEstudio observacional y prospectivo, en el que se clasificó a las gestantes participantes en el estudio en 4 grupos, a partir de su IMC pregestacional, según los rangos establecidos por la OMS: bajo peso (BP<18,5 kg/m2), normopeso (NP: 18,5-24,9 kg/m2), sobrepeso (SP: 25,0-29,9 kg/m2) y obesidad (OB > 30 kg/m2). Se recogió una muestra de 159 gestantes desde febrero de 2011 hasta marzo de 2012.
Se realizó un muestreo bietápico. En una primera etapa se eligieron los centros de salud a estudio (Carlet y Benimodo) mediante un muestreo probabilístico aleatorizado simple, de entre todos los centros de Atención Primaria del Departamento de Salud de La Ribera. En la segunda etapa se seleccionó a las gestantes con un muestreo probabilístico con arranque aleatorizado y seguimiento sistemático de entre el número de embarazos por año, de ambos centros de salud.
Los criterios de inclusión se basaron en: edad materna entre 18 y 36 años, primer control prenatal entre las 5 y 12 semanas y feto único sin malformaciones.
Los criterios de exclusión fueron: negativa de la usuaria a participar en el estudio, gestantes con historia obstétrica desfavorable (2 o más abortos, uno o más prematuros), con enfermedades que modifican significativamente el crecimiento fetal, tales como la diabetes pregestacional, hipertensión esencial previa al embarazo, gestantes con infección materna (TORCH), u otra enfermedad materna (endocrina, cardíaca, respiratoria, adictiva).
La media de partos en el Hospital Universitario de La Ribera (HULR) (2.400 partos/año), con una prevalencia de recién nacidos con bajo peso es del 7% (IC 95%). Una precisión del 4% obtiene un tamaño muestral total de 147.
El presente estudio se realizó de acuerdo con los principios básicos para toda investigación médica de la Declaración de Helsinki. El estudio fue sometido previamente a la evaluación del Comité de Investigación del HULR, con fecha 13 de enero de 2011.
Las variables se clasificaron en 5 categorías: socio-demográficas, antropométricas, hematológicas, ecográficas, obstétrico-neonatales y tóxicas.
Debido a que no fue posible hacer coincidir las medidas y controles en todas las gestantes en la misma semana de gestación, se agruparon en 7 estratos de 4 o 5 semanas cada uno (4-8, 9-13, 14-18, 19-23, 24-28, 29-34 y 35-40).
Las variables socio-demográficas fueron: edad materna, estado civil (soltera, casada, separada, divorciada, viuda), país de origen (España, resto países UE, países no pertenecientes a la UE, Centroamérica y Sudamérica, Norteamérica, Norte de África, resto de África, Asia y Oceanía), nivel de instrucción (analfabeta, sin estudios, primer grado, segundo grado, universitaria), ocupación (empleadora de más de 25 trabajadores, empresaria/profesional, asalariada, pensionista, estudiante, parada, sus labores) y actividad laboral (manual, no manual).
Las variables antropométricas que se incluyeron en el estudio fueron las siguientes: peso corporal y altura materna, IMC pregestacional, ganancia de peso gestacional, perímetro abdominal (PA) y altura uterina (AU). Se utilizó una balanza calibrada (marca SECA) y podómetro metálico. Se pesó y midió a todas las gestantes con ropa de calle y sin zapatos. Se recomendaba orinar previamente a la toma del peso corporal.
El peso pregestacional está basado en el peso recordado en la primera visita por la gestante en los últimos 3 meses anteriores al embarazo. Se tuvo como referencia los rangos de la OMS para el IMC pregestacional.
La ganancia de peso gestacional se determinó restando al peso final del embarazo el peso pregestacional (kg). La duración de la gestación se estimó a partir de la fecha de última regla (FUR) según recordaba la mujer en el momento de la primera visita, y su corrección a través de la ecografía del primer trimestre, entre las semanas 11 y 13 semanas y 5 días.
La medición de la AU y PA fueron realizadas por matronas con suficiente experiencia. Para la medición de la AU se utilizó una cinta métrica flexible, no elástica, apoyada en el borde superior de la sínfisis púbica de la gestante, extendida por el abdomen y con la mano no dominante localizando el fondo uterino. Todas las medidas fueron realizadas con la gestante en decúbito supino. Para la obtención de una medida objetiva se invirtió la cinta métrica con el fin de no ser influido por la edad gestacional9 (EG). Introdujimos la medición a partir de las 15-16 semanas de gestación desde la FUR o en su defecto la calculada por la ecografía de las 12 semanas. La medición del PA de la gestante se realizó en bipedestación y tras la espiración suave forzada, rodeando su abdomen con la cinta métrica, no elástica, a la altura del ombligo.
Las variables hematológicas recogidas fueron, hemograma y ferritina sérica. Se midieron en cada trimestre de embarazo (<12, 24 y 34 semanas).
Las variables ecográficas recogidas fueron, diámetro biparietal, longitud de fémur, circunferencia abdominal de la ecografía realizada en el tercer trimestre, entre la semana 33 y 35. Para el cálculo del peso estimado al nacer y del peso proyectado a las 40 semanas (PP40s) se utilizó la fórmula de Hadlock y los ecógrafos utilizados fueron los Siemens, modelo Sonoline G40 y G60 (Siemens AG Medical Solutions, Eriangen, Alemania). En cuanto a la cantidad de líquido amniótico, solo se seleccionó a las gestantes con ausencia de polihidramnios (índice de líquido amniótico [ILA]>25) u oligoamnios (ILA<5) entre la semana 33 y 35.
Las variables obstétrico-neonatales recogidas fueron: paridad, EG (estimada desde la FUR recordada por la mujer expresada en semanas y confirmada o modificada por la biometría ecográfica a las 12 semanas en semanas), inicio de parto (espontáneo o inducido) y finalización del parto (vaginal o cesárea). Respecto al recién nacido se registró el género y el peso al nacer. Se utilizó una báscula calibrada regularmente (marca SECA).
Las variables tóxicas recogidas mediante entrevista personal en cada trimestre fueron: consumo de tabaco pregestacional, media del número de cigarrillos consumidos al día.
Los datos fueron analizados usando Statistical Package for the Social Sciencies (SPSS Inc., Chicago, IL, EE. UU.) Version 15.0.
Se emplearon los métodos descriptivos básicos. Posteriormente se comprobó la normalidad para cada una de las variables continuas con el test de Kolmogorov-Smirnov. El nivel de significación estadística definido fue p<0,05.
Cada variable fue calculada y comparada entre cada grupo de IMC pregestacional usando el test de χ2 y el análisis de la varianza (test Scheffé).
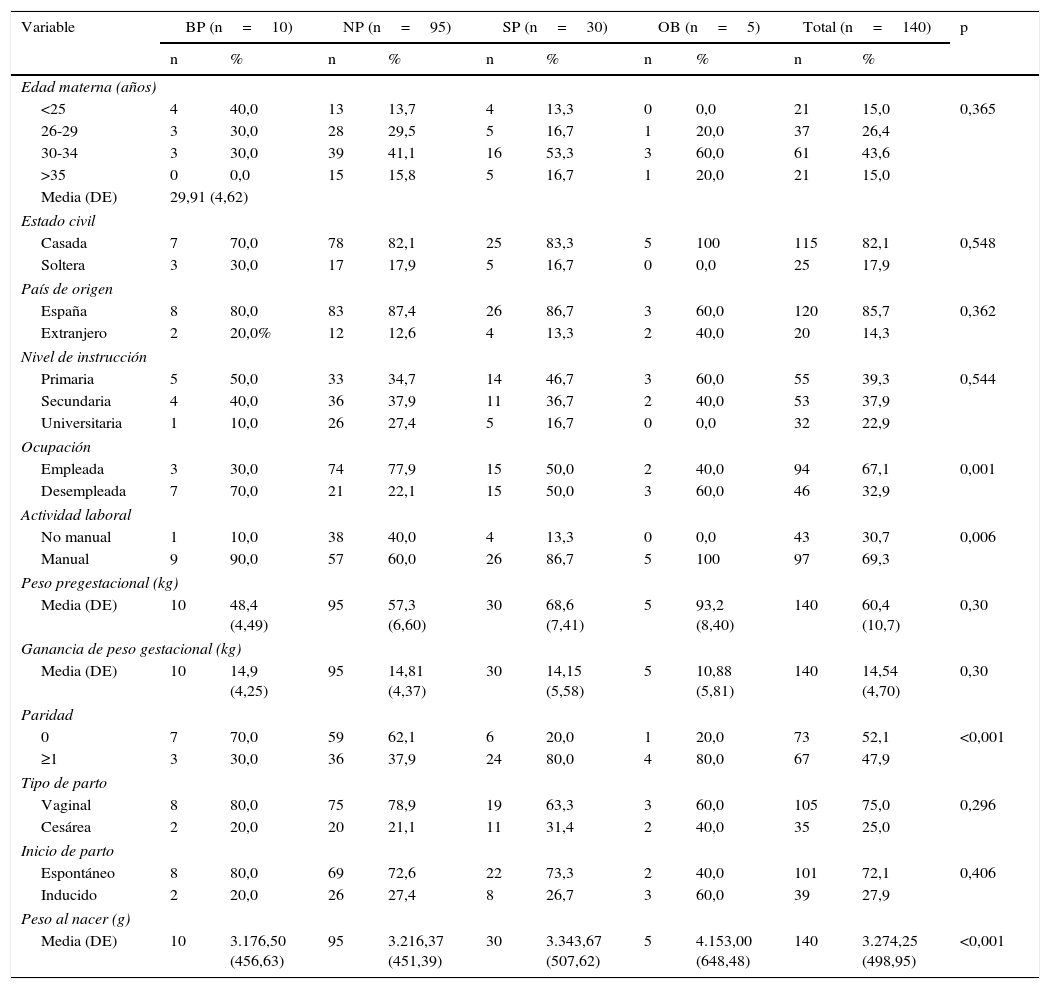
ResultadosPodemos observar en la tabla 1 las características socio-demográficas y clínicas de nuestra muestra.
Variables demográficas y características clínicas de la muestra clasificadas según el IMC pregestacional materno (n=140)
| Variable | BP (n=10) | NP (n=95) | SP (n=30) | OB (n=5) | Total (n=140) | p | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | ||
| Edad materna (años) | |||||||||||
| <25 | 4 | 40,0 | 13 | 13,7 | 4 | 13,3 | 0 | 0,0 | 21 | 15,0 | 0,365 |
| 26-29 | 3 | 30,0 | 28 | 29,5 | 5 | 16,7 | 1 | 20,0 | 37 | 26,4 | |
| 30-34 | 3 | 30,0 | 39 | 41,1 | 16 | 53,3 | 3 | 60,0 | 61 | 43,6 | |
| >35 | 0 | 0,0 | 15 | 15,8 | 5 | 16,7 | 1 | 20,0 | 21 | 15,0 | |
| Media (DE) | 29,91 (4,62) | ||||||||||
| Estado civil | |||||||||||
| Casada | 7 | 70,0 | 78 | 82,1 | 25 | 83,3 | 5 | 100 | 115 | 82,1 | 0,548 |
| Soltera | 3 | 30,0 | 17 | 17,9 | 5 | 16,7 | 0 | 0,0 | 25 | 17,9 | |
| País de origen | |||||||||||
| España | 8 | 80,0 | 83 | 87,4 | 26 | 86,7 | 3 | 60,0 | 120 | 85,7 | 0,362 |
| Extranjero | 2 | 20,0% | 12 | 12,6 | 4 | 13,3 | 2 | 40,0 | 20 | 14,3 | |
| Nivel de instrucción | |||||||||||
| Primaria | 5 | 50,0 | 33 | 34,7 | 14 | 46,7 | 3 | 60,0 | 55 | 39,3 | 0,544 |
| Secundaria | 4 | 40,0 | 36 | 37,9 | 11 | 36,7 | 2 | 40,0 | 53 | 37,9 | |
| Universitaria | 1 | 10,0 | 26 | 27,4 | 5 | 16,7 | 0 | 0,0 | 32 | 22,9 | |
| Ocupación | |||||||||||
| Empleada | 3 | 30,0 | 74 | 77,9 | 15 | 50,0 | 2 | 40,0 | 94 | 67,1 | 0,001 |
| Desempleada | 7 | 70,0 | 21 | 22,1 | 15 | 50,0 | 3 | 60,0 | 46 | 32,9 | |
| Actividad laboral | |||||||||||
| No manual | 1 | 10,0 | 38 | 40,0 | 4 | 13,3 | 0 | 0,0 | 43 | 30,7 | 0,006 |
| Manual | 9 | 90,0 | 57 | 60,0 | 26 | 86,7 | 5 | 100 | 97 | 69,3 | |
| Peso pregestacional (kg) | |||||||||||
| Media (DE) | 10 | 48,4 (4,49) | 95 | 57,3 (6,60) | 30 | 68,6 (7,41) | 5 | 93,2 (8,40) | 140 | 60,4 (10,7) | 0,30 |
| Ganancia de peso gestacional (kg) | |||||||||||
| Media (DE) | 10 | 14,9 (4,25) | 95 | 14,81 (4,37) | 30 | 14,15 (5,58) | 5 | 10,88 (5,81) | 140 | 14,54 (4,70) | 0,30 |
| Paridad | |||||||||||
| 0 | 7 | 70,0 | 59 | 62,1 | 6 | 20,0 | 1 | 20,0 | 73 | 52,1 | <0,001 |
| ≥1 | 3 | 30,0 | 36 | 37,9 | 24 | 80,0 | 4 | 80,0 | 67 | 47,9 | |
| Tipo de parto | |||||||||||
| Vaginal | 8 | 80,0 | 75 | 78,9 | 19 | 63,3 | 3 | 60,0 | 105 | 75,0 | 0,296 |
| Cesárea | 2 | 20,0 | 20 | 21,1 | 11 | 31,4 | 2 | 40,0 | 35 | 25,0 | |
| Inicio de parto | |||||||||||
| Espontáneo | 8 | 80,0 | 69 | 72,6 | 22 | 73,3 | 2 | 40,0 | 101 | 72,1 | 0,406 |
| Inducido | 2 | 20,0 | 26 | 27,4 | 8 | 26,7 | 3 | 60,0 | 39 | 27,9 | |
| Peso al nacer (g) | |||||||||||
| Media (DE) | 10 | 3.176,50 (456,63) | 95 | 3.216,37 (451,39) | 30 | 3.343,67 (507,62) | 5 | 4.153,00 (648,48) | 140 | 3.274,25 (498,95) | <0,001 |
BP: bajo peso IMC<18,5 kg/m2; DE: desviación estándar; NP: normopeso IMC≥18,5 pero IMC<24,9 kg/m2; OB: obesa (IMC≥30,0 kg/m2); SP: sobrepeso IMC>25 pero IMC<29,9 kg/m2.
Valor de p obtenido con test de χ2 y el análisis de la varianza (ANOVA).
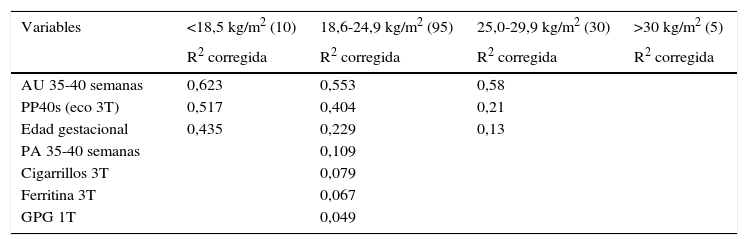
En la tabla 2 podemos observar las variables que mostraron relación con el peso al nacer para las distintas categorías de IMC pregestacional.
Coeficientes de determinación de las regresiones lineales simples con el peso al nacer entre las distintas categorías de IMC pregestacional materno
| Variables | <18,5 kg/m2 (10) | 18,6-24,9 kg/m2 (95) | 25,0-29,9 kg/m2 (30) | >30 kg/m2 (5) |
|---|---|---|---|---|
| R2 corregida | R2 corregida | R2 corregida | R2 corregida | |
| AU 35-40 semanas | 0,623 | 0,553 | 0,58 | |
| PP40s (eco 3T) | 0,517 | 0,404 | 0,21 | |
| Edad gestacional | 0,435 | 0,229 | 0,13 | |
| PA 35-40 semanas | 0,109 | |||
| Cigarrillos 3T | 0,079 | |||
| Ferritina 3T | 0,067 | |||
| GPG 1T | 0,049 |
1T: primer trimestre; 3T: tercer trimestre; AU: altura uterina; eco: ecografía; GPG: ganancia de peso gestacional; PA: perímetro abdominal; PP40s: peso proyectado a las 40 semanas.
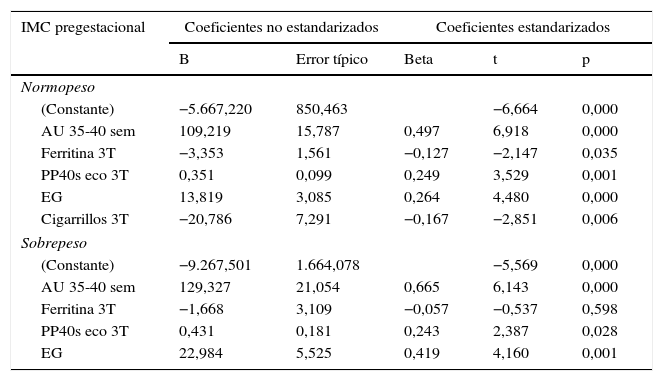
Para observar la relación entre las distintas variables independientes con significación estadística y el peso al nacer se diseñó un modelo multivariante para cada categoría materna de IMC pregestacional (tabla 3). Fueron descartados los modelos para las categorías de bajo peso y obesidad por falta de significación estadística.
Variables predictoras del peso al nacer para gestantes con IMC pregestacional en normopeso y sobrepeso
| IMC pregestacional | Coeficientes no estandarizados | Coeficientes estandarizados | |||
|---|---|---|---|---|---|
| B | Error típico | Beta | t | p | |
| Normopeso | |||||
| (Constante) | −5.667,220 | 850,463 | −6,664 | 0,000 | |
| AU 35-40 sem | 109,219 | 15,787 | 0,497 | 6,918 | 0,000 |
| Ferritina 3T | −3,353 | 1,561 | −0,127 | −2,147 | 0,035 |
| PP40s eco 3T | 0,351 | 0,099 | 0,249 | 3,529 | 0,001 |
| EG | 13,819 | 3,085 | 0,264 | 4,480 | 0,000 |
| Cigarrillos 3T | −20,786 | 7,291 | −0,167 | −2,851 | 0,006 |
| Sobrepeso | |||||
| (Constante) | −9.267,501 | 1.664,078 | −5,569 | 0,000 | |
| AU 35-40 sem | 129,327 | 21,054 | 0,665 | 6,143 | 0,000 |
| Ferritina 3T | −1,668 | 3,109 | −0,057 | −0,537 | 0,598 |
| PP40s eco 3T | 0,431 | 0,181 | 0,243 | 2,387 | 0,028 |
| EG | 22,984 | 5,525 | 0,419 | 4,160 | 0,001 |
3T: tercer trimestre; AU: altura uterina; eco: ecografía; EG: edad gestacional en días hasta el parto; IMC: índice de masa corporal; PP40s: peso proyectado a las 40 semanas.
La regresión múltiple entre el peso al nacer y el grupo NP encontró 5 variables predictoras (PP40s, ferritina sérica 3T, EG, AU 35-40 y cigarrillos fumados 3T), que explican el 72% de la varianza (F=47,321; p<0,001). La fórmula fue:
(Y=−5.667,22+0,35 × PP40s+109,21 × AU+13,81 × EG − 3,35 × Ferritina 3T − 20,78 × Cigarrillos 3T).
Para la categoría materna de SP, las variables predictoras del peso al nacer fueron: PP40W, ferritina 3T, EG y AU 35-40. La bondad de ajuste de la regresión lineal múltiple mostró un coeficiente de determinación R2 corregido = 0,822 (n=25). El modelo fue significativo (F=22,0; p<0,001).
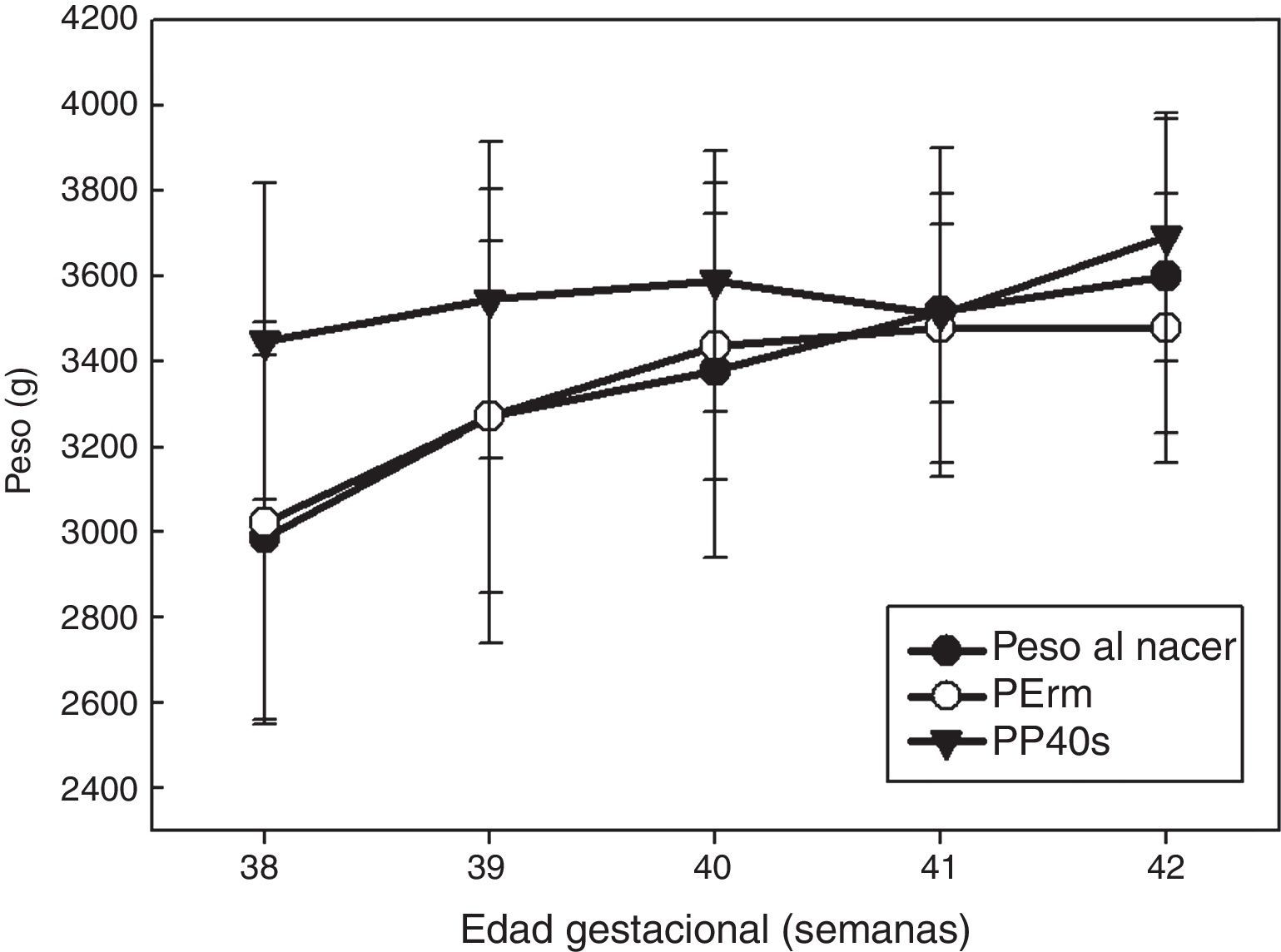
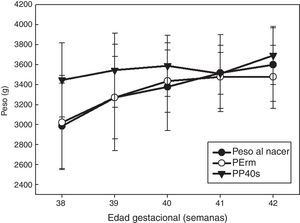
Una vez obtenida la ecuación de regresión decidimos estudiar las diferencias con el peso real del recién nacido entre el PP40s y PErm (fig. 1). Se aplicó el test T o t de Student para muestras relacionadas para el grupo NP. Las diferencias fueron estadísticamente significativas (p<0,001) entre ambas estimaciones, no así para el grupo de SP (p=0,09).
El PP40s, ajustado por la EG, para el grupo NP tuvo una correlación de 0,59 (p=0,01) a las 40 semanas, y PErm de 0,69 (p=0,002).
Las diferencias de las medias obtenidas de cada una (PP40s, PErm) con el peso del recién nacido son estadísticamente significativas (p<0,001). La PErm infravalora el peso al nacer en 0,07g, y la PP40s lo sobrestima en 300,89g. Así pues, el error de predicción es del 0,1 frente al 10,75%.
DiscusiónEn el análisis bivariante de nuestro estudio hubo un número considerable de variables que se relacionaron con el peso al nacer, que posteriormente fueron utilizadas para construir los modelos multivariantes. Únicamente la categoría materna de NP presentó un R2 de 0,72, y mostró diferencias estadísticamente significativas con respecto al PP40s en la predicción del peso al nacer.
En nuestro estudio y de forma bivariante, la AU medida entre las semanas 35-40 se asoció con el peso al nacer para la categoría materna de NP (R2=0,55). Fue la variable antropométrica que mejor explicó esa relación, consiguiendo el mayor coeficiente de determinación de entre todas las variables estudiadas, incluso mayor que el PP40s de la ecografía del tercer trimestre. Rogers et al.10 correlacionaron la AU con la medida de ultrasonido del diámetro biparietal y la circunferencia abdominal, y se obtuvieron R2 de 0,84 y 0,74 respectivamente; el 73% de los recién nacidos pequeños para la edad gestacional fueron detectados por una medida de 3cm o más por debajo de la media en la gestación. Meler et al.9 obtuvieron un R2 de 0,67 para el grupo NP, ajustando la AU por la EG, y construyeron una curva de normalidad para ambas variables, donde una AU inferior al percentil 10 fue relacionada con un bajo peso al nacer (BPN). Buchmann et al.11 describieron como una AU superior a 40cm estaba relacionada con un mayor número de fetos macrosómicos, mayor posibilidad de desproporción cefalopélvica o distocia de hombros. En nuestro caso la AU, y en presencia de las demás variables del modelo multivariante, indica que por cada centímetro de altura uterina desde la semana 35 hasta las 40, el peso al nacer aumenta 109,21g (IC 95%: 77,6-140,6). La medición de la AU tiene varias limitaciones; en primer lugar, existe cierta variabilidad en la medición entre diferentes observadores12 y, en segundo lugar, depende de algunas características del embarazo, como la cantidad de líquido amniótico, la presentación del feto y el número de fetos y el PA. La medición se ha venido utilizando rutinariamente en Obstetricia, y su valor en la predicción del peso de los recién nacidos pequeños para la EG o con retraso del crecimiento intrauterino sigue siendo controvertida debido a su baja sensibilidad que, unida a la alta tasa de falsos positivos de la predicción, ha hecho que cada vez se le preste menos atención en beneficio de la ecografía y el doppler fetal13, pero hay que recordar que es barata y asequible. Una revisión Cochrane indica que el impacto sobre los resultados perinatales de la medida de la AU es desconocido y parece imprudente abandonar su práctica, a menos que posteriores estudios aleatorizados demuestren su inutilidad14. El PA fue correlacionado positivamente con el peso al nacer con la categoría materna de NP, aunque se desestimó por la falta de significación estadística en el modelo multivariante.
En nuestro estudio el PP40s por la ecografía se asoció con el peso al nacer con una R2 igual a 0,40 para la categoría materna de NP. En presencia del resto de variables, el coeficiente de determinación (R2=0,72) fue mayor que el obtenido por Ben-Haroush et al.15 (R2=0,52). El crecimiento intraútero fetal se ve reflejado en el peso al nacer; su utilización, como medio diagnóstico, está ampliamente documentada. Dependiendo de la fórmula manejada, la predicción del peso será más o menos precisa. La fórmula de Hadlock16 es pues la más utilizada, aunque se conocen alrededor de 11 fórmulas diferentes con resultados dispares. En nuestro modelo multivariante, y en presencia del resto de variables ajustadas, por cada gramo de PP40s del recién nacido en la ecografía del tercer trimestre, el peso al nacer aumenta 0,35g (IC 95%: 0,15-0,54). Así pues el factor de corrección corresponde a un tercio del proyectado por la ecografía.
En nuestro estudio, la EG en la categoría materna de NP mostró correlación estadísticamente significativa con el peso al nacer (R2=0,22). Nuestro modelo multivariante mostró que por cada día que transcurre el peso del feto aumenta 13,8g, algo superior a los datos obtenidos por Nahum et al.17, con 9,66g para los niños y 9,15g para las niñas, e inferior a los de Carvalho et al.18 con 28,21g.
La proporción de mujeres fumadoras previa a la gestación fue del 35%, y del 20,7% en el último trimestre, similar a la de los estudios consultados19. Cano-Serral et al.20 observaron que las gestantes de clases sociales con ocupaciones manuales abandonaban el hábito tabáquico durante la gestación en menor proporción que las de ocupaciones no manuales (el 35 frente al 44%). El tabaquismo durante la gestación, y en particular durante el tercer trimestre, está relacionado con el peso al nacer (R2=0,07), mostrando únicamente significación estadística en la categoría de normopeso materno. Esta correlación es negativa, y por tanto, el número de cigarrillos consumidos reduce el peso al nacer. En consecuencia, fumar durante el tercer trimestre parece tener el mayor impacto en el peso al nacer. Las mujeres que dejan de fumar en el tercer trimestre tienen neonatos con un peso al nacer similar a los de las madres no fumadoras según nuestros resultados, pues el tabaquismo en los 2 primeros trimestres no mostró significación estadística en el modelo ajustado. El recién nacido con BPN cobra importancia con este hábito tóxico, así como una posible relación con el deterioro de la salud infantil por el efecto citotóxico3. Petridou et al.21 describieron que el peso de recién nacido se reducía en 190,8g respecto a los recién nacidos de madres no fumadoras. Las cifras obtenidas en nuestro estudio indican que por cada cigarrillo consumido el peso al nacer se reduce en aproximadamente 21g; la media de cigarrillos consumidos fue de 5 al día, por tanto la reducción total alcanzó los 105g, coincidiendo con Gupta et al.22.
En nuestro estudio la cantidad de ferritina en el tercer trimestre tuvo una relación inversamente proporcional con el peso al nacer en el grupo NP, de tal manera que a menor cantidad ferritina mayor peso al nacer (R2=0,06). En los estudios consultados se ha plasmado el efecto contrario en ambos casos, observando que niveles altos de ferritina se asociaban a partos pretérminos, BPN y rotura prematura de membranas23. Los autores intentaron explicar la posible asociación entre niveles altos de ferritina y la restricción del crecimiento fetal24, aduciendo que la ferritina puede servir como marcador para cualquier respuesta vascular inflamatoria no infecciosa o infecciosa, aunque se necesitan más estudios que lo confirmen. Hämäläinen et al.25 observaron que la anemia, y no la ferritina baja, durante el primer trimestre, estaba asociada con el BPN, mientras que la anemia en el segundo y tercer trimestres no estaba asociada con el parto pretérmino, pérdidas fetales ni riesgo de complicaciones perinatales. El efecto encontrado en nuestro estudio podría atribuirse a que cuando existe una depleción de las reservas de hierro maternas, la transferencia de hierro hacia el feto aumenta, aunque la magnitud de este aumento puede estar limitada. La depleción del hierro en el segundo y tercer trimestres de embarazo en la categoría de NP viene descendiendo de forma fisiológica desde el primer trimestre, coincidiendo con el aumento de la capacidad transportadora de hierro (transferrina), aun cuando se elimine la deficiencia mediante la suplementación oral26. En nuestro modelo multivariante, al ser una relación negativa, por cada descenso de una unidad (ng/dl) de la ferritina el peso al nacer aumentó 3,35g.
Las limitaciones del modelo multivariante se centran en la precisión de la ecografía y en la EG al parto, debido a que el peso estimado debería tener una precisión superior en las 40 semanas, todos los recién nacidos con menos de 280 días serán sobrestimados.
En resumen, en la actualidad la predicción del peso al nacer mediante ecografía tiene un error de precisión en torno al 10%. Esta precisión se puede mejorar de 2 formas: 1) controlando las limitaciones de la técnica y 2) añadiendo variables maternas del modelo multivariante a la medición ecográfica. Con esta práctica se puede reducir el error un 10%. La recogida de las variables es factible y no necesita de medios materiales sofisticados, ni de gran pérdida de tiempo.
ConclusionesLas variables que mostraron relación directa con la predicción del peso al nacer, para la categoría de NP, fueron: AU, PP40s, EG, nivel de ferritina sérica y consumo de tabaco.
La AU es la variable con más clara asociación significativa respecto a la predicción del peso al nacer.
El modelo multivariante construido mejora la precisión de la ecografía en un 10,48%.
Por todo ello, pensamos que el estudio tiene una importante aplicación práctica y debería extenderse al resto de grupos de IMC pregestacional que no mostraron significación estadística. La eficacia del método clínico debe determinarse en situaciones que pueden alterar la evaluación del peso al nacer, en mujeres atípicas y debería ser estudiado en futuras líneas de investigación.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todas las gestantes participantes en el estudio y a la dirección del Hospital Universitario de La Ribera por su apoyo en nuestra investigación.