El melanoma es un tumor que se origina en los melanocitos de la piel y de las membranes mucosas. Únicamente el 2,5% de los casos de melanoma cutáneo metastatiza en el tracto genital; son los ovarios los órganos más afectados. El útero, en cambio, sólo se afecta en el 10% de los casos en los que hay afectación genital, y es el miometrio la porción uterina más frecuentemente afectada. Con mucha menos frecuencia se compromete el endometrio.
Presentamos un caso de melanoma primario cutáneo con afectación metastásica endometrial, diagnosticado en nuestro centro, en el que el primer síntoma de afectación metastásica fue la metrorragia. Se aconseja que toda hemorragia uterina anormal en pacientes con antecedentes de melanoma sea investigada con el objetivo de descartar enfermedad metastásica endometrial.
Melanoma is a tumor arising in the melanocytes of the skin and other mucous membranes. Only 2.5% of cases of cutaneous melanoma cause metastases in the female genital tract, the most frequently affected organs being the ovaries. The uterus, mainly the myometrium, is only involved in 10% of cases of genital metastases. The endometrium is less frequently involved.
We present a case of primary cutaneous melanoma with endometrial metastases diagnosed in our hospital. The first symptom of metastatic involvement was metrorrhagia. Any abnormal uterine bleeding in patients with a history of melanoma should be investigated to exclude endometrial metastases.
El melanoma es un tumor que se origina en los melanocitos de la piel y de las membranas mucosas. Comprende el 1% de todos los tumores malignos y se caracteriza por su alto potencial maligno. Las metástasis de melanoma en el tracto genital son infrecuentes y los ovarios son los órganos más afectados (70-80% de los casos), mientras que el útero está sólo afectado en el 10% de los casos.
Cuando el endometrio presenta afectación metastásica, generalmente se manifiesta clínicamente con hemorragias uterinas anormales. Se aconseja que la hemorragia uterina anormal en pacientes con diagnóstico previo de melanoma, incluso en etapa premenopáusica, sea investigada mediante estudio anatomopatológico de tejido endometrial. Presentamos un caso de afectación metastásica endometrial de melanoma primario cutáneo, diagnosticado en nuestro centro.
CASO CLÍNICOPaciente de 50 años, premenopáusica, sin antecedentes medicoquirúrgicos de interés. Menarquia a los 14 años, 4 gestaciones, 2 partos y 2 abortos legrados. Antecedente de ligadura de trompas.
En julio de 2002 fue diagnosticada de carcinoma mamario derecho e intervenida mediante cirugía conservadora. El informe anatomopatológico fue de carcinoma lobulillar infiltrante (CLI) pT2 GIII (Richardson 8) pN0 (0/14).
El estudio inmunohistoquímico mostró una negatividad para receptores de estrógenos, de progesterona y c-erb B2. Se administraron 6 ciclos de quimioterapia adyuvante con la pauta CMF (600-40-600mg/m2) cada 21 días y radioterapia a una dosis de 50Gy y sobreimpresión con 10Gy.
En octubre de 2003, en una visita rutinaria de seguimiento en la unidad de patología mamaria y, tras una supervivencia libre de enfermedad (SLE) de 15 meses, se objetivó una lesión nodular pigmentada de bordes irregulares y sobreelevada en flexura del brazo izquierdo (contralateral al carcinoma mamario), por lo que se remitió a la paciente a consulta de dermatología para valoración. Se realizó una exéresis quirúrgica de la lesión. El diagnóstico anatomopatológico fue de melanoma.
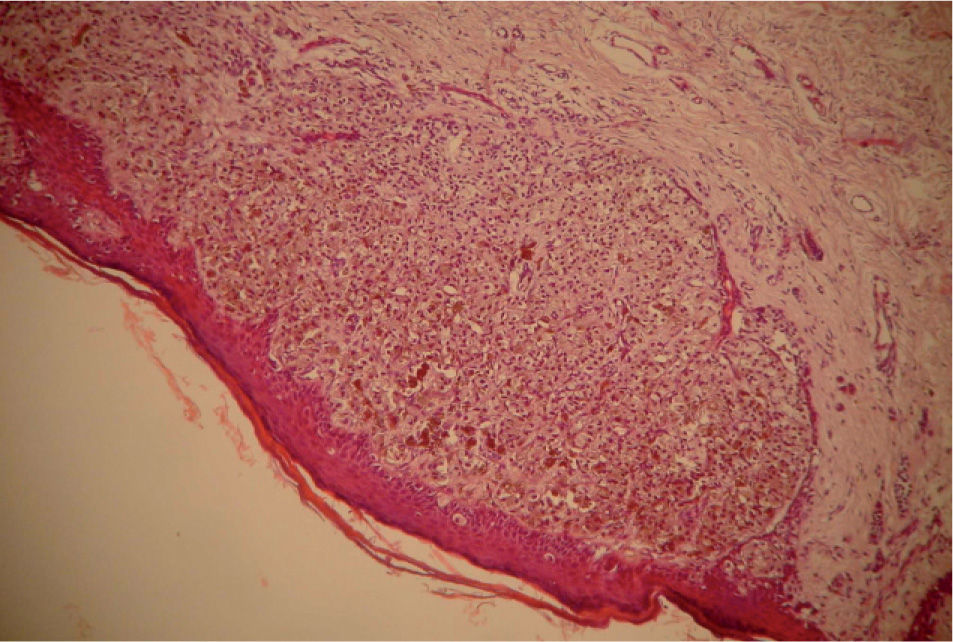
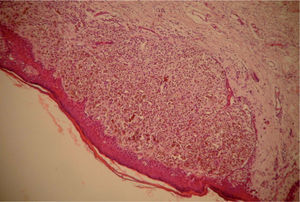
El estudio anatomopatológico macroscópico informó de cuña de piel con lesión redondeada de 0,4mm. En el estudio microscópico se detectó melanoma de extensión superficial, con afectación de dermis reticular y con un espesor de 1mm (fig. 1). Los bordes quirúrgicos se encontraban libres de tumor. En un segundo tiempo se realizó ampliación de tumorrectomía para asegurar márgenes libres superiores a 2cm, sin detectarse tumor residual en la pieza de reescisión.
Los controles de seguimiento posteriores no mostraron alteraciones hasta septiembre de 2005 (tras 23 meses de SLE tras el diagnóstico de melanoma y 38 meses del cáncer de mama), cuando la paciente consultó por metrorragia progresiva e intermitente.
El tacto bimanual mostró un útero aumentado globalmente de tamaño, como 10 semanas de amenorrea, sin otros datos destacables. La ecografía transvaginal mostró un útero globuloso con un endometrio irregular, engrosado y desflecado.
Se realizó una histeroscopia diagnóstica con biopsia dirigida, donde se visualizó una cavidad uterina tumoral, ocupada por una lesión excrecente, friable y sangrante que fue biopsiada para estudio anatomopatológico (anatomía patológica: metástasis endometrial de melanoma maligno).
A los 2 días de la histeroscopia, la paciente ingresó a través del servicio de urgencias por metrorragia severa, por lo que se decidió realizar laparotomía en la que se detectaron un útero globuloso y aumentado de tamaño, ovario izquierdo negruzco y aumentado de tamaño, un implante en tercio superior de vagina de color negruzco y un nódulo en epiplón de 3cm de diámetro polilobulado, duro y blanquecino-amarillento.
Se realizó histerectomía más doble anexectomía y omentectomía parcial.
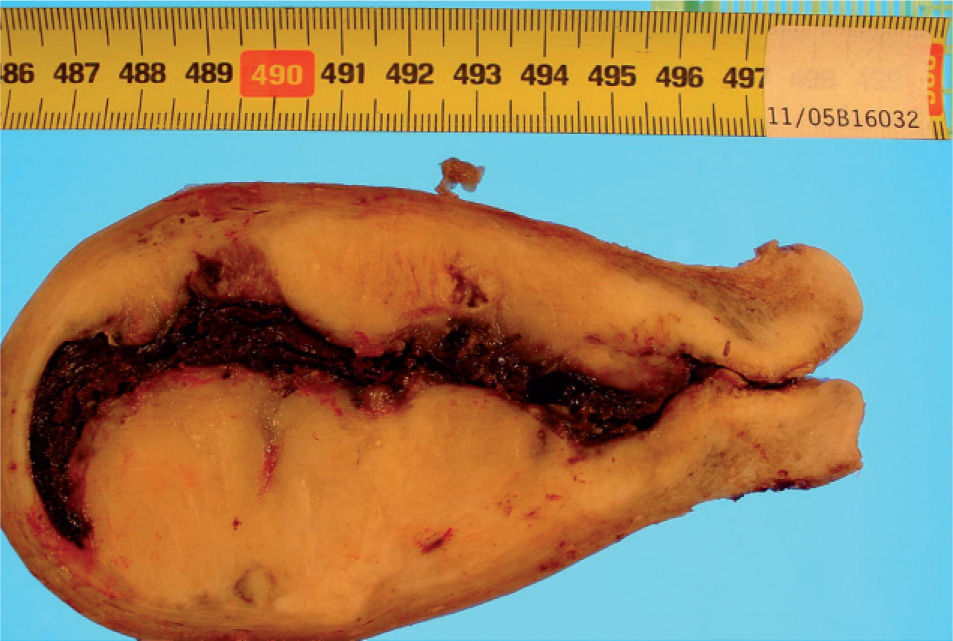
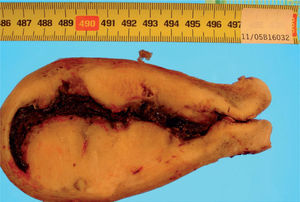
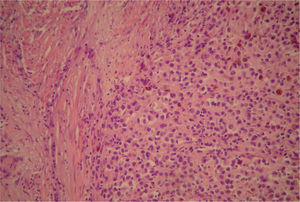
En el estudio anatomopatológico macroscópico, a la apertura de la pieza destaca una lesión tumoral sólida blanquecina, con focos pigmentados, que se extiende desde el fondo uterino hasta prácticamente alcanzar el orificio cervical. La lesión infiltraba la pared uterina dejando un margen libre de 0,3cm en las zonas de mayor infiltración (fig. 2). El anejo izquierdo mostraba a nivel paratubárico una zona engrosada de coloración marrón oscura. En epiplón se detectaba una lesión nodular de 3 × 2cm, blanquecino-amarillenta, que mostraba al corte una superficie lisa y brillante.
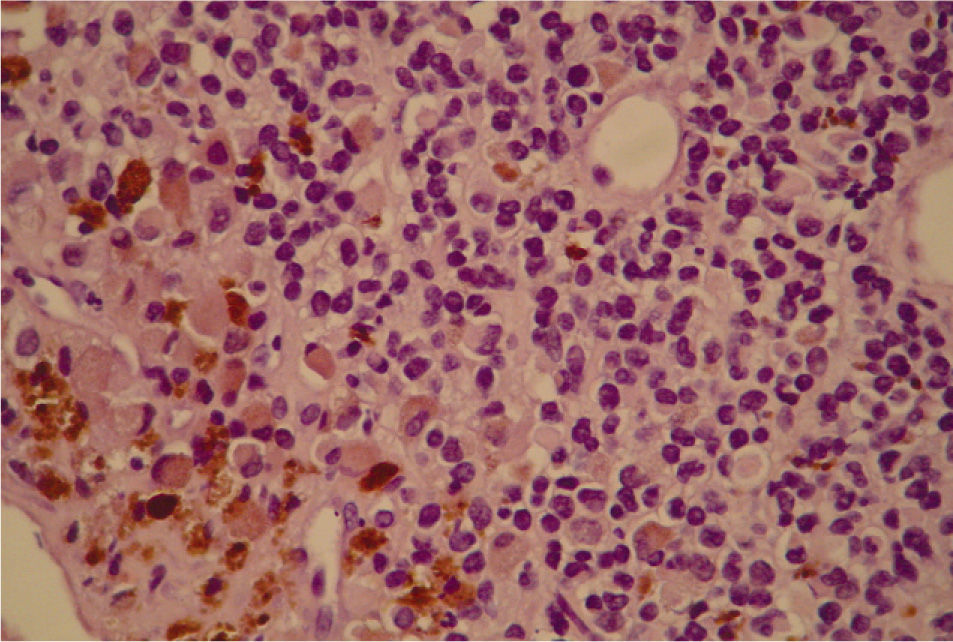
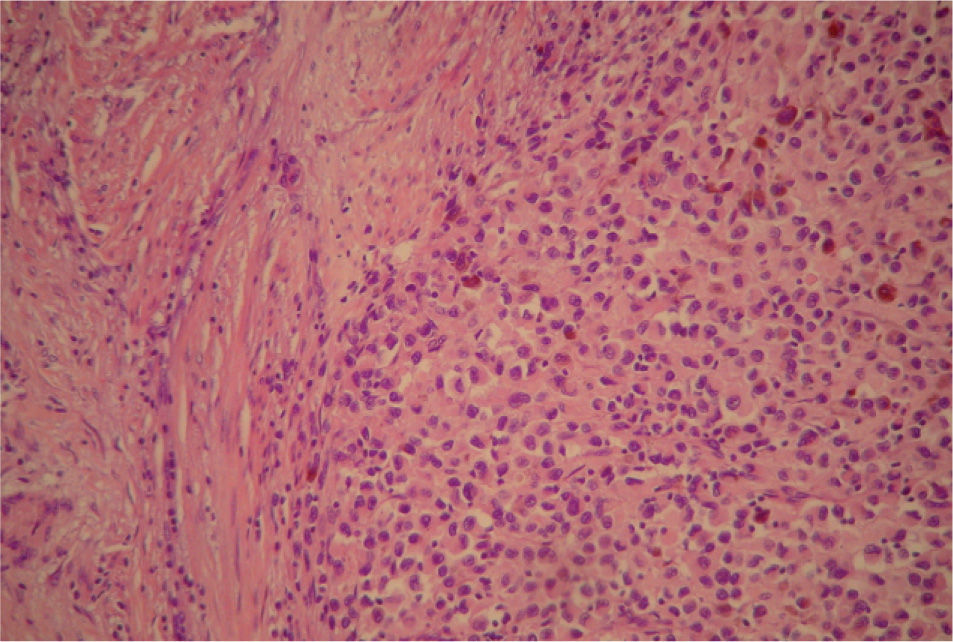
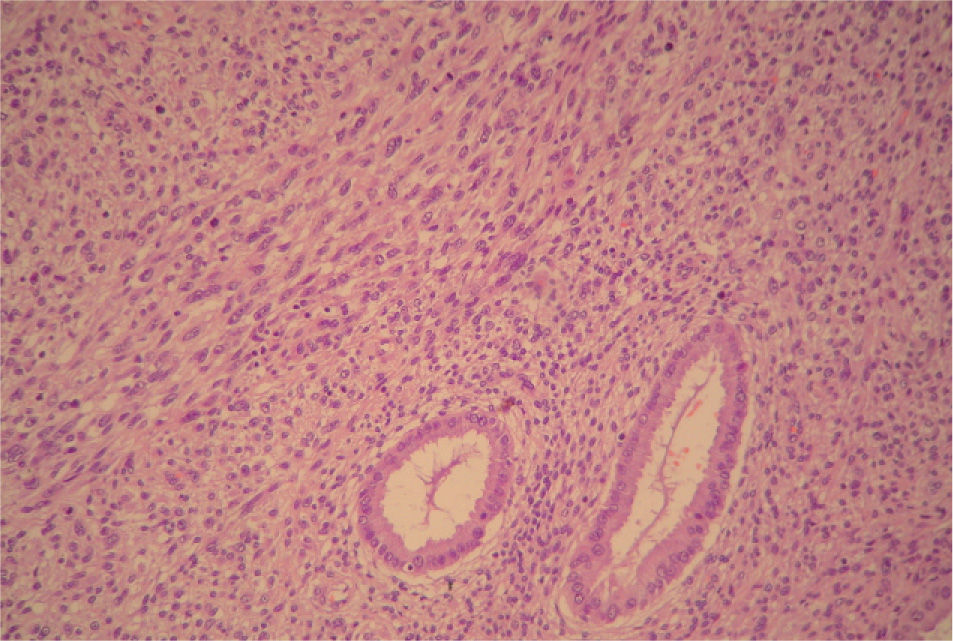
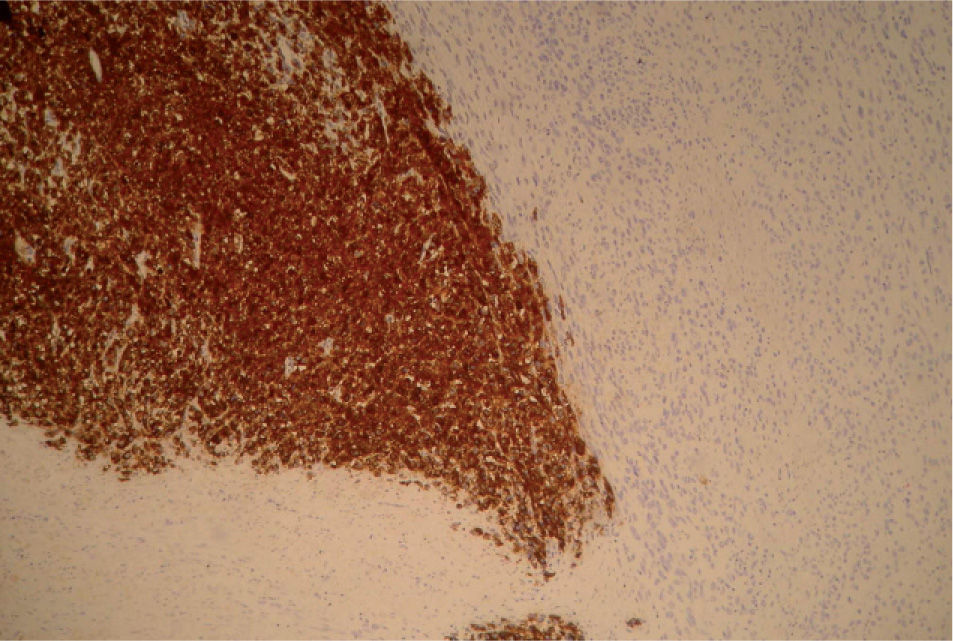
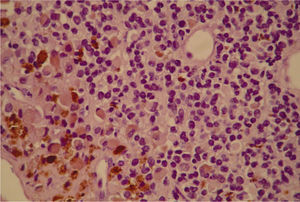
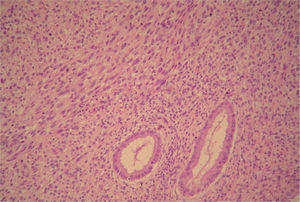
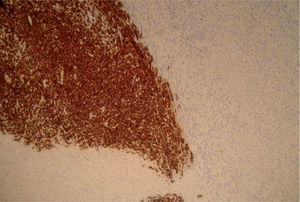
En el estudio microscópico, el endometrio prácticamente ha desaparecido y ha quedado sustituido por un infiltrado de histiocitos con pigmento de hemosiderina. Focalmente las células tumorales presentan pigmento citoplasmático de melanina (fig. 3). Se observaba infiltración del cuerpo uterino (fig. 4) y el endocérvix (fig. 5) por tumor maligno tipo melanoma con patrón fusiforme, sarcomatoide en la zona del cérvix y patrón epitelioide en el área endometrio miometrial. En anejo izquierdo se observaba infiltración parcial del ovario y ligamento ancho por melanoma de patrón epitelioide. En la ampliación de manguito vaginal se observaba una infiltración en lámina propia de lesión atípica nodular tipo melanoma maligno. Asimismo el nódulo epiploico se informó de melanoma maligno de patrón epitelioide, inmunohistoquímica: S-100, HMB-45 y vimentina (+), queratina y ALC (−); técnica de hierro (—), todo ello compatible con melanoma maligno (fig. 6).
El estudio de extensión posquirúrgico, con resonancia magnética cerebral y tomografía computarizada toracoabdominopélvica, no evidenció enfermedad a distancia.
Tras una recidiva tumoral vaginal y cerebral, la paciente falleció a los 29 meses del diagnóstico de melanoma y a los 6 meses del diagnóstico de enfermedad metastásica.
DISCUSIÓNEl melanoma es un tumor que se origina en los melanocitos de la piel y de las membranas mucosas. Comprende el 1% de todos los tumores malignos y se caracteriza por su alto potencial maligno1. Un 75% de los melanomas primarios se localizan en el tronco o en las extremidades inferiores.
Su incidencia se ha incrementado sustancialmente entre la población caucasiana en las últimas décadas2. El incremento anual de su incidencia oscila entre el 3 y el 7% y se ha estimado que ésta tiende a doblar cada 10–20 años, por lo que este incremento es más rápido que en otros tipos de cáncer3. Un análisis de los datos de España entre los años 1975 y 1998ha demostrado un incremento de un 13% en el riesgo de muerte por melanoma maligno entre varones y un 33% entre mujeres4. Evidencias recientes han sugerido que este incremento en la incidencia se debe a la mejora en técnicas de vigilancia y diagnóstico precoz así como a cambios en el estilo de vida, como la excesiva exposición a la luz solar5.
El 20% de los pacientes con melanoma cutáneo recidivan, la mayoría de ellos en los primeros 5 años tras el diagnóstico. La recidiva se localiza generalmente, tanto en el lugar de origen del tumor primario como en los ganglios linfáticos regionales. Si la diseminación es visceral, los lugares más frecuentemente afectados son el pulmón, el hígado y el cerebro. La afectación endometrial, como el caso que nos ocupa, es muy infrecuente; de hecho, únicamente se han descrito 13 casos en la literatura científica hasta la fecha.
Aproximadamente, un 80% de los melanomas primarios se originan en la piel, aunque también se han descrito en los ojos, la orofaringe y el tracto genital. El melanoma primario del tracto genital inferior es extremadamente raro (2-3% del total de melanomas)6.
La mayoría de los casos se originan en la vulva y la vagina, mientras que el ovario, cérvix, endometrio y cuerpo uterino son sitios raros de presentación tanto de melanoma primario como metastásico. Se ha descrito en el seno de un teratoma quístico7.
Las metástasis a ganglios regionales se producen por vía linfática; en cambio, las metástasis extrarregionales generalmente se producen por vía hematógena.
Las metástasis en el tracto genital de los tumores extragenitales son infrecuentes y los tumores de son de origen mamario y los de origen gastrointestinal los más frecuentes8. Únicamente el 2,5% de los casos de melanoma cutáneo metastatizan al tracto genital y los ovarios son los órganos más afectados (70-80% de los casos), mientras que el útero está sólo afectado en el 10% de los casos y en la mayoría de ellos también lo están los ovarios, como el caso que describimos9.
Es más frecuente la afectación metastásica uterina de melanoma con origen en otros órganos del tracto genital inferior, como la vulva o la vagina, que de otra localización. Se ha descrito afectación metastásica de melanoma vulvar en el endometrio y éste es el primer caso descrito de metástasis endometrial de melanoma cuyo primario no se encontraba en el tronco ni en las extremidades10. Incluso se ha descrito un caso de enfermedad metastásica de melanoma en adenomioma uterino (como único lugar de enfermedad metastásica)11. Generalmente, la aparición metastásica se manifiesta varios años tras el diagnóstico de la lesión primaria y aproximadamente en el 4% de los casos se descubren las lesiones metastásicas antes del diagnóstico de la lesión primaria12. Se ha especulado que la escasa frecuencia de diseminación metastásica endometrial se puede deber en mujeres premenopáusicas, al descamamiento endometrial periódico durante la edad reproductiva y en la etapa posmenopáusica al efecto inhibitorio del ovario senil13.
Kurman y Hart14 examinaron la distribución anatómica de metástasis uterina en 52 casos y demostraron que únicamente se encontraban afectados el miometrio en 33 (63,5%) casos, el miometrio y el endometrio en 17 (32,7 %) casos y únicamente en 2 (3,8%) casos se encontraba afectado el endometrio sin afectación miometrial14. Takeda et al13 manifiestan que el endometrio se afecta con menos frecuencia que el cérvix uterino como lugar de enfermedad metastásica.
Cuando el endometrio presenta afectación metastásica, generalmente se manifiesta clínicamente con hemorragias uterinas anormales8,9. En cambio, cuando la afectación es únicamente miometrial la paciente puede estar asintomática, o se puede manifestar como masa uterina y la paciente puede referir dolor abdominal bajo.
El diagnóstico preoperatorio es muy dificultoso, puesto que los síntomas son superponibles a los de otras afecciones. Se aconseja que la hemorragia uterina anormal en pacientes con diagnóstico previo de melanoma, incluso en etapa premenopáusica, se investigue mediante estudio anatomopatológico de tejido endometrial15.
La escasa sospecha hace que la mayoría de los casos se diagnostiquen en el estudio anatomopatológico posquirúrgico. Hasta 1978 se habían descrito 3 casos, pero el primer diagnóstico mediante citología fue realizado por Takeda en 1978; es su artículo describió los hallazgos citológicos del melanoma maligno metastático en endometrio. En el caso que describió, en primer lugar se diagnosticó la metástasis y en un segundo tiempo se encontró la lesión en el dorso.
El diagnóstico se facilita por la presencia de pigmento melánico en alguna de las células neoplásicas presentes entre las glándulas tanto de la biopsia (legrado) como de la histerectomía13. El diagnóstico definitivo radica en la inmunohistoquímica. La positividad citoplasmática para S-100, vimentina y antígeno HMB-45, y la ausencia de queratina proporcionan el diagnóstico. S-100 se expresa tanto en el núcleo como en el citoplasma y se ha catalogado como el marcador más sensible, presente en el 95% de los casos. HMB-45 se expresa en el citoplasma.
El pronóstico de la enfermedad está influido por la profundidad de invasión del tumor, lo que se refleja en la clasificación de Breslow16. El riesgo de metástasis se relaciona con el espesor del tumor primario, de forma que si es superior a 0,76mm, el pronóstico es poco favorable17. En pacientes en los que la diseminación metastásica se produce por vía hematógena, el pronóstico es peor que cuando la diseminación es por vía linfática18.
El tratamiento de los estadios I y II de melanoma cutáneo (enfermedad local sin afectación clínica de los ganglios regionales) consiste en la exéresis amplia de la lesión asociada a linfadenectomía regional o a biopsia selectiva del ganglio centinela en los pacientes que se pueden beneficiar de una disección ganglionar selectiva sin las secuelas de la linfadenectomía completa19.
El tratamiento de las pacientes con afectación ganglionar regional, sin evidencia de enfermedad metastásica a distancia (estadios III y algunos con estadio IV), debe incluir exéresis amplia de la lesión asociada a linfadenectomía terapéutica. Estas pacientes deberían ser candidatas a protocolos de adyuvancia tras la cirugía. Únicamente el interferón ha mostrado ser efectivo en protocolos de adyuvancia20.
Los pacientes con enfermedad metastásica son clasificados en el estadio IV y en la actualidad la dacarbacina es el único agente quimioterápico aprobado por la Food and Drug Administration para el melanoma metastásico. Ninguna combinación de agentes quimioterápicos ha demostrado ser más eficaz que dacarbacina en monoterapia.
El manejo de una única metástasis resecable es quirúrgico, con exéresis del tumor y evaluación local y a distancia. Cuando se diagnostica enfermedad metastásica uterina por melanoma maligno, la inter vención quirúrgica no está generalmente indicada, puesto que la enfermedad está diseminada a otros órganos extragenitales20–22.
Es importante resaltar que la hemorragia uterina anormal en una paciente con historia previa de enfermedad tumoral puede representar el primer síntoma de enfermedad metastásica, incluso cuando el intervalo entre la enfermedad tumoral y la hemorragia uterina es de varios años23. En una reciente revisión sobre 1.521 casos de melanoma maligno, se encontró metástasis en orden decreciente en pulmón, piel, ganglios linfáticos, cerebro, hígado y tracto gastrointestinal. No se encontraron metástasis uterinas. La afectación metastásica múltiple se observó en el 14% de los casos24.
Puesto que células de origen endometrial raramente aparecen en estudios de citología cervicovaginal, se recomienda realizar una muestra directamente del endometrio si un melanoma de origen desconocido se ha diagnosticado en un estudio citológico vaginal14.