Determinar la influencia de medidas reguladoras sobre seguridad en la publicidad de medicamentos para la terapia hormonal sustitutiva (THS) y la calidad de la información de los anuncios.
MétodosEn 3 revistas se identificaron los anuncios de medicamentos para THS, sus características, información, mensajes publicitarios y el índice de presión publicitaria (IPP).
ResultadosSe identificaron 174 anuncios. El IPP fue bajo: 5,65, 4,96, 3,03 y 0,58 para los años 2002 a 2005, lo que demuestra una drástica reducción de la publicidad por las medidas reguladoras de la AEMPS. Se detectaron 41 alteraciones del contenido informativo. Solo el 10% de los mensajes estaban respaldados por bibliografía.
Conclusionesa) Las notas de seguridad de medicamentos pueden influir decisivamente en la publicidad de medicamentos en revistas médicas; b) la calidad de la información contenida en la publicidad es muy baja y, habitualmente, engañosa.
To determine the influence of regulatory measures on safety in the advertising of medicines for hormone replacement therapy (HRT) and the quality of the information contained in these advertisements.
MethodsAdvertisements for HRT were identified in three journals and their characteristics, information, advertising messages and the advertising pressure index (API) were analyzed.
ResultsA total of 174 advertisements were identified. The API was low: 5.65, 4.96, 3.03 and 0.58 for 2002 to 2005, showing a drastic reduction in advertising due to the regulatory measures of the Spanish Agency for Medications and Healthcare Products. Forty-one alterations in information content were detected. Only 10% of messages were supported by published studies.
Conclusionsa) Drug safety information can have a decisive influence on drug advertising in medical journals; b) the quality of the information contained in drugs advertising is very low and is frequently misleading.
Las medidas de regulación de medicamentos por motivos de seguridad son un instrumento normativo presente en todos los países con la finalidad de mantener una relación beneficio-riesgo favorable para los medicamentos de uso humano1,2. La toma de este tipo de decisiones implica no solo una cuestión administrativa, sino que va precedida de estudios científicos que aportan las evidencias que aconsejan la adopción de medidas3. Estas actuaciones están respaldadas por los artículos 12.2 y 13 del Real Decreto 1334/20074 de farmacovigilancia de medicamentos de uso humano. Así ocurrió con la terapia hormonal sustitutiva (THS).
La utilización de la THS ha sido objeto de una investigación amplia sobre sus beneficios y riesgos, siendo los estudios más relevantes el Heart and Estrogen/Progestin Replacement Study (HERS)5, Women¿s Health Iniciative (WHI)6 y Million Women Study (MWS)7. Los resultados de estos revelaron no solo la escasa eficacia de la THS en la prevención de riesgos cardiovasculares, sino también el incremento de riesgos cardiovasculares y de cáncer de mama asociados al uso del tratamiento. Sobre la base de estas evidencias científicas, y en coordinación con el resto de agencias europeas, la Agencia Española de Medicamentos y de Productos Sanitarios (AEMPS) publicó, en julio del 20028, la primera de las 3 alertas sanitarias sobre el uso de THS. En esta expuso brevemente los resultados destacables del estudio WHI y recomendó el posible uso a corto plazo para el tratamiento de los síntomas climatéricos, siempre y cuando la relación beneficio/riesgo fuera favorable, no aconsejando el uso a largo plazo de estrógenos y progestágenos combinados para la prevención de enfermedad cardiovascular. Posteriormente, en enero del 20049, emitió una segunda nota basada en los resultados del estudio MWS7 y amplió las recomendaciones del uso restringido a los estrógenos, a las combinaciones de estrógenos y progestágenos y a la tibolona. Además, recomendó la no utilización de los antedichos principios activos como terapia de primera línea a largo plazo para la prevención de fracturas asociadas a osteoporosis y mantuvo la recomendación sobre el tratamiento de síntomas climatéricos. La última nota informativa fue publicada en octubre del 200810 en la que la AEMPS informó sobre la no necesidad de modificar las anteriores recomendaciones sobre la utilización de la THS.
Por otra parte, las medidas reguladoras pueden tener repercusión en las ventas de los medicamentos puesto que las medidas suelen restringir las indicaciones de uso y, por lo tanto, los pacientes tratados. Sin embargo, en los estudios realizados en España los resultados son variables, incluyendo un brusco descenso11, discretos descensos con tendencia a recuperarse12,13 o una eficacia relativa de la alerta14. Lo mismo puede decirse de otros países15,16. En cambio, no hemos encontrado estudios que relacionen las acciones reguladoras con la publicidad.
El objetivo de este estudio es estudiar la influencia de las medidas reguladoras en THS sobre la utilización de medicamentos y sobre las características de la publicidad de los mismos insertada en revistas españolas de ginecología.
MétodosPara el análisis de la publicidad se realizó un estudio observacional, descriptivo y transversal de la publicidad de los medicamentos caracterizados como THS insertada en los números ordinarios, desde enero del 2002 hasta diciembre del 2009, de 3 relevantes revistas españolas especializadas en ginecología y obstetricia: Acta Ginecológica, Clínica e Investigación en Ginecología y Obstetricia y Progresos de Obstetricia y Ginecología. Con la información extraída de las mismas, se realizaron los siguientes estudios:
- 1.
Determinación del índice de presión publicitaria (IPP) debido a la publicidad de THS. Se realizó según el procedimiento descrito previamente17, como cociente entre el número de páginas de anuncios y las páginas totales de la revista de forma acumulada en el periodo de observación.
- 2.
Identificación de los medicamentos publicitados y descripción de las características de los mismos. Para ello, los medicamentos se agruparon según el principio activo que contenía o la asociación de los mismos. Dentro de las características de los medicamentos se incluyeron su tipificación como genérico o de marca, de prescripción o no, financiación pública o privada y tipo de aportación, fecha de autorización y codificación según la clasificación Clasificación Anatómica, Terapéutica y Química del medicamento (Clasificación ATC).
- 3.
Características y adecuación de la información. Para ello se identificaron los mensajes publicitarios presentes bajo la forma de: eslogan (frase creativa de fácil recuerdo), titular (frase para transmitir una parte clave del mensaje cuya intención es captar la atención) y un texto de apoyo (un enunciado que tiene como finalidad justificar la prescripción) ubicado en el cuerpo del anuncio. Estos textos de apoyo se tipificaron según la información que proporcionaron: eficacia, características del producto, etc. La adecuación de la información se determinó mediante la adecuación del contenido mínimo informativo (tabla 1) que, según el Real Decreto 1416/199418, la Circular 1/200019 y la Guía para la publicidad de medicamentos de uso humano20, debe acompañar a la publicidad farmacéutica, a la ficha técnica del producto. La valoración de dicha adecuación fue realizada por 2 revisores de forma separada y posteriormente puesta en común y el grado de concordancia entre las valoraciones se determinó con el test kappa21 usando el programa IBM SPSS statistics versión 19. En caso de discordancia entre las valoraciones, se consensuó la valoración conjunta. Asimismo, el ajuste a las normas se centró en el análisis de:
- -
Presencia del contenido mínimo informativo. Contrastando las informaciones proporcionadas en los anuncios con las presentes en la ficha técnica del medicamento y en el catálogo oficial de medicamentos del año en el que se publicaba el anuncio.
- -
Exageración de las propiedades de los medicamentos en los esloganes.
- -
Fidelidad de los mensajes (titulares y textos de apoyo) a las referencias bibliográficas que los avalan. Los mensajes se clasificaron como «derivados» (cuando los mensajes se ajustaban a su referencia) o «engañoso» (cuando, de alguna forma, se alteraba la veracidad de la publicación).
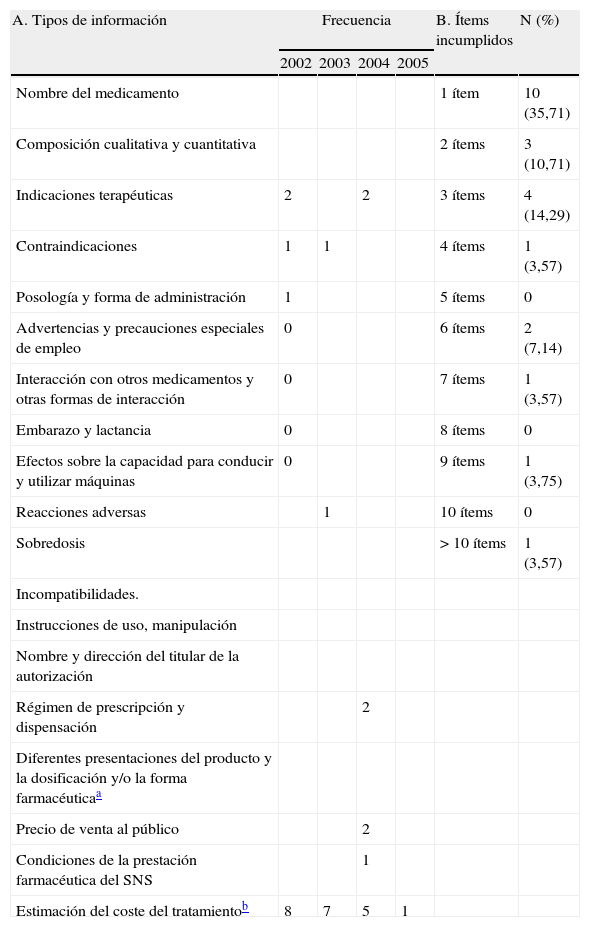
Tabla 1.A. Contenido mínimo informativo que deben tener los anuncios de medicamentos de prescripción de acuerdo con el artículo 10 del Real Decreto 1416/1994 y la frecuencia de incumplimiento (no adecuación y/ausencia). B. Frecuencia de incumplimientos de ítems por anuncio
A. Tipos de información Frecuencia B. Ítems incumplidos N (%) 2002 2003 2004 2005 Nombre del medicamento 1 ítem 10 (35,71) Composición cualitativa y cuantitativa 2 ítems 3 (10,71) Indicaciones terapéuticas 2 2 3 ítems 4 (14,29) Contraindicaciones 1 1 4 ítems 1 (3,57) Posología y forma de administración 1 5 ítems 0 Advertencias y precauciones especiales de empleo 0 6 ítems 2 (7,14) Interacción con otros medicamentos y otras formas de interacción 0 7 ítems 1 (3,57) Embarazo y lactancia 0 8 ítems 0 Efectos sobre la capacidad para conducir y utilizar máquinas 0 9 ítems 1 (3,75) Reacciones adversas 1 10 ítems 0 Sobredosis > 10 ítems 1 (3,57) Incompatibilidades. Instrucciones de uso, manipulación Nombre y dirección del titular de la autorización Régimen de prescripción y dispensación 2 Diferentes presentaciones del producto y la dosificación y/o la forma farmacéuticaa Precio de venta al público 2 Condiciones de la prestación farmacéutica del SNS 1 Estimación del coste del tratamientob 8 7 5 1 SNS: Sistema Nacional de Salud.
- -
Únicamente se publicó publicidad de medicamentos catalogados como THS desde el 2002 hasta el 2005, insertándose un total de 174 anuncios entre las 3 revistas, distribuidos de la forma siguiente: 76 (43,67%) en el 2002; 68 (39,08%) en el 2003; 28 (16,09%) en el 2004, y 2 (0,01%) en el 2005. De estos anuncios, solo 18 eran diferentes y el resto repeticiones de los mismos. En este período, los IPP anuales debidos a los medicamentos relacionados con THS fueron: 5,65 para el 2002; 4,96 para el 2003; 3,03 para el 2004, y 0,58% para el 2005.
Los medicamentos promocionados correspondieron a 16 productos con diferente marca comercial registrada que se distribuyeron entre 6 compañías farmacéuticas. El 2002 fue el año que se promocionaron más medicamentos (n=14) y el 2005 el que menos (n=1). El medicamento más anunciado fue Activelle®, una combinación de un estrógeno (estradiol) y un progestágeno (norestisterona) que se promocionó en el 37,91% (n=66) de los anuncios.
El 81,25% (n=13) de los medicamentos publicitados fueron de prescripción con receta de tratamiento de larga duración y el 18,75% (n=3) con receta ordinaria. Asimismo, el 87,5% (n=14) de los medicamentos anunciados fueron de financiación por el Sistema Nacional de Salud con aportación reducida por el paciente; el 12,5% (n=2) restante no fue financiado.
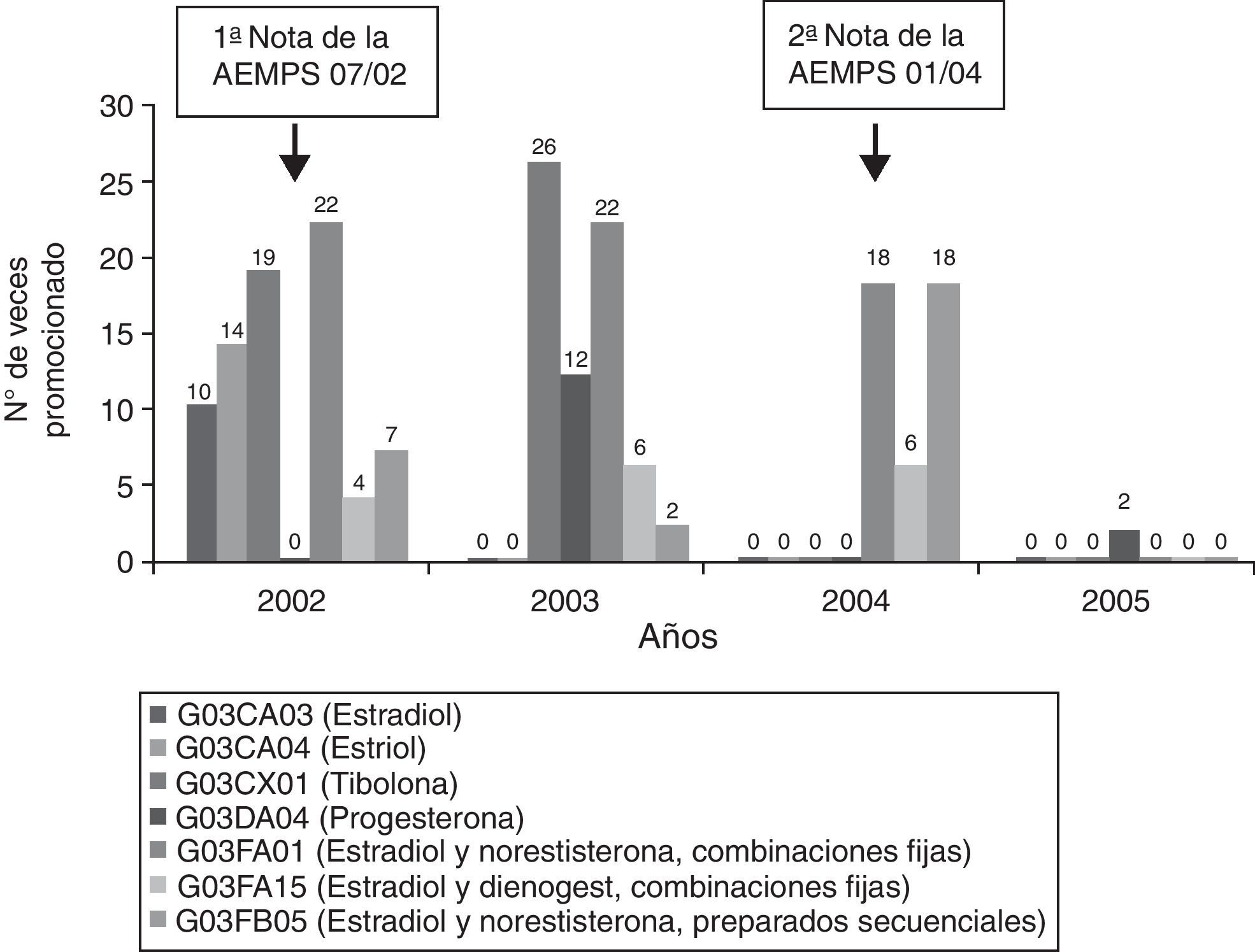
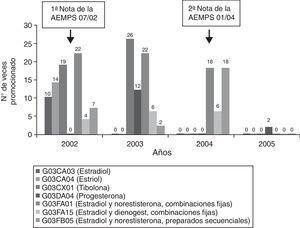
Los medicamentos promocionados pertenecieron a 7 entidades farmacológicas, las cuales se promocionaron como muestra la figura 1. Debemos resaltar que en el 2002 se promocionaron las 7 entidades para reducirse a 5, 3 y 1 en los años sucesivos. También se observa en la misma figura que con la primera nota de seguridad de la AEMPS desaparece la publicidad de estradiol, estriol y una combinación a dosis fijas, pero aumenta la de tibolona. La segunda nota reguladora de enero del 2004 redujo la publicidad a solo 3 productos y con menor frecuencia, mientras que en el 2005 solo se mantiene la publicidad de la progesterona, a la que se dedican 2 anuncios.
Frecuencia anual de la promoción de principios activos o asociaciones en los anuncios de medicamentos. En un mismo anuncio pueden publicitarse monofármacos o asociaciones medicamentosas simultáneamente, por lo que el total de las veces en las que se promocionan los productos no se corresponden con los 174 anuncios de medicamentos identificados. AEMPS: Agencia Española de Medicamentos y Productos Sanitarios.
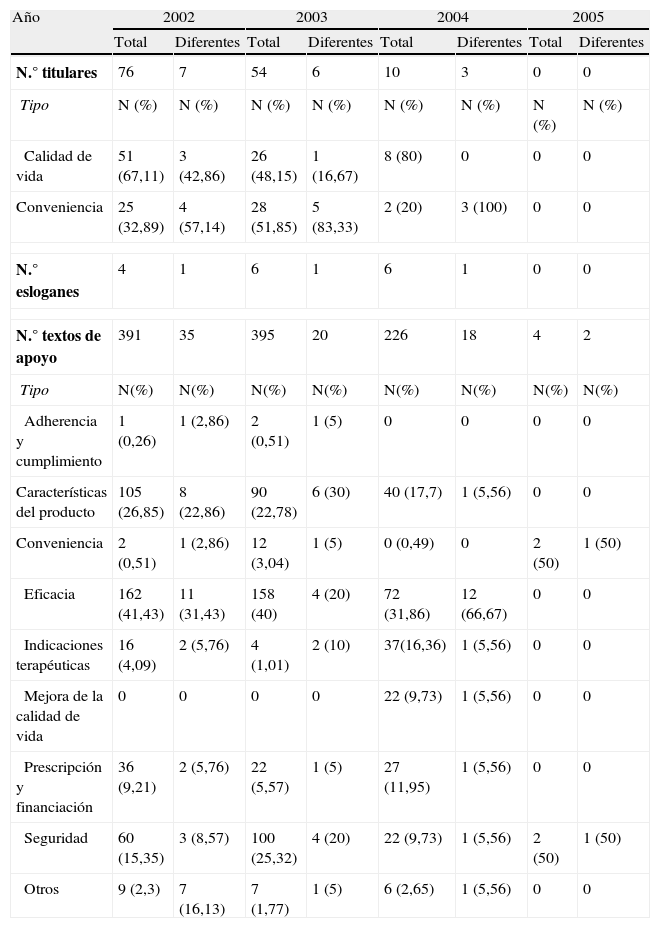
De los 174 anuncios totales insertos desde el 2002 hasta el 2005, el 81,46% (n=140) contenía titulares, el 9,2% (n=16) esloganes y el 100% (n=174) textos de apoyo. En la tabla 2 se presentan diferentes parámetros relacionados con estos aspectos, entre los que resalta que el número de esloganes es limitado, los titulares se centran en promocionar la calidad de vida y la conveniencia, y los textos de apoyo resaltan preferentemente la eficacia y la seguridad. Otro resultado obvio es que, al reducirse el número de anuncios, todos los parámetros analizados disminuyen cuantitativamente a lo largo del período 2002-2005. Por otra parte, cuando se analizó el cumplimiento de la información oficial, se detectaron 41 alteraciones del contenido mínimo informativo (tabla 1), de los que el más frecuente fue la estimación del coste del tratamiento.
Cuantificación y clasificación de los titulares, los esloganes y los textos de apoyo presentes en los anuncios de medicamentos publicados desde el 2002 al 2005
| Año | 2002 | 2003 | 2004 | 2005 | ||||
| Total | Diferentes | Total | Diferentes | Total | Diferentes | Total | Diferentes | |
| N.° titulares | 76 | 7 | 54 | 6 | 10 | 3 | 0 | 0 |
| Tipo | N (%) | N (%) | N (%) | N (%) | N (%) | N (%) | N (%) | N (%) |
| Calidad de vida | 51 (67,11) | 3 (42,86) | 26 (48,15) | 1 (16,67) | 8 (80) | 0 | 0 | 0 |
| Conveniencia | 25 (32,89) | 4 (57,14) | 28 (51,85) | 5 (83,33) | 2 (20) | 3 (100) | 0 | 0 |
| N.° esloganes | 4 | 1 | 6 | 1 | 6 | 1 | 0 | 0 |
| N.° textos de apoyo | 391 | 35 | 395 | 20 | 226 | 18 | 4 | 2 |
| Tipo | N(%) | N(%) | N(%) | N(%) | N(%) | N(%) | N(%) | N(%) |
| Adherencia y cumplimiento | 1 (0,26) | 1 (2,86) | 2 (0,51) | 1 (5) | 0 | 0 | 0 | 0 |
| Características del producto | 105 (26,85) | 8 (22,86) | 90 (22,78) | 6 (30) | 40 (17,7) | 1 (5,56) | 0 | 0 |
| Conveniencia | 2 (0,51) | 1 (2,86) | 12 (3,04) | 1 (5) | 0 (0,49) | 0 | 2 (50) | 1 (50) |
| Eficacia | 162 (41,43) | 11 (31,43) | 158 (40) | 4 (20) | 72 (31,86) | 12 (66,67) | 0 | 0 |
| Indicaciones terapéuticas | 16 (4,09) | 2 (5,76) | 4 (1,01) | 2 (10) | 37(16,36) | 1 (5,56) | 0 | 0 |
| Mejora de la calidad de vida | 0 | 0 | 0 | 0 | 22 (9,73) | 1 (5,56) | 0 | 0 |
| Prescripción y financiación | 36 (9,21) | 2 (5,76) | 22 (5,57) | 1 (5) | 27 (11,95) | 1 (5,56) | 0 | 0 |
| Seguridad | 60 (15,35) | 3 (8,57) | 100 (25,32) | 4 (20) | 22 (9,73) | 1 (5,56) | 2 (50) | 1 (50) |
| Otros | 9 (2,3) | 7 (16,13) | 7 (1,77) | 1 (5) | 6 (2,65) | 1 (5,56) | 0 | 0 |
En los 18 anuncios distintos, tanto los titulares como los textos de apoyo y los esloganes estaban presentes en el 77,78% (n=14), el 94% (n=17) y el 27,27% (n=5), respectivamente. Con estos 18 anuncios se realizó un análisis de la adecuación del contenido informativo teniendo en cuenta su correspondencia con la ficha técnica del producto. Se identificaron 96 mensajes diferentes, de los que 32 (33,37%) estaban asociados a referencias y 64 (66,67%) carecían de respaldo bibliográfico. Fueron 41 las referencias identificadas en los anuncios, de las que solo 18 fueron diferentes. De ellas pudieron recuperarse 17, lo que nos permitió la valoración de la adecuación a la normativa en 31 (96,88%) mensajes.
El resultado más sobresaliente de este análisis es que solo 10 de los mensajes asociados a alguna referencia (el 32,26%) eran realmente refrendado por las mismas mientras que el 67,74% de ellos (n=21) se consideraron engañosos por diferentes motivos: los datos del estudio reseñado no guardaban relación con la afirmación publicitaria (n=11), los resultados a que se aludía en la referencia no eran estadísticamente significativos (n=6), la referencia no evaluaba la asociación causal entre la variable estudiada y el resultado publicado (n=3) y el trabajo referido correspondía a un estudio preclínico (n=1) del que no podían derivarse las conclusiones pretendidas. El grado de concordancia entre los revisores fue del 0,8, de acuerdo con el criterio expuesto por Viera y Garret (2005).
DiscusiónEn los años analizados se ha constatado un descenso de la publicidad de medicamentos destinados a THS desde el 5,65 al 0,58, lo que supone que quedó reducida a un10% de la que se incluía antes de las acciones reguladoras de la Agemed. Atribuimos el efecto a las notas informativas porque hay coincidencia temporal entre la emisión de las mismas y el descenso de publicidad de la misma forma que se ha registrado una disminución de las ventas de estos productos14. En cambio, la inversión publicitaria era alta en las fechas que se centra el estudio y no empieza a disminuir hasta el año 2007, con motivo del inicio de la crisis económica22,23, y se ha sugerido que ha disminuido un 50% entre el 2006 y el 201124. Nuestro estudio demuestra que la primera nota informativa tuvo poca repercusión en la publicidad, pero informa de un fenómeno compensador: disminuye la publicidad de los estrógenos y aumenta la de la tibolona en el año 2003, posiblemente para afianzarse en el mercado teniendo en cuenta de que en esta primera nota este fármaco no era aludido. En cambio, la segunda alerta (de enero del 2004) redujo las campañas publicitarias en las revistas, llegando a desaparecer a partir del 2006.
Nuestro estudio también informa de que solo 6 compañías farmacéuticas controlaron la inversión publicitaria en las revistas, lo que les puede conferir alguna capacidad de influencia en sus contenidos. Por último, también queda patente el reducido número de moléculas de naturaleza hormonal que tenían reconocida alguna indicación en la THS, la mayoría de las cuales, como es razonable, son de prescripción y de cobertura por el Sistema Nacional de Salud. Estos datos están de acuerdo con un estudio general realizado en la revista divulgativa JANO25, así como en la evolución de la prescripción de cuándo los medicamentos son sometidos a restricción15,26-28.
Es importante tener en cuenta que las acciones reguladoras de la AEMPS se basaron en estudios que demostraron una relación beneficio-riesgo desfavorable, siendo las más representativas los conocidos como HERS1, WHI2 y MSW3. Y es importante porque sugieren que la toxicidad de estos medicamentos supera a los beneficios obtenidos en las cohortes de pacientes analizados, porque la THS requiere prescripción médica y, por tanto, su promoción en los países europeos está limitada al médico, porque en España se prescribe como tratamiento de larga duración y porque, como indica el estudio, la calidad de la información incluida en la publicidad es mejorable.
Los insertos publicitarios se centran en comunicar la conveniencia de la utilización del medicamento y la mejora de la calidad de vida probablemente debido a que, al ser medicamentos para un efecto muy conocido, se pretende captar la atención del prescriptor mediante estos tipos de mensajes más que utilizar la eficacia que ya se le presuponen, y utilizar esta junto con las características y la seguridad en textos de apoyo. Es significativo que los mensajes sobre seguridad se utilizaron con más frecuencia tras la emisión de la primera alerta, bien para reivindicar los productos o para que otra compañía no utilice la seguridad como una razón de ventaja en la publicidad frente a potenciales competidores.
Asimismo, el estudio pone de manifiesto que el contenido promocional e informativo también se adapta para no contradecir las alertas sanitarias, lo que explicaría las diferencias observadas entre la exposición de las indicaciones terapéuticas en el anuncio y las recogidas en la ficha técnica vigente en el año de inserción de la publicidad. Este hallazgo demuestra que la actualización del contenido de los anuncios es más rápida que la modificación de la ficha técnica.
La calidad de la publicidad, en cuanto a adecuación a las normas reguladoras, contiene algunas irregularidades, como también han indicado algunos autores29, siendo la más frecuente la no inclusión del coste del tratamiento. Este déficit es importante tanto por el incumplimiento normativo como porque el coste es un elemento de referencia que debe evaluarse en una prescripción racional. También existen incorrecciones en las indicaciones terapéuticas, contraindicaciones, posología, dispensación y reacciones adversas que pueden tener repercusiones en la seguridad de los pacientes. Pero estas, afortunadamente, son menos frecuentes. En todo caso, debe llamarse la atención sobre ellas para evitarlas.
También se detectaron irregularidades en los mensajes publicitarios, fundamentalmente en los textos de apoyo. Además, el 66,67% de los mensajes eran asertos de opinión que carecían de referencias bibliográficas. En los que sí estaban respaldados por referencias bibliográficas solo en el 33% de los casos era fidedigno, mientras que en el 67,74% eran engañosos. En consecuencia, consideramos que esta práctica supone un bajo nivel de control de los insertos publicitarios en las revistas y/o una mala práctica de promoción de los medicamentos por los titulares de las moléculas, lo que debe ser reprobado.
Por último, de los resultados de este estudio se concluye que la publicidad de medicamentos englobados como terapia hormonal sustitutiva se ve influida, tanto a nivel cuantitativo como cualitativo, por las alertas de seguridad sobre la THS. Esta publicidad se desvía de las normativas reguladoras, por lo que, a la vista de los resultados obtenidos, los autores aconsejan a los médicos consultar documentación oficial y fuentes independientes de información.
ConclusionesLas notas de seguridad de medicamentos pueden tener una influencia decisiva en la publicidad de medicamentos en revistas médicas cuya calidad de la información es muy baja y, frecuentemente, engañosa.
FinanciaciónBrezo Diez Díaz tiene otorgada una beca predoctoral (UNOV-08-BECDOC) por la Universidad de Oviedo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.