Valorar la respuesta y la supervivencia utilizando tratamiento hormonoterápico en pacientes con cáncer de mama no subsidiarias de cirugía.
Material y métodosEstudio retrospectivo de 153 pacientes con carcinoma de mama no operable por enfermedad extensa, edad avanzada, comorbilidad grave o rechazo a la terapia convencional, tratadas con hormonoterapia. Valoramos el estadio inicial, la respuesta, la supervivencia global y hasta el primer evento así como causas de fallecimiento.
ResultadosLa edad media±desviación estándar fue 79±7 años y el seguimiento medio 42,6 meses (0-180 meses). Al diagnóstico, 22% presentaba T4; el 47%, afectación ganglionar clínica, y el 16%, enfermedad metastásica. El 87,7% recibió tamoxifeno y el resto, inhibidores de aromatasa o megestrol. El 22% tuvo otros tratamientos sucesivos. El 5,8% presentó respuesta completa; el 31,8%, parcial; el 34,4%, estabilización, y el 9,7%, progresión. El primer evento apareció a 35,7±33 meses de seguimiento. La mortalidad global a 5 años fue del 68,6% y la mortalidad debida a cáncer de mama del 57,3%.
ConclusionesLa hormonoterapia puede plantearse como primera opción en estas pacientes al ser eficaz con escasos efectos secundarios.
To analyze the response to hormonotherapy and survival in non-surgical breast cancer patients.
Material and methodsWe performed a retrospective study of 153 patients with inoperable breast carcinoma due to advanced disease, advanced age, severe comorbidity or refusal to accept conventional therapy, who were treated with hormonotherapy. Initial tumoral stage, response, overall survival and causes of death were evaluated.
ResultsThe mean age was 79±7 years with a mean follow-up of 42.6 months (range: 0-180). At diagnosis, stage T4 tumors were found in 22%, clinical nodal involvement was found in 47% and metastasis in 16%. Tamoxifen was administered in 87.7% of the patients and aromatase inhibitors or megestrol in the remainder. Successive treatments were required in 22%. Complete response occurred in 5.8% and partial response in 31.8%. Of the remaining patients, 34.4% remained stable and 9.7% showed disease progression. The first event occurred at 35.7±33 months of follow-up. Overall mortality was 68.7% and breast cancer mortality was 57.3%.
ConclusionsBecause of its efficacy and scarce adverse effects, hormonotherapy may be an effective treatment in non-surgical patients with breast carcinoma.
El cáncer de mama es un importante problema de salud pública, pues su incidencia es la más alta entre los tumores malignos de la mujer. En España, la incidencia del cáncer de mama puede cifrarse en 35–45 por 100.000 habitantes y, al igual que sucede en otras latitudes, es la primera causa de defunción por cáncer en la mujer, con una tasa de 27/100.0001,2. El cáncer de mama es una enfermedad propia de la edad, su incidencia aumenta dramáticamente con ella: de hecho, aproximadamente, el 70% de los casos se diagnostican en mujeres mayores de 50 años2,3. La tasa de mortalidad de este cáncer también aumenta con la edad4.
La esperanza de vida también ha ido en aumento de manera muy significativa en las últimas décadas. El incremento de la población mayor de 65 años debe hacernos replantear la visión de las afecciones, valorando el efecto de enfermedades coexistentes en la esperanza de vida del cáncer de mama y lo que el futuro puede aportar en pacientes ancianas con carcinoma mamario.
El cáncer de mama se caracteriza habitualmente por su larga evolución y por ello las fases preclínicas, clínica y metastásica pueden prolongarse años o décadas. Además, el comportamiento biológico del cáncer de mama, concepto desarrollado fundamentalmente por Fisher5 hace que se comporte como una enfermedad sistémica desde etapas muy tempranas de su desarrollo.
Los beneficios potenciales de las terapias adyuvantes dependen del riesgo de recurrencia de la paciente, su estado funcional y la coexistencia de otras afecciones (comorbilidad) y todo ello interactúa afectando a la esperanza de vida. A mayor edad, la capacidad funcional disminuye y la comorbilidad aumenta. A pesar de que el número de pacientes ancianas con cáncer de mama está aumentando, se incluyen relativamente pocas pacientes de 65 años o más en ensayos clínicos6. Aun así, la edad se considera un factor determinante en el tratamiento y la terapéutica del cáncer de mama difiere según la edad7-13. Las pacientes ancianas tienen una expectativa de vida más corta, está incrementada la comorbilidad y presentan distintos perfiles funcionales y psicológicos que las pacientes jóvenes14,15. Además, existe un amplio debate sobre la naturaleza del cáncer de mama en pacientes ancianas y parece que posee una menor agresividad en este contexto16,17.
Una de las principales dificultades que hemos encontrado en este trabajo es que no existe una definición aceptada de «paciente anciana». La vejez es un concepto multifactorial y está asociado al descenso de la reserva funcional de múltiples órganos y sistemas, además de recursos personales y sociales. El punto de corte de los 65 años se ha empleado frecuentemente en estudios epidemiológicos, mientras que la edad de 70 años suele ser empleada como el límite bajo en múltiples ensayos clínicos médicos, y ciertos estudios oncológicos manejan un margen más amplio en esta cuestión.
El concepto fundamental es que el valor terapéutico de la adyuvancia disminuye sustancialmente con la edad y la comorbilidad se incrementa, debido a que las afecciones no relacionadas con el cáncer de mama son la principal causa de fallecimiento en las pacientes ancianas18. La idea principal al tomar la decisión sobre qué tratamiento es el más apropiado en las pacientes ancianas con cáncer de mama es: ¿cuál es su expectativa de vida? Ya hemos visto que la edad cronológica sola no es fiable para estimarla, y existen valoraciones geriátricas o escalas que permiten predecir las probabilidades de supervivencia en pacientes ancianas con cáncer, independientemente del estadio o del tipo de cáncer19. Por otro lado, hay que tener en cuenta que son pacientes más susceptibles de toxicidad grave lo que puede minar el éxito del tratamiento adyuvante. Además, el riesgo de interacción entre la quimioterapia y la polimedicación que muchas toman por otras causas médicas, puede disminuir o incrementar la actividad de un fármaco.
El objetivo principal del presente estudio es valorar la respuesta al tratamiento hormonoterápico utilizado como primera línea y la supervivencia global en pacientes diagnosticadas de carcinoma de mama y que no son subsidiarias de cirugía ni de tratamiento quimioterápico inicial por afecciones concomitantes graves asociadas o rechazo al tratamiento estándar.
MATERIAL Y MÉTODOSe trata de un estudio retrospectivo en el que se han incluido pacientes posmenopáusicas con carcinoma de mama no subsidiarias de tratamiento quirúrgico o quimioterápico inicial y en las que como primer tratamiento se empleó exclusivamente la hormonoterapia.
Se recogieron pacientes entre los meses de enero de 1985 y noviembre de 2005, que fueron seguidas en las consultas de patología mamaria del Hospital Universitario La Paz mediante revisiones periódicas que incluyen exploración mamaria, mamografía, radiografía de tórax y pruebas complementarias de extensión, según se precisaran.
Los criterios de inclusión en el estudio fueron: edad avanzada, salvo un caso que se comentará posteriomente, negativa de la paciente al tratamiento convencional, afecciones sistémicas asociadas graves que elevaban considerablemente el riesgo quirúrgico de la paciente, y/o alto riesgo de toxicidad por la aplicación del tratamiento quimioterápico reglado. Se consideró además la calidad de vida previa de la paciente en relación con su afección de base y la sintomatología que presentaban en relación con la patología de mama. Se incluyó a pacientes con esas características independientemente del estadio en que se presentó la enfermedad, tanto enfermedad temprana, carcinomas localmente avanzados como cáncer de mama diseminado.
El tratamiento inicial fue exclusivamente hormonoterapia. Los fármacos empleados fueron: a) agentes moduladores selectivos del receptor estrogénico (SERM): tamoxifeno (10–20mg/24h); b) inhibidores de la aromatasa (IA) no esteroideos: letrozol (2,5mg/24h) y anastrozol (1mg/24h); c) IA esteroideos: exemestano (25mg/24h); d) agentes progestágenos: acetato de megestrol (160–320mg/24h) y acetato de medroxiprogesterona (500–1.000mg/24h), y e) antagonista de los receptores de estrógenos: fulvestrant (250mg/mes por vía intramuscular).
Los datos analizados fueron: edad; antecedentes ginecoobstétricos (paridad, menarquia, menopausia y tipo de ciclo menstrual); tamaño tumoral, que se valoró mediante exploración clínica y, en algunos casos, medición en senografía; existencia y grado de afectación ganglionar clínica; localización de la lesión, según fuera en la mama derecha, izquierda o bilateral; estadio de la enfermedad según la clasificación TNM; tratamiento hormonal inicial pautado; existencia de otros tratamientos consecutivos y cuáles fueron, y tiempo de seguimiento de las pacientes en meses. La respuesta al tratamiento se evaluó según criterios RECIST: a) respuesta completa (ausencia clínica de enfermedad); b) respuesta parcial (disminución del 50% en el tamaño tumoral); c) estabilización de la enfermedad, y d) progresión de la enfermedad. Se recogieron a su vez los eventos aparecidos durante el seguimiento de las pacientes y el tiempo en meses hasta la aparición del primer evento, la tasa de muerte global, diferenciando los fallecimientos debidos a enfermedad de mama y los debidos a otras causas, y la supervivencia global a 1 y 5 años.
El análisis estadístico se realizó mediante el programa Statistical Package Science v. 12.0 (SPSS 12.0 for Windows) con el cálculo de valores estadísticos descriptivos. Las diferencias en las proporciones se calcularon mediante la prueba de la χ2 en las variables paramétricas y la prueba de Mann–Whitney para variables no paramétricas. El análisis de la supervivencia se realizó mediante las curvas de Kaplan-Meier. Finalmente, se aceptó una valor de significación estadística (p) ≤ 0,05 para las pruebas del estudio.
RESULTADOSCaracterísticas de las pacientesSe han recogido datos de un total de 153 pacientes cuya edad media ± desviación estándar fue de 78,9 ± 7,3 años, con un rango de edad de 41–95 años. El 19,6% del total de las pacientes del estudio se incluyó debido a que rehusaron a la terapéutica habitual correspondiente según el estadio de la enfermedad, a pesar de la recomendación médica, y aceptaron la hormonoterapia como única opción; el resto (80,4%) se incluyó según varios factores, tales como ancianidad y comorbilidad grave. Solamente una paciente fue menor de 60 años (41 años) y presentaba grave hepatopatía secundaria a etilismo crónico y virus de la hepatitis C (VHC), estadio C de sida y no deseaba tratamiento convencional.
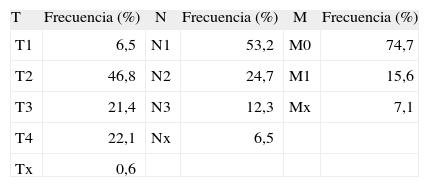
La mediana de hijos fue de 2, con un rango de 0–12; el patrón menstrual más frecuente fue 4/28 días, con una edad media de la menarquia de 13,3 ± 1,6 años y la media de la menopausia a los 48,4 ± 4,2 años (tabla 1).
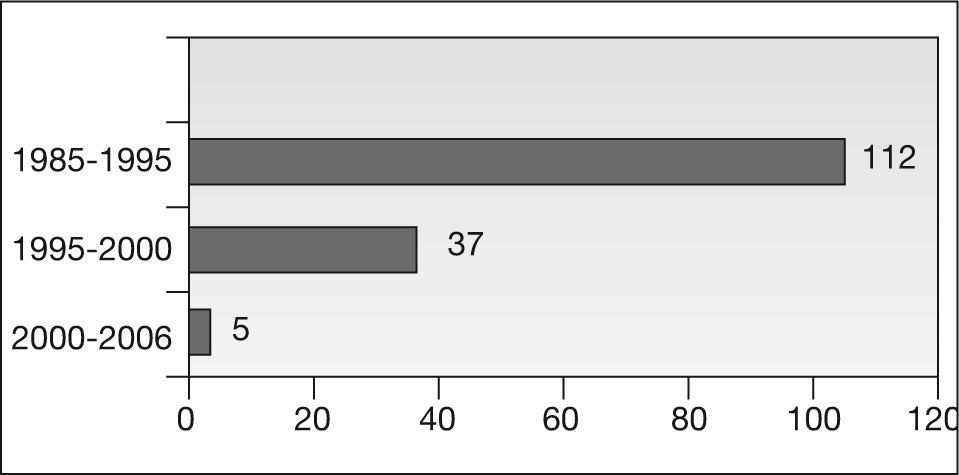
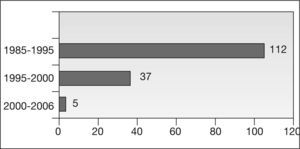
Se seleccionó a pacientes entre el año 1985 y el año 2005; la distribución según el año en que se hizo el diagnóstico se representa en la figura 1.
En atención a las características del tumor, el 41,6% de los tumores tuvieron como primera localización la mama derecha, frente al 54,5% de los de aparición en mama izquierda. Una de las pacientes presentaba un carcinoma de mama bilateral al momento del diagnóstico (0,6%).
El tamaño tumoral medio fue de 5,34 ± 3,03cm. Según la clasificación TNM, la distribución de las pacientes se representa en la tabla 2.
El diagnóstico de carcinoma se realizó mediante punción-aspiración con aguja fina (PAAF) en un 77,3% de los casos, biopsia con aguja gruesa en el 16,9%, realizada de forma ambulatoria, y biopsia escisional con anestesia local en un 5,8%.
Seguimiento y supervivenciaUn 5,8% de las pacientes (10 mujeres) presentaron respuesta completa (RC); una de ellas, al año de tratamiento, y las restantes a los 2 años. El tratamiento empleado fue tamoxifeno en 9 pacientes y anastrozol en 1 paciente. Las pacientes que presentaron respuesta parcial (RP) de la enfermedad fueron el 31,8%; en el 34,4% se consiguió estabilización (E) y en el 9,7% se objetivó progresión (P). El porcentaje acumulado de las pacientes que presentaron respuesta favorable al tratamiento, ya sea completa, parcial o estabilización de la enfermedad, es del 88,1%.
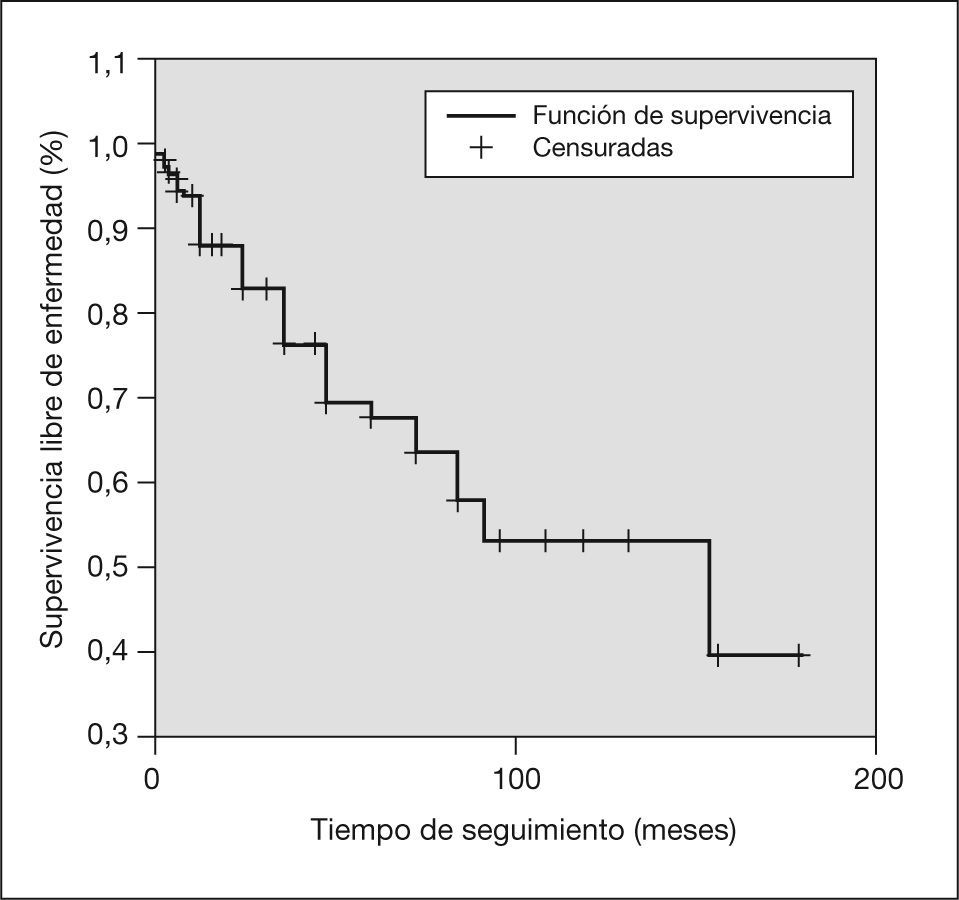
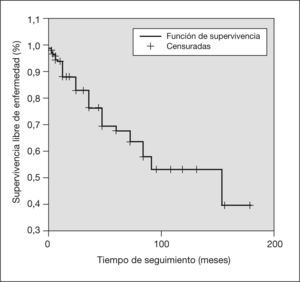
El tiempo medio de seguimiento fue de 42,6 meses (rango: 0–180). El 50,3% de las pacientes no presentaron ningún evento que indicara progresión local de la enfermedad o diseminación a lo largo de su seguimiento. El primer evento apareció como media a los 35,7 ± 33 meses (rango: 1–156); los más frecuentes fueron la progresión o recidiva local de la enfermedad y la aparición de metástasis a distancia. Este tiempo, hasta su aparición, representa la supervivencia libre de eventos (fig. 2) que a los 100 meses de seguimiento supone el 52,3%.
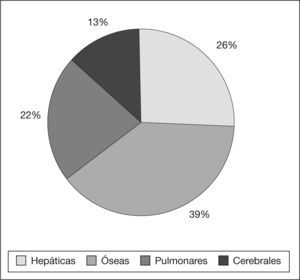
Las metástasis a distancia se localizaron fundamentalmente en el hueso, el pulmón, el hígado y el sistema nervioso central (fig. 3).
Durante el seguimiento, las pacientes refirieron escasos y leves efectos secundarios al tratamiento (4%) que, en ningún caso, precisaron la retirada del fármaco pautado.
El primer tratamiento empleado en las pacientes fue tamoxifeno en el 87,7%; anastrozol en el 0,6%; exemestano en el 0,6%, y letrozol en el 0,6%. En un 22,1% fue necesario el empleo de tratamiento de segunda línea: 10 pacientes con anastrozol, 1 paciente con exemestano, 7 con letrozol y 7 con acetato de megestrol. Ocho pacientes fueron subsidiarias de cirugía; en todos estos casos se practicó una mastectomía simple y en 2 de estas pacientes se empleó tratamiento radioterápico posterior. En un 3,9% de pacientes se utilizó una tercera línea durante su seguimiento; de éstas, en 4 pacientes se inició terapia con exemestano, en una con letrozol y en otra paciente se realizó cirugía (también en este caso una mastectomía simple). Únicamente en 2 pacientes (2,3%) se empleó una cuarta línea, en una de ellas fulvestrant y en otra letrozol.
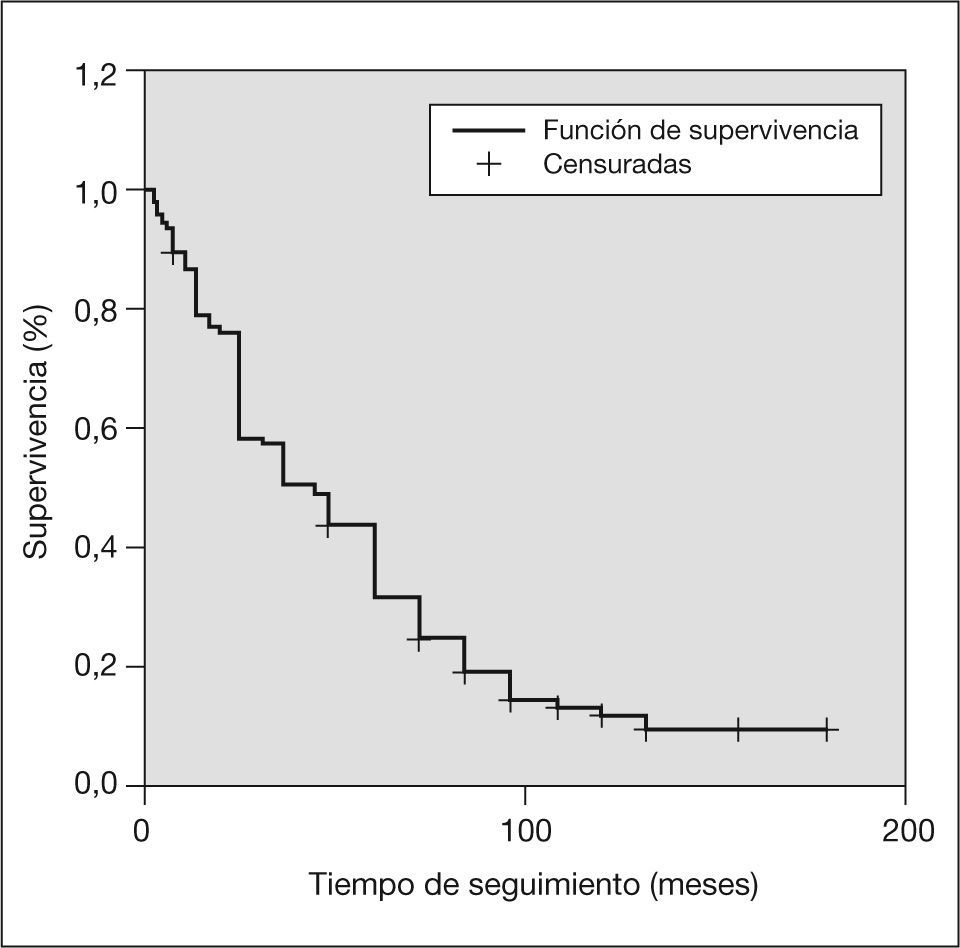
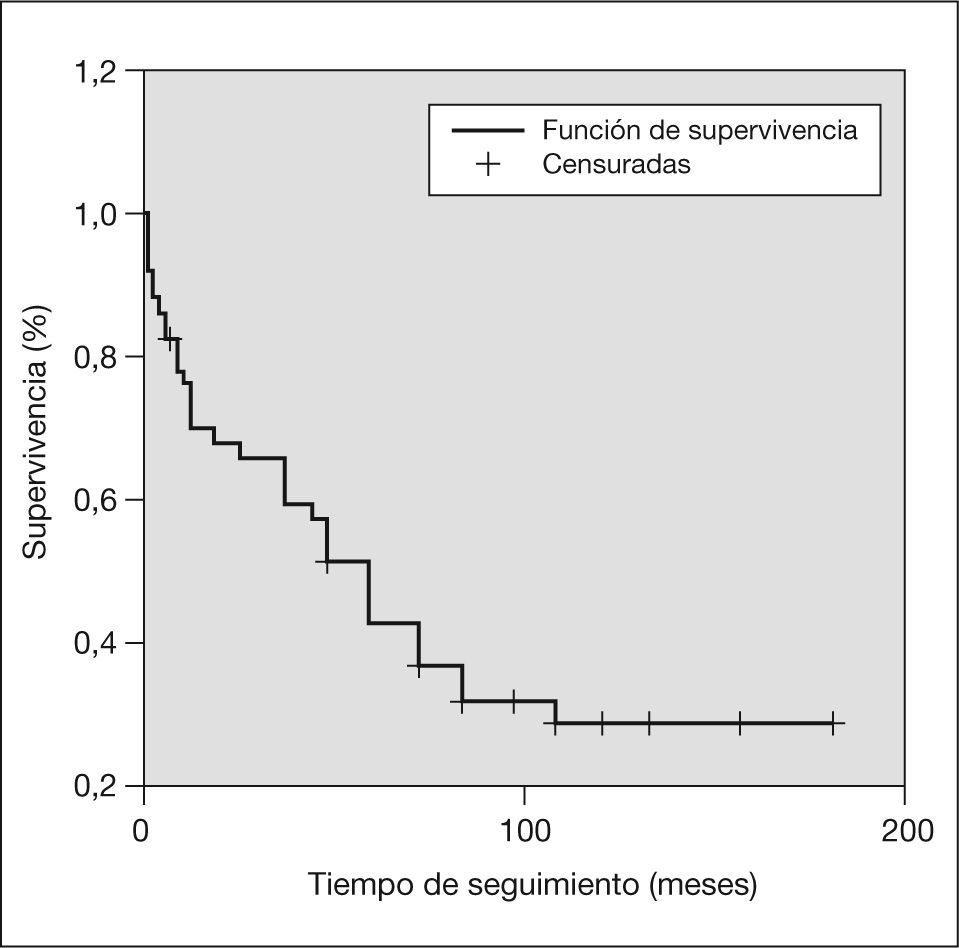
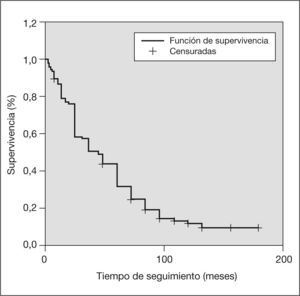
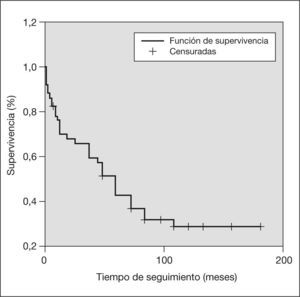
En el análisis de supervivencia, representado por las curvas de Kaplan-Meier, la supervivencia global de todas las pacientes estudiadas, incluida cualquier causa de fallecimiento, a un año fue del 77,86% y a los 5 años del 31,42%. La supervivencia en el grupo de pacientes que fallecieron por cáncer de mama fue al año del 69,70% y a los 5 años del 42,71% (figs. 4 y 5).
DISCUSIÓNLas ancianas representan un grupo de pacientes cada vez más frecuente en nuestra consulta, por la mayor expectativa de vida de la mujer. Con frecuencia, el médico debe plantearse cuál es la primera intención del tratamiento en estas pacientes, es decir, «potencialmente curativo-agresivo» frente a «paliativo», considerando qué opción ofrece mayor supervivencia con una mejor calidad de vida20-22. Históricamente, se las ha excluido de los ensayos clínicos y la extrapolación de datos con pacientes jóvenes no siempre es apropiada, ya que la tolerancia a regímenes de neoadyuvancia estándar puede ser más limitado20,23-25.
En nuestra revisión hemos recogido datos desde 1985 hasta la actualidad y hemos visto que los criterios sobre estas pacientes han variado mucho, tanto por la mejoría en el diagnóstico como en el tratamiento; además, socialmente ha cambiado el concepto de paciente anciana y los criterios de inoperabilidad se han hecho más estrictos26. La posibilidad de neoadyuvancia y cirugía conservadora, y los avances en los tratamientos quimioterápicos y hormonales han abierto ampliamente este campo y generado foros de debate27-30. La coordinación de los servicios de geriatría, oncología y ginecología nos permite una evaluación más global de cada caso y considerar a una paciente inoperable o no apta para un tratamiento convencional, no debe quedar sólo al criterio de un médico31,32.
En nuestra serie hemos encontrado algunas pacientes consideradas inoperables debido a comorbilidad asociada que hoy en día hubieran podido operarse33,34. La tendencia actual es la cirugía en el mayor número de casos, ya que parece que en pacientes ancianas es relativamente segura, aunque en varios de los artículos revisados se selecciona a las pacientes que presentan menor riesgo anestésico y enfermedad temprana35-37, lo que no ocurre en nuestra serie.
La cirugía conservadora parece ser la más adecuada, ya que no se han demostrado diferencias estadísticamente significativas en comparación con la cirugía radical a 20 años de seguimiento38-40. Al igual que en otros subgrupos de edad, la asociación de radioterapia con cirugía conservadora en ancianas disminuye el riesgo de recidiva local41. Recientes estudios sugieren que las pacientes ancianas pueden tolerar la radioterapia, aunque sería ideal identificar el subgrupo de ellas que no la precisarán tras la cirugía conservadora42. Como alternativa, se puede pensar en irradiar parcialmente la mama con braquiterapia intersticial multicatéter, braquiterapia con catéter-balón, radioterapia externa con campo conformado tridimensional o radioterapia intraoperatoria43.
Los criterios diagnósticos observados también han sido más laxos que los considerados necesarios en la actualidad; hoy en día estas pacientes podrían considerarse como infradiagnosticadas44. La mayoría fueron diagnosticadas mediante PAAF, con lo que solamente se pueden obtener datos de malignidad celular; la mayoría de estas pacientes fueron seleccionadas los primeros años en los que la posibilidad de estudio inmunohistoquímico y de receptores hormonales era más limitada en nuestro centro. En la actualidad, es fundamental para orientar una terapéutica correcta, un diagnóstico preciso conociendo la presencia de receptores hormonales y de otros parámetros, como mutación de p53, sobreexpresión de C-erbB2 o índice de proliferación Ki 6745,46.
La biología del cáncer de mama posee unas características específicas en estas pacientes con ciertos factores biológicos más favorables, como positividad de los receptores hormonales, menor índice de proliferación, ausencia de mutación de p53, ausencia de sobreexpresión de C-erbB2, sobreexpresión del receptor del factor de crecimiento epitelial (EGFR) y contenido en ADN diploide normal47,48. En estudios histopatológicos, se ha demostrado menor afectación ganglionar en pacientes mayores de 70 años, menor invasión vascular y menor reacción estromal linfoplasmocitaria, independientemente del grado tumoral. El tiempo de duplicación del tumor se convierte en más prolongado a mayor edad y la proliferación neoplásica es prácticamente la mitad en los tumores obtenidos de pacientes de 70 años o más en comparación con pacientes más jóvenes. La incidencia de enfermedad hormonosensible (± 80% tras 75 años) y la expresión de receptores estrogénicos se incrementa con la edad49. Estas características se pueden resumir en: una célula neoplásica menos agresiva y un huésped poco favorable para el crecimiento del tumor.
Hay que considerar además que estas pacientes presentan una frecuencia de cáncer de mama avanzado mayor que en el resto de grupos de edad. Sin embargo, la probabilidad de fallecimiento debido a cáncer de mama disminuye con la edad, independientemente del estadio de la enfermedad, ya que se ha demostrado que mujeres de ≥ 70 años presentan un 46% menos de riesgo de defunción por carcinoma mamario que las menores de 50 años50-52.
Como consecuencia de todo esto, ha aumentado el interés por la investigación en la terapia hormonal primaria (THP) en este grupo de pacientes53,54. Parece que los beneficios de la quimioterapia disminuyen con la edad; además de aumentar la frecuencia de mielosupresión y de cardiotoxicidad relacionada con los regímenes de antraciclinas55. La THP carece de la toxicidad y los riesgos comúnmente asociados a la QT. Por ello, la terapia hormonal es un tratamiento atractivo para pacientes ancianas y su respuesta es fácilmente predecible en tumores con receptores hormonales positivos53.
El tamoxifeno se ha investigado como THP para cáncer de mama localmente avanzado en pacientes posmenopáusicas desde los años ochenta, y algunos ensayos han demostrado tasas de respuesta del 4767% con excelente tolerancia56,57. Más recientemente, el letrozol (IA) parece ser más activo que el tamoxifeno en neoadyuvancia y como primera línea de tratamiento, sobre todo en pacientes con débil expresión de receptores de estrógeno, y ambos agentes fueron bien tolerados58. El anastrozol y el exemestano (IA) también parecen más eficaces que el tamoxifeno59-62. Un dato interesante de estos trabajos es que los IA presentan una actividad superior al tamoxifeno en tumores con sobreexpresión de CerbB2. Las fracturas óseas representan el mayor riesgo de los IA, especialmente en pacientes ancianas en las que se encuentre muy disminuida la densidad mineral ósea; los bifosfonatos parecen ser especialmente útiles en estos casos como tratamiento preventivo primario y secundario63. Los progestágenos en THP han demostrado también su eficacia y su baja toxicidad, y se han obtenido respuestas en el 16 al 50% de los casos, dependiendo de la presencia o no de receptores hormonales. A pesar de que el fulvestrant ha demostrado su eficacia en el tratamiento de cáncer de mama avanzado, existen pocos datos en la literatura científica de este fármaco en THP64. Hay que considerar que la administración intramuscular mensual del fulvestrant lo convertiría en una opción muy atractiva para estas pacientes ancianas, cuyo cumplimiento es difícil de asegurar y se encuentran habitualmente polimedicadas.
En nuestro trabajo hemos recogido datos de pacientes que inicialmente se han considerado inoperables, pero en varios casos tras el tratamiento inicial algunas de ellas se han sometido a cirugía. Varios estudios han evaluado la efectividad clínica de la THP sola en pacientes ≥ 70 años frente a cirugía con o sin THP y parece que en cohortes de mujeres con importante comorbilidad y tumores con receptores de estrógenos positivos, la THP es una opción superior a la cirugía56. En las pacientes con cáncer de mama localmente avanzado que responden a tratamientos de neoadyuvancia y que no presenten comorbilidad que lo impida, sería recomendable ofrecer tratamiento quirúrgico adecuado, incluso cirugía conservadora seguida de radioterapia si ésta es factible37,39,40.
Este grupo de pacientes se benefician de una valoración multidisciplinar a la hora de optar por el tratamiento más adecuado. Los efectos de la comorbilidad sobre la expectativa de vida pueden estimarse mediante modelos matemáticos y existen varios estudios sobre sus efectos en pacientes con cáncer de mama65. También existen valoraciones geriátricas (Comprehensive Geriatric Assessment [CGA]) o escalas, como la ADL (Activities of Daily Living) y ADLinstrumental que han demostrado predecir las probabilidades de supervivencia en pacientes ancianas con cáncer, independientemente del estadio o del tipo. La CGA, recomendada en pacientes mayores de 70 años, valora los cambios relacionados con la edad que ocurren más rápidamente en este grupo66,67. Es más, aporta información sobre la expectativa de vida, tratamiento, tolerancia, necesidad de soporte social e incidencias inesperadas (demencia, depresión, etc.), que pueden interferir en el tratamiento del cáncer y que son fundamentales para una valoración global de cada paciente (tabla 3).
Valor de la Comprehensive Geriatric Assessment en el manejo de pacientes ancianas con cáncer
| Función | Apariencia |
| Actividades diarias | |
| Actividades instrumentales diarias | |
| Comorbilidad | Número de factores de comorbilidad |
| Gravedad de factores de comorbilidad (índice de comorbilidad) | |
| Condiciones socioeconómicas | Factores económicos |
| Recursos sociales | |
| Presencia de cuidadores | |
| Cognición | Prueba de evaluación (Folestein Mini-Mental) |
| Síndromes geriátricos | Demencia |
| Delirio | |
| Depresión | |
| Caídas | |
| Desatención y abusos | |
| Fracturas óseas espontáneas |
Tomado de Mano et al52.
Por tanto, debemos considerar conjuntamente varios factores específicos de este grupo de pacientes ancianas, como son las características del tumor, las condiciones médicas, sociales y psicológicas a la hora de decidir cuál es el tratamiento más adecuado, coordinando los servicios de oncología y geriatría con el nuestro para tener una visión global del caso.
CONCLUSIONESEl manejo de las pacientes ancianas con carcinoma de mama y enfermedad inoperable ha cambiado y actualmente existen más datos, aunque aún pocos, que apoyen las decisiones terapéuticas. Esto, además, debe implementarse con la presencia de problemas socioeconómicos, síndromes geriátricos y comorbilidad y disminución de la movilidad y funciones cognitivas. Por ello, un acercamiento multidisciplinar es esencial para el manejo adecuado.
En pacientes no subsidiarias de tratamiento quirúrgico debería considerarse THP en tumores hormonosensibles (E y/o P +). Los IA parecen superiores al tamoxifeno. Las pacientes con tumores hormonorresistentes deberían recibir quimioterapia neoadyuvante, aunque desafortunadamente no existen guías terapéuticas sobre los regímenes más apropiados. Es necesaria la realización de más ensayos clínicos que incluyan la necesidad de cirugía o tratamientos combinados.
El empleo de evaluaciones geriátricas multidisciplinares permite una mejor selección de la terapéutica más adecuada e individualizada. El incremento de las opciones de tratamiento en pacientes ancianas con cáncer de mama seguramente conducirá a un incremento en su supervivencia y a una mejoría en su calidad de vida.