Comparar las concentraciones de homocisteína sérica en neonatos de preeclámpticas y de embarazadas normotensas.
MétodoSe seleccionaron 35 pacientes preeclámpticas y sus recién nacidos (grupo A; casos) y 35 embarazadas normotensas y sus recién nacidos (grupo B; controles). Se evaluaron las concentraciones de homocisteína materna-neonatal y el peso de los recién nacidos de pacientes preeclámpticas y normales.
ResultadosSe encontraron diferencias estadísticamente significativas con relación a la edad gestacional, la presión arterial sistólica y diastólica y la presencia de proteinuria (p<0,05). Las concentraciones de homocisteína materna fueron más altas en las pacientes del grupo A al compararlas con las embarazadas del grupo B (p<0,05). Se observó que los recién nacidos de las preeclámpticas presentaban pesos promedios significativamente menores que los recién nacidos de las embarazadas normales (p<0,05). Se encontró que los recién nacidos de las pacientes del grupo A presentaban concentraciones de homocisteína significativamente mas altas que las embarazadas del grupo B (p<0,05). Al correlacionar las concentraciones de homocisteína del recién nacido, se observó que era moderada, positiva y significativa con las concentraciones de homocisteína materna y una correlación moderada, negativa y significativa con el peso del recién nacido (p<0,05).
ConclusiónLos recién nacidos de pacientes preeclámpticas tienen concentraciones significativamente más altas de homocisteína comparado con los recién nacidos de embarazadas normotensas.
To compare serum homocysteine concentrations in the newborns of preeclamptic patients and normotensive pregnant women.
MethodsThirty-five preeclamptic patients and their newborns (group A; cases) and 35 normotensive pregnant women and their newborns (group B; controls) were selected. Maternal-neonatal homocysteine concentrations and neonatal weight were evaluated in both groups.
ResultsStatistically significant differences were found in gestational age, systolic and diastolic blood pressure and the presence of proteinuria (p<0.05). Maternal homocysteine concentrations were higher in group A than in group B (p<0.05). Mean neonatal weight was significantly lower in group A than in group B (p<0.05). Neonatal homocysteine concentrations were higher in group A than in group B (p<0.05). When the homocysteine concentrations of newborns were correlated, there was a moderate, positive and significant correlation with maternal homocysteine concentrations and a moderate, negative and significant correlation with neonatal weight (p<0.05).
ConclusionHomocysteine concentrations were significantly higher in the newborns of preeclamptic patients than in those of normotensive pregnant women.
La preeclampsia es un síndrome que afecta el 5-7% de los embarazos y generalmente causa morbilidad significativa en la madre, el feto y el recién nacido. Diferentes estudios han demostrado que las mujeres con antecedentes de preeclampsia tienen un aumento en el riesgo de enfermedades cardiovasculares y tienen altas concentraciones de insulina en ayunas, lípidos y factores de la coagulación durante el embarazo y el puerperio1.
Se considera que el daño a la capa endotelial de los vasos sanguíneos y la reducción de la perfusión fetoplacentaria, como resultado de la invasión anormal por el citotrofoblasto de las arterias espirales, juegan un importante papel en la fisiopatología de la preeclampsia2. La combinación hipoxia/isquemia placentaria lleva a una amplia activación y disfunción del endotelio vascular materno, lo cual produce aumento en la formación de endotelina, tromboxano y superóxido, aumento de la sensibilidad de los vasos a la angiotensina II y disminución de la formación de vasodilatadores como el óxido nítrico y la prostaciclina2–5.
La homocisteína es un aminoácido que contiene sulfuro que puede ser convertido a cistationina o cistina a través de la vía de la transulfuración o remetilado para formar metionina. Esta última reacción es catalizada por la metionina sintetasa en la mayoría de los tejidos. Las concentraciones plasmáticas de homocisteína están relacionadas con factores genéticos, ambientales y dietéticos6. Las concentraciones de homocisteína disminuyen durante el embarazo normal debido al incremento de la tasa de filtración glomerular, hemodilución secundaria al incremento del volumen plasmático y al incremento de la captación de homocisteína por el feto7.
La hiperhomocisteinemia es un factor de riesgo reconocido para la aterosclerosis y la aterotrombosis8. Se ha propuesto que la tendencia aterogénica está relacionada al daño endotelial y a la disfunción debido a la presencia de altas concentraciones de homocisteína, produciendo activación plaquetaria, formación de trombos y proliferación de células musculares lisas9.
Las altas concentraciones de homocisteína pueden producir disfunción endotelial y las elevaciones de las concentraciones séricas de homocisteína y cisteína están asociadas a enfermedades cardiovasculares10,11. Se han reportado altas concentraciones de homocisteína o cisteína en la preeclampsia e incrementos de la concentración de homocisteína antes de la aparición de los síntomas9,11–13. La relación puede no ser causal, pero estas sustancias puede tener un potencial efecto perjudicial, no solo en el endotelio materno, sino también en el feto y en el recién nacido.
El objetivo de la investigación fue comparar las concentraciones de homocisteína sérica en neonatos de preeclámpticas y de embarazadas normotensas.
MétodoSe seleccionó un total de 70 embarazadas y sus recién nacidos. Se incluyó a 35 preeclámpticas y sus recién nacidos como los casos (grupo A) y un grupo control que fue seleccionado por tener una edad y un índice de masa corporal similares al grupo de estudio, y consistió en 35 embarazadas sanas y sus recién nacidos (grupo B). Todas las embarazadas eran primigestas.
La preeclampsia se definió como presión arterial mayor de 140/90mmHg en dos o más ocasiones con 4h de diferencia entre las mediciones después de la vigésima semana de gestación, con proteinuria de más de dos cruces, en dos ocasiones diferentes con 6h de diferencia. La presión sanguínea se midió en posición sentada después de 15min de descanso.
Se excluyeron embarazadas con antecedentes de hipertensión crónica, con edad gestacional mayor de 30 semanas de embarazo, con enfermedades médicas importantes, en los recién nacidos en los cuales no se pudieron obtener muestras de sangre y en las embarazadas que hayan utilizado medicamentos que alteren la concentración de homocisteína y que se nieguen a participar en el estudio.
Las muestras de sangre materna (10ml) se recogieron en todas las embarazadas antes del parto y en el grupo de estudio inmediatamente después del diagnóstico, antes de la administración de cualquier medicamento, y se las dejó coagular a temperatura ambiente. En los recién nacidos se obtuvo la muestra de sangre (5ml) inmediatamente después del nacimiento. Las muestras se colocaron en un tubo de vidrio seco, estéril, almacenado con ácido etilenediaminetetra-acético y procesado luego de 1h de almacenamiento; se empleó cromatografía líquida usando un kit comercial para la determinación. Los coeficientes de variación intra e interensayo fueron menores del 10 y del 5%, respectivamente.
Los datos se presentan como valores promedios±desviación estándar. Los datos cuantitativos en ambos grupos se analizaron con la prueba t de Student para muestras no relacionadas, y los datos cualitativos fueron analizados con la prueba exacta de Fisher. Se utilizó la prueba de Pearson para establecer las correlaciones entre las concentraciones de homocisteína-neonatal y el peso de los neonatos. Se consideró p<0,05 como estadísticamente significativo.
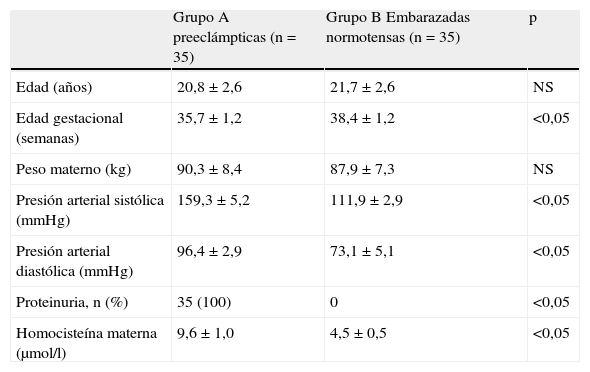
ResultadosLas características de las preeclámpticas (grupo A) y las embarazadas normotensas (grupo B) se muestran en la tabla 1. No se encontraron diferencias estadísticamente significativas con relación a la edad y al peso materno, pero sí con respecto a la edad gestacional, la presión arterial sistólica y diastólica y la presencia de proteinuria (p<0,05). Las concentraciones de homocisteína fueron más altas en el grupo A (9,6±1,0 picomol/l) al compararlas con el grupo B (4,5±0,5 picomol/l; p<0,05).
Características maternas
| Grupo A preeclámpticas (n=35) | Grupo B Embarazadas normotensas (n=35) | p | |
| Edad (años) | 20,8±2,6 | 21,7±2,6 | NS |
| Edad gestacional (semanas) | 35,7±1,2 | 38,4±1,2 | <0,05 |
| Peso materno (kg) | 90,3±8,4 | 87,9±7,3 | NS |
| Presión arterial sistólica (mmHg) | 159,3±5,2 | 111,9±2,9 | <0,05 |
| Presión arterial diastólica (mmHg) | 96,4±2,9 | 73,1±5,1 | <0,05 |
| Proteinuria, n (%) | 35 (100) | 0 | <0,05 |
| Homocisteína materna (μmol/l) | 9,6±1,0 | 4,5±0,5 | <0,05 |
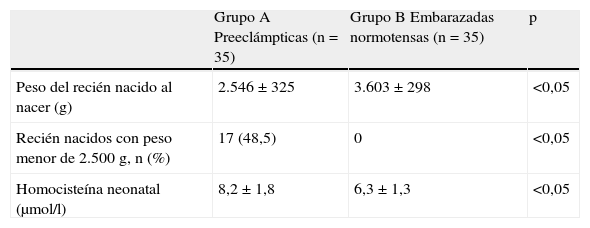
En la tabla 2 se muestran las variables neonatales. Se observó que los recién nacidos de las mujeres del grupo A presentaban pesos promedios significativamente menores que los recién nacidos de las embarazadas del grupo B (2.546±325g comparado con 3.603±298g; p<0,05). También se encontraron 17 recién nacidos (48,5%) con peso menor de 2.500 gramos en el grupo A y ningún recién nacido menor de ese peso en el grupo B (p<0,05). De igual forma se observó que los recién nacidos de las preeclámpticas presentaban concentraciones de homocisteína significativamente más altas (8,2±1,8 picomol/l) que las embarazadas normotensas (6,3±1,3 picomol/l; p<0,05).
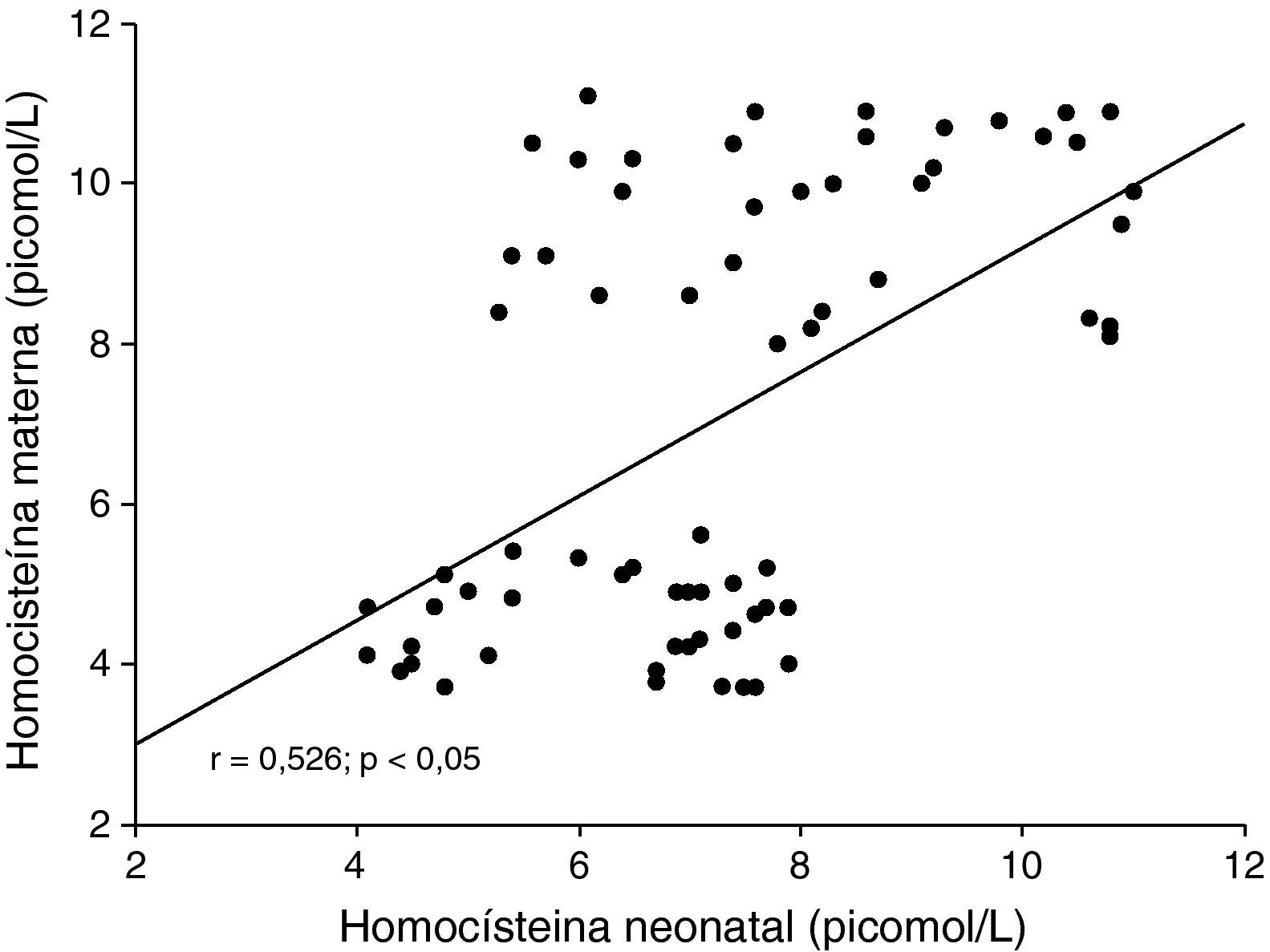
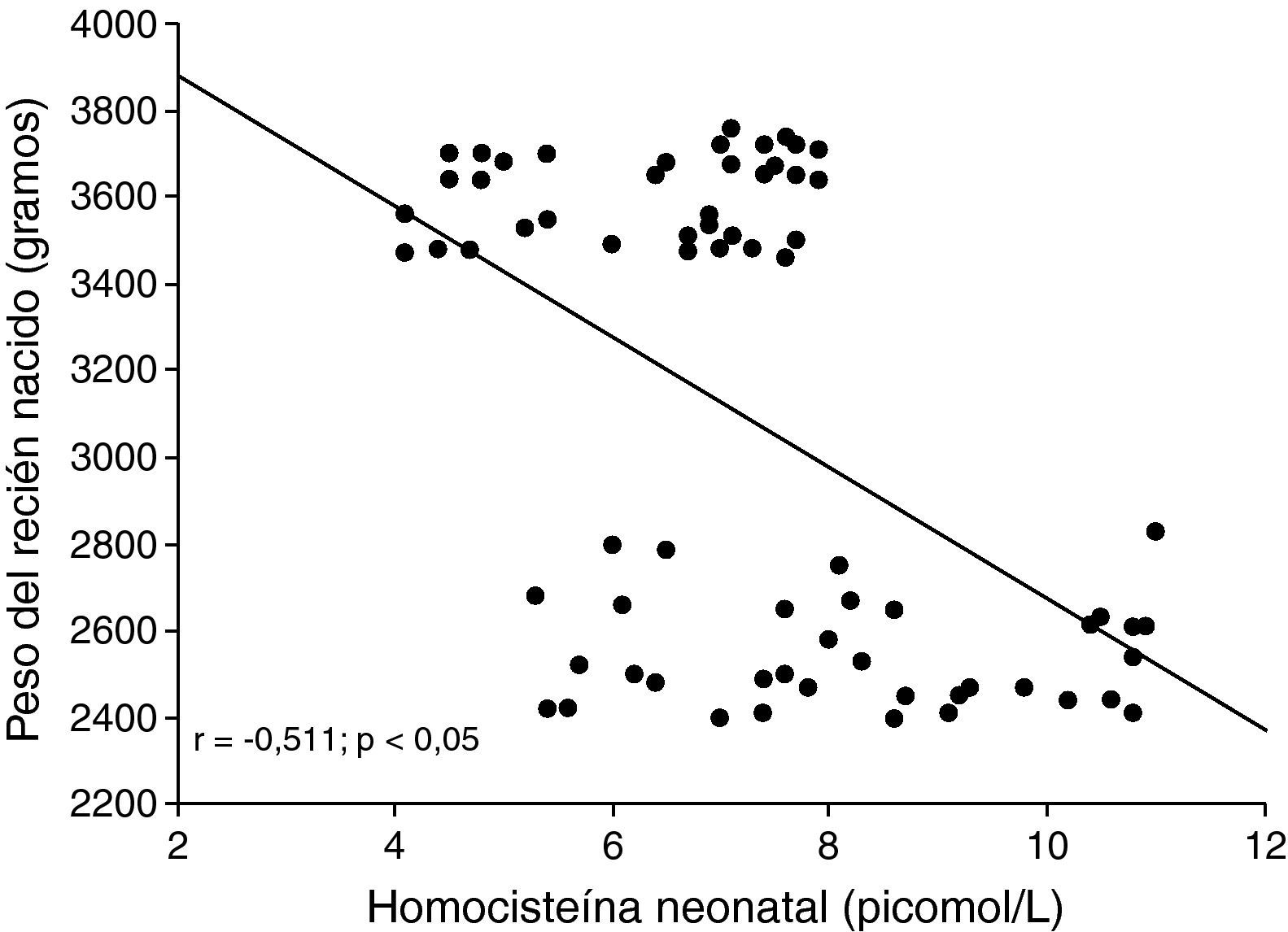
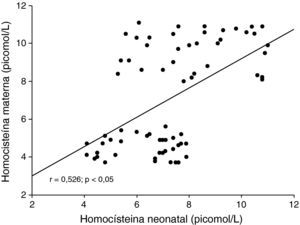
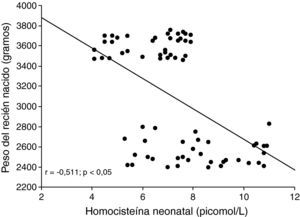
Al correlacionar las concentraciones de homocisteína del recién nacido, se observó una correlación moderada, positiva y significativa con las concentraciones de homocisteína materna (r=0,526; p<0,05; fig. 1). La correlación entre las concentraciones de homocisteína del recién nacido con el peso de éste mostró ser moderada, negativa y significativa (r=−0,511; p<0,05; fig. 2).
DiscusiónLa hiperhomocisteinemia leve se considera un factor de riesgo para enfermedad arterial y trombosis profunda14,15. Se ha reportado que las alteraciones del metabolismo son un factor de riesgo al inicio del embarazo para aborto y alteraciones congénitas. Sin embargo, además de las consecuencias sobre el embrión o el feto, la homocisteína se ha descrito también como una causa de complicaciones obstétricas como la preeclampsia16,17.
La etiología de las altas concentraciones de homocisteína en la preeclampsia es desconocida. Los estudios sobre el polimorfismo del gen de la metilen-tetrahidrofolato reductasa (MTHFR) y las concentraciones de folato y vitamina B12 no han probado tener un impacto significativo. El metabolismo de la homocisteína, junto con el de la vía de la metiltransferasa de betaína-homocisteína, puede ser más importante que el metabolismo dependiente del folato al final del embarazo18,19. Por lo tanto, las concentraciones elevadas en la preeclampsia pueden ser causadas por una disponibilidad insuficiente de betaína y colina. Se ha demostrado correlación entre las concentraciones de homocisteína y colina en la circulación materna entre preeclámpticas y los controles20.
Powers et al21 reportaron que la disminución en las concentraciones de homocisteína plasmática durante el embarazo se correlacionaba con un incremento en su depuración renal. Investigaciones previas, al igual que esta investigación, han reportado altas concentraciones plasmáticas de homocisteína durante el embarazo en las preeclámpticas9,12. Esto puede explicarse por la reducción del volumen plasmático, el cual puede llegar a ser superior al 40% en los casos de preeclampsia severa13,22.
Una consecuencia de la preeclampsia puede ser la reducción de la perfusión placentaria y la restricción del crecimiento intrauterino del feto. Se ha postulado que la unidad fetoplacentaria hipóxica en la preeclampsia produce una serie de factores en la circulación materna y fetal que causa alteraciones vasculares23. Son pocos los datos conocidos sobre los efectos de las altas concentraciones de homocisteína en las preeclámpticas y sus recién nacidos, en especial sobre el potencial papel de la homocisteína en la vida intrauterina7,20. Se piensa que la homocisteína ejerce varios efectos tóxicos. Por ejemplo, la hiperhomocisteinemia produce daños en las células vasculares endoteliales maternas20. El endotelio vascular del feto y del recién nacido son más sensible a las lesiones, y por lo tanto elevaciones marcadas de las concentraciones de homocisteína pueden llevar a lesión endotelial con posterior activación de diferentes mecanismos que pueden, eventualmente, producir enfermedad cardiovascular en la vida adulta.
Uno de los hallazgos importantes de la presente investigación es la correlación positiva observada entre las concentraciones de homocisteína materna y del recién nacido. Investigaciones previas24,25 encontraron una correlación positiva entre las concentraciones de homocisteína maternas y fetales, pero en su caso en embarazos no complicados.
Existen pocos reportes sobre el hallazgo de esta investigación con relación a la correlación negativa entre las concentraciones de homocisteína en el recién nacido y el peso al nacer. Se han descrito que las concentraciones elevadas de homocisteína en la madre y el líquido amniótico pueden estar asociadas con el tamaño al nacer en los recién nacidos pequeños para su edad gestacional26. Más aún, Engel et al27 han propuesto que las variantes en la vías del metabolismo del folato afectan la acumulación de homocisteína, que puede relacionarse con la resultante neonatal. Estos autores sugieren la posibilidad de un papel directo o indirecto de la variación de la enzima hidroximetiltransferasa 1 de serina soluble (1420T) en los recién nacidos pequeños para su edad gestacional.
Kumar et al28 fueron los primeros en reportar la relación entre la restricción del crecimiento intrauterino del feto y la hiperhomocisteinemia. Encontraron la presencia de hiperhomocisteinemia en el 14% de las pacientes con restricción del crecimiento intrauterino del feto. Quere et al29 reportaron tres casos de restricción del crecimiento intrauterino del feto temprano y dos casos de muerte fetal intrauterina. El único factor etiológico identificado en estos casos fue la hiperhomocisteinemia y el MTHFR.
ConclusiónSe concluye que los recién nacidos de las preeclámpticas tienen concentraciones significativamente más altas de homocisteína comparado con los recién nacidos de embarazadas normotensas.